过量表达Fa14-3-3C促进拟南芥对低氮胁迫耐受性的研究
李小冬,吴佳海,孙方,陈光吉,王小利
(贵州省农业科学院草业研究所,贵州 贵阳 550006)
过量表达Fa14-3-3C促进拟南芥对低氮胁迫耐受性的研究
李小冬,吴佳海,孙方,陈光吉,王小利*
(贵州省农业科学院草业研究所,贵州 贵阳 550006)
氮元素是植物生长发育过程必不可少的营养元素之一,对禾本科作物生长的影响更加明显。本研究采用RACE技术从高羊茅叶片中克隆获得Fa14-3-3C基因全长,并对其亚细胞定位与分子功能进行系统研究。在烟草表皮细胞中观察发现Fa14-3-3C-GFP主要定位在细胞质中与细胞膜上。将Fa14-3-3C基因在拟南芥中过量表达获得3个单拷贝转基因株系(抗性分离比为3∶1)。在低氮胁迫反应中,Fa14-3-3C过量表达株系OE-1与OE-3的根鲜重显著比野生型高,而OE-2与野生型差异不显著,通过荧光定量PCR分析发现OE-1与OE-3过量表达明显而OE-2没有过量表达,说明Fa14-3-3C对植物耐低氮胁迫调节具有剂量效应。定量观察植物根系生长发现在低氮处理早期OE-1转基因株系就显著优于野生型,主要是通过补偿根系生长的方式缓解低氮胁迫对植物的伤害。因此本研究不仅获得了耐低氮胁迫候选基因,而且验证了其在模式植物中的分子功能,为进一步通过基因工程等手段培育耐低氮胁迫种质资源奠定基础,具有重要理论研究价值与生产应用前景。
高羊茅;Fa14-3-3C;低氮胁迫;转基因
氮元素是影响植物生长发育的主要营养元素之一,其参与植物有机体的结构组成,也参与植物生理代谢反应。因此,合理施用氮肥对提高作物产量起到极大的促进作用,但近年来农业生产中氮肥的过量施用导致地下水硝酸盐含量超标、地表水富营养化等环境问题。我国是氮肥消费大国,并且氮肥使用量仍呈递增的趋势,然而作物对人工施加氮肥的利用率不到50%[1-2],因此培育耐低氮肥胁迫的作物新品种对高效生产以及保护环境都有极其重要的意义。高羊茅(Festucaarundinacea)是主要的冷季型牧草和草坪草,在水土保持、环境保护、城市绿化和运动场建植上发挥着重要的作用[3]。但作为一种禾本科牧草,在其栽培和种子生产过程中对氮肥的依赖性很强,因此,培育经济环保的耐低氮高羊茅新品种,对有效降低草地栽培管理成本,减少环境污染,促进草地农业生产可持续发展有重要促进作用[4-5]。
由于氮元素对植物生长以及农业生产等至关重要,前人从氮元素的吸收、转运、同化、转移、再生以及碳氮平衡等方面进行了系统的研究,并已进行了很好的综述[6]。这些研究发现并阐述了多个家族基因的功能,其中包括响应NO3-的NRT[7]、NAXT[8]、NAR[7, 9]等家族基因,响应NH4+的AMT家族基因[10],以及响应有机氮的ProT[11]、LHT[12]、AAP[13]等家族基因,并且这些基因在多个物种中的功能保守。除直接参与氮元素代谢的基因外,许多基因间接受氮元素含量的调节,14-3-3家族基因是其中之一。
14-3-3蛋白在真核生物中保守性较高,常通过单体或二聚体形式与靶蛋白结合行使调节功能,在植物中亦被称为GF家族蛋白[14-15]。因为具有结合多种蛋白的功能,14-3-3家族基因不仅参与干旱[16]、高盐[17]等多种植物逆境调节,而且受铁元素[18]、磷元素与钾元素[19]等多种营养元素含量水平的调控。氮元素的吸收与同化也显著受14-3-3家族基因的调节,前人研究发现14-3-3蛋白能够通过与NIR结合调节氮同化过程的关键酶NR的活性[20],最近的研究发现14-3-3蛋白作为一种重要的信号转导调节因子通过磷酸化靶标蛋白参与碳水化合物代谢以及氮元素的同化与利用[21]。尽管14-3-3家族基因功能重要,且在多个作物中被广泛研究,然而在牧草类作物中关于14-3-3家族基因的研究还比较少,其在牧草中的同源基因是否能够调控植物抵抗相应的逆境胁迫还不清楚,基于此,本研究克隆了Fa14-3-3C的全长,并将其在拟南芥中过量表达,系统分析了Fa14-3-3C在耐低氮胁迫中的功能,为下一步采用分子育种手段培育耐低氮胁迫牧草种质资源奠定基础。
1 材料与方法
1.1材料
本研究采用的植物材料为黔草1号高羊茅(由贵州省草业研究所选育而成),以及哥伦比亚野生型拟南芥(ArabidopsisthalianaColumbia),由华中农业大学周永明教授团队馈赠,拟南芥以及高羊茅种植参考Li等[22]的方法,在人工气候室中设定生长温度为22 ℃,相对湿度为60%,光周期为16 h光照/8 h黑暗,光照强度为51750~67500 μmol/(m2·s)。Fa14-3-3C基因克隆于2014-2015年在贵州省草业研究所完成,亚细胞定位与耐低氮胁迫分析于2015-2016年在贵州省草业研究所完成。
1.2方法
1.2.1RNA的提取及反转录 称取100 mg新鲜黔草1号高羊茅叶片,用液氮研磨成粉末,RNA的提取采用TRIZOLTMKit RNA提取试剂(Invitrogen,USA)。 cDNA 第一链的反转录采用RevertAid H Minus First Strand cDNA Synthesis Kit (Fermentas),操作参照所用试剂盒说明进行。
1.2.2Fa14-3-3C的克隆及过量表达载体的构建 利用前期转录组数据设计引物,进行5′RACE(rapid amplification of cDNA ends)以及3′RACE扩增,设计的引物如下,5′RACE:FaGF14-C-REV1,5′-GTTCTTGTAGGCGACG-3′;FaGF14-C-REV2,5′-CTCCTCGACGGTGAGCTC-3′;FaGF14-C-REV-3,5′-CGACCATCTCCTCGTACC-3′。3′RACE:FaGF14-C-FWD1,5′-GCAGAGCAGGCTGAGAGTTATGAAGAGA-3′;FaGF14-C-FWD2,5′-TTCATGGAGAAGGTGGCAAAGACAGTT-3′,具体操作过程参照RACE试剂盒说明书(Clontech SMART RACE kit,USA),获得高羊茅Fa14-3-3C全长mRNA的5′端与3′端的序列。
根据RACE结果,设计克隆Fa14-3-3C的全长CDS的引物,FaGF14-C-FWD4,5′-CGGGATCCATGTCGGCACCAGCGGAGCTTTC-3′;FaGF14-C-REV4,5′-GCTCTAGACTCGGCGGCTCCCTTTCG-3′。反应体系如下:10×buffer,2 μL;dNTP mix,0.5 μL;MgCl2,1.5 μL; FaGF14-C-FWD4,1 μL;FaGF14-C-REV4,1 μL;cDNA模板,2 μL;DNA Polymerase,0.2 μL;dd H2O,12 μL。程序如下,95 ℃ 1 min,95 ℃ 10 s,58 ℃ 10 s,72 ℃ 1 min,30个循环,72 ℃ 5 min,25 ℃ 5 min。并将其连接到pEASY-Blunt克隆载体(pEASY-Blunt Cloning Kit,Transgene),进行测序分析,利用BamHⅠ与XbaⅠ将正确的序列与p1300-GFP载体酶切后,用T4连接酶连接成p1300-Fa14-3-3C-GFP过量表达载体(Fermentas),具体操作参照试剂盒说明书。
1.2.3Fa14-3-3C-GFP亚细胞定位 采用电转法将p1300-Fa14-3-3C-GFP载体转化到GV3101感受态细胞,利用硫酸庆大霉素和卡那霉素进行抗性筛选,利用35S和FaGF14-C-REV4进行PCR 鉴定,反应体系与程序同Fa14-3-3C克隆,获得转化p1300-Fa14-3-3C-GFP阳性农杆菌克隆。将阳性菌落接种到5 mL Luria-Bertani培养基(LB)+25 mg/L 庆大霉素+50 mg/L卡那霉素的液体培养基中28 ℃, 220 r/min活化24 h。按照1∶50的比例将活化的菌液接种到200 mL LB+25 mg/L庆大霉素+50 mg/L卡那霉素的培养基28 ℃, 220 r/min培养8~12 h。室温5000 r/min离心15 min。弃上清,将农杆菌沉淀悬浮于新鲜配制的稀释缓冲液[10 mmol/L MgCl2,10 mmol/L MES (2-4-morpholino ethanesulfonic acid),pH=5.7,0.5% 葡萄糖,200 mmol/L 乙酰丁香酮]。将活化好的农杆菌用1 mL的一次性注射器打入烟草(Nicotianatabacum)叶片下表皮细胞,暗光培养3~5 d,撕烟草下表皮在紫外激发光下观察508 nm的荧光信号(微分干涉荧光显微镜,Nikon,日本)。
1.2.4p1300-Fa14-3-3C-GFP转化拟南芥 农杆菌的活化及培养同1.2.3,将收集的农杆菌菌体悬浮于新鲜配制的诱导培养基中(10 g 蔗糖充分溶解于200 mL蒸馏水中),在转化之前加入20 μL Silwet(上海生工)。将去除花和角果的野生型植株浸泡在农杆菌悬浮液30 s。避光培养过夜,然后正常培养至种子成熟,收获的种子为T0转基因拟南芥。
1.2.5转基因拟南芥的筛选及分子鉴定 将T0代转基因的拟南芥种子分装成200 mg每管,用75%乙醇表面消毒1 min,用50% 84消毒液消毒3 min, 用无菌水清洗种子3~4次,均匀悬浮于0.1%的琼脂糖,然后铺布于1/2 Murashige & Skoog (MS)培养基+300 mg/L特美汀+50 mg/L潮霉素培养基,4 ℃放置3 d转移到人工气候室中筛选15~30 d,挑选绿色健壮的植株移栽到营养土中备用。抗性分离比的筛选挑选T1代种子,每份准备30~60颗种子,消毒与筛选参考T0代方法,15~30 d后统计阳性与非阳性比例。挑选接近3∶1分离的株系进行分子筛选(OE-1,OE-2,OE-3),采用天根植物DNA提取试剂盒(DP305)提取转基因与野生型拟南芥的新鲜叶片组织的DNA,程序方法参照试剂盒说明书。利用HptF+HptR以及35S+FaGF14-C-REV4两个引物组合进行PCR 鉴定,PCR反应采用上海生工 2×Taq PCR反应试剂盒,反应体系如下:2×Taq PCR Mixture,10 μL;正向引物,1 μL;反向引物,1 μL;DNA,2 μL;dd H2O,6 μL。混匀后进行PCR扩增反应,程序如下:94 ℃ 3 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,30个循环,72 ℃ 5 min,25 ℃ 5 min。取8 μL PCR产物电泳检测,挑选阳性植株用于表型考察与表达分析。
1.2.6荧光定量分析 RNA提取及反转录参照1.2.1,采用GoTaq Real-Time PCR Systems (Promega,A6001)检测转基因植物和野生型中14-3-3C的表达,引物组合为:Fa14-3-3C-FWD5,5′-TTGCCTACCCTGGATAAGATCTAAG-3′与Fa14-3-3C-REV5,5′-TAATAAACCCAGTCGTATCGCTTAG-3′,内参基因为Ubiquitin,引物组合为UBI-FWD1,5′-CACCTCGATCACCCACCTCT-3′,UBI-REV1,5′-AGGGTCTCCGATAACCTCCA-3′,操作方法按照试剂盒说明书,反应程序为94 ℃ 2 min,94 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s,读取荧光信号,45个循环,72 ℃ 5 min,25 ℃ 5 min。采用2-ΔΔct方法[22]分析14-3-3C的表达变化,每个样品3个生物学重复,每个生物学重复3个技术重复。
1.2.7转基因拟南芥耐低氮胁迫分析 将野生型以及转Fa14-3-3C基因的拟南芥表面消毒后播种于Hoagland固体培养基中[1.25 mmol/L KNO3,1.25 mmol/L Ca(NO3)2·4H2O,0.5 mmol/L MgSO4·7H2O,0.25 mmol/L KH2(PO4),11.6 μmol/L H3BO3,4.6 μmol/L MnCl2·4H2O,0.19 μmol/L ZnSO4·7H2O,0.12 μmol/L Na2MoO4·2H2O,0.08 μmol/L CuSO4·5H2O 和10 μmol/L Fe(III)-EDTA,10 g/L琼脂,用HCl调整pH值到6.0],正常条件预培养4 d,挑选整齐一致的幼苗分别移栽到Hoagland全营养培养基与Hoagland缺氮培养基[1.25 mmol/L KCl,1.25 mmol/L CaCl2,0.5 mmol/L MgSO4·7H2O,0.25 mmol/L KH2(PO4),11.6 μmol/L H3BO3,4.6 μmol/L MnCl2·4H2O,0.19 μmol/L ZnSO4·7H2O,0.12 μmol/L Na2MoO4·2H2O,0.08 μmol/L CuSO4·5H2O 和 10 μmol/L Fe(III)-EDTA,10 g/L琼脂,用HCl调整pH值到6.0]中生长15 d,6株为一组分别取对应植物的根样称量鲜重,每个材料4个生物学重复。根长动态观察:野生型与Fa14-3-3COE-1材料表面消毒、预培养及处理与生物产量测定相同,每天对处理以及对照的植物拍照,利用Image J软件统计每个植株根系生长,每个材料统计30个单株。
1.3数据分析
采用Excel 2010进行实验数据分析,荧光定量、根鲜重以及根长动态观察采用t测验分析差异显著性,P<0.05被认为是差异显著,采用Excel 2010与PowerPoint 2010作图。
2 结果与分析
2.1Fa14-3-3C的克隆及过量表达载体构建
因为高羊茅为六倍体禾本科牧草,其基因组信息较少,本研究采用RACE (rapid amplification of cDNA end)技术以高羊茅叶片cDNA为模板,获得Fa14-3-3C5′端(图1A)与3′端(图1B)序列,根据RACE结果扩增Fa14-3-3C整个编码区序列(图1C),Fa14-3-3C整个编码区长783 bp,编码一个261氨基酸的小分子蛋白。利用设计的BamHⅠ与XbaⅠ酶切pGEM-Fa14-3-3C与p1300-GFP空载体,回收并连接线性化载体和Fa14-3-3C基因,获得过量表达载体(图1D)。
2.2Fa14-3-3C亚细胞定位
14-3-3家族基因在信号转导、细胞凋亡、营养物质感应等过程中起十分重要的作用。前人研究发现14-3-3 作为蛋白结合配体能够与多种蛋白结合,通过目标蛋白质结合改变其在细胞内定位,例如14-3-3 蛋白能够促进许多核定位的信号蛋白定位到细胞质中,包括促凋亡蛋白BAD以及细胞周期调控磷酸酶Cdc25C等[23]。然而Fa14-3-3C在植物细胞中的定位还没有被研究,本研究将Fa14-3-3C与绿色荧光蛋白GFP融合表达,观察其在烟草表皮细胞中的定位,发现Fa14-3-3C主要定位于细胞质与细胞膜上(图2A,B)。而对照35S:eGFP在细胞内均有很强的荧光信号(图2C,D)。
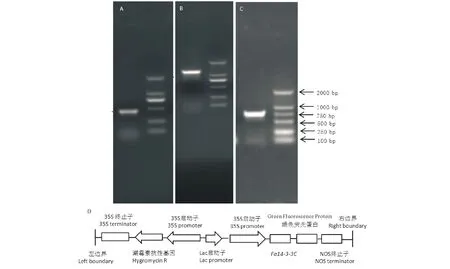
图1 Fa14-3-3C的克隆与过量表达载体构建Fig.1 Cloning of Fa14-3-3C and constructing of p1300-Fa14-3-3C-GFP over-expression vector A~C: Fa14-3-3C 5′端(A)、3′端(B)以及全长编码区(C)的克隆Electrophoresis of PCR products from 5′ RACE (A), 3′ RACE (B) and full coding sequence amplification (C) of Fa14-3-3C. D:p1300-Fa14-3-3C-GFP过量表达载体示意图 Diagrammatic drawing of p1300-Fa14-3-3C-GFP overexpression vector.

图2 Fa14-3-3C亚细胞定位Fig.2 Subcellular localization of Fa14-3-3C protein 在紫外激发光(A,C)以及白光(B,D)条件下,转p1300-Fa14-3-3C-GFP表达载体(A~B)与p1300-GFP空载体对照(C~D)在烟草表皮细胞的荧光信号定位以及细胞形态。Fluorescence signal distribution and cellular morphology of tobacco adaxial epidermis cells transiently expressed p1300-Fa14-3-3C-GFP (A-B) and p1300-GFP mocked control (C-D), pictures were taken under ultraviolet light field (A, C) and bright light field (B, D).
2.3Fa14-3-3C转基因拟南芥获得与验证
在前期研究结果中,发现Fa14-3-3C能显著被低氮胁迫诱导,为进一步研究Fa14-3-3C的功能,本研究利用农杆菌介导的花器官侵染法将p1300-Fa14-3-3C-GFP转化野生型拟南芥。以25 mg/L潮霉素进行抗性筛选,共获得12株阳性转基因植株,对各株系T2代植株抗性统计分析获得3个分离比接近3∶1的株系,为可能的单拷贝插入转基因植株,随机挑选6个抗性单株分别用潮霉素抗性引物以及35S启动子与基因下游引物进行组合扩增,结果显示抗性植株都为阳性(图3A,B)。
2.4Fa14-3-3C转基因植株在低氮胁迫条件下的生物产量及表达分析
氮元素的吸收主要是通过植物根系起作用,本研究重点分析了3个抗性分离比接近3∶1的株系(OE-1,OE-2,OE-3)在低氮胁迫条件下根系鲜重的变化。在正常条件下,野生型与Fa14-3-3C过量表达植株的根鲜重没有显著区别(图4A),而在低氮胁迫条件下,Fa14-3-3COE-1与OE-3的根鲜重显著比野生型高(图4B),OE-2与野生型差异不显著。OE-2与OE-1及OE-3的表型不一致,猜测这种现象可能与Fa14-3-3C在植物中的表达量有关。因此,分析在正常条件下,3个过表达株系与野生型拟南芥中Fa14-3-3C的表达变化,Fa14-3-3C在OE-1与OE-3株系中均显著上调,而OE-2中Fa14-3-3C的表达与野生型差异不显著。
为进一步分析低氮胁迫条件下,Fa14-3-3C对植物根系的影响,本研究平行观察了OE-1与野生型拟南芥根系的变化。在正常情况下,OE-1与野生型没有显著区别(图5A),其根长从开始处理到结束都与野生植株差异不显著(图5B)。在低氮胁迫条件下,OE-1的根长显著比野生型拟南芥长(图5C),在动态观察中,本研究发现从处理的第2天开始,OE-1的根系显著比野生型长,并且一直维持到处理结束(图5D)。因此14-3-3C能够显著提高植物对低氮胁迫的耐受性。

图3 Fa14-3-3C转拟南芥植株分子鉴定Fig.3 Molecular detection of Fa14-3-3C transgenic plants in Arabidopsis A~B:转基因拟南芥分子检测示意图,分别用潮霉素抗性引物(A,Hpt基因)与基因特异引物(B,35S+14-3-3C rev)检测6株阳性转基因植株Molecular detections of hygromycim resistant plants with primers for hygromycim resistant gene (A, Hpt) and specific gene (B, 35S+14-3-3C rev), 6 individual plants were detected.
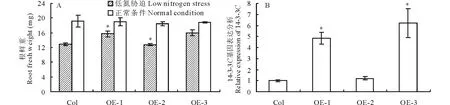
图4 Fa14-3-3C转基因拟南芥生物产量以及基因表达分析Fig.4 Bio-production and gene expression analysis in three Fa14-3-3C over expression strains and wild type plants A:在正常条件下以及低氮胁迫条件下,3个过表达株系(OE-1、OE-2与OE-3)与野生型根系生物产量分析Under normal and low nitrogen conditions, fresh weight of three different over expression (OE) strains and wild type plants; B:在正常条件下,过表达株系与野生型中14-3-3C基因的表达分析Gene expression analysis of three OE strains and wild type plants under normal growth condition;10株幼苗(包括根)混为1个样品,每个样品3个生物学重复,用Ubiquitin基因做内参, *表示差异在P<0.05达显著水平。 Ten seedlings were grouped as a sample (root included); Each sample had three biological repeats, Ubiquitin were used as an internal reference, *stands for a significant difference at P<0.05 level. Col表示野生拟南芥,OE-1~OE-3表示3个Fa14-3-3C过量表达拟南芥株系Col stands for wild type seedlings, while OEs stands for different Fa14-3-3C over expression strains.
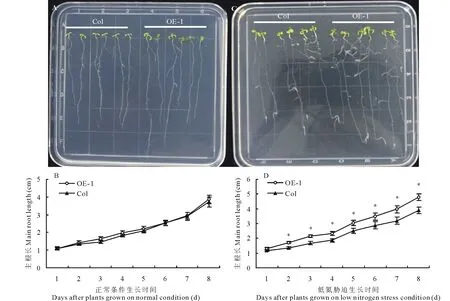
图5 Fa14-3-3C OE-1在低氮胁迫条件下的表型考察Fig.5 Morphological observation of Fa14-3-3C OE-1 under low nitrogen stress 在正常条件下(A)与低氮胁迫条件下(C)OE-1与野生型拟南芥植株。在正常条件下(B)与低氮胁迫条件下(D)OE-1与野生型拟南芥根系动态测量。*表示差异在P<0.05达显著水平。 Seedlings of wild type and Fa14-3-3C OE-1 under normal (A) and low nitrogen stress (C) conditions. Dynamic analysis of root length in wild type and Fa14-3-3C OE-1 plants under normal (B) and low nitrogen (D) conditions. *stands for a significant difference at P<0.05 level.Col表示野生拟南芥,OE-1表示Fa14-3-3C OE-1过量表达拟南芥株系,植株先在1/2 MS培养基上育苗3 d,再转移到低氮胁迫培养基上胁迫8 d。Col stands for wild type seedlings, while OE-1 stands for Fa14-3-3C over expression strains-1. Seedlings were pre-cultured in 1/2 MS for 3 d, then transferred into low nitrogen stress medium for 8 d.
3 讨论
在植物基因组中,一个生物学过程需要多个功能蛋白协同才能完成,同时某些蛋白与其他不同的蛋白互作表现不同的功能。14-3-3蛋白作为广谱的代谢物质感应分子以及信号调节因子,主要是由其能与多个不同蛋白结合的特性决定,例如参与氮代谢的NR基因[24]、参与糖代谢的SPS基因[25]。在前期研究中发现4个Fa14-3-3家族基因能够不同程度的受高温、干旱、高盐以及低氮胁迫诱导[26],而且过量表达Fa14-3-3C能够显著增强植物对低氮胁迫的抵抗力,其同源基因在其他植物的抗旱、耐盐以及耐低磷低钾等抗逆性中也均有报道[16-17,19],说明Fa14-3-3家族基因可能与其同源基因类似,具有多效性,通过多个途径调节植物对不同胁迫反应的应答。
14-3-3蛋白属于小分子蛋白(25~32 Kd),在真核生物中广泛存在,序列保守性较高[27],在细胞中常常以同聚化或者寡聚化的形式与靶标蛋白结合,引导其在细胞结构中的定位[28]。在本研究中,Fa14-3-3C-GFP的荧光信号主要分布在细胞质中以及细胞膜上,符合其作为信号转导分子与多功能的小分子配体的特点,并且以往研究发现14-3-3蛋白作为到校因子行使功能的机理之一是与靶标蛋白结合并改变其亚细胞定位,如促凋亡蛋白BAD与细胞周期调控磷酸酶Cdc25C等[23]。
植物基因表达受转录因子调控,如果转录因子表达发生变化会由于级联放大效应导致下游基因的表达发生剧烈变化[29]。而对于直接行使功能的酶或配体作为直接的效应分子,往往具有较明显的剂量效应。在本研究挑选的3个转基因阳性株系中,OE-1与OE-3根鲜重显著高于野生型,而OE-2与野生型差异不显著,这个表型与对应株系中Fa14-3-3C的表达量相吻合(图4),说明Fa14-3-3C调节植物耐低氮胁迫反应的剂量效应比较明显。而OE-2可能由于转化过程中转入片段不完全或者T-DNA插入的位置效应使Fa14-3-3C不能过量表达导致与野生型耐低氮胁迫差异不明显。
14-3-3家族基因能与碳、氮代谢的关键基因相互作用,说明其协调与利用代谢物的机制可能具有普遍性[27],因为碳、氮作为植物生长发育最重要元素之一,其含量失衡会导致植物生理与发育改变[30]。例如,氮元素不仅能够影响植物根系的形成,而且对植物光合作用的效率有重要影响[31]。前人研究发现在土豆(Solanumtuberosum)中过量表达14-3-3基因能显著降低蔗糖、儿茶酚胺以及油脂的含量,反义表达14-3-3基因能影响土豆块茎淀粉的含量与氨基酸的组成[32-33]。在本研究中只分析过量Fa14-3-3C在低氮胁迫条件下对植物根系形态的影响,其是否能调节植物对其他逆境的抵抗性,是否影响植物品质性状及其是否具有与其同源基因相同的分子作用机理还有待于进一步研究。
4 结论
高羊茅Fa14-3-3C蛋白在细胞中主要定位在细胞质与细胞膜。作为耐低氮胁迫的关键调控基因,Fa14-3-3C能正向调节拟南芥对低氮胁迫耐受性,并且具有显著的剂量效应。Fa14-3-3C能够通过促进根系生长提高植物对低氮胁迫的耐受性。
References:
[1] Raun W R, Johnson G V. Improving nitrogen use efficiency for cereal production. Agronomy Journal, 1999, 91(3): 357-363.
[2] Hodge A, Robinson D, Fitter A. Are microorganisms more effective than plants at competing for nitrogen. Trends in Plant Science, 2000, 5(7): 304-308.
[3] Wang X L, Liu Z S, Mou Q,etal. Genetic diversity ofFestucaarundinacesdetected by RAPD. Acta Prataculturae Sinica, 2007, 16(4): 82-86. 王小利, 刘正书, 牟琼, 等. 高羊茅遗传多样性RAPD分析. 草业学报, 2007, 16(4): 82-86.
[4] Li X D, Shu J H, Yu E R,etal. Proteomic analysis of nitrogen stress responsive proteins in the leaves of tall fescue. Acta Prataculturae Sinica, 2016, 25(3): 67-76. 李小冬, 舒健虹, 于二汝, 等. 高羊茅在低氮胁迫下的蛋白组学分析. 草业学报, 2016, 25(3): 67-76.
[5] Li X D, Shu J H, Wang Q,etal. Auxin signaling pathways respond to low nitrogen stress as revealed by metabolomics profiling analysis in tall fescue. Acta Prataculturae Sinica, 2016, 25(9): 64-73. 李小冬, 舒键虹, 王茜, 等. 低氮胁迫对高羊茅 IAA 生长素代谢组影响的研究. 草业学报, 2016, 25(9): 64-73.
[6] Wang M, Shen Q, Xu G,etal. New insight into the strategy for nitrogen metabolism in plant cells. International Review of Cell & Molecular Biology, 2014, 310: 1-37.
[7] Tsay Y F, Chiu C C, Tsai C B,etal. Nitrate transporters and peptide transporters. Febs Letters, 2007, 581(12): 2290-2300.
[8] Dechorgnat J, Nguyen C T, Armengaud P,etal. From the soil to the seeds: the long journey of nitrate in plants. Journal of Experimental Botany, 2011, 62(4): 1349-1359.
[9] Okamoto M, Kumar A, Li W,etal. High-affinity nitrate transport in roots ofArabidopsisdepends on expression of the NAR2-like geneAtNRT3. 1. Plant Physiology, 2006, 140(3): 1036-1046.
[10] Ferreira L M, Souza V M D, Tavares O C H,etal.OsAMT1. 3 expression alters rice ammonium uptake kinetics and root morphology. Plant Biotechnology Reports, 2015, 9(4): 221-229.
[11] Lehmann S, Gumy C, Blatter E,etal. In planta function of compatible solute transporters of theAtProTfamily. Journal of Experimental Botany, 2011, 62(2): 787-796.
[12] Brady S M, Orlando D A, Lee J Y,etal. A high-resolution root spatiotemporal map reveals dominant expression patterns. Science, 2007, 318(5851): 801-806.
[13] Ahmad I. Transporters inArabidopsisroots mediating uptake of amino acids at naturally occurring concentrations. New Phytologist, 2011, 191(2): 459-467.
[14] Hirsch S, Aitken A, Bertsch U,etal. A plant homologue to mammalian brain 14-3-3 protein and protein kinase C inhibitor. FEBS Letters, 1992, 296(2): 222-224.
[15] Rooney M F, Ferl R J. Sequences of threeArabidopsisgeneral regulatory factor genes encoding GF14 (14-3-3) proteins. Plant Physiology, 1995, 107(1): 283-284.
[16] Zhu J K. Regulation of ion homeostasis under salt stress. Current Opinion in Plant Biology, 2003, 6(5): 441-445.
[17] Sehnke P C, Henry R, Cline K,etal. Interaction of a plant 14-3-3 protein with the signal peptide of a thylakoid-targeted chloroplast precursor protein and the presence of 14-3-3 isoforms in the chloroplast stroma. Plant Physiology, 2000, 122(1): 235-241.
[18] Wei F X, Wei M S. Expression profiling of the 14-3-3 gene family in response to salt stress and potassium and iron deficiencies in young tomato (Solanumlycopersicum) roots: analysis by real-time RT-PCR. Annals of Botany, 2006, 98(5): 965-974.
[19] Bunney T D, van Walraven H S, de Boer A H. 14-3-3 protein is a regulator of the mitochondrial and chloroplast ATP synthase. Proceedings of the National Academy of Sciences USA, 2001, 98(7): 4249-4254.
[20] Moorhead G, Douglas P, Morrice N,etal. Phosphorylated nitrate reductase from spinach leaves is inhibited by 14-3-3 proteins and activated by fusicoccin. Current Biology, 1996, 6(6): 1104-1113.
[21] Liang B Z, Li A, Cai H,etal. The effect of nitrogen level on rice growth, carbon-nitrogen metabolism and gene expression. Biologia, 2015, 70(10): 1340-1350.
[22] Li X D, Yu E R, Fan C C,etal. Developmental, cytological and transcriptional analysis of autotetraploidArabidopsis. Planta, 2012, 236(2): 579-596.
[23] Muslin A J, Xing H. 14-3-3 proteins: regulation of subcellular localization by molecular interference. Cellular Signalling, 2000, 12(12): 703-709.
[24] Crawford N M. Nitrate: nutrient and signal for plant growth. Plant Cell, 1995, 7(7): 859-868.
[25] Cotelle V, Meek S E, Provan F,etal. 14-3-3s regulate global cleavage of their diverse binding partners in sugar-starvedArabidopsiscells. Embo Journal, 2000, 19(12): 2869-2876.
[26] Wang X L, Li X D, Shu J H,etal. Expression analysis of 14-3-3 genes in tall fescue under several abiotic stress conditions. Agricultural Science & Technology, 2015, (10): 2207-2213. 王小利, 李小冬, 舒健虹, 等. 高羊茅14-3-3基因在多种逆境胁迫下表达分析. 农业科学与技术, 2015, (10): 2207-2213.
[27] Wang W, Shakes D C. Molecular evolution of the 14-3-3 protein family. Journal of Molecular Evolution, 1996, 43(4): 384-398.
[28] Comparot S, Lingiah G, Martin T. Function and specificity of 14-3-3 proteins in the regulation of carbohydrate and nitrogen metabolism. Journal of Experimental Botany, 2003, 54(382): 595-604.
[29] Yoo S J, Kim S H, Kim M J,etal. Involvement of theOsMKK4-OsMPK1 cascade and its downstream transcription factorOsWRKY53 in the wounding response in rice. Plant Pathology Journal, 2014, 30(2): 168-177.
[30] Palme K, Teale W, Dovzhenko A. Plant signaling: HY5 synchronizes resource supply. Current Biology, 2016, 26(8): 328-329.
[31] Heinonsalo J, Juurola E, Linden A,etal. Ectomycorrhizal fungi affect Scots pine photosynthesis through nitrogen and water economy, not only through increased carbon demand. Environmental & Experimental Botany, 2015, 109: 103-112.
[32] Prescha A, Swiedrych A, Biernat J,etal. Increase in lipid content in potato tubers modified by 14-3-3 gene overexpression. Journal of Agricultural & Food Chemistry, 2001, 49(8): 3638-3643.
[33] Swiedrych A, Prescha A, Matysiakkata I,etal. Repression of the 14-3-3 gene affects the amino acid and mineral composition of potato tubers. Journal of Agricultural & Food Chemistry, 2002, 50(7): 2137-2141.
EnhancedtoleranceofArabidopsisoverexpressingFa14-3-3Cfromtallfescue(Festucaarundinacea)tolow-nitrogenstress
LI Xiao-Dong, WU Jia-Hai, SUN Fang, CHEN Guang-Ji, WANG Xiao-Li*
GuizhouAcademyofAgricultureScience;GuizhouInstituteofPrataculture,Guiyang550006,China
Nitrogen is essential for the growth and development of plants, especially gramineous crop plants. In this study, the full-lengthFa14-3-3Cgene was obtained by rapid amplification of cDNA ends from leaves of tall fescue (Festucaarundinacea). Subcellular localization analyses showed thatFa14-3-3C-GFP was mainly located in the cytoplasm and cell membrane when it was transiently expressed in tobacco epidermal cells.Fa14-3-3Cwas transferred intoArabidopsis, and three single-copy T-DNA insertion strains showing a 3∶1 hygromycin resistance segregation ratio were obtained. When wild-type andFa14-3-3Coverexpression strains were subjected to nitrogen deficiency, the root fresh weight was higher in strains OE-1 and OE-3 (but not OE-2) than in wild type. Quantitative real-time PCR analyses showed thatFa14-3-3Cwas highly expressed in OE-1 and OE-3, but not in OE-2, reflecting a dosage effect on the response to nitrogen deficiency. Dynamic analyses of the root growth of wild-type andFa14-3-3Coverexpression strains in nitrogen-deficient medium revealed that OE-1 showed a dramatic advantage over wild-type plants at the early stage of nitrogen deficiency. This was mainly due to compensation growth to alleviate the negative effects of low-nitrogen stress in the OE-1 strain. Therefore, we have cloned a candidate gene conferring resistance to low-nitrogen stress, and verified its molecular function in the model plantArabidopsis. These results are fundamentally important for breeding crop plants resistant to low-nitrogen stress via genetic engineering.
tall fescue;Fa14-3-3C; low nitrogen stress; transgenic
10.11686/cyxb2017058
http://cyxb.lzu.edu.cn
李小冬, 吴佳海, 孙方, 陈光吉, 王小利. 过量表达Fa14-3-3C促进拟南芥对低氮胁迫耐受性的研究. 草业学报, 2017, 26(9): 104-112.
LI Xiao-Dong, WU Jia-Hai, SUN Fang, CHEN Guang-Ji, WANG Xiao-Li. Enhanced tolerance ofArabidopsisover expressingFa14-3-3Cfrom tall fescue (Festucaarundinacea) to low-nitrogen stress. Acta Prataculturae Sinica, 2017, 26(9): 104-112.
2017-02-20;改回日期:2017-03-31
贵州省重大科技专项(黔科合重大专项字[2014]6017),贵州省农业科学院专项基金(黔农科院院专项 [2013]03)和贵州省百层次人才培养专项(黔科合人才[2016]4024)资助。
李小冬(1984-),男,湖南邵阳人,副研究员,博士。 E-mail: lixiaodongzl@163.com*通信作者Corresponding author. E-mail:wangxiaolizhenyuan@126.com

