滴灌AM真菌孢子水溶液对苜蓿的促生长效应研究
景鹏成,吕艳萍,王树林,陈乙实,鲁为华
(石河子大学动物科技学院,新疆 石河子 832000)
滴灌AM真菌孢子水溶液对苜蓿的促生长效应研究
景鹏成,吕艳萍,王树林,陈乙实,鲁为华*
(石河子大学动物科技学院,新疆 石河子 832000)
以紫花苜蓿作为研究对象,通过采用Sufer软件对滴灌AM真菌孢子前后土壤的水、盐分和丛枝菌根真菌(AMF)孢子进行等值线图的绘制,分析滴灌前后的运移状态;在苜蓿的生长期进行定期滴灌菌肥AMF孢子,在50 d后测定苜蓿植株菌根侵染率、根瘤数、产孢性能和生物量等指标,分析不同AMF的滴灌效果,对苜蓿进行关于滴灌AMF孢子水溶液的可行性研究。结果表明,1)AMF孢子在水溶液中的数量随着时间的延长而不断降低,滴灌前土壤含水量呈现出表层低而深层高的总体特点。土层的电导率分布范围较均匀。AM真菌孢子主要集中在土层10~25 cm处。滴灌后,水分大部分集中在距离滴头30 cm左右的土层,含水量较滴灌前升高。在滴头附近盐分向四周扩散,在30~45 cm处形成盐分高值区。孢子主要集中在距滴头0~25 cm左右,对于远距离的湿润区,其孢子数有一定的下降趋势。滴灌不同AM菌种孢子水溶液及滴灌距离对苜蓿生长的影响具有一定的差异性。近距离滴灌的植株地上生物量和株高显著高于远距离滴灌的植株(P<0.05);2)滴灌菌种根内球囊霉(Gi)的苜蓿植株干物质(地上、地下)显著高于对照6.59%和13.29%(P<0.05)。菌种摩西球囊霉(Gm)、内球囊霉(Gi)和幼套球囊霉(Ge)处理的地下干重显著高于对照处理9.05%,13.29%和9.96%(P<0.05),地表球囊霉(Gv)处理的地下干重与对照无显著性差异(P>0.05)。Gi处理苜蓿的分枝数显著高于对照处理19.73%(P<0.05),其他菌种间无显著性差异但都显著高于对照处理(P<0.05)。Gi和Ge处理的苜蓿植株的根瘤数、孢子数和侵染率显著高于对照组(P<0.05)。滴灌菌种间菌根侵染率和根瘤数无显著性差异(P>0.05)。滴灌距离对植株地下部干重、株高、孢子数有显著性影响(P<0.05)。滴灌距离和滴灌菌种的互作除了对菌根侵染率、根瘤数和根长具有显著地影响外(P<0.05),对其余的各指标都没有显著性影响(P>0.05)。综合分析Gi菌种的滴灌应用对苜蓿的效果较好。
苜蓿;AM真菌;滴灌
紫花苜蓿(Medicagosativa)在我国已有2000多年的栽培历史[1],是具有产草量高、适应性强、营养丰富、适口性好等特点的多年生豆科牧草。随着我国畜牧业的迅速发展,苜蓿作为主要的饲料作物,对我国畜牧业发展起着举足轻重的作用[2]。苜蓿作为高蒸腾类型的牧草,在整个生育期耗水量较大,干旱已成为制约北方苜蓿栽培面积的扩大和产量提高的重要原因[3],同时干旱对牧草所造成的损失在非生物因素中占首位,仅次于病虫害产生的损失[4]。近年来,在一些缺水地区滴灌事业逐渐发展起来,其中新疆石河子相关生产单位将滴灌技术应用于苜蓿栽培,较以往的漫灌生产大幅度地提高了苜蓿产量[5]。随着滴灌系统的不断创新和优化,水肥调控技术逐渐应用在滴灌生产中,但易造成施肥不匀,养分流失,作物灼烧等问题,而生物肥料具有提高作物产量、提升作物抗逆性,培肥土壤等能力。因此探索生物肥料与滴灌设备结合逐渐成为研究新方向。
国内外的大量研究表明:丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)可以与约90%的陆生植物形成互惠共生体[6],是迄今发现与植物关系最为密切的土壤微生物之一[7]。一定条件下接种丛枝菌根真菌,可以促进植物对土壤中磷、硫、铜、锌、硼等中、微量元素的吸收[8-11],从而改善植物的营养状况[12-13],提高对外部不利因素的抗逆性,如:病害、干旱、冷害、盐碱等[14-17]。作为土壤习居菌,AM真菌还可以通过改变植物根系形态与结构形成物理防御体系,拮抗土传病原真菌、细菌和线虫等病原物,提高植物的抗病性,即具有生物药肥双重的作用[18]。紫花苜蓿作为一种多年生豆科植物,通过苜蓿根瘤菌固定的氮可以满足自身在生长期间所需的氮,减少了氮肥的施用;土壤中微生物的活动对土壤磷素的转移和利用影响也很大,其中丛枝菌根真菌通过对苜蓿细根的侵染,促进苜蓿对水分、养分和矿质元素的吸收,因此,利用AM真菌提高苜蓿产量是目前最好的生物方法之一。
目前新疆滴灌苜蓿栽培已取得了良好效果,但关于盐渍土条件下的苜蓿滴灌栽培基础研究仍比较薄弱,由于AM真菌对豆科植物根系的侵染,可以增加根系对外界胁迫因子的抵抗力[19],如病原体的入侵、干旱和重金属毒性[20]等,同时还能够使土壤形成大颗粒结构,增加水分、空气的渗透性以及在防止土壤的侵蚀方面起了很大的作用[21]。因此本研究首次探讨关于将外源AMF孢子水溶液与滴灌模拟应用于苜蓿生产,旨在探讨高效菌根与滴灌设备相结合的可行性,为今后菌根技术的应用和推广进入一个新的发展阶段,同时对缓解草原退化恢复草地生态系统也有着重要的意义。
1 材料与方法
1.1材料
实验开始于2016年5月,在苜蓿生长8周之后开始收割测定。供试菌种:根据调查结果发现摩西球囊霉(Glomusmosseae,简称Gm)、根内球囊霉(Glomusintraradices,简称Gi)、地表球囊霉(Glomusversifome,简称Gv)、幼套球囊霉(Glomusversifome,简称Ge)在新疆地区最常见,因此从青岛农业大学购买。
供试紫花苜蓿品种:“劲能”紫花苜蓿,由华丰草业科技有限公司提供。
试验土箱:长宽高分别为60 cm×60 cm×68 cm(10 mm厚的有机玻璃制成,透明的有机玻璃便于观测记录湿润峰)和60 cm×25 cm×20 cm的两个供试土箱。
所需土壤:采自石河子大学试验站三龄苜蓿试验地土壤,土壤质地为重壤土,含有机质2.01%,全氮0.12%,碱解氮72.8 mg/kg,速效磷34.8 mg/kg。使用医用输液管模拟滴灌带。
1.2试验装置
滴灌模拟试验装置由土箱和供水装置两部分组成(图1),试验土箱由厚度为10 mm的有机玻璃制成,箱体规格为(长×宽×高为60 cm×60 cm×68 cm)。利用10 L广口瓶作为AM孢子水溶液的容器,医用输液管模拟滴头输送AMF孢子的水溶液,并用输液管控制滴灌速度(小滴头流量)基本保证滴头流量供水强度小于等于土壤入渗能力,使菌肥溶液滴入土壤即下渗,土壤表面无明显积水。为保证成功将AM孢子水溶液直接输送到植物根际,本试验不断进行氧气供给和一定时间AM孢子的补充。将采集于石河子大学农学院试验站苜蓿实验地10~30 cm表层的土壤,在自然情况下风干粉碎,利用高压蒸汽灭菌法,121 ℃维持 1 h,然后将土样按每层10 cm厚夯入试验有机玻璃土箱中。为了更加直观看出土壤剖面各种属性分布特征,利用surfer 8.0软件绘制土壤剖面等值线图。以滴头为原点,水平方向的X轴为距离滴头的水平距离,垂直方向的Z轴为距滴头的垂向深度。

图1 试验装置Fig.1 Test equipment diagram
再次将风干的供试土壤粉碎均匀装于自制有机玻璃土箱中(60 cm×25 cm×20 cm),进行紫花苜蓿种子的播种,通过医用输液管模拟滴头进行AM真菌孢子水溶液的输送。以供试菌根真菌菌种(Gm、Ge、Gv和Gi)设为4个处理,每个处理3个重复,滴灌水溶液的空白处理作为对照。在苜蓿初花期距离滴头10和20 cm进行取样,测定根际孢子密度,根瘤数,菌根侵染率和植株的相关生理指标,与对照植株进行比较分析,并确定AMF菌肥滴灌的促生长效应。
1.3测定项目与方法
1.3.1AM真菌孢子的观察 由10 L广口瓶和医用输液管模拟的滴灌入渗试验系统,从广口瓶上部向其注入8 L的AM真菌孢子水溶液,每隔30 min从下方的输液管中提取定量的溶液,然后在体视显微镜下进行AM 真菌孢子的观察与计数。
1.3.2土样的采集 在滴灌孢子水溶液的过程中不断补充AMF孢子水溶液和通过氧气泵向其中注入氧气,使广口瓶中的AM真菌孢子水溶液不少于1 L,保证水溶液中AMF孢子的供给。在滴灌48 h后立即取样,即分别在不同深度(z)土层(0~10 cm,10~20 cm,20~30 cm,30~40 cm,40~50 cm)上,以滴头为圆心,湿润峰为半径划不同半径r(10,20,30,40,50 cm)的圆弧,并在圆弧上采样,直到取到干湿土交界为止。并依次在相应的垂直深度10,20,30,40 cm等直到干湿土交界处停止取土样(由于水分入渗是三维运动,各个方向各个点的土壤含水量都不相同,因此在每点取土样时尽量取的少,以代表这一点的平均值)。样品分别装于真空塑封袋中,标记备用,以滴灌前的取样点作为对照试验。
1.3.3水分和盐分的测定 将装有取样点土壤的小型铝盒放入烘箱中,在(105±2) ℃条件下烘烤6~8 h,然后移入底部装有无水硫酸铜的干燥器内冷却30 min左右,然后再放入烘箱中烘烤2~3 h后取出称重。一直到前后两次称量相差不超过0.05 g时为止,3次平行测定取平均值,土壤含水率=(M1-M2)/(M1-M)×100%(式中:M1为烘干前铝盒和土壤的质量;M2为烘干后铝盒和土壤的质量;M为铝盒质量)。
此外,每取样点格外多取5 g土样,采用1∶5的土水比配制土壤浸提液,振荡30 min后静置24 h,并用EC110型电导率仪测定浸提液电导率。
1.3.4样品的采集及相关生物量的测定 播种培养2个月后进行植株样本的采集,将根际土壤和地下部分样本置于冰箱4 ℃条件下保存,待测菌根侵染率和孢子数。植株鲜重和干重(地上、地下和全株)采用称重法测定[22],株高和根系长用度量法[23]测定。采用美国手持式CM1000NDVI叶绿素测量仪测量植株叶片叶绿素含量。
1.3.5孢子的分离与测定(湿筛倾析—蔗糖离心法) 称取50 g土壤样品,放在大烧杯中加入1000 mL水并不断搅拌使其充分溶解,静置10 s后将上层溶液过双层分样筛(上筛0.90 mm,下筛0.037 mm),并用清水重复冲洗筛上的土样3次以上,将0.037 mm筛上的残留物质转移到50 mL的离心管中,3000 r/min离心3 min左右,将上清液去除,在下层沉淀中加入50%蔗糖溶液,迅速振荡后2000 r/min离心1 min,上清液过0.037 mm筛,弃去残渣,清水冲洗筛上的物质,并将筛上孢子转移到离心管中,摇匀后取1 mL,在光学显微镜下进行观察与计数,计算该土壤中AM孢子的总数(单位,个/g)。
1.3.6菌根侵染率和根瘤数的测定 从植株根系的不同部位随机挑取细根2~3 g,并将细根剪成0.5~1.0 cm的小段放入到试管中,向其中加入5%~10%的氢氧化钾溶液,在90 ℃的水浴锅中加热20~60 min,老根依情况延长时间,然后用蒸馏水不断冲洗根系,放入2%的盐酸溶液中浸泡5 min左右,将根系取出并冲洗,最后加入0.01%的酸性品红乳酸甘油染色液(乳酸为875 mL、甘油为63 mL、蒸馏水为63 mL、酸性品红为0.1 g),再放在90 ℃水浴锅内加热20~60 min,或室温下过夜,染色处理后加入乳酸进行分色,在体视显微镜下进行菌根侵染率的检测,用以下公式计算菌根侵染率,菌根侵染率[24](%)=(菌根段数/被检根段数)×100。根瘤数测定时将植株根系收获,用自来水冲洗干净,选取 5 株进行根瘤数的计数,数其根瘤总数、有效根瘤数。
1.4数据处理
用Microsoft Excel软件进行原始数据的录入,并进行初步统计。用SPSS 13.0统计软件进行方差分析,结果采用Duncan进行多重比较。土壤中含水率、含盐量和孢子的空间分布等值线图采用软件surfer 8.0进行绘制。
2 结果与分析
2.1土壤水分、盐分和AM真菌孢子运移特征
2.1.1土壤水分运移特征 滴灌前土壤中的含水量表现为下层土壤高于上层土壤。0~15 cm土层内含水量在1.46%~1.58%之间,15~35 cm土层含水量在1.58%~1.68%之间,35~50 cm土层内含水量在1.68%~1.70%左右。总体来看,整个土层的含水量在水平方向上分布较均匀,垂直方向上随着深度的增加含水量呈增加趋势(图2a)。
滴灌48 h后,水分大部分集中在土壤上层的0~30 cm左右,水平方向0~35 cm处,含水率在8.00%~12.00%之间。含水率在土层35~40 cm处降到3.5%~8.5%左右。并通过缓慢下渗至垂直水平45 cm左右,水平方向可通过侧渗至40 cm左右,含水率在1.5%左右。在土壤上层0~25 cm水平渗透距离小于垂直下渗距离(图2b)。
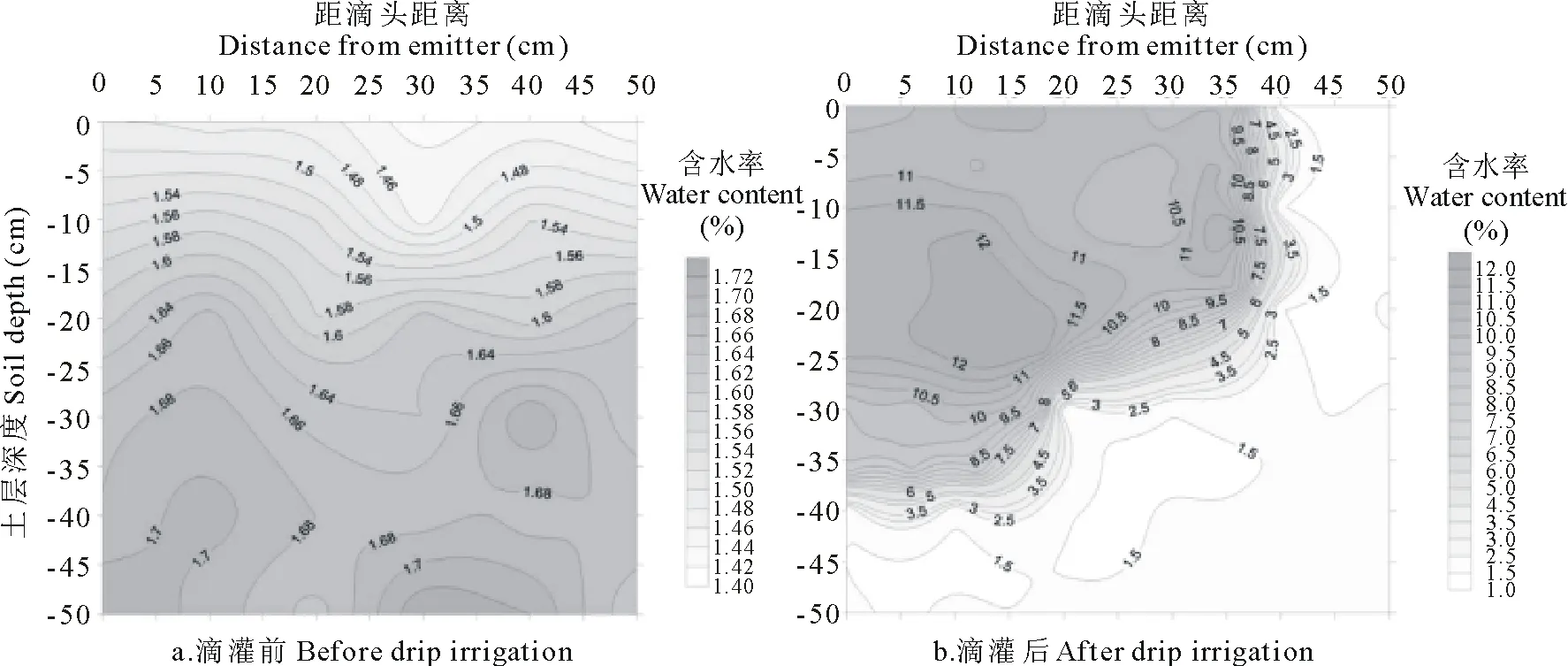
图2 滴灌前、后土壤含水量等值线图Fig.2 Contour map of soil water content before and after drip irrigation
2.1.2土壤盐分运移特征 滴灌前,0~30 cm土层的电导率值在0.67~0.70 mS/cm之间,30~50 cm土壤深度等值线密集,含盐量高于上层土壤,电导率值在0.70~0.76 mS/cm之间(图3a)。
滴灌48 h后,上层土壤含盐量明显下降,距滴头水平方向0~30 cm,深度0~30 cm土层的电导率由未滴灌前的0.67~0.70 mS/cm降到0.56~0.66 mS/cm。随着距离滴头距离的增加,在距离滴头30~45 cm两湿润峰交界处又形成了盐分高值区。电导率由未滴灌前的0.70~0.76 mS/cm提升到0.76~0.86 mS/cm。整体来看,滴灌可有效地降低苜蓿植物根系的含盐量(图3b)。
2.1.3AMF孢子运移特征 图4为0~50 cm土层在滴灌AMF孢子处理下试验开始和试验结束时的土壤AMF孢子变化。由图4a可知,滴灌前AMF孢子主要集中在土层10~25 cm处,孢子数量在52~56个之间。土层0~10 cm和25~50 cm处的孢子数在44~49个之间。滴灌48 h后,不同土层深度的AM真菌孢子数目具有一定的差异。其中滴灌后的孢子主要集中在距滴头水平0~15 cm,深度0~25 cm处的土层,孢子数在38~52个范围内。其中0~10 cm处的土层孢子数最多。20~40 cm处AM真菌孢子数范围在34~40个内。整体上看,滴灌AM真菌孢子液后,孢子主要集中在滴头0~25 cm左右,对于远距离湿润区的孢子数有一定的下降趋势(图4b)。
2.2滴灌菌肥(AMF孢子)对紫花苜蓿的影响
2.2.1滴灌AMF孢子后紫花苜蓿的出苗情况 在距离滴灌点源10和20 cm的单位面积紫花苜蓿种子出苗过程如图5。在距离滴灌点10和20 cm处,开始滴灌后紫花苜蓿出苗高峰期在第2天到第5天,从曲线的倾斜度显示出距离滴灌点源10 cm处的苜蓿出苗速率大于20 cm处苜蓿的出苗速率。滴灌不同AMF孢子处理与对照组的出苗趋势基本相同。与对照相比,在距离滴灌点源10 cm处滴灌Gi处理的出苗数最多,而距离滴灌点源20 cm处滴灌Gm处理的出苗数最多。而其他菌种处理在第5天开始出苗数均大于对照组。第7天后出苗数逐渐稳定开始结束出苗。
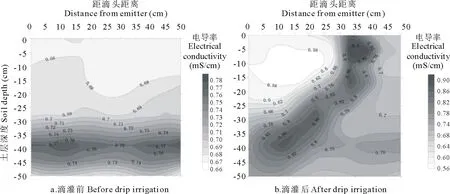
图3 滴灌前、后土壤含盐量的等值线图Fig.3 Contour map of soil salt content before and after drip irrigation

图4 滴灌前、后土壤AMF孢子剖面图Fig.4 Contour map of soil AMF spore before and after drip irrigation

图5 距离滴灌点源10和20 cm的单位面积紫花苜蓿种子出苗过程Fig.5 The germination of alfalfa seeds from 10 and 20 cm of the point source with distance drip irrigation A. 距滴头10 cm单位面积的苜蓿出苗率;B. 距滴头20 cm单位面积的苜蓿出苗率;Gm:摩西球囊霉;Gv:地表球囊霉;Gi:根内球囊霉;Ge:幼套球囊霉;CK:对照。A. Alfalfa germination rate of 10 cm per unit area of drip; B. Alfalfa germination rate of 20 cm per unit area of drip. Gm: Glomus mosseae; Gi: Glomus intraradices; Ge: Glomus etunicatum; Gv: Glomus versiforme; CK: Control.
2.2.2滴灌AMF孢子对苜蓿干重、根长度、株高、分枝数和叶绿素的影响 由表1可知,不同AM真菌孢子的滴灌处理对苜蓿生长具有一定的影响。其中滴灌菌种Gi的苜蓿植株干物质(地上、地下)显著高于对照6.59%和13.29%(P<0.05)。菌种Gm和Ge处理的地下干物质显著高于对照处理9.05%和9.96%(P<0.05)。而Gv处理的地下干重与对照无显著性差异,Gm和Ge的地上干物质与对照处理无显著性差异(P>0.05)。Gv地上干物质显著高于对照3.41%(P<0.05)。
Gi处理苜蓿的分枝数显著高于对照处理19.73%(P<0.05)。其他菌种间无显著性差异(P>0.05),但都显著高于对照处理(P<0.05)。Gi处理与Ge处理苜蓿叶绿素无显著性差异(P>0.05),但显著高于对照处理6.49%和10.39%(P<0.05)。其他处理与对照无显著性差异(P>0.05)。不同菌种处理的滴灌苜蓿根系长都显著高于对照处理(P<0.05)。Gv和Ge处理的株高显著高于对照处理11.97%和3.43%(P<0.05)。其他菌种处理株高与对照无显著性差异(P>0.05)(表1)。
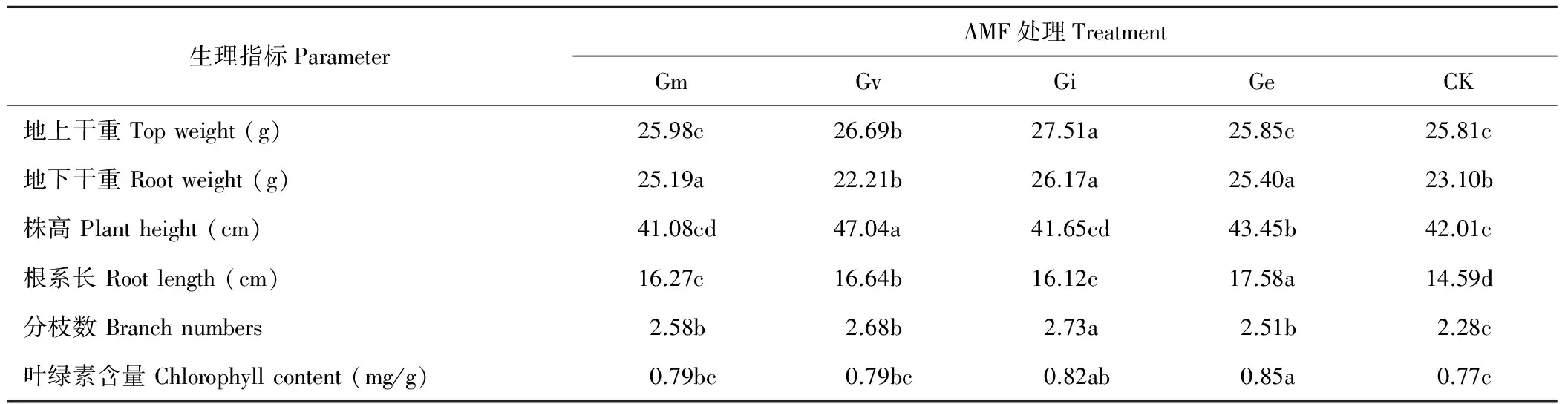
表1 滴灌不同AMF孢子水溶液对苜蓿植株生长的影响Table 1 Effects of different AMF spore aqueous solution on the growth of alfalfa plants under drip irrigation
注:同行不同字母表示差异显著(P<0.05);Gm:摩西球囊霉;Gv:地表球囊霉;Gi:根内球囊霉;Ge:幼套球囊霉;CK:对照。
Note:Different letters after the values in the same row indicated significant difference among treatments (P<0.05); Gm:Glomusmosseae; Gi:Glomusintraradices; Ge:Glomusetunicatum; Gv:Glomusversiforme; CK: Control.
2.2.3苜蓿AMF侵染率、孢子数和根瘤数

图6 滴灌AMF对紫花苜蓿的根瘤数、孢子数和侵染率的影响 Fig.6 Effects of drip irrigation AMF on nodule number, spore number and colonization of alfalfa 不同字母表示差异显著(P<0.05)。 Different letters indicate significant difference (P<0.05).
不同菌种处理的苜蓿根瘤数、孢子数和侵染率有一定的差异性。其中Gi和Ge处理的苜蓿植株根系的根瘤菌数、孢子数和侵染率显著高于对照处理(P<0.05),Gi和Ge处理间的根瘤菌数、孢子数和侵染率间差异不显著(P>0.05)。其他菌种处理与对照无显著性差异(P>0.05)(图6)。
2.2.4滴灌距离对苜蓿植物学性状的影响 距离滴头的10和20 cm处的苜蓿地上生物量和株高有显著性差异(P<0.05),其中10 cm处的植株地上生物量和株高分别显著高于20 cm处植株11.14%和3.70%(P<0.05)。植株的地下生物量、根长度、分枝数和叶绿素含量无显著性差异(P>0.05),10 cm处的植株地下生物量和根长度分别高于20 cm处植株5.37%和6.06%(表2)。
2.2.5滴灌距离对苜蓿侵染率、孢子数和根瘤数的影响 滴灌距离对植株根瘤数、侵染率和根际土壤孢子数具有一定的差异性。不同滴灌距离下植株根际土壤的孢子数具有显著性差异(P<0.05),其中10 cm处的植株根际土壤孢子数显著高于20 cm处植株10.89%(P<0.05)。滴灌距离对植株根系侵染率和根瘤数之间的差异性不显著(P>0.05)(表3)。

表2 滴灌距离对植株生长的影响Table 2 Effect of drip irrigation distance on plant growth
注:*为P<0.05,显著差异。下同。
Note:* forP<0.05, significant difference. The same below.
2.2.6交互效应对紫花苜蓿的影响 由表4可以看出菌根侵染率的AMF和距离都表现为差异不显著(P>0.05),但是AMF和距离的交互作用却表现为差异极显著(P<0.01);根瘤数的AMF和距离也都表现为差异不显著(P>0.05),AMF和距离的交互作用却表现为差异显著(P<0.05);孢子数、地上部分干重、地下部分干重、株高、分株数和叶绿素含量的AMF和距离虽然有不同程度的显著差异,但是它们的AMF和距离的交互作用却都表现为差异不显著(P>0.05)。
3 讨论
AM真菌一直被认为是好氧微生物,但已有研究证实湿地植物具有AM结构[25-27],根据土壤水分、盐分和AM真菌孢子的分布状态与作物根系分布的密切相关性,本试验研究结果显示,土壤盐分一般随着土壤水分的运动而迁移[28-29],脱盐区的形状类似于水分运移湿润区形状,滴头附近土壤盐分明显降低,在土壤湿润区边缘逐渐出现盐分的积累。在距离滴头30 cm左右形成明显的脱盐区,说明滴灌对于土壤中的盐分进行了再分配,使苜蓿根系处于脱盐区范围内,与前人研究结果一致[30]。AM真菌在盐胁迫环境下可促进苜蓿植株生长发育及渗透调节物质的积累[31],因此研究AM真菌孢子在新疆盐碱土的分布具有重要意义。滴灌前AMF孢子主要集中在土层10~25 cm处,0~10 cm处孢子数最多。在滴灌AMF孢子后,不同土层深度的AM真菌孢子数具有一定的差异, 孢子大部分集中在滴头0~25 cm左右。而对于远距离湿润区的孢子数有一定的下降趋势,可能是受土壤因子的影响[32],也有可能与AM真菌的专性活体营养及好氧微生物的生物学特性随着土层深度的增加逐渐缺氧死亡有关。
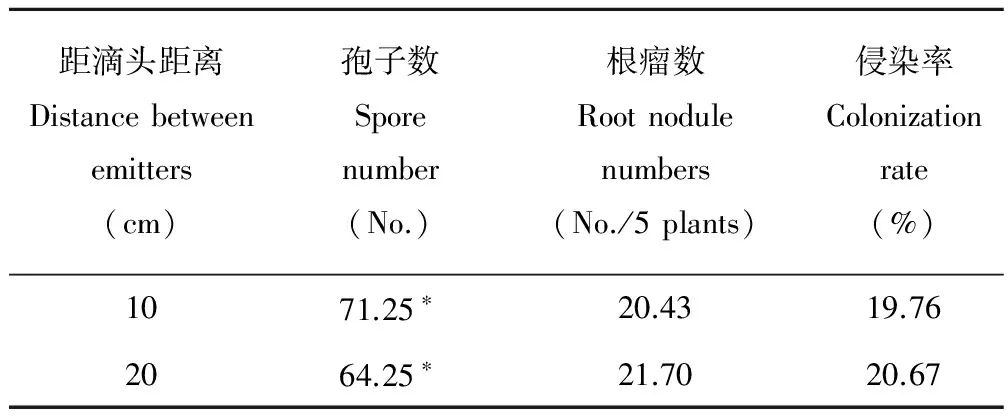
表3 不同滴灌距离对苜蓿侵染率、孢子数和根瘤数的影响Table 3 Effects of different drip irrigation distance on alfalfa infection rate, spore number and nodule number

表4 紫花苜蓿试验数据的双因素方差分析Table 4 Two-way ANOVA of experimental data from alfalfa
注:**为P<0.01,*为P<0.05,NS为差异不显著。
Note:** meanP<0.01, * meanP<0.05, NS mean not significant.
本试验利用滴灌设备将AM孢子水溶液直接输送到植物根际,并观察其对苜蓿植株生长的影响。试验表明,不同菌种处理的促进效果存在较大差异。其中Gi与Ge处理对苜蓿叶绿素无显著性差异,但显著高于对照处理6.49%和10.39%。Gi与Ge处理的地下干物质显著高于对照13.29%和9.96%。有可能是AM真菌可使植株内叶绿素含量增加,加快叶片光合作用速率与植株体内干物质的积累,从而为细胞生长提供了充足的物质基础,这可能是引起AM真菌促进紫花苜蓿生长发育的一个重要原因。不同菌种处理的滴灌苜蓿根系长都显著高于对照处理(P<0.05)。其中Gv和Ge处理的株高显著高于对照处理。其他菌种处理株高与对照无显著性差异(P>0.05)。说明菌种Gv和Ge对紫花苜蓿的株高具有正效应,促进苜蓿的生长发育。这与在香椿(Toonasinensis)[33]、黄瓜(Cucumissativus)[34]等植物上试验的结果相一致。然而菌种间的差异,可能由于植物与AM真菌之间共生关系具有一定的选择性,另外与菌根真菌种间的生理特征差异也有一定关系。滴灌菌种Gi孢子水溶液对于苜蓿干物质(地上、地下)、叶绿素、根系长分别显著高于对照处理(P<0.05)。说明菌根真菌Gi在促进紫花苜蓿生长发育方面具有更为显著的促进效果,可能由于不同菌株促进紫花苜蓿生长的作用机制存在一定的差异,而菌种Gi与苜蓿植物有更好的亲和性,但具体的原因还有待进一步的研究。
不同菌种处理的苜蓿根瘤数、孢子数和侵染率有一定的差异性。其中Gi和Ge处理的苜蓿根系的根瘤菌数、孢子数和侵染率显著高于对照处理(P<0.05)。其他处理与对照无显著性差异(P>0.05)。这与马雷猛等[35]在湿地植物香蒲(Typhaelatifolia)和水稻(Oryzasativa)植株试验结果不一致,可能由于植物与AM 真菌之间共生关系有一定的选择性,高效菌根菌可以与宿主植物有更好的亲和性,并促进植物体内物质的代谢和循环以及植物对养分和水分的吸收。因此,在提高紫花苜蓿产量方面高效菌种Ge的作用更为显著。在AM孢子水溶液对苜蓿的应用效果来看Gi菌种效果较好。距滴头距离的不同对植株产生的影响不同,可能由于滴灌后水分、盐分和AMF孢子的再分布所影响。播种初期近距离的滴灌苜蓿种子要比远距离滴灌的苜蓿出苗速度快,可能由于近距离的种子可以较快的吸水膨胀促进了出苗。在后期近距离滴灌的植株的干重(地上、地下)、株高都高于远距离滴灌植株。在生长初期,菌根主要是促进幼苗的生长和成活,但随着植株的不断生长,对养分的需求增加以及形成菌根的时间不同,从而使得在养分的竞争中的不均衡,导致了植株间出现了差异[36]。近距离滴灌后的植物根际土壤孢子数显著高于远距离的植株(P<0.05),与上述研究结果显示的0~10 cm处孢子数最多相应。
4 结论
滴灌前土壤含水量呈现出表层低而深层高的总体特点,土层30~60 cm处的电导率比0~30 cm处的电导率高,分布范围较均匀。不同土层深度孢子数具有一定的差异性,其中AM真菌孢子主要集中在土层10~25 cm处。滴灌后,水分大部分集中在距离滴头30 cm左右的土层,润湿范围内的含水量较滴灌前呈不同程度的升高。在滴头附近盐分向四周扩散,在距离滴头30~45 cm处形成盐分高值区。孢子主要集中在距滴头0~25 cm左右,对于远距离的湿润区,其孢子数有一定的下降趋势。
滴灌不同AM菌种孢子水溶液及滴灌距离对苜蓿的影响具有一定的差异性。近距离滴灌的植株地上生物量和株高显著高于远距离的植株(P<0.05)。滴灌菌种Gi的苜蓿植株干物质(地上、地下)显著高于对照6.59%和13.29%(P<0.05)。菌种Gm、Gi和Ge处理的地下干物质显著高于对照处理9.05%,13.29%和9.96%(P<0.05),而Gv处理的地下干重与对照无显著性差异。Gi处理苜蓿的分枝数显著高于对照处理19.73%(P<0.05)。其他菌种间无显著性差异但都显著高于对照处理。Gi和Ge处理的苜蓿植株的根瘤数、孢子数和侵染率显著高于对照处理(P<0.05)。其他菌种处理的根瘤数、孢子数和侵染率与对照无显著性差异(P>0.05)。滴灌菌种间菌根侵染率和根瘤数无显著性差异(P>0.05)。滴灌距离对植株地下部干重、株高、孢子数有显著性影响。滴灌距离和滴灌不同菌种的互作除了菌根侵染率、根瘤数和根长具有显著影响外,对其余的各指标都没有显著性的影响。综合分析,滴灌菌种Gi孢子水溶液对于苜蓿干物质(地上、地下)、叶绿素、根系长分别显著高于对照处理(P<0.05)。说明根菌真菌Gi在促进紫花苜蓿生长发育方面具有更为显著的促进效果,可能是由于不同菌株促进紫花苜蓿生长的作用机制存在一定的差异,而菌种Gi与苜蓿植物有更好的亲和性,Gi菌种的滴灌应用对苜蓿的效果也最好。
References:
[1] Sun Q Z, Liu Q, Tao Y,etal. Research on the introduction of alfalfa into China during the Han Dynasty. Acta Prataculturae Sinica, 2016, 25(12): 194-205. 孙启忠, 柳茜, 陶雅, 等. 汉代苜蓿传入我国的时间考述. 草业学报, 2016, 25(12): 194-205.
[2] Sun Q Z, Liu Q, Li F,etal. Alfalfa in ancient China: Botanical aspects. Acta Prataculturae Sinica, 2016, 25(5): 202-213. 孙启忠, 柳茜, 李峰, 等. 我国古代苜蓿的植物学研究考. 草业学报, 2016, 25(5): 202-213.
[3] Song L P, Luo Z Z, Li L L,etal. Effect of lucerne-crop rotations on soil physical properties in the semiarid Loess Plateau of Central Gansu. Acta Prataculturae Sinica, 2015, 24(7): 12-20. 宋丽萍, 罗珠珠, 李玲玲, 等. 陇中黄土高原半干旱区苜蓿-作物轮作对土壤物理性质的影响. 草业学报, 2015, 24(7): 12-20.
[4] Li S X, Wang Y R, Sun J H. Genetic diversity of seed yield characteristics in Chinese alfalfa (Medicagosativa) varieties. Acta Prataculturae Sinica, 2003, 12(1): 23-29. 李世雄, 王彦荣, 孙建华. 中国苜蓿品种种子产量性状的遗传多样性. 草业学报, 2003, 12(1): 23-29.
[5] Gao Y, Ren Z B, Duan R P,etal. High yield cultivation technique of alfalfa drip irrigation. Xinjiang Farmland Reclamation Science & Technology, 2011, 34(3): 11. 高杨, 任志斌, 段瑞萍, 等. 苜蓿滴灌高产栽培技术. 新疆农垦科技, 2011, 34(3): 11.
[6] Qiao X. Regulation of Arbuscular Mycorrhizal Fungi in Plant-Plant Interactions[D]. Beijing: China Agricultural University, 2016. 乔旭. 丛枝菌根真菌在植物种间互作中的调节机制[D]. 北京: 中国农业大学, 2016.
[7] Li J S. Studying on between Hyphal Infection Characteristics of AMF and Phylogeny of Plant[D]. Lanzhou: Lanzhou University, 2016. 李军帅. 丛枝菌根真菌菌丝侵染特性与植物系统性关系的研究[D]. 兰州: 兰州大学, 2016.
[8] Ruiz F M, Palencia P, Weiland C M,etal. Response of two strawberry cultivars to inoculation with arbuscular mycorrhizal fungus in different soils[C]//Symposium on Horticulture in Europe. 2012: 82.
[9] Rhodes L H, Gerdemann J W. Hyphal translocation and uptake of sulfur by vesicular-arbuscular mycorrhizae of onion. Soil Biology & Biochemistry, 1978, 10(5): 355-360.
[10] Chen Y Y. Growth and nutrient content of trifoliate orange seedlings influenced by arbuscular mycorrhizal fungi inoculation in low magnesium soil. Journal of Plant Nutrition, 2015, 38(10): 1516-1529.
[11] Bowen G D, Skinner M F, Bevege D I. Zinc uptake by mycorrhizal and uninfected roots ofPinusradiataandAraucariacunninghamii. Soil Biology & Biochemistry, 1974, 6(3): 141-144.
[12] Zubek S, Rola K, Szewczyk A,etal. Enhanced concentrations of elements and secondary metabolites inViolatricolorL. induced by arbuscular mycorrhizal fungi. Plant and Soil, 2015, 390(1): 129-142.
[13] Gai J, Gao W, Liu L,etal. Infectivity and community composition of arbuscular mycorrhizal fungi from different soil depths in intensively managed agricultural ecosystems. Journal of Soils and Sediments, 2015, 15(5): 1200-1211.
[14] Voríšková A, Janoušková M, Slavíková R,etal. Effect of past agricultural use on the infectivity and composition of a community of arbuscular mycorrhizal fungi. Agriculture Ecosystems & Environment, 2016, 221: 28-39.
[15] Estaún V, Savé R, Biel C. AM inoculation as a biological tool to improve plant revegetation of a disturbed soil withRosmarinusofficinalisunder semi-arid conditions. Applied Soil Ecology, 1997, 6(3): 223-229.
[16] Grandmaison J, Olah G M, Calsteren M R V,etal. Characterization and localization of plant phenolics likely involved in the pathogen resistance expressed by endomycorrhizal roots. Mycorrhiza, 1993, 3(4): 155-164.
[17] Omirou M, Fasoula D A, Ioannides I M. Bradyrhizobium, inoculation alters indigenous AMF community assemblages and interacts positively with AMF inoculum to improve cowpea performance. Applied Soil Ecology, 2016, 108: 381-389.
[18] Ishii A F C T. Arbuscular mycorrhizal fungal spores host bacteria that affect nutrient biodynamics and biocontrol of soil-borne plant pathogens. Biology Open, 2012, 1(1): 52-57.
[19] Borowicz V A. Do arbuscular mycorrhizal fungi alter plant-pathogen relations. Ecology, 2001, 82(11): 3057-3068.
[20] Maron J L, Connors P G. A native nitrogen-fixing shrub facilitates weed invasion. Oecologia, 1996, 105(3): 302-312.
[21] Saito M, Marumoto T. Inoculation with arbuscular mycorrhizal fungi: the status quo in Japan and the future prospects. Plant and Soil, 2002, 244(1): 273-279.
[22] Hobart J. Weighing method: US, US4010809[P]. 1977.
[23] Reimar W I, Oberhans J. Measurement method: EP, EP 0246404 A2[P]. 1987.
[24] Wu Q S, Yuan F Y, Fei Y J,etal. Effects of arbuscular mycorrhizal fungi on root system architecture and sugar contents of white clover. Acta Prataculturae Sinica, 2014, 23(1): 199-204. 吴强盛, 袁芳英, 费永俊, 等. 丛枝菌根真菌对白三叶根系构型和糖含量的影响. 草业学报, 2014, 23(1): 199-204.
[25] Wang K, Zhao Z. Occurrence of arbuscular mycorrhizas and dark septate endophytes in hydrophytes from lakes and streams in Southwest China. Internationale Revue Der Gesamten Hydrobiologie Und Hydrographie, 2006, 91(1): 29-37.
[26] Wilde P, Manal A, Stodden M,etal. Biodiversity of arbuscular mycorrhizal fungi in roots and soils of two salt marshes. Environmental Microbiology, 2009, 11(6): 1548-1561.
[27] Xu P B, Deng J M, Zhao C M. Study on grassland community characteristics and species diversity along altitudinal gradients in the Gahai wetland, Gansu province. Acta Prataculturae Sinica, 2012, 21(2): 219-226. 徐鹏彬, 邓建明, 赵长明. 甘肃尕海湿地不同海拔草地群落组分及物种多样性研究. 草业学报, 2012, 21(2): 219-226.
[28] Wang Z H, Yang P L, Zhen X R,etal. Soil salinity changes of root zone and arable in cotton field with drip irrigation under mulch for different years. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(4): 90-99. 王振华, 杨培岭, 郑旭荣, 等. 膜下滴灌系统不同应用年限棉田根区盐分变化及适耕性. 农业工程学报, 2014, 30(4): 90-99.
[29] Zhang W, Lv X, Li L H,etal. Salt transfer law for cotton field with drip irrigation under the plastic mulch in Xinjiang region. Transactions of the Chinese Society of Agricultural Engineering, 2008, 24(8): 15-19. 张伟, 吕新, 李鲁华, 等. 新疆棉田膜下滴灌盐分运移规律. 农业工程学报, 2008, 24(8): 15-19.
[30] Yang P N, Dong X G, Liu L,etal. Soil salt movement and regulation of drip irrigation under plastic film in arid area. Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(12): 90-95. 杨鹏年, 董新光, 刘磊, 等. 干旱区大田膜下滴灌土壤盐分运移与调控. 农业工程学报, 2011, 27(12): 90-95.
[31] Lu S, Guo H, Wang S M,etal. Effects of AM fungi on growth and physiological characters ofMedicagosativaL. under NaCl stress. Journal of Soil and Water Conservation, 2011, 25(2): 227-231. 陆爽, 郭欢, 王绍明, 等. 盐胁迫下AM真菌对紫花苜蓿生长及生理特征的影响. 水土保持学报, 2011, 25(2): 227-231.
[32] Gai J P, Liu R J. Effects of soil factors on arbuscular mycorrhizae (AM) fungi around roots of wild plants. Chinese Journal of Applied Ecology, 2003, 14(3): 470-472. 盖京苹, 刘润进. 土壤因子对野生植物AM真菌的影响. 应用生态学报, 2003, 14(3): 470-472.
[33] Meng X X, Li M, Wang Y S,etal. Effect of arbuscular mycorrhizal fungi and phosphorus on the growth ofToouasinesis(A.Juss) Roem. Journal of Laiyang Agricultural College, 2000, 17(3): 170-172. 孟祥霞, 李敏, 王幼珊, 等. 丛枝菌根真菌对香椿实生苗生长的影响. 莱阳农学院学报, 2000, 17(3): 170-172.
[34] Wang C X, Qin L, Feng G. Soil salinity changes of root zone and arable in cotton field with drip irrigation under mulch for different years. Journal of Agricultural Environmental Science, 2003, 6(3): 301-303. 王昌宪, 秦岭, 冯固. 三种丛枝菌根真菌对黄瓜幼苗生长的影响. 农业环境科学学报, 2003, 6(3): 301-303.
[35] Ma L M, Wang P T, Wang S G. Effect of flooding time length on mycorrhizal colonization of three AM fungi in two wetland plants. Environmental Science, 2014, 35(1): 263-270. 马雷猛, 王鹏腾, 王曙光. 淹水时长对3种丛枝菌根(AM)真菌侵染2种湿地植物的影响. 环境科学, 2014, 35(1): 263-270.
[36] Watts-Williams S J, Cavagnaro T R. Using mycorrhiza-defective mutant genotypes of non-legume plant species to study the formation and functioning of arbuscular mycorrhiza: a review. Mycorrhiza, 2015, 25(8): 587-597.
Dripirrigationofarbuscularmycorrhizalfungalsporesandtheirgrowth-promotingeffectsonalfalfa
JING Peng-Cheng, LV Yan-Ping, WANG Shu-Lin, CHEN Yi-Shi, LU Wei-Hua*
CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832000,China
We drew an isoline map of soil moisture content, soil salt content, and spores of arbuscular mycorrhizal fungi (AMF) on alfalfa using Sufer software to analyze the AMF migration state before and after regular drip irrigation. Alfalfa was drip-irrigated at different rates with solutions containing AMF spores. The mycorrhizal infection rate, number of nodules, biomass, and sporulation performance were measured after 50 days of irrigation to evaluate the effects of supplying AMF by this method. The results showed that the number of AMF spores in aqueous solution decreased over time, the soil moisture content was low in upper soil layers and high in deeper soil layers before drip irrigation, and the soil conductivity distribution was uniform. The AMF spores were mainly concentrated in the 10-25 cm soil layer after drip irrigation. The drip water was mostly concentrated within 30 cm of the dripper, and the soil water in this region was higher after drip irrigation than before. Salts were also distributed by the dripper, and concentrated in soil at a distance of 30-45 cm from the dripper. The AMF spores were mainly concentrated within 0-25 cm distance of the dripper, and their abundance decreased with increasing distance from the dripper. Alfalfa growth was affected by drip irrigation of AMF fungal spores and the distance from the dripper. The aboveground biomass and height of alfalfa were significantly higher for plants close to the dripper than for plants more distant from the dripper (P<0.05). The aboveground and belowground biomass of alfalfa were higher for plants irrigated with Gi AMF spore solution than for those in the control (P<0.05). The underground biomass was significantly higher for alfalfa plants irrigated with Gm, Gi, and Ge AMF spore solutions than for those in the control (P<0.05). There was no significant difference in underground biomass of alfalfa between plants irrigated with Gv AMF spore solution and those in the control. The number of alfalfa branches was significantly higher for plants irrigated with Gi AMF spores than for plants in the control (P<0.05). The root nodule number, spore number, and infection rate of alfalfa were significantly higher for plants irrigated with Gi and Ge AMF spore solutions (P<0.05) than for those in the control. The distance from the dripper significantly affected underground biomass, plant height. and number of spores (P<0.05). The interaction between distance from the dripper and AMF strain did not have significant effects for most tested indices, except for infection rate, nodule number, and root length. These results showed that drip irrigation of a solution containing Gi AM fungal spores is beneficial for alfalfa.
alfalfa; AM fungi; drip irrigation
10.11686/cyxb2016453
http://cyxb.lzu.edu.cn
景鹏成, 吕艳萍, 王树林, 陈乙实, 鲁为华. 滴灌AM真菌孢子水溶液对苜蓿的促生长效应研究. 草业学报, 2017, 26(9): 121-131.
JING Peng-Cheng, LV Yan-Ping, WANG Shu-Lin, CHEN Yi-Shi, LU Wei-Hua. Drip irrigation of arbuscular mycorrhizal fungal spores and their growth-promoting effects on alfalfa. Acta Prataculturae Sinica, 2017, 26(9): 121-131.
2016-11-29;改回日期:2017-03-13
兵团博士资金专项(2012BB017)和国家牧草产业技术体系项目(CARS-35)资助。
景鹏成(1992-),男,甘肃民勤人,硕士。E-mail:1107463928@qq.com*通信作者Corresponding author. E-mail:winnerlwh@sina.com

