酶响应水凝胶研究进展
(1.淄博职业学院 制药与生物工程系,山东 淄博 255314; 2.中国石油大学化学工程学院 重质油国家重点实验室,山东 青岛 266580)
酶响应水凝胶研究进展
白靖琨1,2
(1.淄博职业学院制药与生物工程系,山东淄博255314;2.中国石油大学化学工程学院重质油国家重点实验室,山东青岛266580)
本文简要介绍了环境响应型水凝胶的研究现状,重点分析了酶响应水凝胶,包括谷氨酰胺转氨酶、激酶与磷酸酶、酪氨酸酶、枯草杆菌蛋白酶与嗜热菌蛋白酶、过氧化物酶、酯酶与核酸内切酶等引起水凝胶响应的酶因素,并介绍了酶响应引起自组装的形成、自组装的破坏以及动态自组装等材料响应。此外,分析了酶响应水凝胶研究中存在的问题,并介绍了肽水凝胶的生物学功能。
环境响应型水凝胶; 酶响应水凝胶; 功能; 自组装
1 引 言
环境响应型水凝胶是智能敏感材料中的一种,对于外界条件的影响做出响应,其自身性质会发生明显变化,并伴随水凝胶的形成或破坏。目前研究较多的环境刺激因素如pH值、温度、超声、光照等[1-2];此外,酶响应因素在近年来开始引起人们的广泛关注。酶响应型水凝胶作为新兴的一种环境响应型水凝胶,其组成材料多为肽及衍生物,合成高聚物等,主要指对酶的催化作用具有特殊响应特性,并伴随水凝胶形成或破坏的一种智能水凝胶。肽及衍生物由氨基酸序列组成,除了设计可控外,还能对周围的环境刺激因素,尤其是酶刺激因素做出有效响应。以肽及衍生物为组成材料的水凝胶,简称为肽水凝胶。我们结合近年来的研究文献,简要介绍了环境响应型水凝胶,基于不同的酶因素,重点介绍了酶响应型水凝胶,以及酶响应引起自组装的形成、破坏,动态自组装等,并对自组装形貌改变与宏观结构改变之间的关系进行了阐述。
2 环境响应型水凝胶
自1993年张曙光研究离子互补肽(AKAKAEAE)2的自组装行为,并形成水凝胶以来[3],离子互补肽[3]、β-发卡肽[4]等肽自组装行为被发现, pH等[5]环境响应型肽水凝胶引起人们的广泛研究。能感知、响应如pH值、温度、超声、光照等理化因素带来的微小变化与刺激,引起自身自组装形貌的改变,并可导致宏观结构的改变,如水凝胶形成或破坏的材料被称为环境响应型材料。此类研究已经非常广泛[6],如pH值可以引起氨基酸侧链电荷性质发生变化,从而影响肽的自组装。谭天伟课题组[5]设计了pH敏感型肽RATEA16(Ac-[RATARAEA]2-CONH2),当pH为酸性时,分子带有大量的正电荷,不能形成纤维结构,此时为溶液;当pH为碱性时,肽分子为电中性,产生沉淀;当pH为中性时,分子携带电荷与分子间氢键作用及反平行的β-折叠能力达到平衡,自组装为纤维,易形成水凝胶。温度会影响材料的相状态或引起材料的溶胀和收缩。Pochan等人[7]设计的发卡肽序列VKVKVKTK-VDPPT-KVKTKVKV-NH2(MAX3),当温度升高时,分子内折叠形成凝胶,当温度降低,水凝胶溶解。
超声,即高频(>20kHz)压力波,在超分子材料中可以破坏分子间的相互作用,已被用于控制自组装和凝胶化过程。 Ulijn等人对DFFD的甲醇溶液进行定向超声处理,肽从杂乱无章的短纤维形成定向纤维簇,同时伴随凝胶的形成[8]。Kraatz等人将Fc-VFF(Fc=二茂铁)溶于热甲苯溶液,进行冷却,随后超声,形貌从纳米棒转变为纳米纤维,同时形成水凝胶,不进行超声则无法形成水凝胶。超声有助于分子间氢键更快地形成,并可能引起肽分子的结构变化,促进形成纳米纤维,进一步形成水凝胶[9]。
可见光或者UV光可引起光敏基团的断裂或者通过吸附氢供体,从而产生自由基,促使聚合作用形成交联水凝胶。偶氮苯及其衍生物,在紫外-可见光的照射下,引发反式-顺式结构的转换,应用广泛[10-11]。李峻柏等人研究紫外/可见光引发材料可逆结构转变。乙氧基偶氮苯磺酸与阳离子二肽FF·HCl,在可见光照射下,乙氧基偶氮苯磺酸形成反式结构,与FF·HCl共组装形成分枝结构;在紫外光照射下,乙氧基偶氮苯磺酸形成顺式结构,阳离子二肽FF·HCl游离出来,自组装形成囊泡结构[12]。
3 酶响应型水凝胶
自2004年第一篇关于磷酸酶刺激肽水凝胶形成的文献报道后,酶响应型水凝胶开始引起人们的关注[13]。肽来自生物体,是酶作用的重要底物之一,所以大多数酶响应型水凝胶的组成材料是基于肽及其衍生物,以及具有酶作用位点的合成高聚物等[13]。肽水凝胶降解后的产物都是氨基酸,一般不会引起人体的非特异性免疫反应,所以,肽及其衍生物作为酶响应型水凝胶的组成材料,研究更为广泛。
3.1谷氨酰胺转氨酶响应型水凝胶
酶可以催化肽及衍生物形成共价交联产物,如谷氨酰胺转氨酶催化形成材料内的交叉联接,已被用来加强酶响应材料结构。Liu等人使用物理交联的明胶,加入谷氨酰胺转氨酶后,可以与富含赖氨酸和谷氨酰胺的蛋白质形成化学共价交联网络结构,流变学实验表明水凝胶可快速形成,并具有热响应性,在15℃~50℃范围内,随着温度的升高,储能模量降低,细胞可存活于交联基质中培养[14]。
3.2激酶/磷酸酶响应型水凝胶
激酶能够在5’-腺苷三磷酸(ATP)的存在下使分子磷酸化,磷酸酶能够催化去磷酸化反应,激酶/磷酸酶体系可被用来设计可逆性酶响应材料。徐兵等人研究在碱性磷酸酶的作用下,Fmoc-pY去磷酸化生成Fmoc-Y,形成自支撑水凝胶,水凝胶的储能模量在1000Pa左右[13]。随后该课题组报道数篇关于磷酸酶的研究。如短肽Nap-FFGEY可自组装形成超分子水凝胶,加入激酶后肽磷酸化为Nap-FFGEpY,亲水性增强,水凝胶破坏,再加入磷酸酶,水凝胶再次形成,皮下注射Nap-FFGEpY进入小鼠体内1小时后可形成水凝胶,Nap-FFGEY的生成率约80.5%,这种调控水凝胶状态的仿生方法,为设计和建造生物材料提供了新的思路,见图1[15]。
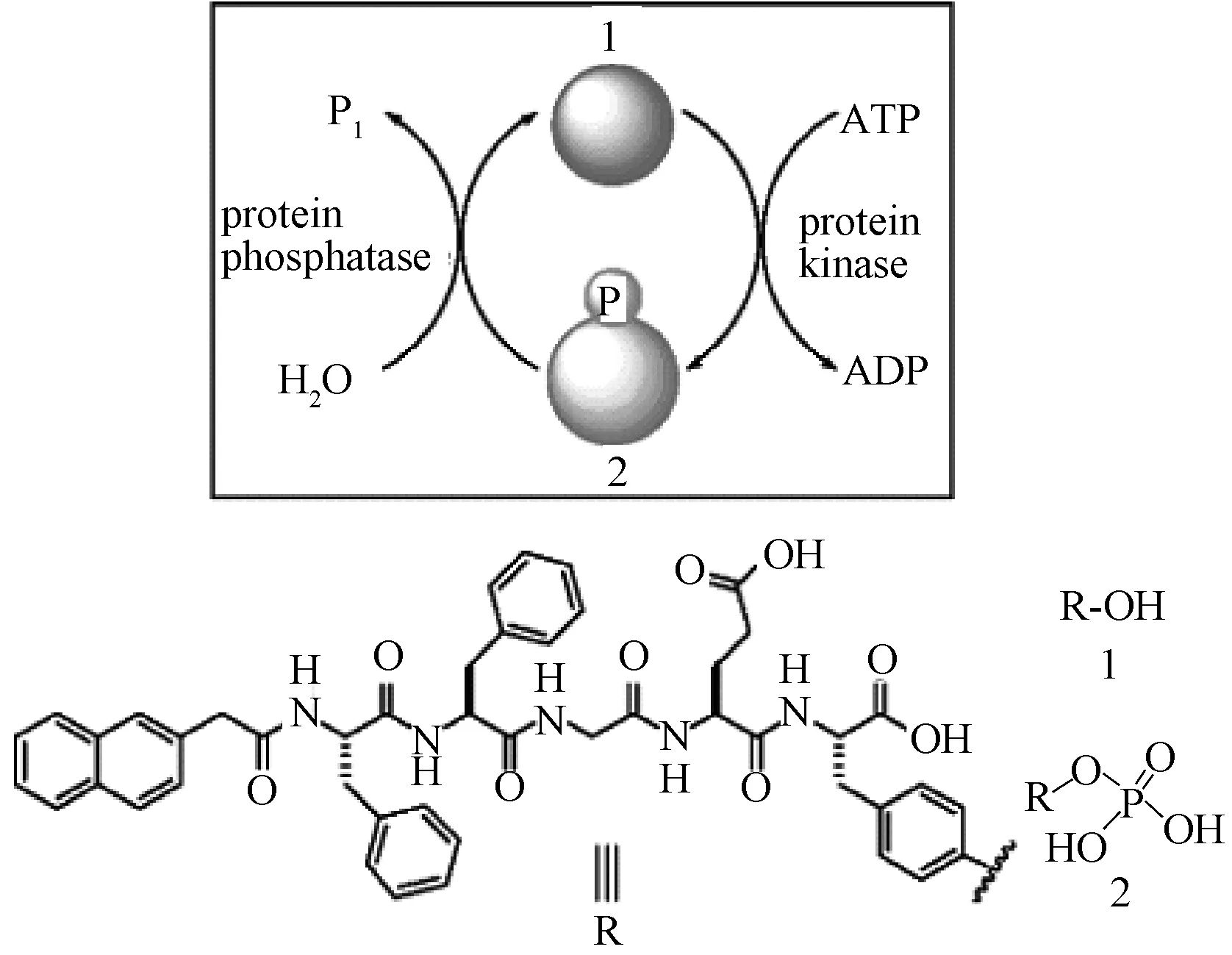
图1 短肽Nap-FFGEY在激酶和磷酸酶作用下的动态转换[15]Fig.1 Dynamic conversion of short peptide Nap-FFGEY in the role of kinase and phosphatase[15]
3.3酪氨酸酶响应型水凝胶
酪氨酸酶含铜离子,在氧气存在的条件下,能催化苯酚氧化成活化的醌类,活化的苯醌可与羟基或氨基进行加成反应,发生迈克尔加成反应,如图2所示[16-17]。杨志谋等人设计肽序列Ac-YYYpY-OMe,Ac-FYYpY-OMe,Ac-FFYpY-OMe,Ac-FFFpY-OMe,在磷酸酶的作用下去磷酸化后都形成水凝胶,进一步加入酪氨酸酶后,Ac-YYYY-OMe水凝胶破坏,生成醌类化合物,形成褐色溶液,其余三条肽去磷酸化形成的水凝胶,在加入酪氨酸酶一周后,颜色由无色变为褐色,仍然形成水凝胶,核磁共振表明醌的生成率在70%以上。此结果表明,苯环间的相互作用对凝胶的稳定性至关重要,其中Ac-FFFpY-OMe去磷酸化后成胶强度最高,储能模量稳定在3000Pa以上[18]。
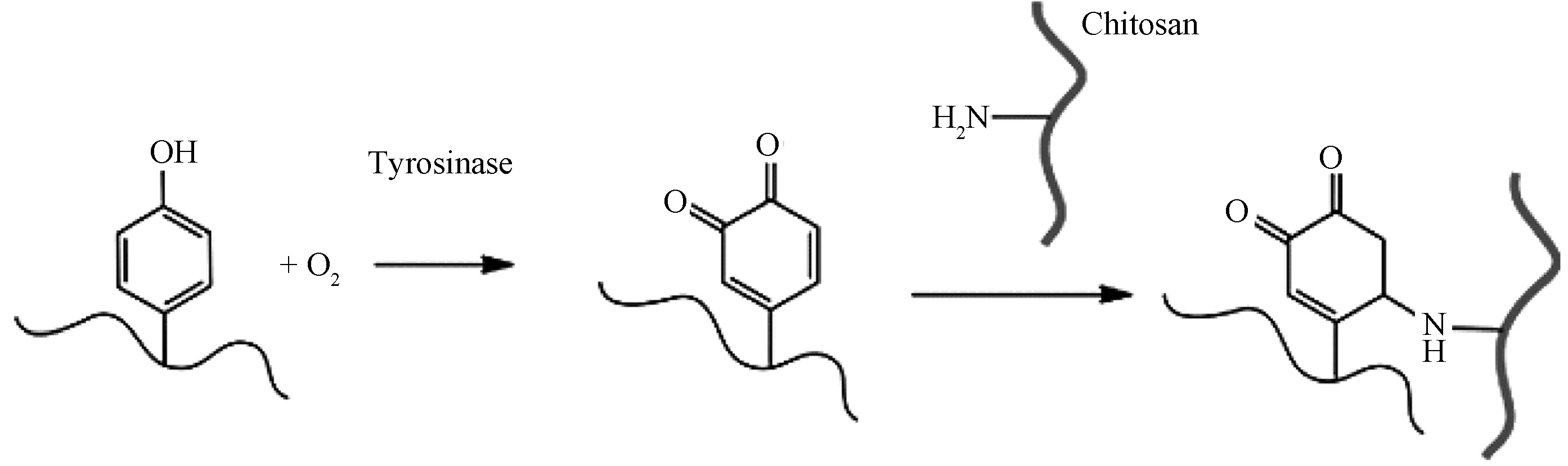
图2 酪氨酸酶催化下的酶促反应机理[16-17]Fig.2 Mechanism of enzymatic reaction catalyzed by tyrosinase[16-17]
3.4枯草杆菌蛋白酶与嗜热菌蛋白酶
枯草杆菌蛋白酶可催化氨基酸的水解,嗜热菌蛋白酶可催化氨基酸的合成。Uljin课题组考察Fmoc-F与FF在嗜热菌蛋白酶作用下反应生成Fmoc-F3,形成自支撑水凝胶,冷冻扫描电镜观察结果显示自组装形貌为纳米纤维[19]。Williams等人研究Fmoc-T与L-OMe或F-OMe在嗜热菌蛋白酶的作用下分别生成Fmoc-TL-OMe与Fmoc-TF-OMe;在嗜热菌蛋白酶催化生成Fmoc-TL-OMe后,再加入F-OMe,Fmoc-TL-OMe迅速减少,大量生成Fmoc-TF-OMe,对热力学控制下的酶促自组装进行了深入研究[20]。此外,Hughe等人进一步研究了嗜热菌蛋白酶形成Fmoc-SF-OMe等短肽(图3)[21]。Ulijn等人研究Fmoc-L3-OMe在枯草杆菌蛋白酶的作用下催化酯键水解生成Fmoc-L3,红外光谱、荧光光谱和广角X射线衍射数据证实,分子间的π-π堆积作用驱动形成β-折叠结构,聚集扭转成纳米管结构,表现出较强的电荷输送能力,有望用于电子元器件的制作[22]。Hirst等人研究Fmoc-YL-OMe在枯草杆菌蛋白酶的作用下,酯键断裂生成Fmoc-YL,分子自组装为纳米纤维结构,同时伴随水凝胶的形成[23]。

图3 嗜热菌蛋白酶催化下形成(a)Fmoc-SF-OMe,(b)Fmoc-SL-OMe,(c)Fmoc-TF-OMe,(d)Fmoc-TL-OMe的TEM照片与光学照片[21]Fig.3 TEM micrographs and images of of (a) Fmoc-SF-OMe, (b) Fmoc-SL-OMe, (c) Fmoc-TF-OMe, and (d) Fmoc-TL-OMe in the presence of thermolysin[21]
3.5过氧化物酶响应型水凝胶
目前研究较多的过氧化物酶如辣根过氧化物酶,可迅速与过氧化氢结合形成复合体,该复合体能够氧化酪氨酸等的酚羟基形成聚合物,快速原位形成超分子水凝胶。Tran等人研究酪氨酸封端化合物与壳聚糖衍生物在辣根过氧化物酶(HRP)和过氧化氢(H2O2)的作用下形成聚合物PRx-CHPA(图4),在5秒到10分钟内快速形成超分子凝胶,此外,水凝胶表现出了良好的细胞相容性,成纤维细胞在水凝胶上方培养24小时后,荧光显微镜图像显示绝大部分细胞存活[24]。此外,Sofia报道了聚天冬氨酸与芳族基团在过氧化氢酶的作用下交联形成聚合物,可用于制备水凝胶,同时考察了凝胶溶胀率、储能模量和耗能模量,确定形成凝胶的最佳反应条件[25]。
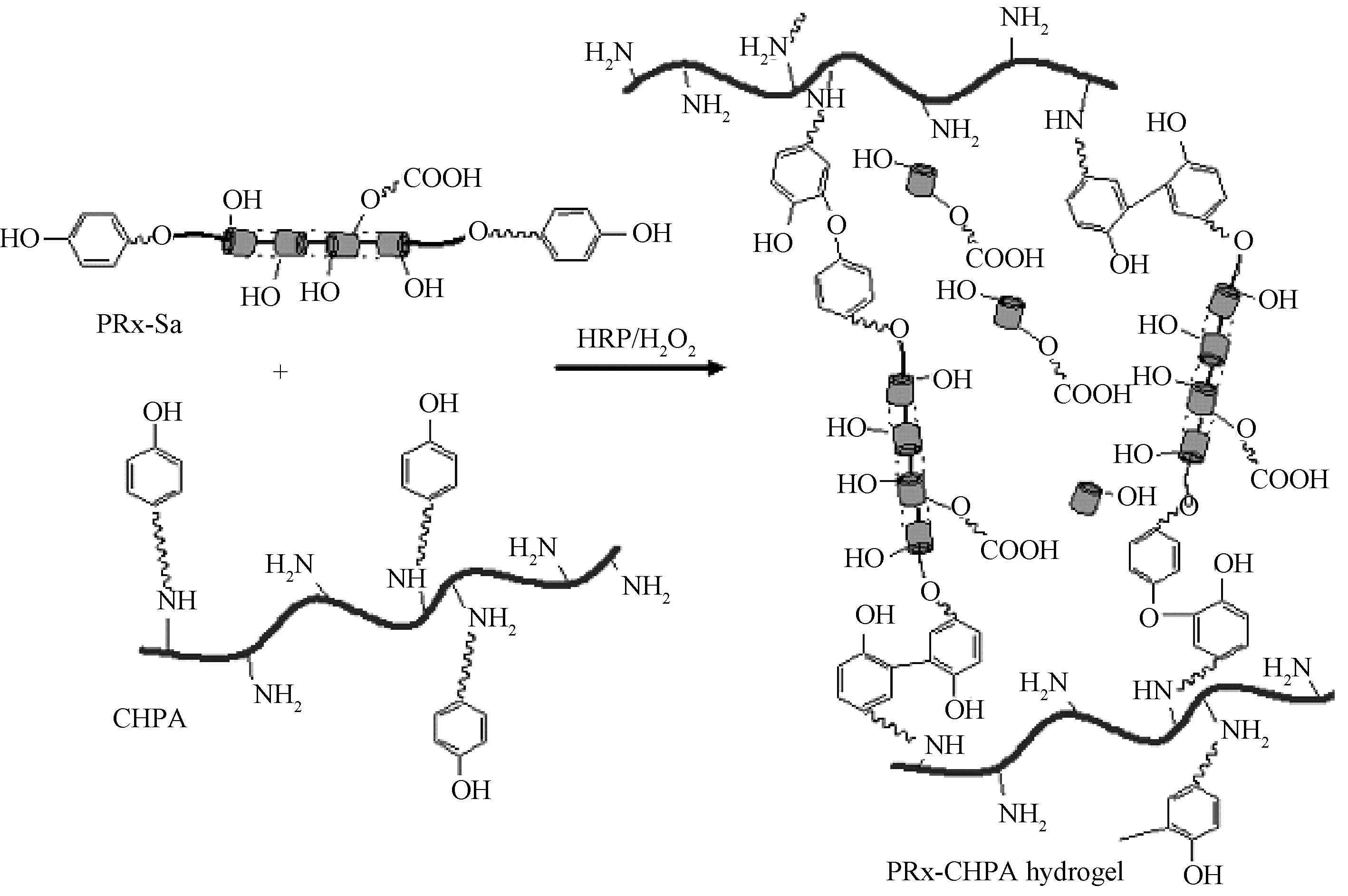
图4 辣根过氧化物酶催化交联形成超分子水凝胶的原理图[24]Fig.4 Schematics of the formation of supramolecular hydrogels via enzymatic cross-linking[24]
3.6酯酶与核酸内切酶响应型水凝胶
用于催化材料响应的酶除了催化肽及其衍生物的酶,此外还有酯酶、核酸内切酶等。酯酶与核酸内切酶的能力分别是切割酯键与切割寡聚核苷酸,通常用于降解或分解酶响应材料。Liu等人设计含硫酯键肽衍生物,在酯酶的作用下硫酯键断裂,在电荷吸引的作用下,可以结合金纳米粒子进行自组装,此时纳米颗粒直径从9.6+1.4nm增大为153+10.8nm,紫外-可见光谱分析表明520nm波长处吸收峰降低,600nm波长处产生新的吸收峰;由于自身肽序列GGGFGGK又可以被蛋白酶降解为GGG与FGGK,引起金纳米粒子解组装,此时颗粒直径降低为14.6+2.7nm,600nm波长处吸收峰消失[26]。Giorgio等人使用交联包埋氧化铁粒子的聚合物,动态光散射实验显示聚合物胶束直径大于1μm,暴露于核酸内切酶EcoR V后导致粒子分散,胶束直径降至约70nm,该酶响应型纳米粒子可用于药物的控制释放[27]。
4 酶响应自组装
在酶的催化作用下,酶响应材料首先会发生分子结构的变化,同时多伴随自组装形貌的变化,如从无自组装聚集体到纤维的形成,这种微观结构的改变称为酶响应自组装。自组装形貌的改变未必会引起宏观结构(相)的改变,如囊泡的破坏并未引起水凝胶的形成、破坏、动态转换等[30];但宏观结构的改变,多以自组装形貌的改变为基础,如水凝胶破坏,伴随纳米纤维破坏;水凝胶再次形成,同时伴随纳米管的形成[15]。酶响应自组装是材料的内在变化,水凝胶的制备成功或破坏是材料的外在表现。
4.1酶响应自组装的形成
酶催化材料的分子结构改变,导致α螺旋或β折叠的形成,并进一步形成特定的自组装形貌。如上文提到徐兵等人使用碱性磷酸酶诱导磷酸化酪氨酸(Fmoc-pY)去磷酸化生成Fmoc-Y,自组装形成纳米纤维,并进一步形成自支撑水凝胶[13]。随后,酪氨酸的磷酸化/去磷酸化引起了人们的广泛关注,研究人员设计了大量含酪氨酸的短肽,通过激酶/磷酸酶系统进行自组装研究。
Mutter等人介绍了酶诱导构象改变。通过设计不同的酶底物作为保护基团,与淀粉样蛋白Aβ(1-42)结合后,在胰蛋白酶等的作用下可以实现随后的酰基迁移,圆二色谱观察发现二级结构由无规卷曲转化为β-折叠或α-螺旋,透射电镜图像显示自组装形貌由无自组装体形成纳米纤维,高效液相色谱检测发现新产物的生成,随着作用时间的增加,产物增多(图5)[28-29]。此研究中,酰基迁移导致α螺旋,β折叠,并进一步形成自组装体。
4.2酶响应解组装
通过酶将形成自组装结构的聚合物分解,可将自组装基元转化为非自组装分子,自组装形貌破坏。如形成胶束的两亲性聚合物,分离聚合物可以有效完成解组装。刘铮等人设计葡萄糖与烷基链的聚合物,在二甲基亚砜中可以形成囊泡,采用脂肪酶催化水解葡聚糖和烷基链之间的酯键,有效切割两亲物,透射电镜和扫描电镜观察发现囊泡的破坏,可用于模型药物的释放;加入脂肪酶后,包覆荧光素FITC的纳米颗粒的荧光强度明显增强,荧光显微镜观察发现FITC的释放(图6)[30]。Thayumanavan等人设计两亲性树状大分子,临界聚集浓度低,稳定性高,可自组装形成囊泡,用酯酶裂解树状大分子的疏水性基团,在聚合物中生成更多的亲水性末端基团,从而引起囊泡破裂,动态光散射显示颗粒直径从大于100nm下降至10nm左右,荧光强度检测发现模型药物的释放[31-32]。Hennink等人设计的两亲性聚合物由肽序列SGPQGIFGQMG连接在一起,该序列对基质金属蛋白酶MMP敏感,从而能够被酶分离为两种聚合物,荧光标记的聚合物在加入酶后,荧光强度明显降低[33]。Hamley等人制备肽-PEG共聚物自组装形成胶束,这些胶束对α-胰凝乳蛋白酶敏感,材料的肽部分可被酶降解,从而导致自组装结构的破坏[34]。张希课题组制备了一种PEG和聚赖氨酸共聚物,当与ATP混合时,静电相互作用使ATP吸附到带正电的赖氨酸上,从而形成一个能够自组装成胶束的超级两亲物,冷冻电镜观察自组装形貌为纳米球,通过引入磷酸酶,裂解ATP分子的磷酸基团后,ATP与赖氨酸的静电吸附作用被破坏,胶束结构解体,冷冻电镜观察无自组装聚集体[35]。此外,Gazit和Shabat研究树状分子通过青霉素G酰胺酶引发聚合物自我破坏,从而释放自组装二肽(FF)[36]。
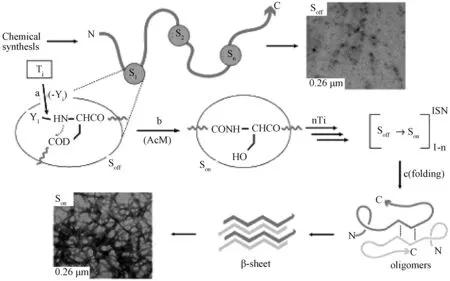
图5 开关肽:连续触发的酰基迁移控制肽的自组装[28]Fig.5 Switch-Peptides: Controlling Self-Assembly of Peptides by Consecutive Triggering of Acyl Migrations[28]
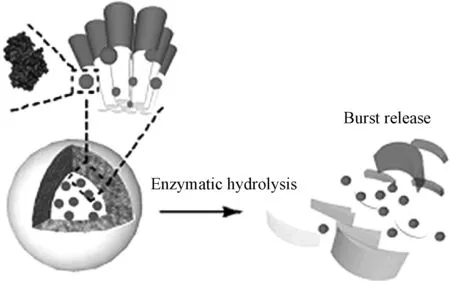
图6 聚合物囊泡的酶法合成/降解和脂肪酶触发释放蛋白质的示意图[30]Fig.6 Schematic representation of the enzymatic synthesis/degradation of the polymer vehicles and lipase-triggered release of proteins from the polymer vehicles[30]
4.3动态自组装
酶响应材料的动态自组装,可以基于激酶/磷酸酶系统对底物的磷酸化/去磷酸化反应,引起材料疏水性的变化,使自组装形貌发生改变,进一步导致水凝胶的形成和破坏。如上文提到徐兵课题组设计肽序列Nap-FFGEY自组装形成水凝胶,自组装形貌为纳米纤维,加入激酶后磷酸化为Nap-FFGEpY,纳米纤维破坏,此时水凝胶破坏;再加入磷酸酶生成Nap-FFGEY,自组装形成纳米管,水凝胶再次形成[15]。Gianneschi等人在一个两亲性DNA共聚物中,通过暴露于脱氧核酶DNAzyme下,DNA侧链的长度缩短,引发球形到柱状胶束的转化,胶束大小的变化可以通过酶催化多聚物长度的增加实现,加入19个碱基的可以互补的单链DNA后,胶束可重新形成球状结构[37]。Morimoto等人设计烷基连接直链淀粉,可自组装形成囊泡,用磷酸化酶b通过酶促去磷酸化作用延长直链淀粉,形成胶束结构,当超过一定的长度,聚合物胶束结构重排形成囊泡[38]。此外,Alemdaroglu等人通过DNA聚合酶催化DNA-聚丙烯氧化物(PPO)共轭延长DNA序列,纳米球直径从6nm增大至11nm左右[39]。
5 肽水凝胶的功能及存在问题
肽及衍生物构成的水凝胶,即肽水凝胶,其功能一方面依赖于肽及衍生物材料自身的特性,如抗菌性能等;另一方面体现在形成水凝胶后产生的新功能,如用于细胞的三维培养,作为可注射材料等。
肽及衍生物材料的生物学功能广泛,如Pochan等人通过酶联免疫吸附测定实验证明,MAX1(VKVKVKVKVK-VDPPT-KVKVKVKV-NH2)等发卡肽细胞毒性低,且不会引起细胞的非特异性免疫反应[40]。目前对肽纳米材料的抗菌性能研究较多。如Watson等人研究表明纳米颗粒可以改变大肠杆菌细胞膜的渗透压,导致大肠杆菌死亡[41]。徐海课题组研究阳离子肽AmKn自组装形成纳米短棒和胶束,表现出良好的抗菌和抗肿瘤性能,同时对NIH 3T3细胞毒性低,且不会引起淋巴细胞的非特异性免疫反应[42-44];并进一步研究螺旋肽G(IIKK)3INH2对大肠杆菌和枯草芽孢杆菌有强效抗菌活性,对耐药ESBL细菌不产生耐药性,但是未形成水凝胶[45-46]。Pochan课题组进一步研究2 wt%的两亲肽MAX1形成水凝胶,对菌浓不高于107cfu/dm2的大肠杆菌、金黄色葡萄球菌、肺炎球菌等培养48h后,表现出优秀的抗菌性能,将NIH 3T3细胞与嗜麦芽窄食单胞菌在水凝胶表面进行共培养,32h后观察发现,NIH 3T3细胞生长状态良好,细胞伸展成纤维状,同时细菌生长受到抑制;在对照空白96孔板中,细菌大量增殖,NIH 3T3细胞数量减少,且形态收缩成球状[47]。
肽水凝胶与合成高分子水凝胶和天然水凝胶相比,其优势在于不存在化学残留和病原传播等问题,而且由于在分子组成、微观尺寸和结构上与细胞外基质(ECM)类似,可以提供细胞生长的水溶液微环境,展示出良好的生物相容性和一定的细胞粘附活性[48-50]。较传统的二维培养,这种立体培养更接近于细胞在机体内的生长方式,加上支架本身的稳定性,所以可作为组织工程材料用于培养成纤维细胞等,而且能根据细胞增殖和组织培养需求设计特定的肽序列,进行试验研究。另外,一些β-发卡肽(如MAX-8)自组装形成的水凝胶具有很好的自愈性能,即受外力剪切变稀,外力撤消后快速完全恢复,这使得该类水凝胶可以作为原位可注射水凝胶支架材料[51-52]。此外,肽水凝胶还用于药物运输、生物传感器、蛋白质探针和记忆存贮等[53-57]。酶响应型肽水凝胶的主要优点,比较其他的环境响应肽水凝胶,一方面在于引起材料响应的酶大部分来自生物体自身,另一方面在于他们与生物的相互作用,与在自然环境下的生物体具有相同的控制机制。
6 结论与展望
酶响应型水凝胶作为新兴的一种环境响应型水凝胶,常用的水凝胶材料为肽及衍生物,本文重点介绍了酶响应下的肽水凝胶,以及常用于肽材料响应的酶,如谷氨酰胺转氨酶、激酶/磷酸酶、酪氨酸酶、枯草杆菌蛋白酶、嗜热菌蛋白酶、过氧化物酶、酯酶与核酸内切酶等,酶催化肽材料响应的机制稳定,无副产物生成,可诱导自组装形貌的改进。酶响应水凝胶的形成,多基于自组装形貌的改变,如无自组装聚集体形成纳米纤维;但并非所有自组装形貌的改变,都会诱导形成水凝胶。自组装聚集体形貌的改变,与宏观结构的改变,本文对两者之间的关系进行了分析。
通过pH值、温度等刺激响应因素形成的肽水凝胶,与ECM相比仍存在一些差距,限制了肽水凝胶在再生医学中的临床应用。酶响应水凝胶具有降解时间可调节,细胞行为可控等优点,是药物控释缓释的良好载体,也是有前途的可注射生物材料,作为组织材料可用于细胞培养,哺乳动物细胞生长和粘附,同时部分肽材料可杀灭病原菌,从而有效避免细菌污染。所以,设计合理的自组装水凝胶因子,采用温和、生物相容性好的酶促交联方法调控肽水凝胶的强度,提高其细胞识别活性和生物可降解性,将为该研究领域带来更多的解决思路。
[1] 尚枝, 穆齐锋, 张青松. 中国温度敏感凝胶研究——回顾与展望[J]. 材料导报, 2014, 28(7): 53~60,84.
[2] 于京, 哈伟, 师彦平. 智能水凝胶双抗癌药物控释体系[J]. 化学进展, 2015, 27(11): 1640~1648.
[3] Zhang S, Holmes T, Lockshin C, et al. Spontaneous Assembly of a Self-complementary Oligopeptide to Form a Stable Macroscopic Membrane[J]. Proceedings of the National Academy of Sciences, 1993, 90(8): 3334~3338.
[4] Schneider J P, Pochan D J, Ozbas B, et al. Responsive Hydrogels from the Intramolecular Folding and Self-assembly of a Designed Peptide[J]. Journal of the American Chemical Society, 2002, 124(50): 15030~15037.
[5] Zhao Y, Yokoi H, Tanaka M, et al. Self-assembled pH-responsive Hydrogels Composed of the RATEA16 Peptide[J]. Biomacromolecules, 2008, 9(6): 1511~1518.
[6] 程新峰, 金勇, 漆锐, 等. 刺激响应降解型聚合物水凝胶[J]. 化学进展, 2015, 27(12): 1784~1798.
[7] Pochan D J, Schneider J P, Kretsinger J, et al. Thermally Reversible Hydrogels via Intramolecular Folding and Consequent Self-assembly of a De Novo Designed Peptide[J]. Journal of the American Chemical Society, 2003, 125(39): 11802~11803.
[8] Pappas C G, Frederix P W, Mutasa T, et al. Alignment of Nanostructured Tripeptide Dels by Directional Ultrasonication[J]. Chemical Communications, 2015, 51(40): 8465~8468.
[9] Adhikari B, Kraatz H-B. Redox-triggered Changes in the Self-assembly of a Ferrocene-peptide Conjugate[J]. Chemical Communications, 2014, 50(42): 5551~5553.
[10] Wang C, Chen Q, Xu H, et al. Photoresponsive Supramolecular Amphiphiles for Controlled Self-Assembly of Nanofibers and Vesicles[J]. Advanced Materials, 2010, 22(23): 2553~2555.
[11] Altieri A, Bottari G, Dehez F, et al. Remarkable Positional Discrimination in Bistable Light-and Heat-Switchable Hydrogen-Bonded Molecular Shuttles[J]. Angewandte Chemie, International Edition, 2003, 115(20): 2398~2402.
[12] Ma H, Fei J, Li Q, et al. Photo-induced Reversible Structural Transition of Cationic Diphenylalanine Peptide Self-Assembly[J]. Small, 2015, 11(15): 1787~1791.
[13] Yang Z, Gu H, Fu D, et al. Enzymatic Formation of Supramolecular Hydrogels[J]. Advanced Materials, 2004, 16(16): 1440~1444.
[14] Liu Y, Terrell J L, Tsao C Y, et al. Biofabricating Multifunctional Soft Matter with Enzymes and Stimuli-Responsive Materials[J]. Advanced Functional Materials, 2012, 22(14): 3004~3012.
[15] Yang Z, Liang G, Wang L, et al. Using a Kinase/phosphatase Switch to Regulate a Supramolecular Hydrogel and Forming the Supramolecular Hydrogel in Vivo[J]. Journal of the American Chemical Society, 2006, 128(9): 3038~3043.
[16] Yamamoto H, Kuno S, Nagai A, et al. Insolubilizing and Adhesive Studies of Water-soluble Synthetic Model Proteins[J]. International Journal of Biological Macromolecules, 1990, 12(5): 305~310.
[17] Moreira Teixeira L S, Feijen J, et al. Enzyme-catalyzed Crosslinkable Hydrogels: Emerging Strategies for Tissue Engineering[J]. Biomaterials, 2012, 33(5): 1281~1290.
[18] Gao J, Zheng W T, Kong D L, et al. Dual Enzymes Regulate the Molecular Self-assembly of Tetra-peptide Derivatives[J]. Soft Matter, 2011, 7(21): 10443~10448.
[19] Toledano S, Williams R J, Jayawarna V, et al. Enzyme-triggered Self-assembly of Peptide Hydrogels via Reversed Hydrolysis[J]. Journal of the American Chemical Society, 2006, 128(4): 1070~1071.
[20] Williams R J, Smith A M, Collins R, et al. Enzyme-assisted Self-assembly Under Thermodynamic Control[J]. Nature Nanotechnology, 2009, 4(1): 19~24.
[21] Hughes M, Frederix P W J M, Raeburn J, et al. Sequence/structure Relationships in Aromatic Dipeptide Hydrogels Formed Under Thermodynamic Control by Enzyme-assisted Self-assembly[J]. Soft Matter, 2012, 8(20): 5595~5602.
[22] Xu H, Das A K, Horie M, et al. An Investigation of the Conductivity of Peptide Nanotube Networks Prepared by Enzyme-triggered Self-assembly[J]. Nanoscale, 2010, 2(6): 960~966.
[23] Hirst A R, Roy S, Arora M, et al. Biocatalytic Induction of Supramolecular Order[J]. Nature Chemistry, 2010, 2(12): 1089~1094.
[24] Tran N Q, Joung Y K, Lih E, et al. Supramolecular Hydrogels Exhibiting Fast in Situ Gel Forming and Adjustable Degradation Properties[J]. Biomacromolecules, 2010, 11(3): 617~625.
[25] Sofia S J, Singh A, Kaplan D L. Peroxidase-catalyzed Crosslinking of Functionalized Polyaspartic Acid Polymers[J]. Journal of Macromolecular Science, Part A, 2002, 39(10): 1151~1181.
[26] Liu R, Aw J, Teo W, et al. Novel Trimethyl Lock Based Enzyme Switch for the Self-assembly and Disassembly of Gold Nanoparticles[J]. New Journal of Chemistry, 2010, 34(4): 594~598.
[27] Yu S S, Scherer R L, Ortega R A, et al. Enzymatic-and Temperature-sensitive Controlled Release of Ultrasmall Superparamagnetic Iron Oxides (USPIOs)[J]. Journal of Nanobiotechnology, 2011, 9: 7.
[28] Mutter M, Chandravarkar A, Boyat C, et al. Switch Peptides in Statu Nascendi: Induction of Conformational Transitions Relevant to Degenerative diseases[J]. Angewandte Chemie, International Edition, 2004, 43(32): 4172~4178.
[29] Dos Santos S, Chandravarkar A, Mandal B, et al. Switch-peptides: Controlling Self-assembly of Amyloid β-derived Peptides in Vitro by Consecutive Triggering of Acyl Migrations[J]. Journal of the American Chemical Society, 2005, 127(34): 11888~11889.
[30] Ge J, Lu D N, Yang C, et al. A Lipase-Responsive Vehicle Using Amphipathic Polymer Synthesized with the Lipase as Catalyst[J]. Macromolecular Rapid Communications, 2011, 32(6): 546~550.
[31] Azagarsamy M A, Sokkalingam P, Thayumanavan S. Enzyme-Triggered Disassembly of Dendrimer-Based Amphiphilic Nanocontainers[J]. Journal of the American Chemical Society, 2009, 131(40): 14184~14185.
[32] Raghupathi K R, Azagarsamy M A, Thayumanavan S. Guest-Release Control in Enzyme-Sensitive, Amphiphilic-Dendrimer-Based Nanoparticles through Photochemical Crosslinking[J]. Chemistry-A European Journal, 2011, 17(42): 11752~11760.
[33] de Graaf A J, Mastrobattista E, Vermonden T, et al. Thermosensitive Peptide-Hybrid ABC Block Copolymers Obtained by ATRP: Synthesis, Self-Assembly, and Enzymatic Degradation[J]. Macromolecules, 2012, 45(2): 842~851.
[34] Castelletto V, McKendrick J E, Hamley I W, et al. PEGylated Amyloid Peptide Nanocontainer Delivery and Release System[J]. Langmuir, 2010, 26(14): 11624~11627.
[35] Wang C, Chen Q, Wang Z, et al. An Enzyme-Responsive Polymeric Superamphiphile[J]. Angewandte Chemie, International Edition, 2010, 122(46): 8794~8797.
[36] Adler-Abramovich L, Perry R, Sagi A, et al. Controlled Assembly of Peptide Nanotubes Triggered by Enzymatic Activation of Self-immolative Dendrimers[J]. Chembiochem, 2007, 8(8): 859~862.
[37] Chien M P, Rush A M, Thompson M P, et al. Programmable Shape-Shifting Micelles[J]. Angewandte Chemie, International Edition, 2010, 49(30): 5076~5080.
[38] Morimoto N, Ogino N, Narita T, et al. Enzyme-responsive Molecular Assembly System with Amylose-primer Surfactants[J]. Journal of the American Chemical Society, 2007, 129(3): 458~459.
[39] Alemdaroglu F E, Wang J, Börsch M, et al. Enzymatic Control of the Size of DNA Block Copolymer Nanoparticles[J]. Angewandte Chemie, International Edition, 2008, 47(5): 974~976.
[40] Haines-Butterick L A, Salick D A, et al. In Vitro Assessment of the Pro-inflammatory Potential of β-hairpin Peptide Hydrogels[J]. Biomaterials,.2008, 29(31): 4164~4169.
[41] Watson J, Cressey B, Roberts A, et al. Structural and Magnetic Studies on Heavy-metal-adsorbing Iron Sulphide Nanoparticles Produced by Sulphate-reducing Bacteria[J]. Journal of Magnetism and Magnetic Materials, 2000, 214(1): 13~30.
[42] Chen C, Hu J, Zhang S, et al. Molecular Mechanisms of Antibacterial and Antitumor Actions of Designed Surfactant-like Peptides[J]. Biomaterials, 2012, 33(2): 592~603.
[43] Chen C, Pan F, Zhang S, et al. Antibacterial Activities of Short Designer Peptides: a Link Between Propensity for Nanostructuring and Capacity for Membrane Destabilization[J]. Biomacromolecules, 2010, 11(2): 402~411.
[44] Xu H, Chen C X, Hu J, et al. Dual modes of Antitumor Action of an Amphiphilic Peptide A9K[J]. Biomaterials, 2013, 34(11): 2731~2737.
[45] Hu J, Chen C, Zhang S, et al. Designed Antimicrobial and Antitumor Peptides with High Selectivity[J]. Biomacromolecules, 2011, 12(11): 3839~3843.
[46] Chen C, Hu J, Zeng P, et al. Molecular Mechanisms of Anticancer Action and cell Selectivity of Short α-helical Peptides[J]. Biomaterials, 2014, 35(5): 1552~1561.
[47] Salick D A, Kretsinger J K, et al. Inherent Antibacterial Activity of a Peptide-based β-hairpin Hydrogel[J]. Journal of the American Chemical Society, 2007, 129(47): 14793~14799.
[48] Jung J P, Gasiorowski J Z, Collier J H. Fibrillar Peptide Gels in Biotechnology and Biomedicine[J]. Peptide Science, 2010, 94(1): 49~59.
[49] Matson J B, Stupp S I. Self-assembling Peptide Scaffolds for Regenerative Medicine[J]. Chemical Communications, 2012, 48(1): 26~33.
[50] Wu E C, Zhang S, Hauser C A. Self-Assembling Peptides as Cell-Interactive Scaffolds[J]. Advanced Functional Materials, 2012, 22(3): 456~468.
[51] Haines-Butterick L, Rajagopal K, Branco M, et al. Controlling Hydrogelation Kinetics by Peptide Design for Three-dimensional Encapsulation and Injectable Delivery of Cells[J]. Proceedings of the National Academy of Sciences, 2007, 104(19): 7791~7796.
[52] Yan C, Mackay M E, Czymmek K, et al. Injectable Solid Peptide Hydrogel as a Cell Carrier: Effects of Shear Flow on Hydrogels and Cell Payload[J]. Langmuir, 2012, 28(14): 6076~6087.
[53] Bae Y, Fukushima S, Harada A, et al. Design of Environment-sensitive Supramolecular Assemblies for Intracellular Drug Delivery: Polymeric Micelles that are Responsive to Intracellular pH Change[J]. Angewandte Chemie, International Edition, 2003, 42(38): 4640~4643.
[54] Elsabahy M, Wooley K L. Design of Polymeric Nanoparticles for Biomedical Delivery Applications[J]. Chemical Society Reviews, 2012, 41(7): 2545~2561.
[55] Liu X, Li J, Dong J, et al. Genetic Incorporation of a Metal-Chelating Amino Acid as a Probe for Protein Electron Transfer[J]. Angewandte Chemie, International Edition, 2012, 51(41): 10261~10265.
[56] Medintz I L, Stewart M H, Trammell S A, et al. Quantum-dot/dopamine Bioconjugates Function as Redox Coupled Assemblies for in Vitro and Intracellular pH Sensing[J]. Nature Materials, 2010, 9(8): 676~684.
[57] Babu S S, Möhwald H, Nakanishi T. Recent Progress in Morphology Control of Supramolecular Fullerene Assemblies and its Applications[J]. Chemical Society Reviews, 2010, 39(11): 4021~4035.
[58] 周俊宇, 聂景怡, 等. LiOH/尿素溶剂体系制备高强度壳聚糖水凝胶膜[J]. 材料科学与工程学报, 2013, 31(4): 525~528.
[59] 随献伟, 黄君华, 谭本来, 等. 聚丙烯酰胺磁性水凝胶的互穿改性[J]. 材料科学与工程学报, 2015, 33(1): 51~55.
[60] 罗骁, 陈思, 等. 基于POSS核凝胶因子的光、热双控液晶物理凝胶[J]. 材料科学与工程学报, 2015, 33(5): 685~691.
ResearchProgressonEnzymeResponsiveHydrogel
BAIJingkun1,2
(1.DepartmentofPharmaceuticalandBiologicalEngineering,ZiboVocationalInstitute,Zibo255314,China;2.StateKeyLaboratoryofHeavyOilProcessing,SchoolofChemicalEngineering,ChinaUniversityofPetroleum(EastChina),Qingdao266580,China)
Environmental responsive hydrogel was briefly explained, and the enzyme factors causing the hydrogels response were introduced, including the transglutaminase, kinase and phosphatase, tyrosinase, subtilisin and thermolysin, peroxidase, esterase and endonuclease. Meanwhile, material responses induced by enzyme were analyzed, including the formation of self assembly, the disassembly and the dynamic self-assembly. In addition, the functions of enzyme responsive peptide hydrogel were introduced. Finally, existing problems in the process of enzyme responsive hydrogel were presented, and the biological function of peptide hydrogel was also introduced.
environmental responsive hydrogel; enzyme responsive hydrogel; function; self assembly
TB381
:ADOI:10.14136/j.cnki.issn1673-2812.2017.04.033
2015-11-18;
:2016-05-16
国家自然科学基金资助项目(21373270)
白靖琨(1982-),男,讲师,博士研究生,研究方向:酶响应生物材料及其抗菌、抗肿瘤性能研究。E-mail:jkbaizg@163.com。
1673-2812(2017)04-0681-09

