Nrf2-ARE信号通路在左乙拉西坦抗癫痫中的作用
吴 可,赵文丽,李月影,邱长雨,施海静,张咏梅
(徐州医科大学麻醉学院,江苏 徐州 221004)
Nrf2-ARE信号通路在左乙拉西坦抗癫痫中的作用
吴 可,赵文丽,李月影,邱长雨,施海静,张咏梅
(徐州医科大学麻醉学院,江苏 徐州 221004)
目的探讨Nrf2-ARE信号通路在左乙拉西坦抗癫痫中的作用,以及应用左乙拉西坦对认知功能的影响。方法成年♂ SD大鼠36只,250~300 g,随机分为生理盐水对照(control)组、戊四唑(1,5-pentamethylene-1H-tetrazole,PTZ)癫痫模型组、左乙拉西坦(levetiracetam,LEV)对照组以及左乙拉西坦治疗组,每组9只。以Morris水迷宫测试大鼠的空间学习记忆能力;用免疫印迹法测定海马组织中Nrf2、HO-1和NQO1蛋白表达量。结果与癫痫模型组相比,给予左乙拉西坦治疗的癫痫大鼠在Morris水迷宫测试中潜伏期明显缩短(P<0.05),海马Nrf2、HO-1、NQO1蛋白表达均明显增高(P<0.01)。结论左乙拉西坦能够改善癫痫大鼠的认知功能,其机制可能通过Nrf2-ARE通路,使HO-1、NQO1蛋白表达增多,起到抗癫痫的作用。
癫痫;Nrf2;ARE;信号通路;左乙拉西坦;认知功能
癫痫是由脑组织局部病灶的神经元异常高频放电,并向周围扩散,导致大脑功能短暂失调综合征。癫痫主要临床表现为突然发作,出现短暂运动、感觉、意识和精神异常,并反复发作,发作时常伴有异常脑电图。反复癫痫发作的患者常伴有认知功能障碍。癫痫的发病机制非常复杂,迄今尚未完全阐明。氧化应激损伤、谷氨酸兴奋性毒性、钙超载、神经胶质细胞增生等多种因素都能诱导神经元异常放电,触发癫痫。其中,氧化应激在癫痫发病中起着重要的作用,可影响脑组织神经元的功能,诱导海马神经元的凋亡[1],且癫痫的持续时间与氧化损伤呈正相关。有研究表明,部分抗癫痫药物可以通过调节氧化应激系统改善癫痫患者的症状。
Nrf2/ARE通路是机体抵抗内、外界氧化和化学等刺激的防御性转导通路[2],其核心分子包括核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)、抗氧化反应元件(antioxidant response element, ARE)和胞质蛋白Kelch样环氧氯丙烷相关蛋白 1(Kelch ECH associating protein 1,Keap1)。核转录因子Nrf2属于CNC亮氨酸拉链转录激活因子家族(cap-‘n’-collar subfamily of basic leucine-zipper, CNC-Bzip),Nrf2活化还能抑制炎症介质的生成[3]。Keap是与Nrf2的直接结合蛋白[4]。Keap1含有5个主要结构域,分别是氨基末端NTR、BTB、富半胱氨酸插入域IVR、双甘氨酸重复域DGR以及羧基端CTR。其中,IVR和BTB容易进行氧化还原反应,是调控Nrf2所必需的结构。DGR的6个Kelch功能域形成β折叠结构,与Nrf2的Neh2端序列结合[5]。Keap1在体内抑制Nrf2的活性,允许Nrf2从细胞质转位到细胞核并增强ARE的反应。ARE是一个特异的DNA 启动子结合序列,能被多种氧化性和亲电性化合物激活,从而启动Ⅱ相解毒酶和抗氧化酶基因的表达。
左乙拉西坦(levetiracetam, LEV)作为新型广谱的抗癫痫药已广泛应用。有研究表明,突触囊泡蛋白SV2A是抗癫痫药左乙拉西坦的结合位点[6],其作用机制为阻断突触前神经递质的有效释放[7],但其确切机制并未完全明确。左乙拉西坦可以扭转锌等负变构调节剂对γ-氨基丁酸(γ-aminobutyric acid,GABA)和甘氨酸门控电流的抑制作用,可以抑制三磷酸肌醇受体 (inositol triphosphate receptor,IP3R)和兰尼碱受体(ryanodine receptor, RyR)介导的钙离子释放[8],还可以减少钾电流,这些都与其抗癫痫作用相关。左乙拉西坦在癫痫等疾病中还有神经保护作用,且能改善颅脑损伤后的认知[9]。
本实验旨在探讨左乙拉西坦抗癫痫的可能机制,明确Nrf2-ARE信号通路在左乙拉西坦抗癫痫中的作用。有研究表明,抗癫痫药苯巴比妥钠对大鼠学习记忆功能有损害[10],本实验通过水迷宫模型探讨左乙拉西坦对认知功能的影响。
1 材料与方法
1.1实验动物成年SD大鼠36只,♂,体质量250~300 g,由山东济南朋悦实验动物繁育有限公司提供,许可证号:SCXK(鲁)20140007。大鼠置于昼夜(12 h/12 h)节律光照条件下,室温(23±1)℃,自由饮水和摄食,所有大鼠实验前静养1周。
1.2实验分组随机将大鼠分为4组,每组9只。生理盐水对照(Control)组:0.9% 生理盐水(normalsaline, NS)+0.9% NS;戊四唑(pentylenetetrazole, PTZ)癫痫模型组:0.9% NS+戊四唑;左乙拉西坦(LEV)对照组:LEV(20 g·L-1)+0.9% NS;左乙拉西坦(LEV)治疗组:LEV(20 g·L-1)+戊四唑。大鼠首先用8号灌胃针进行灌胃,灌胃物质为分组中的前一试剂,剂量均为10 mL·kg-1。灌胃30 min后,以分组中的后一试剂进行腹腔注射,大约于每天上午8 ∶00~10 ∶00进行,剂量均为2 mL·kg-1。以上各组动物平均体质量差异无统计学意义。1.3仪器与试剂Morris水迷宫购自上海软隆科技发展有限公司产品。左乙拉西坦片购自优时比制药有限公司;戊四唑购自Aladdin公司;抗Nrf2 (Lot:GR249953-6)、抗HO-1 (Lot:GR96795-23)、抗NQO1抗体 (Lot:GR195043-8),均购自Abcam艾美捷科技有限公司。
1.4大鼠癫痫模型制备大鼠于每天上午8 ∶00~10 ∶00腹腔注射浓度为15 g·L-1的戊四唑溶液,连续28 d。模型成功与否以其发作时的行为变化为主要依据,按Racine分级,0级:无任何反应;1级:面部阵挛,包括眨眼、动须、节奏性咀嚼等;2级:1级加节律性点头;3级:2级加前肢阵挛;4级:3级加后肢站立;5级:4级加摔倒。达到4~5级的大鼠选用,未达到4级的淘汰[11]。
1.5Morris水迷宫实验Morris水迷宫为直径125 cm、高50 cm的圆形水池,水深30 cm,水温保持(26.0±1.0)℃。池壁上有象征4个象限的不同标志,在一个象限的正中离池壁33 cm处放一个直径9 cm、高28 cm的黑色平台,平台顶低于水面15 cm。训练期间迷宫外参照物保持不变。Morris水迷宫测试大鼠对水迷宫的学习和记忆能力。定位航行实验:将水池等分为4个象限,目标象限的中央放置一隐匿平台,定位航行实验共历经5 d。实验开始前l d,让大鼠放入水池(不含平台)自由游泳2 min,d 2开始每天分上、下午两个时间段,每个时间段训练4次。每个时间段分别从池壁2个起点将大鼠面向池壁放入水池,记录每次找到平台的时间(逃避潜伏期,escape latency)和游泳路径。如大鼠在60 s内找不到平台,由实验者将其引上平台,潜伏期记为 60 s,每次间隔 4 min 让大鼠休息,再行下次实验[12]。
1.6Western blot 行为学测试结束后,10%水合氯醛(3 mL·kg-1)腹腔注射对大鼠进行麻醉,后断头,取双侧海马。将取出的海马放入预冷的裂解液中,在冰上使用电动匀浆机进行匀浆,每个样本匀浆4次,每次10 s,间隔10 s冷却,充分裂解后离心。BCA法对裂解后的蛋白浓度进行定量,随后加入5×上样缓冲液(总体积1/4),放入沸水中煮沸15 min促进蛋白变性。配制10%或者12%的胶进行恒压电泳,电压设置为:浓缩胶70 V, 35 min;分离胶110 V, 90~120 min。电泳结束后,采用PVDF膜冰上进行恒压转膜,100 V, 75 min。转膜后,3% BSA封闭2 h,加入抗Nrf2、HO-1、NQO1 (1 ∶250)、GAPDH(1 ∶2 000)一抗孵育,4℃过夜。Washing buffer,摇床5 min×3次,加入碱性磷酸酶羊抗兔或羊抗小鼠二抗(1 ∶2 000,Abcam公司,英国),室温孵育2 h。二抗孵育后,Washing buffer,摇床5min×3次,显色,采用Image J软件进行灰度值分析。
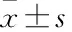
2.1左乙拉西坦对癫痫大鼠认知功能的影响在Morris水迷宫测试中,各组大鼠给药后d 1的逃避潜伏期无明显差别,d 2、3、4、5的潜伏期均开始缩短(Fig 1A)。PTZ模型组总潜伏期相对于正常对照组明显提高(P<0.01,Fig 1B),表明大鼠癫痫模型制备成功;而LEV治疗组可以明显逆转此改变,降低大鼠逃避潜伏期(P<0.05,Fig 1B),表明应用左乙拉西坦可以改善癫痫大鼠的认知功能。
2.2Nrf2在左乙拉西坦抗癫痫中的表达变化Fig 2结果显示,与control相比,PTZ致癫痫模型组海马的Nrf2蛋白表达明显降低(P<0.01),说明在此模型中Nrf2介导的防御性转导通路减弱;而给予左乙拉西坦治疗后,与control组、PTZ模型组相比,海马Nrf2蛋白表达明显增加(P<0.01),表明左乙拉西坦可能通过加强Nrf2通路的表达起到抗癫痫的作用。2.3HO-1在左乙拉西坦抗癫痫中的作用Fig 3结果显示,与control组相比,PTZ致癫痫模型组海马的HO-1蛋白表达明显升高(P<0.01);给予左乙拉西坦治疗后,与control组、PTZ模型组相比,海马HO-1蛋白表达水平进一步明显增高(P<0.01),表明左乙拉西坦治疗后进一步升高的HO-1可能参与了抗癫痫作用。
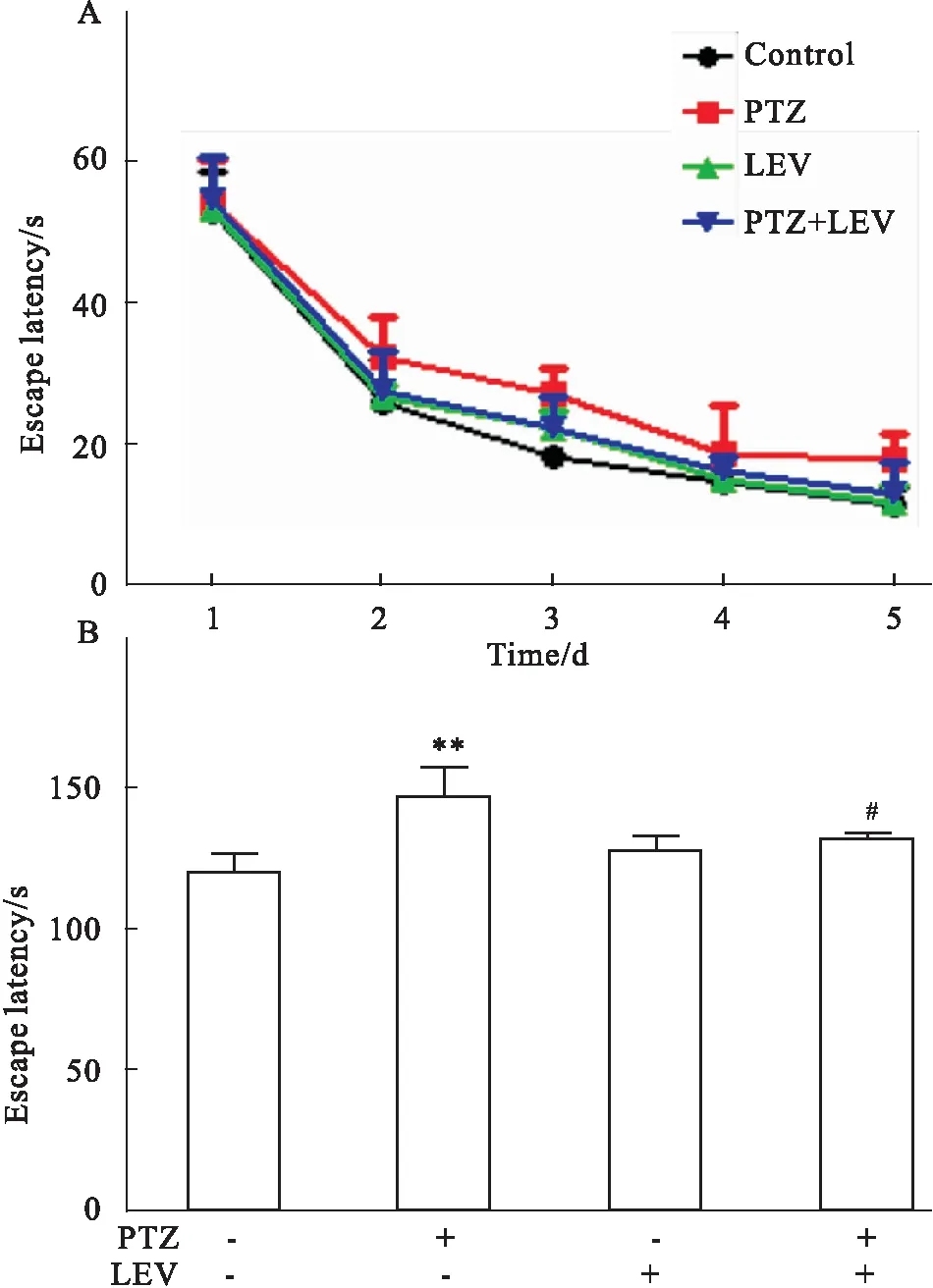
Fig 1 The escape latency of S-D rats in training test
A: The change tendency of escape latency in rats during 5 days; B: Changes of total escape latency of rats in 5 days.**P<0.01vscontrol group;#P<0.05vsPTZ group
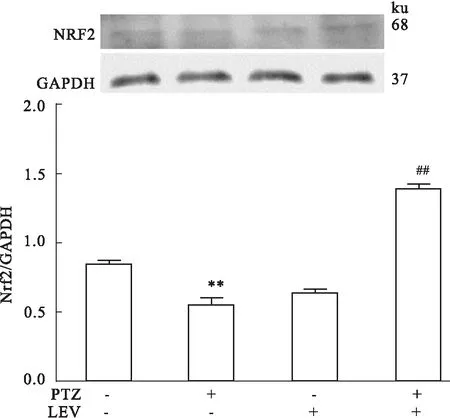
Fig 2 Expressions of hippocampus Nrf2 in rats
**P<0.01vscontrol group;##P<0.01vsPTZ group
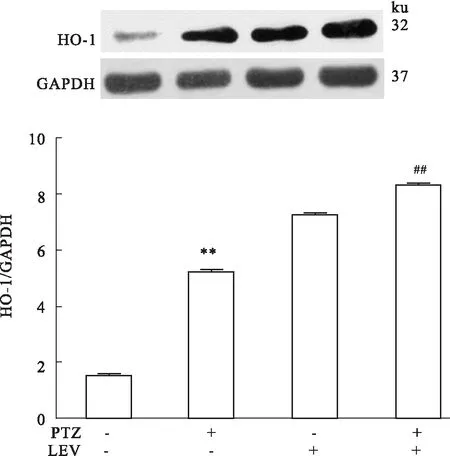
Fig 3 Expressions of hippocampus HO-1 in rats
**P<0.01vscontrol group;##P<0.01vsPTZ group
2.4NQO1在左乙拉西坦抗癫痫中的作用Fig 4结果显示,与control组相比,PTZ致癫痫模型组海马水平的NQO1蛋白表达明显升高(P<0.01);给予左乙拉西坦治疗后,与control组、PTZ模型组相比,海马NQO1蛋白表达水平进一步明显增高(P<0.01),表明左乙拉西坦治疗后进一步升高的 NQO1可能参与了抗癫痫作用。
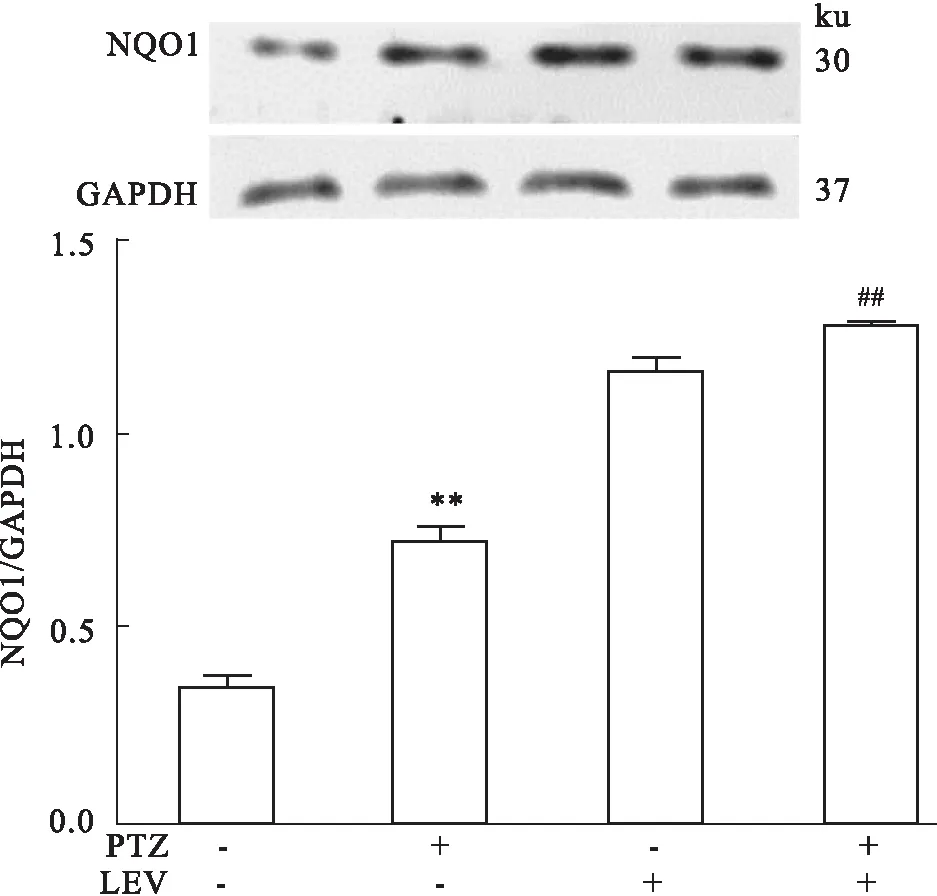
Fig 4 Expressions of hippocampus NQO1 in rats
**P<0.01vscontrol group;##P<0.01vsPTZ group
3 讨论
作为神经科仅次于头疼的第二大常见病,癫痫的预防和治疗已成为医学界的焦点问题,癫痫对大鼠的学习记忆损害机制并未明了。既往的研究发现,反复癫痫发作可以导致海马结构发生病理变化,包括海马神经元的变性坏死、突触间隙异常增宽及突触后膜的密度改变、海马异常苔藓样发芽以及由此导致的突触联系异常,与学习记忆联系紧密的N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor, NMDA)受体表达分布异常、信号转导通路异常等。
Nrf2/ARE通路是机体抵抗内外界氧化和化学等刺激的防御性转导通路,生理状态下,Nrf2与Keap1相偶联,且Keap1与胞质肌动蛋白结合而被锚定在胞质。Keap1还会促进Nrf2被泛素蛋白酶迅速降解保持低活性。而当Keap1构象变化,通过直接磷酸化或减少降解,竞争性抑制等方式均可激动Nrf2。Nrf2与Keap1解离,半衰期延长,以稳定状态转位进入细胞核。与小Maf蛋白结合形成异二聚体,然后识别ARE上DNA序列(GCTGAGTCA),并与之结合形成复合物,诱导抗氧化蛋白和Ⅱ相解毒酶基因的表达。包括血红素氧化酶(hemeoxygenase-1,HO-1)、醌氧化还原酶[quinone oxidoreductase,NAD(P)H]以及其它参与氧化应激反应的基因[13]。HO-1和NADH是该通路编码的重要的抗氧化酶。HO-1、 NADH含量升高,提高了细胞的氧化应激及修复功能。由此可见,真正发挥作用的Nrf2是在入核以后,但胞核的Nrf2表达过少,而以往有文献指出,总Nrf2也可以间接反映各组间Nrf2表达变化的差别[14]。所以,我们在本实验中以总Nrf2作为各组间比较的对象,间接反映各组间Nrf2表达的不同。
在癫痫发作时,可以诱导海马组织中Nrf和其编码的基因产物HO-1和NQO1在蛋白和基因水平表达明显增强。LEV作为新型广谱的抗癫痫药已广泛应用,但其抗癫痫机制并未完全明确。有研究表明,LEV对癫痫患者氧化应激系统有作用,但未探明到底通过何种途径影响。上述已知机体可通过上调Nrf2,提高抗氧化水平和降低氧化产物水平,同时,Nrf2-ARE通路对认知功能的影响,提示LEV是否可以通过此通路起到抗癫痫作用,从而对癫痫患者认知障碍有改善作用。
本实验结果表明,与模型组相比,给予LEV的癫痫大鼠潜伏期明显缩短,海马Nrf2、HO-1、NQO1蛋白表达明显增高,提示LEV可能通过上调Nrf2,提高抗氧化水平和降低氧化产物水平。针对在Western blot结果中,在模型组中,Nrf2的表达是减少的,而其下游蛋白HO-1和NQO-1的表达是增多的结果,有研究表明HO-1基因的表达受多条通路的调控,其调控位点包括ABi序列、HSE区域、USF位点、NF-κB位点、E-box部位、STAP3/AP识别位点、Nrf2结构、UTR结构等多个方面[15],调控HO-1基因表达的上游通路较多,所以我们暂且保留本实验条件下的结果,在后续的实验中将继续探讨。
针对癫痫患者常伴有认知功能障碍,实验中应用的Morris 水迷宫是神经生物学研究动物空间学习、记忆功能常用的行为学检测方法,能够较准确地反映实验动物以视觉为基础的空间学习、记忆、定向及定位能力的变化。与对照组相比,模型组潜伏期明显延长,与模型组相比,治疗组潜伏期明显缩短,表明LEV对癫痫大鼠的认知功能也有一定的改善作用。且本实验采用的PTZ点燃癫痫模型,有组织学分析揭示该模型引起的海马CA1 区神经元丢失和齿状回苔藓纤维发芽与人类癫痫极其相似。同时,也有研究表明该模型大鼠海马p38蛋白表达减少,而p38作为突触前终末特异性标记物, 用来检测突触的密度和分布, 是神经元功能状态的标示物之一,这说明PTZ 点燃癫痫可能引起海马突触前膜突触囊泡数量减少及功能受损、突触活动减弱、神经递质合成与释放减少等一系列变化,从而导致了认知功能障碍[16]。这为癫痫后认知功能障碍机制的探讨提供了有力证据。但癫痫后认知功能障碍机制复杂,还需要进一步的探索和研究。
综上所述,左乙拉西坦能改善癫痫大鼠的认知功能,左乙拉西坦可能通过Nrf2-ARE通路使HO-1、NQO1蛋白含量表达增多,起到抗癫痫的作用。
[1] Méndez-Armenta M, Nava-Ruíz C, Juárez-Rebollar D, et al. Oxidative stress associated with neuronal apoptosis in experimental models of epilepsy[J].OxidMedCellLongev, 2014,2014: 293689.
[2] Wan Hasan W N, Kwak M K, Makpol S, et al. Piper betle induces phase I & II genes through Nrf2/ARE signaling pathway in mouse embryonic fibroblasts derived from wild type and Nrf2 knockout cells [J].BMCComplementAlternMed, 2014,14(1): 72.
[3] 曹思思,颜 苗,张毕奎,等. 以Nrf2为靶点防治肾脏疾病的研究进展[J]. 中国药理学通报,2017,33(3):301-5.
[3] Cao S S,Yan M,Zhang B K, et al. Research on preventative role of Nrf2 in kidney diseases[J].ChinPharmacolBull,2017,33(3):301-5.
[4] Abed D A, Goldstein M, Albanyan H,et al. Discovery of direct inhibitors of Keap1-Nrf2 protein-protein interaction as potential therapeutic and preventive agents[J].ActaPharmSinB, 2015,5(4):285-99.
[5] Taguchi K,Motohashi H,Yamamoto M. Molecular mechanisms of the Keap1 & Nrf2 pathway in stress response and cancer evolution[J].GenesCells, 2011,16(2):123-40.
[6] Lynch B A, Lambeng N, Nocka K, et al. The synaptic vesicle protein SV2A is the binding site for the antiepileptic drug levetiracetam[J].ProcNatlAcadSci, 2004,101(26):9861-6.
[7] Peng C M. Clinical analysis of sodium valproate and levetiracetam using in pediatric epilepsy[J].ChinForeignMedRes, 2014,12(16):20-1.
[8] Nagarkatti N, Deshpande L S, DeLorenzo R J .Levetiracetam inhibits both ryanodine and IP3 receptor activated calcium induced calcium release in hippocampal neurons in culture[J].NeurosciLett, 2008,436(3):289-93.
[9] Szanarski J P,Nazzal Y,Dreer L E.Post-tmumatic epilepsy:current and emerging teatment options[J].NeuropsychiatrDisTreat,2014,10:1469-77.
[10] 宋 炜,蔡 鹏,杜 雷,等.丙泊酚对癫痫大鼠学习记忆及海马TLR4表达的影响[J].中国药理学通报,2014 ,30(12):1725-9.
[10] Song W,Cai P,Du L,et al.Effects of propofol on learning and memorizing ability and hippocampus TLR4 in epileptic rats[J].ChinPharmacolBull,2014,30(12):1725-9.
[11] Fabisiak J P, Schwark W S. Aspects of pentylenetetrazol kindling model of epileptogenesis in the rat[J].ExpNeurol, 1982,78(1):7-14.
[12] Morris R G, Garrud P, Rawlins J N, O’Keefe J. Place navigation impaired in rats with hippocampal lesions[J].Nature, 1982,297(5868): 681-3.
[13] Johnson D A, Johnson J A. Nrf2-a therapeutic target for the treatment of neurodegenerative diseases[J].FreeRadicBiolMed, 2015,88:253-67.
[14] 高梦颖,何永昌,孙国柱,等. 大鼠液压冲击脑损伤Nrf2、HO-1和NQO-1动态表达及意义[J]. 第三军医大学学报,2016,38(18):2023-8.
[14] Gao M Y, He Y C, Sun G Z,et al. Expression of Nrf2,HO-1 and NQO-1 in rat brain following fluid percussion injury[J].JThirdMilitaryMedUniv,2016,38(18):2023-8.
[15] 杨晓瑜,黄维义.诱导HO-1基因表达的信号通路[J]. 国际病理科学与临床杂志 ,2006,26(3):238-42.
[15] Yang X Y, Huang W Y,et al.Signal transduction pathways of heme oxygenase-1 gene expression[J].IntJPatholClinMed,2006,26(3):238-42.
[16] 王 佩,吴东霞,王海祥,等.戊四氮点燃癫痫大鼠空间学习记忆障碍及海马突触素表达减少的研究[J]. 脑与神经疾病杂志,2008,16(5):604-7.
[16] Wang P, Wu D X, Wang H X, et al .Impaired spatial learning and memory and decreased p38 expression in hippocampus of pentylenetetrazol-kindled rats[J].JBrainNervousDis,2008,16(5): 604-7.
EffectsofNrf2-AREsignalpathonlevrtiracetamanti-epilepticandlevrtiracetamonlearningandmemorizingability
WU Ke, ZHAO Wen-li, LI Yue-ying, QIU Chang-yu, SHI Hai-jing, ZHANG Yong-mei
(SchoolofAnesthesiology,XuzhouMedicalUniverity,XuzhouJiangsu221004,China)
AimTo explore the effects of Nrf2-ARE signal path on levrtiracetam anti-epileptic and levrtiracetam on learning and memorizing ability.MethodsThirty-six SD rats were divided into normal saline group, levrtiracetam group, model group and treatment group. Each group recruited nine rats. Tests of Morries water maze were given to the rats to evaluate their learning and memorizing ability. The protein expression of nuclear factor (erythroid-derived2)-like2 (Nrf2), heme oxygenase 1(HO-1) and NAD(P)H quinone oxidoreductase(NQO1) were examined by Western blot.ResultsCompared with model group, levrtiracetam could shorten the plateau period in epileptic rats (P<0.05), and increase the expression of Nrf2 protein, HO-1 protein and NQO1 protein in hippocampus(P<0.05).ConclusionsLevrtiracetam could improve the learning and memorizing ability in epileptic rats. Levrtiracetam may increase the expression of HO-1 protein and NQO1 protein through the Nrf2-ARE pathway and play a part in antiepileptic effects.
epilepsia; Nrf2; ARE; signal path; levrtiracetam; learning and memorizing ability
10.3969/j.issn.1001-1978.2017.10.026
A
:1001-1978(2017)10-1462-05
R-332;R322.81;R338.64;R742.1;R971.6
时间:2017-9-5 9:26 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170905.0925.052.html
2017-04-20,
2017-07-24
国家自然科学基金资助项目(No 81171041);江苏省高校自然科学基金重点项目(No 13KJA320001);江苏省自然科学基金资助项目(No BK20161171);江苏省大学生创新创业训练计划(No 201610313039Y);江苏高校品牌专业建设工程资助项目(No PPZY2015A066)
吴 可(1995-),男,研究方向:疼痛信号转导及其调控,E-mail:742296844@qq.com; 张咏梅(1970-),女,博士,教授,博士生导师,研究方向:疼痛信号转导及其调控,通讯作者,E-mail: zhangym700@xzhmu.com.cn

