儿童青少年游泳运动员高原训练心脏功能变化研究
宋小波,陆一帆,王 斌,高 扬,闫会萍,王娟娟
SONG Xiao-bo1,LU Yi-fan2,WANG Bin1,GAO Yang2,YAN Hui-ping2,WANG Juan-juan2
儿童青少年游泳运动员高原训练心脏功能变化研究
宋小波1,陆一帆2,王 斌1,高 扬2,闫会萍2,王娟娟2
SONG Xiao-bo1,LU Yi-fan2,WANG Bin1,GAO Yang2,YAN Hui-ping2,WANG Juan-juan2
目的:研究儿童青少年游泳运动员高原训练心脏功能低氧应答反应和适应性变化规律,并进行AMS评估和HAPE早期症状问诊,结合分析高原乳酸阈强度训练对运动员心脏功能以及血清cTnI、NT-proBNP含量的影响,探讨儿童青少年游泳运动员基础训练阶段高原训练的可行性。方法:以11周岁基础训练阶段的低年龄组游泳运动员和14周岁高年龄组游泳运动员各9名为研究对象,在青海多巴进行2周的高原训练。于高原第1天进行AMS评估和HAPE早期症状问诊。高原前、高原第1、14天和高原后第7天采用多普勒心超评估心脏功能。高原第11天评估乳酸阈强度训练对运动员心脏功能以及血清cTnI、NT-proBNP含量的影响。结果:1)高原第1天低年龄组运动员2人(22.2%)出现轻度AMS,所有运动员均未出现HAPE临床症状。2)高原前,两组运动员HR、PASP、CO、EF、FS和RV-Tei无显著差异,低年龄组EDV、SV显著低于高年龄组(EDV:86.73±12.23 vs. 91.11±17.54,P<0.05;SV:56.34±9.89 vs. 61.74±13.77,P<0.05)。高原第1天,运动员HR、PASP显著升高,低年龄组显著高于高年龄组(HR:82.76±14.24 vs. 75.28±14.87,P<0.05;PASP:20.61±4.79 vs. 19.41±4.69,P<0.05);SV显著减少而CO显著增加,低年龄组显著低于高年龄组(CO:4.41±1.16 vs. 4.91±1.47,P<0.05;SV:47.89±12.11 vs. 57.81±9.17,P<0.05);EF、FS显著增加,组间比较无显著差异。高原第14天,运动员CO、PASP恢复高原前水平,HR、EF和FS显著高于高原前,各指标组间比较无显著差异;SV低于高原前水平,低年龄组显著低于高年龄组(51.84±10.93 vs. 58.5±9.39,P<0.05)。高原后第7天,运动员HR、SV恢复高原前水平,EF、FS持续高于高原前,各指标组间比较无显著差异。高原前、后两组运动员RV-Tei均未发生显著变化。3)训练前安静状态,两组运动员HR、PASP、CO、EF、E/A、RV-Tei和血液指标无显著差异。训练后即刻,运动员HR、PASP显著升高,低年龄组显著高于高年龄组(HR:135±13.46 vs. 128±15.37,P<0.05;PASP:21.4±4.81 vs. 19.74±5.78,P<0.05);CO增加而EF、E/A降低,各指标组间比较无显著差异。训练后6 h以上各指标均恢复训练前水平。训练前、后运动员RV-Tei未发生显著变化。4)血清cTnI于训练后4 h显著增加,训练后24 h恢复训练前水平,各测试点组间比较无显著差异。血清NT-proBNP于训练后即刻显著升高,训练后24 h持续高值,各测试点组间比较无显著差异。训练后即刻运动员血清NT-proBNP同PASP呈显著正相关(R=0.49,P<0.05),血清cTnI同EF相关性不显著。结论:1)基础训练阶段的低年龄组游泳运动员心脏功能低氧应答反应强于高年龄组,但低氧适应性变化规律同高年龄组一致,2周高原训练可提高其心脏功能。2)在高原进行乳酸阈强度训练并未对基础训练阶段的儿童青少年游泳运动员心脏功能造成不利影响。
儿童青少年;游泳运动员;高原训练;心脏功能;心肌肌钙蛋白I;氨基末端脑钠肽前体
高原训练在游泳项目中得到广泛应用,越来越多的儿童青少年运动员,甚至基础训练阶段的低年龄组运动员采用高原训练的手段来提高竞技能力。目前,已有游泳高原训练理论主要针对高水平运动员,但鲜有儿童青少年运动员高原训练的针对性研究报道[24]。儿童青少年身体机能及器官功能处于快速的生长发育阶段,是否应该参加高原训练以及过早参加高原训练的安全性、可行性和有效性等系列问题均有待深入研究。低氧暴露结合运动训练引起运动员机体器官系统,甚至细胞分子水平的应答反应和适应性变化是高原训练提高运动能力的基础。而高原相关病症(High-Altitude Illness,HAI)的发病风险同样取决于心、肺等器官系统的低氧应答反应,其反应类型和程度同年龄有关[8,9,16,29]。Moraga等[16]认为,同青少年和健康成年人相比,儿童对于高原低氧更为敏感,急性高山病(Acute Mountain Sickness,AMS)发病率更高。Kriemler等[8,9]研究发现,随着年龄的增长,心血管系统低氧应答反应下降而呼吸系统低氧应答反应增强,低氧性肺动脉高压在儿童的发病率显著高于其父辈。低氧性肺动脉高压可导致右心室压力负荷异常而影响心脏功能,并进一步引发高原肺水肿(High Altitude Pulmonary Edema,HAPE)[25]。HAPE对急进高原人群的生命构成威胁,是海拔4 000 m以上高原突发死亡的常见原因[28]。进入海拔2 500~3 000 m的高原旅行,0.1%~7%的健康个体同样会出现HAPE[13,26,28],其发病率随着年龄的增长呈现显著下降趋势[23]。以上研究均提示,同青少年和健康成年人相比,年龄更低的儿童高原低氧暴露存在更高的健康风险。此外,低氧环境下大强度运动可引起运动员血清心肌肌钙蛋白释放增加[10]。心肌肌钙蛋白是目前敏感性和特异性最好的心肌损伤标志物,是心肌梗死等疾病重要的临床诊断依据。研究表明,低氧环境下运动引起的心肌肌钙蛋白释放增加在低氧性肺动脉高压个体更为显著[15]。进一步说明,高原低氧环境下进行大强度训练可能对低年龄组儿童青少年运动员心脏功能造成不利影响,增加其健康风险。
本研究以11周岁基础训练阶段游泳运动员和14周岁高年龄组游泳运动员各9人为研究对象,研究儿童青少年游泳运动员高原训练心脏功能的低氧应答反应和适应性变化规律,结合分析高原乳酸阈强度训练对运动员心脏功能以及血清cTnI、NT-proBNP含量的影响,并进行AMS评估和HAPE早期症状问诊,分别从高原低氧暴露和高原强度训练两个方面探讨儿童青少年游泳运动员基础训练阶段高原训练的可行性,为儿童青少年游泳运动员高原训练实践和医务监督工作提供理论支持。
1 研究对象与方法
1.1 研究对象和分组
本研究以山西省游泳队11周岁低年龄组运动员和14周岁高年龄组运动员各9名为研究对象,分为2组(低年龄组和高年龄组,表1)。所有受试者均为平原人,长期在山西省体育中心训练(位于太原市,海拔800 m)。实验之前所有运动员均未到过高原或接受任何形式的低氧训练。所有运动员无心血管疾病史,安静状态彩色多普勒超声心动图和12导联心电图检查结果正常,实验前1个月内无感冒等呼吸道感染病史,均详细了解本研究整体试验流程,并签署知情同意书。
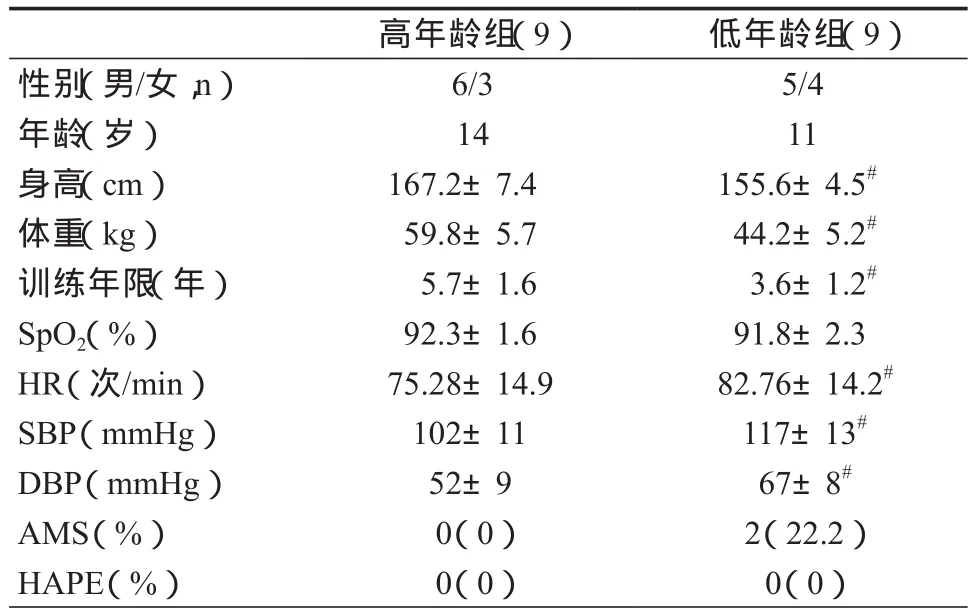
表1 本研究运动员基本情况Table 1 Clinical and Training Characteristics of Athletes
1.2 研究方法
1.2.1 实验方案
本次高原训练在青海多巴基地(海拔2 388 m,平均气压76.5KPa)进行,为期2周。整个训练过程包括适应性训练、逐步增量和强度训练3个阶段。高原第1~4天为适应性训练阶段,训练内容以任意游(REC)、技术游和一般有氧(EN1)为主。高原第6~9天为增量阶段,要求在上一阶段训练内容的基础上逐步增加训练量。高原第11~14天为强度训练阶段,训练内容以乳酸阈强度训练(EN2)为主,结合进行调整和恢复性训练。高原第5天和第10天进行调整和恢复性训练。整个训练过程未安排最大摄氧量强度训练(EN3),适度安排无氧训练的训练内容(图1)。
运动员乘坐火车进入高原,历时9 h 51 min。于高原第1天进行AMS评估和HAPE早期症状问诊。分别于高原前(H0),高原第1、14天(A1、A2)以及高原后第7天(P1)采用彩色多普勒心脏超声估测肺动脉收缩压(Pulmonary Artery Systolic Pressure,PASP)并评估运动员心脏功能。测试日晨起采集静脉血进行血清内皮素1(Endothelin-1, ET-1)和一氧化氮(Nitric Oxide,NO)测试。于高原第11天(强度训练阶段第1天)评估乳酸阈强度训练对儿童青少年游泳运动员心脏功能的影响。分别于训练前以及训练后即刻、6 h进行彩色多普勒心脏超声测试。于训练前以及训练后即刻、4 h和24 h采集静脉血进行血清心肌肌钙蛋白I(Cardiac Troponin I,cTnI)和氨基末端脑钠肽前体(N-Terminal Pro Brain Natriuretic Peptide,NT-proBNP)测试。
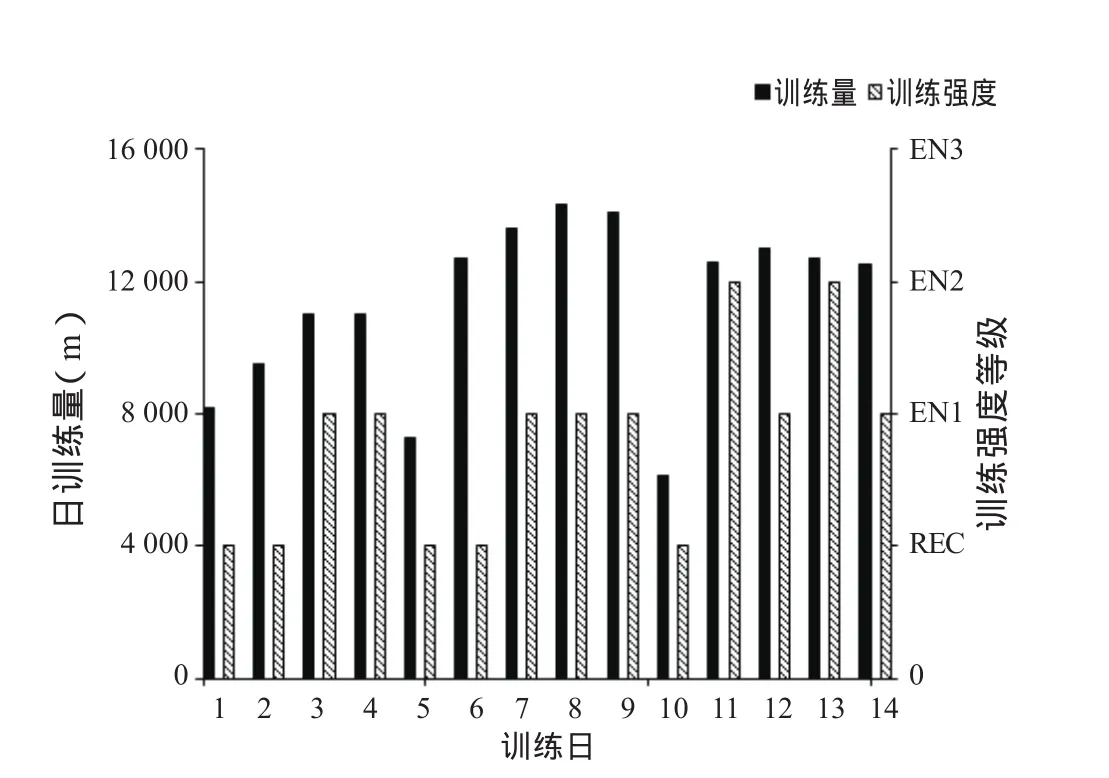
图1 高原训练的负荷结构柱状图Figure 1. The Training Load of Altitude Training
1.2.2 AMS评估和HAPE早期症状问诊
AMS评估采用路易斯湖诊断标准(Lake Louise Scoring System),该诊断标准将头痛、胃肠症状(食欲不振、恶心、呕吐)、疲劳、头晕及失眠5种症状分为无、轻、中、重,各自对应0~3分,进行自我评价并相加得出综合评分。基于AMS-LLS诊断标准,在近期内快速从低海拔地区进入高原地区,个体出现头痛症状并伴有至少下列1项症状,即胃肠症状(食欲不振、恶心、呕吐)、疲劳、头晕及失眠,如AMS-LLS总分≥3分则诊断为AMS,≥5分诊断为重度AMS。HAPE主要通过由临床医师问诊早期症状的方法进行评估。HAPE的早期症状包括:咳嗽、呼吸急促以及活动受限等。
1.2.3 彩色多普勒超声测试
采用GE LOGIQ I 便携式多普勒超声仪,安静状态下左侧卧位,取胸骨旁左室长轴图和心尖四腔面,进行M型、二维及多普勒超声心动图检查,测量心率(Heart Rate,HR)、每搏输出量(Stroke Volume,SV)、心输出量(Cardiac Output,CO)、左心室射血分数(Ejection Fraction,EF)、左室短轴缩短率( Fraction Shortening,FS)以及E/A比值等心脏结构和功能参数。选取右心室流入道、胸骨旁短轴和心尖四腔切面,测量右心室形态指标,计算右心室Tei指数。彩色多普勒显示最大三尖瓣返流速度,调整探头角度和连续多普勒取样线,使之与射流方向保持一致,测量三尖瓣最大返流速度,根据简化伯努利方程计算△ p,并估测PASP。
△ p=4v2,其中,v为三尖瓣最大返流速度;
PASP=RAP+△ p,其中,RAP为右心房压;
Tei指数=(ICT+IRT)/ ET,其中,ICT为心室等容收缩时间,IRT为等容舒张时间,ET为心室射血时间。
1.2.4 乳酸阈强度训练内容
高原第11天为强度训练阶段的第1天,本研究对高原强度训练课前、后运动员心脏功能变化进行评估。训练课的主要训练内容为乳酸阈强度训练(70%~90%O2max强
度)。所有运动员在完成热身和技术游(训练量2 700 m)后进行3组6×200 m自由泳的间歇性大强度训练。根据运动员个人最好成绩确定每个200 m包干时间,要求速度达到比赛成绩的85%~95%,血乳酸达到3~5 mmol/L。在高原强度训练阶段开始前,所有运动员在完成高原适应性训练,并逐步提高高原训练的训练量后,进行了适当的恢复和调整。测试开始前24 h内所有运动员禁止有任何形式的剧烈运动。
1.2.5血液指标测试
安静坐位,肘正中静脉取血5 mL,离心15 min(3 000 r/min,室温)提取血清,分装并于-80℃冰箱保存待测。ET-1、NO和NT-proBNP采用ELISA法进行测试,试剂盒由加拿大ELIXIR公司提供。血清cTnI的测定采用化学发光免疫法,应用“双抗体夹心法”原理,参考范围为<0.04 ng/mL,试剂盒由美国Beckman-Coulter公司提供。各指标的测试过程均严格按照说明书进行操作。
1.3统计方法
所有试验数据由SPSS统计软件(SPSS 19.0 for Windows)处理。连续变量做正态性检验,符合正态分布则用均数±标准差(X±SD)表示,不符合正态分布则以中位数和4分位数间距来描述,分类变量用数值和百分比表示。经正态分布检验,符合正态分布的数据进行重复测量方差分析,不符合正态分布则采用非参数检验。同一时间点的组间比较采用单因素方差分析或Mann-Whitney秩和检验。连续变量的相关分析采用Pearson相关分析,P<0.05表示具有显著性差异。
2 研究结果
2.1 运动员一般情况
低年龄组运动员身高、体重、训练年限均显著低于高年龄组运动员。初次进入2 388 m高原后,两组运动员脉搏血氧饱和度未出现显著差异,但低年龄组运动员安静心率、收缩压和舒张压均显著高于高年龄组运动员。低年龄组运动员中有2人出现轻度AMS(平均值:3.2±0.4;范围:2~5)。所有运动员均未出现HAPE的典型临床症状(表1)。
2.2 高原安静状态测试结果
高原前,低年龄组运动员左室舒张末期容积(End-Diastolic Volume,EDV)和SV显著低于高年龄组,两组运动员HR、PASP、CO、EF、FS和RV-Tei无显著差异。高原第1天,运动员HR、PASP显著升高,CO、EF和FS显著增加,而左室收缩末期容积(End Systolic Volume,ESV)、EDV和SV均显著减少。低年龄组运动员HR、PASP显著高于高年龄组运动员,而CO和SV显著低于高年龄组运动员,EF和FS组间比较无显著差异。高原第14天,运动员CO、PASP恢复高原前水平,而HR、EF和FS持续高于高原前水平,各指标组间比较无显著差异。运动员SV低于高原前水平,低年龄组运动员显著低于高年龄组。高原后第7天,两组运动员HR恢复高原前水平,EDV增加而ESV依旧低于高原前水平,SV恢复高原前水平,EF、FS则持续高于高原前水平。高原前、后两组运动员RV-Tei指数均未发生显著变化(表2)。
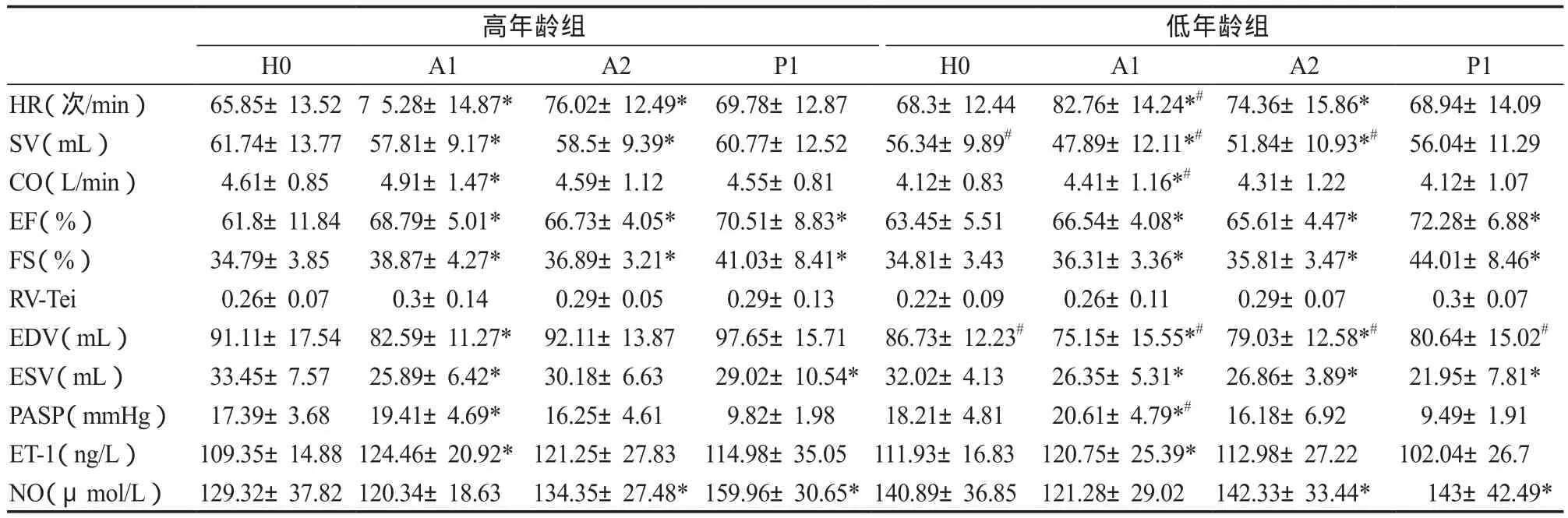
表2 运动员高原训练安静状态各指标变化Table 2 The Cardiac Function and Serum Markers of Athletes during Altitude Training
高原前两组运动员血清ET-1和NO含量无显著差异。高原第1天运动员血清ET-1含量显著升高,于高原第14天恢复至高原前水平,组间比较无显著差异。高原第14天以及高原后第7天,运动员血清NO含量显著高于高原前水平,组间比较无显著差异(表2)。高原第1天运动员血清ET-1同PASP呈显著正相关(r=0.3,P=0.035)[1]。
2.3 高原强度训练课测试结果
训练前,两组运动员HR、PASP、CO、EF和E/A组间比较无显著差异。训练后即刻,运动员HR和PASP显著升高,低年龄组显著高于高年龄组,于训练后6 h恢复训练前水平。训练后即刻,运动员CO显著增加,而EF和E/A显著降低,各指标组间比较无显著差异,均于训练后6 h恢复训练前水平。训练前、后运动员RV-Tei指数未发生显著变化(表3)。
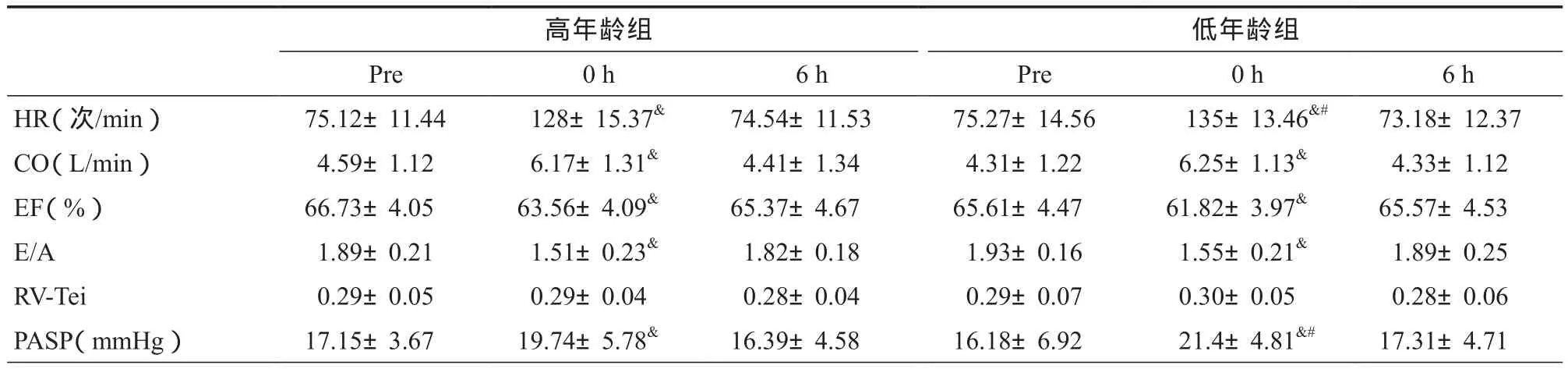
表3 高原训练课前、后运动员心脏功能变化Table 3 The Cardiac Function of Athletes before and after Altitude Training
训练后4 h运动员血清cTnI显著高于训练前水平〔低年龄组:0.031(0.023~0.077) vs. 0.011(0.007~0.016),P<0.05;高年龄组: 0.028(0.019~0.051) vs. 0.009(0.0075~0.0145),P<0.05〕组间比较无显著差异。两组运动员各有2名,共4名(22%)运动员训练后cTnI峰值>0.04 ng/mL。除1名低年龄组运动员外,所有运动员血清cTnI于训练后24 h恢复到训练前水平(图2)。训练后即刻运动员血清cTnI同心脏功能参数EF相关性不显著(r=-0.051,P>0.05)。
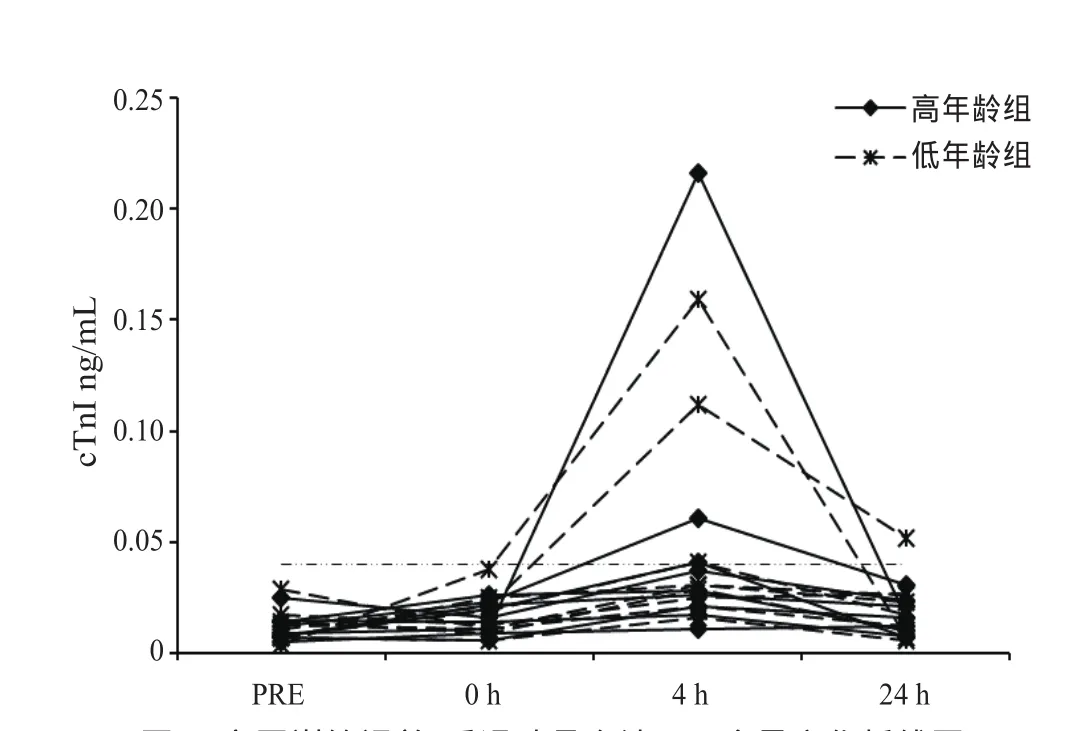
图2 高原训练课前、后运动员血清cTnI含量变化折线图Figure 2. Individual Data Points for cTnI in Athletes before and after Altitude Training
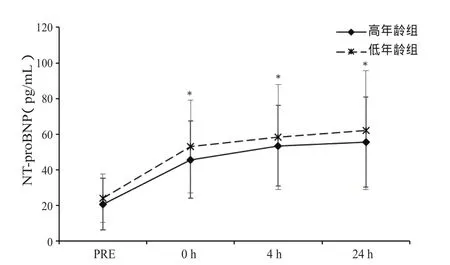
图3 高原训练课前、后运动员血清NT-proBNP含量变化折线图Figure 3. The Serum NT-proBNP of Athletes before and after Altitude Training
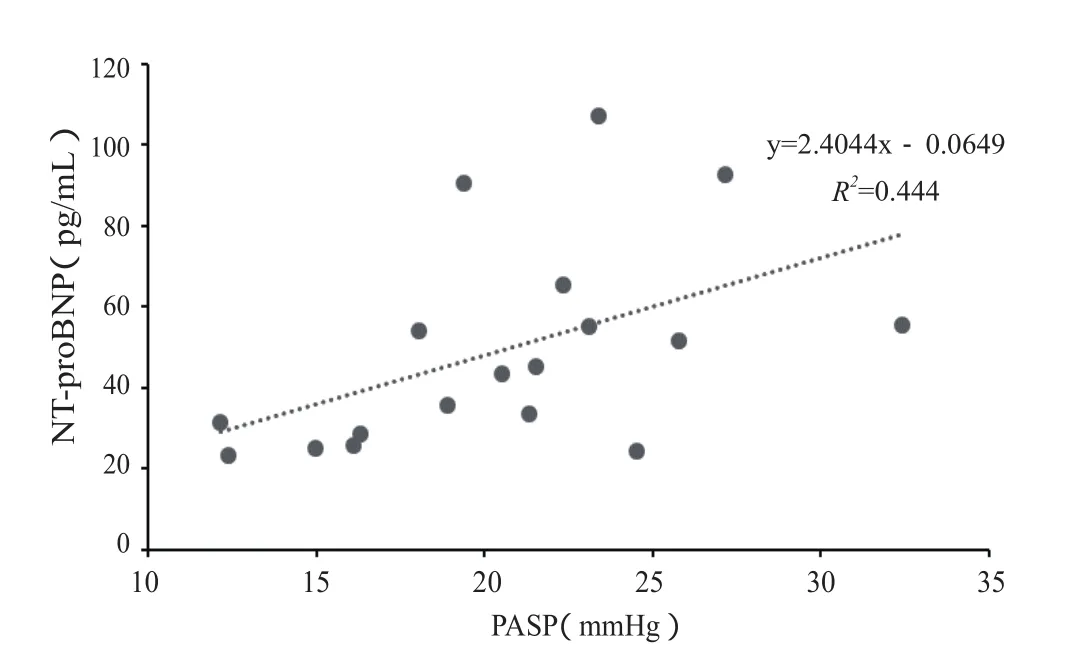
图4 高原训练课后NT-proBNP与PASP的相关关系示意图Figure 4. Correlation between NT-proBNP and PASP before and after Altitude Training
训练后即刻运动员血清NT-proBNP显著高于高原前水平〔低年龄组:55.2(29.65~78.1) vs. 20.3(11.55~33.85),P<0.05;高年龄组:43.4(26.95~52.8) vs. 15.9(10.6~25.45),P<0.05〕,直至训练后24 h仍未恢复训练前水平。组间比较无显著差异(图3)。训练后运动员血清NT-proBNP同PASP呈显著正相关关系(r=0.49,P<0.05,图4)。
3 分析讨论
本研究发现初入海拔2 388 m高原,11周岁低年龄组运动员中有2人(22.2%)出现轻度AMS,而高年龄组运动员无1人出现AMS,两组运动员均未出现HAPE的典型临床症状。AMS和HAPE为HAI最常见的两种类型,可见于急进2 000~3 000 m以上海拔高原的健康人群[7,20]。严重AMS可以发展为高原脑水肿(High-AltitudeCerebral Edema,HACE)。HACE和HAPE均为潜在致命性临床综合征,是影响高原习服的重要因素[7,28]。Moraga等[16]对进入海拔4 400 m高原旅行的儿童(6~48个月)、青少年(13~18岁)以及健康成年人(21~44岁)进行AMS评估和心肺功能测试,发现进入高原后儿童AMS发病率显著高于青少年和健康成年人(儿童:100%;青少年:50%;健康成年人:23%),AMS发病率同旅行者年龄呈负相关关系,因此认为儿童对于高原低氧更为敏感。Scoggin等[29]则发现,同健康成年人相比,儿童青少年进入高原后更容易出现HAPE的典型临床症状,同样证明,年龄因素构成HAI发病的风险因素,初次进入高原地区年龄越低者健康风险越高。本研究中,儿童青少年游泳运动员初次进入海拔2 388 m高原后,仅11周岁低年龄组运动员出现2例轻度AMS,进一步提示,要提高儿童青少年运动员尤其基础训练阶段的低年龄组运动员参加高原训练的风险意识。儿童青少年运动员参加高原训练,不仅高原前要加强对HAI高危人群的筛查力度,而且要加强高原初期的针对性医务监督工作。两组运动员均未出现HAPE的典型临床症状以及整体相对较低的AMS发病率(11.1%),这同本研究高原训练的海拔高度以及进入高原的方式有关。除年龄因素外,高原海拔高度、进入高原的速度、HAI既往史、久居平原以及气温等环境因素同样构成HAI发病风险因素。研究表明,海拔高于2 500 m以及急进高原的方式均可增加HAI发病风险[5,7]。Murdoch[18]研究发现,采用乘坐飞机的方式急进海拔3 740 m高原,健康人群AMS发病率可高达84%。Bloch等[4]则发现,采用乘坐火车的方式渐进海拔3 450 m高原,儿童青少年AMS发病率相对较低,临床症状轻微且存在一定自限性。由此可见,本研究采用乘坐火车的方式渐进性进入海拔2 388 m高原,对于儿童青少年运动员而言是一种安全可靠的方法。
研究表明,低氧环境下肺动脉压升高在HAPE的发病过程中起着关键作用[25]。本研究虽然两组运动员高原第1天均未出现典型的HAPE早期临床症状,但PASP显著增加提示,低氧暴露引起了运动员肺动脉压的升高。肺血管内皮ET-1和NO的合成释放在肺循环低氧应答反应和适应性变化过程中发挥重要作用。低氧可引起肺循环血流动力学改变,甚至损伤血管内皮细胞造成内皮形态和结构功能紊乱,合成释放ET-1增加而引起肺动脉收缩,导致肺循环阻力增加而压力升高[19]。本研究高原训练期间运动员血清ET-1含量同PASP表现出相同的变化规律,均于高原第1天显著升高,高原第14天恢复高原前水平,且高原第1天运动员血清ET-1含量同PASP呈显著正相关(r=0.3,P=0.035)[1]。因此,本研究认为肺血管内皮ET-1的合成释放增加是高原第1天运动员PASP升高的主要原因。高原第14天运动员血清ET-1恢复高原前水平,而血清NO含量显著升高。ET-1合成释放减少以及NO合成释放增加是低氧适应后运动员PASP恢复高原前水平的原因所在。高原第1天11周岁低年龄组运动员PASP显著高于高年龄组,PASP同运动员年龄呈显著负相关(R=-0.26,P=0.008)[1],可能同自主神经调节有关。Kriemler等[8]同样采用多普勒心超估测PASP的方法对青春期前儿童及其父辈海拔3 450 m高原暴露的肺动脉压进行评估,发现高原第1天两组人群PASP均显著升高,其中儿童PASP显著高于其父辈,且低氧性肺动脉高压(PASP≥30 mm Hg)发病率更高。由于儿童动脉血氧饱和度同其父辈无显著差异而心率和体循环收缩压显著高于其父辈,Kriemler等[8]认为,高原暴露后肺循环低氧应答反应的年龄差异主要由自主神经调节引起,同肺循环局部低氧无关。本研究高原第1天低年龄组运动员动脉血氧饱和度同高年龄组运动员相比无显著差异,但心率和血压均高于高年龄组运动员,同Kriemler等[8]的研究结果一致,因此认为,自主神经调节功能的年龄差异是本研究高原第1天低年龄组运动员PASP高于高年龄组运动员的可能原因。初入高原运动员PASP显著升高却并未引起HAPE的原因在于肺动脉压升高的幅度未达到引发HAPE的阈值。健康个体肺毛细血管压>19 mmHg是发生HAPE的临界点,而PASP>55 mmHg时可以引起严重HAPE。本研究高原第1天仅有2名运动员PASP>25 mmHg,最高值为29 mmHg,所有运动员均未达到低氧性肺动脉高压的诊断标准。而儿童青少年较强的肺泡及肺间质渗出液清除能力在预防HAPE发病的过程中可发挥重要作用[25]。
低氧引起肺血管收缩,肺动脉压力升高而肺循环阻力增加,将会加重右心室后负荷而影响右心功能。因此,心脏功能的低氧效应更多体现在右心功能的变化[19]。右心室Tei指数(Right Ventricular Tei Index,RV-Tei)是评估右心室整体收缩和舒张功能的有效指标[17]。本研究发现,高原训练前后两组运动员RV-Tei指数均未发生显著变化,组间比较无显著差异。因此认为,海拔2 388 m高原低氧暴露,PASP的升高并未对儿童青少年运动员右心功能造成影响。左心功能方面,高原训练期间11周岁低年龄组运动员同高年龄组运动员表现出相同的低氧应答反应和适应性变化规律。具体表现为:高原第1天运动员HR显著升高而SV显著减少,CO、EF和FS则显著增加;高原第14天运动员HR有所下降但仍高于高原前水平,SV有所增加但仍低于高原前水平,CO则恢复至高原前水平;高原后第7天运动员HR下降,SV增加,CO维持高原前水平,EF和FS则持续高于高原前水平。高原第1天,HR升高是CO增加的主要原因,通过增加CO可以维持低氧环境下循环系统对氧和营养物质的运输,保证运动员机体的代谢需求。交感-肾上腺素系统活动增强是高原第1天运动员HR升高的主要原因[7],而自主神经调节功能的年龄差异是高原第1天低年龄组运动员HR显著高于高年龄组运动员的原因所在。Finley等[6]以心率变异性(Heart Rate Variability,HRV)指标为评估参数研究儿童和青少年自主神经调节功能的差异,发现自主神经调节功能存在一定的年龄依赖性。具体而言,儿童自主神经系统发育并未成熟,交感副交感平衡性差,同青少年和健康成年人相比交感神经活跃而迷走神经张力较低,交感-肾上腺素系统调节更占优势。因此,高原低氧环境下儿童青少年运动员年龄越低HR和血压变化越显著。随着低氧适应和高原习服,迷走神经活性增强而肾上腺素能受体活性下降,自主神经调节趋于平衡,运动员HR则呈现逐步下降的趋势[14]。高原第1天,运动员SV减少的可能原因包括左心室收缩功能下降和循环血量减少两个方面。Rao等[22]以139名健康青年男性为研究对象的大样本调查研究证明,高原低氧暴露并不影响健康人群左心室收缩功能。本研究高原第1天运动员EF和FS显著增加同样说明高原低氧暴露并未对儿童青少年运动员左心室收缩功能造成不利影响。EDV和ESV的显著减少则表明,低氧环境下机体血液浓缩和血浆容量减少是高原第1天运动员SV减少的可能原因[30]。高原后第7天,运动员HR下降至高原前水平,EDV增加引起SV增加是CO维持稳定的主要原因。EDV增加而ESV持续低于高原前水平是EF高于高原前水平的原因所在。高原后第7天两组运动员EF和FS均高于高原前水平说明,两周高原训练在一定程度上提高了儿童青少年游泳运动员的左心室收缩功能。
训练负荷的合理安排是高原训练的核心内容,科学的负荷结构不仅是取得良好训练效果的前提,而且是高原训练得以安全、顺利进行的基础。对于高水平运动员而言,目前建议高原训练的训练负荷可以接近或达到平原训练水平[24]。儿童青少年游泳运动员,尤其基础训练阶段的低年龄组运动员高原训练的负荷安排并无相应的理论指导。游泳运动员年龄组训练大纲指出,9~12岁年龄段属于游泳项目的基础训练阶段,该阶段的训练目标要求逐步提高运动员有氧能力[2,3]。乳酸阈强度训练是提高运动员有氧运动能力的有效手段,是基础训练阶段的低年龄组运动员可以采用的间歇性大强度训练方式之一。本研究高原乳酸阈强度训练后即刻,运动员PASP显著升高,11周岁低年龄组显著高于高年龄组。PASP的升高势必加重运动员右心室后负荷[33],可能对运动员右心室功能造成影响。作为心肌细胞的一种生理性保护机制,运动后血清NT-proBNP含量的增加同运动引起的右心室舒张末期容积改变导致室壁应力增强有关[27]。本研究训练后即刻,运动员血清NT-proBNP含量显著增加,且同PASP呈正相关,证明了高原乳酸阈强度训练引起的肺动脉压升高在一定程度上加重了右心室后负荷。但训练前、后两组运动员RV-Tei指数均未发生显著变化,说明高原乳酸阈强度训练引起的肺动脉压升高并未对运动员右心室整体收缩和舒张功能造成影响。左心功能方面,本研究高原乳酸阈强度训练后即刻,两组运动员EF、E/A均显著降低。Vanoverschelde等[32]的研究认为,运动后EF、E/A的下降表明中等以上强度耐力训练可以引起健康个体左心室收缩和舒张功能紊乱。田野等[31]则认为,虽然训练可以引起运动员左心室收缩和舒张功能降低,但其变化幅度并不足以明确左心室功能紊乱的临床诊断。本研究高原乳酸阈强度训练后运动员EF、E/A的下降程度同样未达到左心功能紊乱的诊断标准,加之训练后6 h即恢复训练前水平,本研究认为,高原进行乳酸阈强度训练并未对儿童青少年游泳运动员左心室功能造成影响。此外,本研究运动员血清cTnI含量于乳酸阈强度训练后4 h显著升高,低年龄组运动员和高年龄组运动员各有2人血清cTnI峰值超过0.04 ng/mL,但血清cTnI含量同心脏功能指标(EF)并不相关,不能明确训练后运动员血清cTnI含量增加同心脏功能变化之间的关系。有研究者认为,间歇性大强度运动后运动员血清cTnI的释放和清除规律不同于急性冠脉综合征,是一种生理现象而非运动应激引起的病理反应[12]。李菲菲等[10,11]研究发现,低氧环境下间歇性大强度运动引起的血清cTnI释放增加可能同低氧导致心肌局部抗氧化保护效应减弱有关。总体而言,高原进行乳酸阈强度训练并未对儿童青少年游泳运动员,尤其基础训练阶段的低年龄组游泳运动员心脏功能造成不利影响。
4 总结
本研究采用对照观察的研究方法探讨儿童青少年游泳运动员基础训练阶段高原训练的可行性。样本量的大小在一定程度上限制了论证强度,这是一切针对高水平竞技运动员的研究所不可避免的问题。本研究发现,高原训练期间,基础训练阶段的低年龄组游泳运动员心脏功能低氧适应性变化规律同高年龄组运动员一致,2周高原训练可提高其心脏功能,证明基础训练阶段的低年龄组游泳运动员参加高原训练的可行性。但心脏功能低氧应答反应和年龄有关,年龄越低反应越强烈。同高年龄组运动员相比,基础训练阶段的低年龄组游泳运动员高原初期HR和PASP升高更为显著,具有更高的HAI发病风险。因此,要提高低年龄组儿童青少年游泳运动员参加高原训练的风险意识,加强针对性医务监督工作。参加高原训练前,有必要加强对运动员病毒感染、呼吸系统疾病、先天性心脏病以及阻塞性睡眠呼吸暂停综合征等可增加HAI发病风险的相关疾病的筛查力度[34]。选择合适的高原训练海拔高度以及渐进性进入高原的方式均可有效降低儿童青少年游泳运动员高原训练HAI的发病风险[21]。高原进行乳酸阈强度训练并未对儿童青少年游泳运动员心脏功能造成不利影响,可以将其作为儿童青少年游泳运动员,尤其是基础训练阶段的低年龄组运动员高原训练强度训练课的主要训练内容。
[1] 宋小波,王斌,高扬,等. 儿童青少年游泳运动员初入2 366 m高原肺动脉收缩压及心脏功能变化的超声心动图研究[J].中国运动医学杂志,2015,34(11):1058-1063.
[2] 中国游泳协会. 游泳年龄组教学训练大纲[M].北京:人民体育出版社,2006.
[3] 徐国伟. 游泳年龄组运动员(9~12岁)训练安排多样化研究[D].北京:北京体育大学,2013.
[4] BLOCH J,DUPLAIN H,RIMOLDI S F,et al. Prevalence and time course of acute mountain sickness in older children and adolescents after rapid ascent to 3450 meters [J]. Pediatrics,2009,123(1):1-5.
[5] CHAN C W,LIN Y C,CHIU Y H,et al. Incidence and risk factors associated with acute mountain sickness in children trekking on Jade Mountain,Taiwan [J]. J Travel Med,2016,23(1):tav008.
[6] FINLEY J P,NUGENT S T. Heart rate variability in infants,children and young adults [J]. J Auton Nerv Syst,1995,51(2):103-108.
[7] HEVRONI A,GOLDMAN A,KEREM E. High altitude:Physiology and pathophysiology in adults and children:A review [J]. Clini Pulm Med,2015,22(3):105-113.
[8] KRIEMLER S,JANSEN C,LINKA A,et al. Higher pulmonary artery pressure in children than in adults upon fast ascent to high altitude [J]. Eur Respir J,2008,32(3):664-669.
[9] KRIEMLER S,RADTKE T,BURGI F,et al. Short‐term cardiorespiratory adaptation to high altitude in children compared with adults [J]. Scand J Medi Sci Sports,2016,26(2):147-155.
[10] LI F F,HU Y,NIE J,et al. Effects of acute,intermittent exercise in hypoxic environments on the release of cardiac troponin [J]. Scand J Med Sci Sports,2015.
[11] LI F F,NIE J,LU Y,et al. The impact of intermittent exercise in a hypoxic environment on redox status and cardiac troponin release in the serum of well-trained marathon runners [J]. Eur J Appl Physiol,2016,116(10):2045-2051.
[12] LOPEZ-LAVAL I,LEGAZ-ARRESE A,GEORGR K,et al. Cardiac troponin I release after a basketball match in elite,amateur and junior players[J]. Clin Chem Lab Med,2016,54(2):333-338.
[13] MAGGIORINI M,MELOT C,PIERRE S,et al. High-altitude pulmonary edema is initially caused by an increase in capillary pressure [J]. Circulation,2001,103(16):2078-2083.
[14] MAZZEO R S. Physiological responses to exercise at altitude [J]. Sports Med,2008,38(1):1-8.
[15] MELLOR A,BOOS C,HOLDSWORTH D,et al. Cardiac biomarkers at high altitude [J]. High Alt Med Biol,2014,15(4):452-458.
[16] MORAGA F A,OSORIO J D,VARGAS M E. Acute mountain sickness in tourists with children at Lake Chungara (4 400 m) in Northern Chile [J]. Wilderness Environmental Med,2002,13(1):31-35.
[17] MORITA T,NAKAMURA K,OSUGA T,et al. Repeatability and reproducibility of right ventricular Tei index valves derived from three echocardiographic methods for evaluation of cardiac function in dogs [J]. Am J Vet Res,2016,77(7):715-720.
[18] MURDOCH D R. Altitude illness among tourists fl ying to 3740 meters elevation in the Nepal Himalayas [J]. J Travel Med,1995,2(4):255-256.
[19] NETZER N C,STROHL K P,HOGEL J,et al. Right ventricle dimensions and function in response to acute hypoxia in healthy human subjects [J]. Acta Physiol,2016,219(2):478.
[20] PALMER B F. Physiology and pathophysiology with ascent to altitude [J]. Am J Med Sci,2010,340(1):69-77.
[21] POLLARD A,MURDOCH D R,BARTSCH P,et al. Children in the mountains:High mountain trekking holidays are best avoided for the very young [J]. Br Med J,1998,316(7135):874-876.
[22] RAO M,LI J,QIN J,et al. Left ventricular function during acute high-altitude exposure in a large group of healthy young Chinese men [J]. PloSone,2015,10(1):e0116936.
[23] RICHALET J P,LHUISSIER F J. Aging,tolerance to high altitude,and cardiorespiratory response to hypoxia [J]. High Alti Med Biol,2015,16(2):117-124.
[24] RODRIGUEZ F A,IGLESIAS X,FERICHE B,et al. Altitude training in elite swimmers for sea level performance (altitude project) [J]. Med Sci Sports Exerc,2015,47(9):1965-1978.
[25] SARTORI C,RIMOLDI S F,SCHERRER U. Lung fl uid movements in hypoxia [J]. Prog Cardiovasc Dis,2010,52(6):493-499.
[26] SARTORI C,VOLLENWEIDER L,LOFFLER B M,et al. Exaggerated endothelin release in high altitude pulmonary edema [J]. Circulation,1999,99(20):2665-2668.
[27] SCHARHAG J,GEORGE K,SHAVE R,et al. Exercise-associated increases in cardiac biomarkers [J]. Med Sci Sports Exerc,2008,40(8):1408-1415.
[28] SCHOENE R B. Illnesses at high altitude [J]. Chest J,2008,134(2):402-416.
[29] SCOGGIN C H,HYERS T M,REEVES J T,et al. High-altitude pulmonary edema in the children and young adults of Leadville,Colorado[J]. N Engl J Med,1977,297(23):1269-1272.
[30] STEMBRIDGE M,AINSLIE P N,SHAVE R. Mechanisms underlying reductions in stroke volume at rest and during exercise at high altitude[J]. Eur J Sport Sci,2016,16(5):577-584.
[31] TIAN Y,NIE J,HUANG C,et al. The kinetics of highly sensitive cardiac troponin T release after prolonged treadmill exercise in adolescent and adult athletes [J]. J Appl Physiol,2012,113(3):418-425.
[32] VANOVERSCHELDE J L,YOUNIS L T,MELIN J A,et al. Prolonged exercise induces left ventricular dysfunction in healthy subjects [J]. J Appl Physiol,1991,70(3):1356-1363.
[33] WOODS D R,MELLOR A,BEGLEY J,et al. Brain natriuretic peptide and NT-proBNP levels ref l ect pulmonary artery systolic pressure in trekkers at high altitude [J]. Physiol Res,2013,62(6):597.
[34] YARON M,NIERMEYER S. Travel to high altitude with young children:an approach for clinicians [J]. High Alt Med Biol,2008,9(4):265-269.
Effects of Altitude Training on Cardiac Function of Children and Adolescent Swimmers
Objective:To investigate the response and adaptation of children swimmers’ cardiac function about altitude training and the changes of cardiac function after intensity training at plateau. Methods:Eighteenth young swimmers were divided into two groups (Child:11 years old;Adolescent:14 years old) and two-weeks altitude training was carried out in Duoba (altitude:2388 meters).The presence of AMS and the symptoms of HAPE was assessed clinically in the 1st day of plateau. Cardiac function was assessed by Color Doppler ultrasonography before and after altitude training and in the 1st and 14th day of plateau. The effects of altitude training at lactate threshold intensity on cardiac function were evaluated in the 11th day of plateau. Result:1) 2 athletes in children group were diagnosed with mild AMS. All athletes did not show any symptoms of HAPE. 2) Therewas no signif i cant difference between two groups in cardiac function before plateau except that the EDV and SV of child were signif i cant lower than adolescent (EDV:86.73±12.23 vs. 91.11±17.54,P<0.05;SV:56.34±9.89 vs. 61.74±13.77,P<0.05). After entering the plateau,the HR、CO、EF、FS and PASP of athletes increased signif i cantly,but the SV decreased signif i cantly. The HR and PASP of child was signif i cantly higher than adolescent (HR:82.76±14.24 vs. 75.28±14.87,P<0.05;PASP:20.61±4.79 vs. 19.41±4.69,P<0.05),but the CO and SV was signif i cantly lower than adolescent (CO:4.41±1.16 vs. 4.91±1.47,P<0.05;SV:47.89±12.11 vs. 57.81±9.17,P<0.05). The CO and PASP in two groups were restored to the pre-plateau level on the 14th day of plateau,but EF and FS increased continuously to the 7th day of post-plateau. The RV-Tei index did not change during altitude training. 3) There were no signif i cant difference between two groups in cardiac function and the serum indexes before plateau. The CO and PASP increased significantly and EF and E/A decreased signif i cantly after altitude training at lactate threshold intensity. The HR and PASP of child was signif i cantly higher than adolescent (HR:135±13.46 vs. 128±15.37,P<0.05;PASP:21.4±4.81 vs. 19.74±5.78,P<0.05). All indicators returned to pre-training levels 6 hours after training. The RV-Tei index did not change before and after training. 4) The serum cTnI and NT-proBNP were signif i cantly increased 4 hours after training and immediately after training respectively. The serum cTnI returned to pre-training levels 24 hours after training,but NT-proBNP continued to be high. There were no signif i cant difference between groups at any point. The serum NT-proBNP was positively correlated with PASP (r=0.49,P<0.05),while serum cTnI had no signif i cant correlation with EF after training. Conclusions:1) Hypoxia response of cardiovascular is more strongly in child,but the adaptation of children’s cardiac function about altitude training is consistent with adolescent and altitude training can improve their cardiac function. 2) Altitude training at lactate threshold intensity could not impair the cardiac function of young children swimmers.
children and adolescent;swimmers;altitude training;cardiac function;cTnI;NT-proBNP
G808.1
A
1002-9826(2017)05-0101-09
10. 16470/j. csst. 201705012
2016-12-19;
2017-06-22
中央高校基本科研业务费专项资金资助课题(2015ZD001)
宋小波,男,博士,主要研究方向为医务监督和训练监控,Tel:(010)62985219,E-mail:songxiaobohcc@ hotmail.com。
陆一帆,男,教授,博士,主要研究方向为运动生理学,Tel:(010)62985219,E-mail:luyifan@bsu.edu.cn。
1. 华中师范大学,湖北 武汉 430079;2. 北京体育大学,北京 100084 1. Central China Normal University,Wuhan 430079,China;2. Beijing Sport University,Beijing 100084,China.

