米根霉α-淀粉酶高麦芽糖生成能力相关氨基酸的初步分析
田方源,汤斌,2*,李松,2,杨倩
1(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000) 2(微生物发酵安徽省工程研究中心,安徽 芜湖,241000)
米根霉α-淀粉酶高麦芽糖生成能力相关氨基酸的初步分析
田方源1,汤斌1,2*,李松1,2,杨倩1
1(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000) 2(微生物发酵安徽省工程研究中心,安徽 芜湖,241000)
利用计算机辅助模拟分析技术对米根霉α-淀粉酶与麦芽三糖进行分子对接,并选择可能与该酶的高麦芽糖生成能力相关的氨基酸残基进行突变和分析。研究表明:突变体YHR和H286L最适作用温度分别比原酶的最适作用温度(50 ℃)提高了10 ℃和5 ℃;突变体H286L的最适作用pH下降了0.5。与原酶相比,突变体YHR和H286L作用麦芽三糖终产物中麦芽糖含量分别提高了18.87%和16.87%,作用可溶性淀粉终产物中麦芽糖含量分别提高了11.67%和10.32%。初步确定H286与该酶高麦芽糖生成能力之间的关系最为密切,其次为Y80和R333。
真菌α-淀粉酶;麦芽糖;蛋白质结构;定点突变
工业用α-淀粉酶(EC 3.2.1.1)按微生物来源不同可以分为细菌α-淀粉酶和真菌α-淀粉酶2大类[1]。细菌α-淀粉酶水解淀粉的主要产物是糊精及少量寡糖和葡萄糖,其在淀粉质原料的水解过程中主要起到液化作用(如高温α-淀粉酶)或淀粉乳的降黏作用(如中温α-淀粉酶)[2]。与细菌α-淀粉不同,真菌α-淀粉酶可以水解淀粉和麦芽三糖,终产物中主要物质为麦芽糖和部分低聚寡糖及少量葡萄糖。其中,真菌来源的α-淀粉酶有很多种,主要指黑曲霉、米曲霉或米根霉等真菌来源并可分泌至细胞外的在蛋白质结构和底物催化特征等方面比较相似的一类α-淀粉酶,在现代研究或工业应用领域统称为真菌α-淀粉酶[1, 3]。
高麦芽糖浆是一种以麦芽糖为主(通常含量>50%)的淀粉糖,在食品和饮料行业具有广泛的应用[4-5]。在现代淀粉糖行业,高麦芽糖浆主要采用酶转化淀粉工艺进行生产。随着糖化工艺的改进,真菌α-淀粉酶已逐渐替代β-淀粉酶做为主要糖化剂用于高麦芽糖浆的生产,成为高麦芽糖浆生产过程中的关键酶制剂[6]。真菌α-淀粉酶之所以能够替代相对昂贵的β-淀粉酶,是因其具有特殊的产物生成能力——高麦芽糖生成能力。高麦芽糖浆品质的高低依据糖浆中麦芽糖的含量而定,因此,在高麦芽糖浆的工业生产过程中,真菌α-淀粉酶催化水解淀粉所生成的终产物中麦芽糖浓度的高低是评价其应用性能的一个重要特征指标。目前,真菌α-淀粉酶高麦芽糖生成能力的研究主要集中在酶的底物催化形式等生化性质研究阶段,其中一种研究认为,α-淀粉酶对麦芽三糖的亲和力的不同可能对麦芽糖的形成和终产物中麦芽糖的含量具有重要影响[7];另一种研究认为真菌α-淀粉酶具有高麦芽糖生成能力是由于该淀粉酶可以催化低浓度麦芽三糖发生转糖基化反应所致[8]。而有关真菌α-淀粉酶结构与其高麦芽糖生成能力之间关系的研究则未见报道,即没有结合酶蛋白质结构分析从根本的分子水平上加以研究,使得真菌α-淀粉酶的高麦芽糖生成能力及其作用机制一直没有得到合理的阐释。
因此,为了在分子水平上研究与真菌α-淀粉酶高麦芽糖生成能力相关的关键蛋白结构特征,本研究通过蛋白结构建模和底物对接等生物信息学分析方法初步对米根霉α-淀粉酶中可能与高麦芽糖生成能力相关的关键氨基酸进行了分析,并利用定点突变技术获得了系列突变体。研究中进一步对突变体的结构、理化性质和底物水解特征等进行了分析,以期为深入研究真菌α-淀粉酶的高麦芽糖生成机制及其高麦芽糖生成能力这一重要催化功能的定向进化方法提供参考。
1 材料与方法
1.1材料与试剂
菌株:大肠杆菌(Escherichiacoli)JM109和巴斯德毕赤酵母(Pichiapastoris)GS115,以及质粒pUC57和pPIC9k,为本实验室保藏;含有米根霉α-淀粉酶基因(ROAmy)的重组质粒pUC57-ROAmy为本实验室在前期研究工作中构建。其中,基因ROAmy(GenBank:HM234170)克隆自菌株米根霉(Rhizopusoryzae)F0071(中国高校工业微生物资源与信息中心,CICIM—CU)。实验中所使用的各种限制性核酸内切酶、DNA聚合酶、T4DNA连接酶以及质粒抽提、PCR产物纯化和胶回收等试剂盒分别购于宝生物工程(大连)有限公司或生工生物工程(上海)有限公司。酵母氮基(YNB)购于北京拜尔迪生物公司;麦芽寡糖标准品购于日本林原生化研究所公司(Hayashibara Biochemical Laboratories, Inc)。其他试剂均为国产或进口的生化或分析纯试剂。
1.2培养基
LB培养基:NaCl 10 g/L,蛋白胨10 g/L,酵母膏0.5 g/L;向LB液体培养基中添加15 g/L琼脂粉即制得LB固体培养基。基本培养基MM、种子培养基YPD、初始发酵培养基BMGY以及诱导发酵培养基BMMY等培养基的配制按照毕赤酵母操作手册[9]进行。向MM固体培养基中添加5 g/L可溶性淀粉即制得突变体筛选培养基。
1.3仪器与设备
紫外可见光分光光度计,上海精科仪器有限公司,型号:YXLZ820KBSQ;蛋白质纯化设备,美国GE Healthcare公司,型号:AKTA-Explorer 100;电穿孔仪,美国BTX公司,型号:ECM 630;Ni亲和柱,美国GE Healthcare公司,型号:His TrapTMHP 1 mL;高效液相色谱仪,美国Water公司,型号:Water 1525。
1.4方法
1.4.1 ROAmy分子建模及定点突变
基于7taa (PDB entry code),利用同源建模软件(SWISS-MODEL)构建米根霉α-淀粉酶3D模型,运用软件Molegro Virtual Docker(MVD)对ROAmy与麦芽三糖底物进行分子对接,分析并选择ROAmy结构中与麦芽三糖结合较为密切的氨基酸为待突变位点,设计引物并利用Overlapping PCR技术对待突变位点氨基酸进行突变。
1.4.2 突变体表达菌株的构建及发酵
以含有原始基因的重组质粒pUC57-ROAmy为模板,利用突变引物进行扩增,Overlapping PCR产物经EcoR Ⅰ和NotⅠ双酶切后与相同双酶切处理的质粒pPIC9k相连接并导入E.coliJM109中,构建得到含有突变基因的重组质粒pPIC-rROAmy。抽提重组质粒pPIC-rROAmy并对突变基因进行序列测定,验证正确后进一步使用SacI进行线性化并利用电转化方法导入P.pastorisGS115。酵母转化子经划线分离纯化后再利用含淀粉的筛选培养基进行培养,于30 ℃培养48 h后使用稀碘液进行染色,出现透明圈的菌落即为目标重组表达菌株。重组菌的摇瓶发酵方法及步骤按照毕赤酵母操作手册[9]进行。
1.4.3 酶活测定
取1 mL可溶性淀粉(10 g/L)溶液与0.25 mL柠檬酸-磷酸二氢钠缓冲液(0.2 mol/L, pH 5.0)混合,50 ℃温浴5 min后加入0.1 mL α-淀粉酶液,继续保温10 min后立即加入0.1 mL HCl溶液(0.1 mol/L)终止反应。使用DNS[10]法对反应液中的还原糖进行定量。以烘干至恒重的麦芽糖为标样绘制DNS标准曲线。1个α-淀粉酶活力单位(U)定义为:在上述反应条件下,每分钟生成1 mg麦芽糖所需要的酶量。
1.4.4 最适反应温度及热稳定性测定
在pH 5.0条件下,分别在25~75 ℃温度下测定酶活力,以最高酶活力为100%计算相对酶活力确定酶的最适反应温度;将酶液用pH 5.0缓冲液(柠檬酸-磷酸氢钠0.2 mol/L)稀释后,分别在40~70 ℃温度下保温0~20 min,保温一定时间后立即取出样品,冰上放置30 min后对酶活力进行检测,以最高酶活力为100%计算相对酶活力以研究酶的热稳定性。
1.4.5 最适反应pH测定
在55 ℃条件下分别使用不同pH(3.0~8.0)缓冲液进行酶活力测定,以最高酶活力为100%计算相对酶活力以确定酶的最适反应pH。
1.4.6 酶作用底物终产物分析
使用pH 5.0的柠檬酸-磷酸氢钠缓冲液分别配置10 mg/mL的可溶性淀粉溶液与40 mmol/L的麦芽三糖溶液,在1.8 mL的溶液中加入0.2 mL酶液(10 U),并在40 ℃下反应8 h,酶反应产物使用等体积三氯乙酸(100 g/L)终止反应,4 ℃静置沉淀3 h后于7 000 r/min离心30 min,取上清液用0.2 μm微孔滤膜过滤,滤液中糖组分及含量HPLC法进行定量分析。HPLC检测条件:色谱柱为Luna-NH2,流动相为甲醇+水(10+90,v/v),流速为1.0 mL/min,检测波长为285 nm,柱温为30 ℃,进样量为10 μL。
2 结果与分析
2.1淀粉酶的底物分子对接和定点突变
研究报道发现,真菌α-淀粉酶的高麦芽糖形成能力可能与该淀粉酶水解麦芽三糖的能力有关,如与麦芽三糖亲和常数的高低和低浓度麦芽三糖浓度下能够发生的转糖基化作用等[7-8]。因此,本研究选择麦芽三糖(SID:22394327)为底物配体与ROAmy进行分子对接。由于不同编号的麦芽三糖分子在计算机模拟结构上的差异,在进行生物信息学模拟时会引起对接结结果的不同,因此研究中只能先预设一个特定编号的底物进行对接。在本研究中使用该编号底物进行对接时,发现与麦芽三糖底物可形成氢键相互作用的氨基酸残基有Y80、H286和R333三个位点(如图1所示),该3个位点氨基酸残基虽然在一级结构上距离较远,但在三级结构中距离较近,均处于该淀粉酶的催化区域(Domain A)内。其中,Y80、H286和R333其与麦芽三糖的亲和力分别为:-1.613 1 kJ/mol、-1.545 3 kJ/mol和-1.361 2 kJ/mol。由于可能影响酶水解特性的氨基酸多为结合位点氨基酸[2, 11],因此研究中初步选择以Y80、H286和R333三个位点氨基酸为待突变位点。

a-ROAmy; b-Y80; c-R333; d-H286; e-YHR; f-L286图1 ROAmy及其突变体与麦芽三糖对接结果Fig.1 Docking results of maltotriose with ROAmy and its mutants
研究中以亮氨酸(L)为替换氨基酸,设计引物对上述3个位点氨基酸进行单位点突变和组合突变,分别获得突变体Y80L、H286L、R333L和YHR(3个待突变氨基酸全部突变为亮氨酸)。同时,将4个突变体分别与麦芽三糖进行对接模拟(如图1所示),结果显示突变体YHR与麦芽三糖对接后,突变体中仅有L286与麦芽三糖有相互作用,且与麦芽三糖的亲和力降低为-2.117 6 kJ/mol,而突变后的L80与L333与麦芽三糖之间没有发现相互氢键作用(结果未显示)。
2.2ROAmy及其突变体最适作用温度研究
在不同温度下测定原酶ROAmy及其突变体的酶活力并计算相对值,发现单突变体中H286L最适作用温度为55 ℃,较原酶提高了5 ℃,组合突变体YHR最适作用温度为60 ℃,较原酶提高了10 ℃;突变体YHR在65 ℃和70 ℃时相对酶活力分别为最适温度(60 ℃)下的91.1%和42.1%;H286L在65 ℃和70 ℃时的酶活力为最适温度(55 ℃)下的64.5%和23.1%(如图2所示)。其他2个单突变体Y80L和R333L的最适作用温度与原酶相同(其数据可参考ROAmy)。通过单突变体与组合突变体的最适作用温度比较可以发现,虽然单突变Y80L和R333L的最适作用温度与原酶相同,但通过与H286L突变进行组合后会进一步提高单突变体H286L最适作用温度。

图2 温度对ROAmy及其突变体YHR和H286L催化活力的影响Fig.2 Effect of temperature on the catalytic activities of ROAmy, YHR and H286L
2.3ROAmy及其突变体温度稳定性研究
将原酶ROAmy及其突变体在不同温度下保温20 min后,测定残留酶活力,通过比较发现在40 ℃、60 ℃和70 ℃条件下突变体YHR与原酶的热稳定性在总体趋势上差异不明显;在50 ℃条件下2者具有明显差异,如原酶在该温度下保温20 min后酶活残留为72.8%(图3),而突变体YHR残留酶活仅为61.2%(图4)。另,突变体H286L的热稳定性趋势与突变体YHR相似,而突变体Y80L和R333L的热稳定性趋势与原酶相近(其数据可参考ROAmy)。突变体YHR和H286L在最适催化温度方面较原酶均有所提升,但是2者的热稳性却有所下降,表明虽然本研究中引入的氨基酸残基变化可提高突变体在更高温度下的催化速率,但同时也在一定程度上破坏了原始酶蛋白结构的稳定性。

图3 温度对ROAmy稳定性的影响Fig.3 Effect of temperature on the stability of ROAmy

图4 温度对突变体YHR稳定性的影响Fig.4 Effect of temperature on the stability of YHB
2.4ROAmy及突变体最适作用pH研究
实验数据表明突变体YHR比原酶(ROAmy)的最适作用pH均为5.5,在其他pH范围内催化速率的总体趋势较为相似(图5),而突变体H286L的最适作用pH为5.0,比原酶减低了0.5,且总体pH作用条件向酸性范围内偏移;突变体Y80L和R333L的最适作用pH与原酶相近(其数据可参考ROAmy)。与研究预期不同的是,虽然组合突变体YHR以及单突变体Y80L和R333L的pH作用条件与原酶相似,但是突变体H286L的最适作用pH却明显发生了偏移。

图5 pH对ROAmy及其突变体YHR和H286L催化活力的影响Fig.5 Effect of pH on the catalytic activities of ROAmy, YHR and H286L
2.5ROAmy及突变体作用麦芽三糖终产物分析
以相同浓度的麦芽三糖为底物,加入酶活相同的ROAmy、YHR、Y80L、H286L和R333L于40 ℃、pH 5.0条件下反应8 h后对形成的终产物进行分析可知:与原酶相比,突变体YHR和H286L的作用产物中麦芽糖含量分别提高了18.87%和16.87%(如表1所示),相应的底物残留变少;突变体Y80L的产物中底物残留较多,相应的产物葡萄糖和麦芽糖浓度略有降低;突变体R333L的产物中各组分浓度与原酶相当。上述数据显示突变体YHR和H286L对底物麦芽三糖的转化率得到了提升,而突变体Y80L对底物的转化率却有所下降,表明该蛋白中H286和Y80两个位点的氨基酸残基可能与该酶的高麦芽糖性能能力有关。另,需要指出的是,H286的突变(L)对底物转化能力具有提升作用,而Y80的突变(L)则会引起转化率降低,然而两者却在组合突变体YHR中表现出了一定的正向叠加效应。
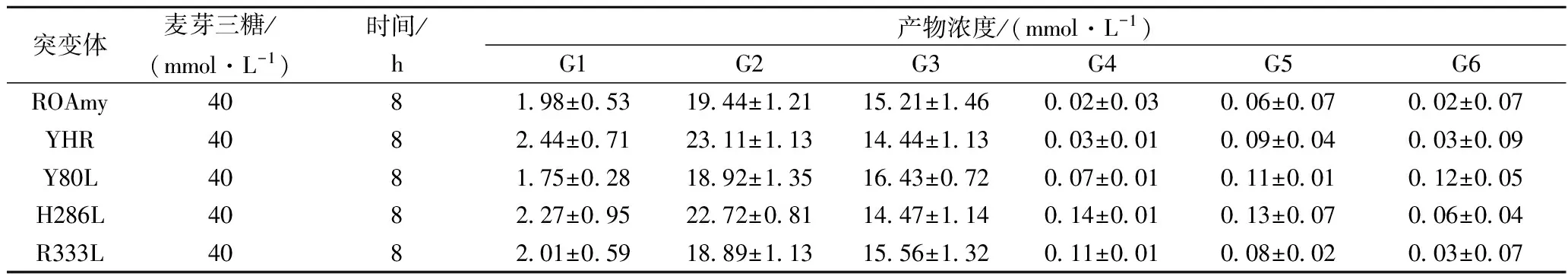
表1 ROAmy及其突变体水解麦芽三糖终产物比较
注:G1-G6分别表示葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖和麦芽六糖。
2.6 ROAmy及突变体作用淀粉酶终产物分析
在以麦芽三糖为底物研究的基础上,为进一步分析各突变体在淀粉水解过程中的差异,研究中以相同浓度的可溶性淀粉为底物,加入相同酶活力的ROAmy、YHR、Y80L、H286L和R333L于40 ℃、pH 5.0条件下反应8 h后可以发现,突变体YHR作用产物中麦芽糖的浓度最高,其次为突变体H286L,与原酶相比分别提高了11.67%和10.32%(如表2所示);突变体Y80L的作用产物中麦芽糖浓度与原酶相近,而突变R333L的作用产物中麦芽糖浓度略低于原酶。同时可以发现,突变体Y80L的作用产物中葡萄糖的量减少,麦芽三糖和麦芽四糖的浓度上升。上述数据表明,研究中所选择的3个位点氨基酸残基的变化对该酶作用淀粉终产物中糖组分含量均有不同程度的影响,其影响的规律与以麦芽三糖为底物获得数据相似,表明该淀粉酶对麦芽三糖转化能力的变化可直接影响水解淀粉生成麦芽糖的效率。

表2 ROAmy及其突变体水解可溶性终产物比较
注:G1-G6分别表示葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖和麦芽六糖。
3 讨论
在工业应用过程中,真菌α-淀粉酶与细菌α-淀粉酶在水解淀粉的过程中最显著的区别是真菌α-淀粉酶的作用产物中以麦芽糖为主,因此真菌α-淀粉酶有时又被称为糖化型淀粉酶。然而针对真菌α-淀粉酶为什么具有高麦芽糖形成能力这一问题一直没有得到明确的解释,有关真菌α-淀粉酶蛋白质结构及其高麦芽糖形成能力之间的关系研究在国内外相关研究领域中尚处于空白阶段。为此,本文以探索真菌α-淀粉酶蛋白质结构与高麦芽糖形成能力之间的关系为目的,以麦芽三糖为底物配体,通过生物信息学辅助分析对米根霉α-淀粉酶进行了分子对接模型构建,确定了3个可能与该淀粉酶高麦芽糖生成能力相关的氨基酸并利用定点突变技术获得了相应的单突变体和组合突变体,同时对突变体的理化性质和作用产物进行了分析。研究中发现Y74和H286两个残基的变化对该酶以麦芽三糖和淀粉为底物形成麦芽糖的能力均有影响,且对麦芽三糖的作用规律与对淀粉的作用规律相似,表明真菌α-淀粉酶的麦芽糖生成能力与其对麦芽三糖的水解能力关系较为密切,这与其他部分有关该类酶的性质研究报道相符[7, 12]。
研究中初步获得了与米根霉α-淀粉酶麦芽糖生成能力相关的部分氨基酸,并使突变体的作用产物中麦芽糖含量得到明显提升,结果可为真菌α-淀粉酶高麦芽糖形成机制以及高麦芽糖形成能力的定向进化研究提供一定的理论和方法方面的参考。同时,蛋白质结构与功能关系研究是一个长期而无止境的过程,本研究中只初步选择了3个氨基酸残基进行单突变和组合突变研究,所获得的数据尚不完整。因此,在以后的工作将选取更多的氨基酸残基进行单突变或定点饱和突变,以综合比较各突变体性能并进一步解释本研究中无法解答的一些实验现象,以期更为详细的解析真菌α-淀粉酶高麦芽糖生成能力相关的关键氨基酸或蛋白质结构。
[1] GUPTA R, GIGRAS P, MOHAPATRA H, et al. Microbial α-amylases: a biotechnological perspective [J]. Process Biochemistry, 2003, 38(11): 1 599-1 616.
[2] DEY T B, KUMAR A, BANERJEE R, et al. Improvement of microbial α-amylase stability: Strategic approaches [J]. Process Biochemistry, 2016, 51(10): 1 380-1 390.
[3] 刘仲敏, 郭士军, 薛永梅, 等. 真菌α-淀粉酶固态发酵工艺及酶学性质研究[J]. 河南科学, 2008, 26(2): 177-180.
[4] 方安然, 牛丹丹, 乔舰, 等. 耐热异淀粉酶的高效表达及其在麦芽糖浆制备中的作用[J]. 食品与发酵工业, 2016, 42(7): 23-29.
[5] 夏永军, 沈哲, 艾连中, 等. 两级酶解工艺制备超高麦芽糖浆的研究[J]. 食品与发酵科技, 2015, 51(2): 70-73.
[6] SWETHA S, DHANYA G, KESAYAN M N, et al. α-Amylases from microbial sources—an overview on recent developments [J]. Food Technology and Biotechnology, 2006, 44(2): 173-184.
[7] MCMAHON H E M, KELLY C T, FORGARTY W M. High maltose-producing amylolytic system of aStreptomycessp. [J]. Biotechnology Letter, 1999, 21(1): 23-26.
[8] DOYEL E M, NOONE A M, KELLY C T, et al. Comparison of the action pattern of two high maltose-forming α-amylases on linear maltooligosaccharides [J]. Enzyme and Microbial Technology, 1999, 25(3): 330-335.
[9] Invitrogen Corporation. Pichia Expression Kit (Version F, Catalog No.: K1710-01): A manual of methods for expression of recombinant proteins inPichiapastoris[R]. San Diego: Invitrogen Corporation, 1997.
[10] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar [J]. Analytical Chemistry, 1959, 31(3): 426-429.
[11] 谌容, 陈敏, 杨春贤. 基于SWISS-MODEL的蛋白质三维结构建模[J]. 生命的化学, 2006, 26(1): 54-56.
[12] COLLINS B S, KELLY C T, FORGAATY W M, et al. The high maltose-producing α-amylase of the thermophilic actinomycete,Thermomonosporacurvata[J]. Applied Microbiology and Biotechnology, 1993, 39(1): 31-35.
Preliminaryanalysisofthekeyaminoacidsrelatedtothehighmaltose-formingabilityofRhizopusoryzaeα-amylase
TIAN Fang-yuan1,TANG Bin1,2*,LI Song1,2,YANG Qian1
1(School of Biological and Chemical Engineering, Anhui Polytechnic University, Wuhu 241000, China) 2(Anhui Engineering Technology Research Center of Microbial Fermentation, Wuhu 241000, China)
In this study, the computer-assisted simulation technique was used to perform molecular docking forRhizopusoryzaeα-amylase with maltotriose. The amino acid residues related to high maltose-forming ability of the enzyme were selected and mutated. The results showed that the optimum temperature of the mutants YHR and H286L was 10 ℃ and 5 ℃ higher than that of the native enzyme (50 ℃), respectively, and the optimum pH of the mutant H286L decreased by 0.5. Compared with the native enzyme, the content of maltose in the end-products formed from maltotriose by the mutants YHR and H286L increased by 18.87% and 16.87%, respectively, and the content of maltose in the end-products formed from soluble starch was increased by 11.67% and 10.32%, respectively. The results showed that the relationship between H286 and the high maltose production capacity of the enzyme was the closest, and followed by Y80 and R333.
fungal α-amylase; maltose; protein structure; site-directed mutation
10.13995/j.cnki.11-1802/ts.014278
硕士研究生(汤斌教授为通讯作者,E-mail:tangbin@ahpu.edu.cn)。
国家自然科学基金青年项目(31401630)
2017-03-11,改回日期:2017-05-05

