海藻糖对草鱼鱼糜冻藏品质的影响
苏 赵
胡 强
李树红
但 静
李美良
林 灵
白稚子
杨 娟
柯勤勤
(四川农业大学食品学院,四川 雅安 625014)
海藻糖对草鱼鱼糜冻藏品质的影响
苏 赵
胡 强
李树红
但 静
李美良
林 灵
白稚子
杨 娟
柯勤勤
(四川农业大学食品学院,四川 雅安 625014)
为研究添加海藻糖对草鱼冷冻鱼糜蛋白质变性的抑制效果,首先检测冻藏期(12周)内各组盐溶性蛋白、总巯基、Ca2+-ATP酶活力、羰基含量的变化,发现6%添加量能最大程度地抑制蛋白质的变性,并于冻藏6个月后对基质构特性进行测定,其凝胶强度达3 026 g·mm,极显著高于对照组(P<0.01),扫描电镜发现该组鱼糜凝胶超微三维网状结构更为紧实、致密、坚韧。综上表明,6%的海藻糖能抑制草鱼鱼糜蛋白在冷冻过程中的变性,延缓鱼糜冻藏品质的下降,其作为一种潜在的商业鱼糜抗冻剂具有良好的应用前景。
草鱼鱼糜;海藻糖;抗冻剂;抗冻效果;鱼糜品质
草鱼(Ctenopharyngodonidella) 属鲤形目鲤科雅罗鱼亚科草鱼属,是中国主要的淡水养殖经济鱼种,年养殖产量达5.676 2×106t,位居全国第二位[1],具有肉厚刺少、肉质白嫩、蛋白含量高、韧性好、出肉率高等优良特性,是加工鱼糜及其制品的优良原料[2]。但2015年中国鱼糜制品产量仅为1.454 2×106t,尚不及全国水产加工总量的10%。而将草鱼精深加工制成鱼糜能提高草鱼的附加值,有利于充分利用中国的渔业资源,具有极为广阔的市场前景[3]。
淡水鱼类鱼肉蛋白质多有稳定性较差的问题[4],尤其容易在冷冻贮藏过程中发生变性,导致鱼糜制品的弹性品质下降[5]59-60[6]23-26[7]。并且鱼糜的工业化生产中采用机械采肉,通常原料为剖片后的整个鱼片[8],采肉后,鱼糜中往往混有较多脂质成分,主要是由于鱼类腹部肌肉组织中脂肪含量丰富[9]。而贮藏过程鱼糜中脂肪氧化的次级产物(低级醛、酮类物质)也可进一步引起蛋白的氧化[5]20[6]29-30[10],加剧蛋白贮藏期间的变性。因此,如何在鱼糜冷藏过程中采取适宜的措施防止鱼糜蛋白的冷冻变性,对提高淡水鱼糜的冻藏品质具有重要的意义。
目前,工业上大多采用蔗糖、复合磷酸盐为商业抗冻剂,虽对鱼糜蛋白质有较好的抗冻效果[11],但其“高热、高甜”的特点不符合“低甜、低热”的消费要求,过多的磷酸盐摄入亦会导致机体钙磷失衡,影响人体对钙的吸收,可能导致骨质疏松症等疾病[12]。海藻糖低甜、无毒,其甜度仅为蔗糖的45%,且WHO及FAO组织对其每日允许摄入量(ADI)不作限制[13],中国在2014年已将海藻糖按照普通食品管理[14]。同时有研究发现,非还原性二糖海藻糖不仅具有稳定细胞膜和蛋白质的结构,增强细胞对高温、干燥失水、高寒及高渗透压等恶劣环境的抗性作用[15-16],而且还能够抑制脂肪酸的分解,稳定蛋白质,防止蛋白质冷冻变性和三甲胺等鱼腥味物质生成[17]。研究表明,采用海藻糖溶液浸渍能防止冷冻罗非鱼片的蛋白质变性[18],采用海藻糖涂膜处理也对冻藏草鱼块的感官品质和质构特性均有所改善[19]。
截止目前,在以机械采肉制备的草鱼鱼糜蛋白冷冻变性方面的防治效果,尚无相关报道。因此,本试验拟探讨海藻糖对机械采肉加工的草鱼鱼糜冻藏品质的影响,为其以后在淡水鱼糜中的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
鲜活健康草鱼:采购于四川省雅安市雨城区农贸市场,约1.5 kg/尾;
总蛋白(TP)测定试剂盒:南京建成生物研究所;
海藻糖:食品级,纯度98%,日本株式会社林原;
其余试剂均为分析纯。
1.1.2 主要仪器设备
滚筒采肉机:CR-200型,山东省诸城市美川机械有限公司;
超级恒温水浴锅:HH-601型,江苏省金坛市荣华仪器制造有限公司;
可见分光光度计:V-1200型,翱艺仪器(上海)有限公司;
酶标仪:Varioskan Flash-3001型,美国Thermo Scientific公司;
超声破碎仪:Scientz-IID型,宁波新芝生物科技股份有限公司;
物性测试仪:TA-XTPlus型,英国Stable Micro System公司;
超纯水机:ULUP-IV-10T型,成都超纯科技有限公司;
冰箱:BCD-579WE型,青岛海尔股份有限公司;
电子天平:FA1204B型,上海越平仪器有限公司;
数显pH计:PHS-3C型,上海佑科仪器有限公司;
扫描电镜:JSM-7500F型,日本电子株式会社;
高速冷冻离心机:ST-16R型,美国Thermo Scientific公司。
1.2 方法
1.2.1 鱼糜制备 工艺流程:
鲜活草鱼→前处理→洗净→机械采肉→漂洗→脱水→生鲜鱼糜
工艺要点:
(1) 前处理:采用手工操作去头、内脏、鳞片,将鱼体沿主骨剖成两半,并清洗鱼体。
(2) 采肉:使用滚筒采肉机(孔径3 mm)机械采肉,转速:20 r/min。
(3) 漂洗:鱼肉糜采用两次清水一次食盐水进行漂洗(鱼肉糜与水质量比为1∶5,食盐水浓度为0.15%,水温0~4 ℃)。每次漂洗均搅拌10 min,静置5 min,倾去漂洗液。
(4) 脱水:4 ℃条件下8 800×g离心15 min。
1.2.2 冻藏试验
(1) 筛选适宜添加量:取制备的生鲜鱼糜,分成6组,每组1 kg,按质量比添加海藻糖,依次为0,2%,4%,6%,8%,10%,混匀后各组于-20 ℃冻藏12周。分别于0,2,4,6,8,10,12周取样测定各项指标,筛选适宜添加量。所有指标进行3次平行试验。
(2) 适宜添加量组组织状态测定:取制备的生鲜鱼糜,分成2组,每组1 kg,一组添加6%海藻糖,另一组(空白组)不添加海藻糖,其他条件相同。2组-20 ℃冻藏24周。于24周冻藏结束后取样,进行指标测定。所有指标进行3次平行试验。
1.2.3 盐溶性蛋白(SSP)含量的测定 称取1 g鱼糜样品加入50 mmol/L KH2PO4—NaOH缓冲液(pH 7.0) 20 mL,离心(4 ℃,6 600×g,20 min)。取沉淀再加入0.6 mol/L KCl—50 mmol/L KH2PO4—NaOH缓冲液(pH 7.0) 20 mL,离心(4 ℃,6 600×g,20 min)。取上层离心液,使用含0.6 mol/L KCl—50 mmol/L KH2PO4—NaOH(pH 7.0)缓冲液定容至25 mL[20]。并采用考马斯亮蓝法测得盐溶性蛋白(SSP)的浓度。盐溶性蛋白含量按式(1)计算:
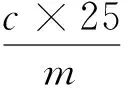
(1)
式中:
ssp——盐溶性蛋白含量,mg/g;
c——考马斯亮蓝法测得蛋白浓度,mg/mL;
m——鱼糜样品质量,g。
1.2.4 鱼糜肌动球蛋白的提取测定 参考文献[21]的方法并稍作改动:称取1.5 g鱼糜样品加入20 mL预冷的0.6 mol/L KCl(4 ℃,pH=7),研磨,均质,离心(5 000×g,30 min,4 ℃),取上层清液加入3倍体积去离子水再次离心(5 000×g,20 min,4 ℃),取沉淀加入等体积的KCl(1.2 mol/L,pH=7)充分溶解,用考马斯亮蓝法测定蛋白浓度。
1.2.5 蛋白总巯基(TSH)含量的测定 参考文献[22]的方法。取1.2.4中提取并稀释至4 mg/mL的肌动球蛋白溶液0.4 mL,加入0.2 mol/L Tris-HCl(含2% SDS,8 mol/L尿素,10 mmol/L EDTA,pH 6.8)缓冲液3.6 mL及0.2 mol/L的Tris-HCl(含0.1% DTNB,pH 8.0)缓冲液0.4 mL,将反应混合液于40 ℃水浴保温25 min,在412 nm波长测定吸光度。分子吸光系数为13 600 L/(mol·cm)。蛋白质总巯基含量按式(2)计算:

(2)
式中:
TSH——蛋白质总巯基含量,μmol/g;
A412——412 nm处吸光度;
n——稀释倍数;
ρ——蛋白质质量浓度,mg/g。
1.2.6 蛋白Ca2+-ATP酶(CA)活力的测定 参考文献[22]。用0.1 mL 4 mg/mL的肌动球蛋白溶液与0.06 mL 0.5 mol/L Tris-马来酸、0.79 mL 10 mm/L CaCl2、0.5 mL 20 mmol/L ATP溶液混合均匀,于25 ℃反应25 min后,加入0.5 mL 15% 三氯乙酸溶液终止反应,同时做空白对照,并提前加入三氯乙酸溶液。采用钼酸铵法测定产生的无机磷含量[23]。Ca2+-ATP酶活力(CA)以在室温(25 ℃)条件下每毫克肌动球蛋白在每分钟内所生成的无机磷的微摩尔数表示,单位:μmol P/(mg Pro·min)。
1.2.7 蛋白羰基(CBG)含量测定 参考文献[24]。取1 g鱼糜与含0.6 mol/L NaCl的10 mmol/L磷酸缓冲液(pH=6.0),匀浆1 min,离心(8 000×g,20 min,4 ℃),取上清液在激发波长和发射波长为350~450 nm下测定荧光强度。羰基(CBG)含量表示为荧光强度F/mg·Pro。
1.2.8 鱼糜凝胶强度的测定 对解冻的鱼糜样品加入20%冰水空擂60 s后,加入3%的食盐盐擂30 s后,立即灌入折径为52 mm的肠衣。40 ℃水浴60 min,90 ℃水浴20 min,冰水浴30 min。取出切成25 mm鱼糕段,保持切面整齐、光滑、无破裂口。使用直径5 mm的球形探头,载物平台与探头速度为1 mm/s,用质构仪测定凝胶强度[25-26]。
1.2.9 鱼糜凝胶超微结构测定 参考文献[27]的方法。将鱼糕段切成厚度为3 mm的圆片,用真空冷冻干燥机冻干48 h(-80 ℃)。分别从冻干的鱼糕圆片样中切下适宜大小的薄片样品,置于扫描电子显微镜下观察鱼糜凝胶超微结构,放大倍数为10 000倍。
2 结果与分析
2.1 海藻糖最佳添加量的筛选
2.1.1 海藻糖对SSP含量的影响 海藻糖对SSP含量的影响见图1。6组样品的SSP蛋白含量整体上均随冻藏期的延长而下降,但下降程度有所不同。冻藏至12周时,6%组和8%组的SSP含量极显著高于其他组(P<0.01),且6%组高于8%组;相对于冻藏0周时SSP含量的初始值,12周时6%组SSP含量下降程度[(16.64±4.06)%]明显低于0%组[(28.33±2.52)%]。由以上结果可知,海藻糖可有效延缓草鱼鱼糜SSP含量在冻藏期间的下降,且添加量为6%的抗冻效果最好。张静雅[28]研究发现5%海藻糖能较好地延缓淡水鱼鱼糜SSP在冻藏期间的下降;但也有研究[29-31]表明5%,9%,10%海藻糖具有相似的延缓作用。与本研究结果相似。
SSP在鱼糜凝胶三维结构形成的过程中起重要的作用,其含量的下降不利于鱼糜凝胶结构的形成。SSP的损失与鱼糜蛋白质冻藏期间的变性有关[32]。蛋白质的空间构象依靠分子内的氢键、二硫键、疏水键及静电相互作用维持,而水分子的状态能影响这些键的分布。在冻藏过程中,自由水冻结产生的大型冰晶会破坏结合水与蛋白质的结合状态,使部分化学键受到破坏,这些化学键的断裂将影响蛋白质的三维空间结构,引起蛋白质的变性。而海藻糖含有的游离羟基能增强自由水转化成结合水的能力,从而减少冻结过程中冰晶的生成量,保护了蛋白质的三维空间结构;另一方面,海藻糖分子结构中含有的羟基还能与蛋白质分子中的一些基团发生反应,从而避免了蛋白质的聚集变性[29]。
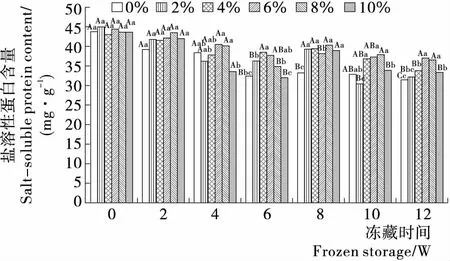
不同大小写字母分别表示在0.01和0.05水平上的差异
Figure 1 The salt-soluble protein content changes of added trehalose in grass carp surimi during frozen storage
2.1.2 海藻糖对TSH含量的影响 有研究[6]42发现,鱼糜凝胶强度与鱼糜蛋白TSH含量呈显著性正相关,因此TSH含量能反映鱼糜的加工品质。由图2可知,各组的TSH含量在整个冻藏期内总体呈缓慢下降趋势。在冻藏初期(0~4周),各组的TSH含量呈先下降后上升的趋势,可能是冻藏初期蛋白质表面的TSH被氧化,而随着冻藏时间的延长,蛋白构型继续发生变化,使蛋白质内部的TSH暴露出来,表现为TSH上升[7, 33-35]。从第6周开始,添加海藻糖各组TSH含量显著或极显著高于0%组(P<0.05或P<0.01);冻藏结束时,添加6%组TSH含量[(74.94±0.51) μmol/g]高于其余各组,且极显著高于0%组(P<0.01);相对于冻藏0周时TSH含量的初始值,12周时6%组TSH含量下降程度[(15.86±0.72)%]明显低于0%组[(22.30±1.85)%]。结果显示,不同浓度的海藻糖都能延缓草鱼鱼糜冻藏期间TSH的下降,以6%添加量最佳,可能与藻糖具有稳定蛋白质结构的作用[15-17]有关。其他关于添加海藻糖对冻藏期间淡水鱼糜TSH含量变化的研究[29],也得到与本研究相似的结果。

不同大小写字母分别表示在0.01和0.05水平上的差异
Figure 2 Total sulfhydryl content changes of added trehalose in grass carp surimi during frozen storage
2.1.3 海藻糖对CA活力的影响 由图3可知,在冻藏期内,各冻藏组的CA活性整体呈下降趋势。在冻藏初期,各组的CA活性无显著性差异(P>0.05);从第2周开始,添加海藻糖各组的CA活性显著或极显著高于0%组(P<0.05或P<0.01),说明添加海藻糖可以明显保护肌动球蛋白的变性。冻藏结束时,6%添加组的CA活性[(0.21±0.006 2) μmol P/(mg Pro·min)] 高于其余各组,且极显著高于0%组(P<0.01)。相对于冻藏0周时CA活性的初始值,12周时6%组CA活性的下降程度[(35.33±7.28)%]明显低于0%组[(58.23±9.14)%]。由此可见,海藻糖可以有效延缓冻藏期间CA活性的降低,且6%组的效果最理想,比0%组的降低率低(22.90±8.21)%,可以有效防止鱼糜蛋白变性,延长鱼糜的冻藏期。有其他相关报道也与本研究得到了类似的结果,发现海藻糖能延缓鳙鱼肌原纤维蛋白溶液[36]、罗非鱼鱼糜[37]、金鲳鱼鱼糜[38]冻藏期间CA活性的下降。
CA活性是体现鱼糜肌动球蛋白稳定性的重要指标,其活性越高,肌动球蛋白的变性程度就越小,鱼糜的品质就越好。有研究认为冻藏期间CA活性的改变主要有以下几点原因:① 肌动球蛋白重链头部具有CA活性区域,肌动球蛋白变性将导致CA活性下降[39];② CA活性区域含有的两个活性巯基,在冻藏过程中容易被氧化形成二硫键,从而导致区域构象发生变化,也会使CA活性改变[40];③ 在冻藏期间,自由水形成的大型冰晶破坏了结合水与蛋白质的结合状态,冰晶之间的相互挤压也会使蛋白质的三维结构发生变化,进而使肌动球蛋白重链头部的CA活性区域暴露,导致CA活性下降。有理论[29]认为海藻糖分子中的游离羟基能在蛋白质分子表面形成氢键,稳定蛋白质的分子结构;同时,海藻糖能增强自由水转化成结合水的能力,既增强了结合水与蛋白质的结合状态,又减少了大型冰晶的生成量,从而保护了蛋白质结构,抑制了CA活性的下降。本试验采用生产实际中常用的机械采肉法,通常原料为剖片后的整个鱼片,鱼体腹部含有的大量脂肪混入采得的鱼糜中,有报道[24]称蛋白质的氧化与脂质的氧化呈正相关,且二者可能存在相互促进的作用,而权国波等[41]研究发现海藻糖能抑制细胞脂质的过氧化损伤。因此根据本试验结果推测,海藻糖还可能通过抑制冻藏过程中脂肪氧化产生过氧化物而抑制了蛋白质的氧化变性。综上所述,推测添加海藻糖不仅通过稳定蛋白结构也可能通过抑制脂肪次级氧化,在保持CA活性方面发挥积极的作用。

不同大小写字母分别表示在0.01和0.05水平上的差异
Figure 3 Ca2+-ATPase activity changes of added trehalose in grass carp surimi during frozen storage
2.1.4 海藻糖对CBG含量的影响 蛋白质氧化的过程中会形成CBG(醛基和酮基),故CBG含量被广泛地用于测量蛋白质的氧化程度。在冻藏过程中会发生蛋白的氧化变性,氨基酸侧链上含有的氨基或亚氨基对羟基自由基敏感,被氧化成CBG基团;而冻藏过程中肽骨架的断裂也会产生CBG[42]。CBG含量能从一定程度上反应冻藏鱼糜蛋白质的变性,但目前关于海藻糖对淡水鱼糜在冻藏期间CBG含量变化的影响尚未见报道。由图4可知,在整个冻藏期间,各组的CBG含量均呈上升趋势,且冻藏前4周增势较平缓,6~12周增加迅速。但是从第4周开始,添加海藻糖的各组CBG均低于未添加组,尤其第6周后,该差异表现为显著(P<0.05)或极显著 (P<0.01);冻藏12周结束时,6%,8%,10%添加组的CBG含量极显著低于0%,2%,4%添加组的,而6%,8%,10% 3组间并无显著性差异(P>0.05)。相对于冻藏0周时CBG含量的初始值,12周时6%组CBG含量上升程度[(224.77±9.51)%]明显低于0%组[(278.88±10.18)%]。考虑到工厂生产实际中的成本问题以及前述各指标的结果,添加6%海藻糖能较好地节约生产成本。本试验从CBG变化的角度证明了海藻糖对淡水鱼糜冻藏期间的蛋白稳定性起到一定的保护作用。鉴于脂肪的次级氧化会产生自由基[24],因此,推测这种保护作用也可能与海藻糖能抑制脂肪的次级氧化有关。

不同大小写字母分别表示在0.01和0.05水平上的差异
2.2 海藻糖最佳添加量的抗冻效果分析
于-20 ℃冻藏6个月后,分别测定了对照组和海藻糖适宜加量组(6%)草鱼鱼糜的凝胶强度和超微结构,进一步分析海藻糖对草鱼鱼糜冻藏品质的影响,结果见图5、6。适宜添加组的凝胶强度极显著高于对照组(P<0.01)。且适宜添加组的凝胶强度达3 026 g·mm,符合农业部SC/T 3702—2014标准AA级,说明冻藏6个月后,鱼糜品质仍保持良好。经扫描电镜观察,适宜添加量组鱼糜凝胶内部网状结构紧实、致密、空洞较少,纤维粗壮;而对照组的鱼糜凝胶内部网状结构表现为疏松多孔、三维网状结构中的纤维较为纤细。邓海萍等[43-44]也发现添加多糖类物质能提高鱼糜的凝胶性能。
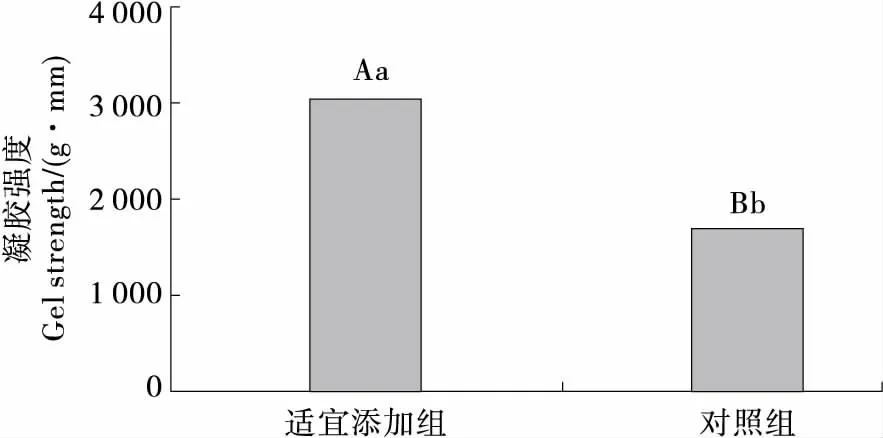
不同大小写字母分别表示在0.01和0.05水平上的差异

图6 最佳添加量组、对照组超微结构的比较
Figure 6 The comparison in ultrafine 3-dimentional network of best addition amount group and control group
3 结论
通过在机械采肉制备的草鱼鱼糜中添加不同量的海藻糖,以草鱼鱼糜盐溶性蛋白含量、总巯基含量、Ca2+-ATP酶活力和羰基含量为指标,并结合生产实践中的成本控制,筛选出海藻糖在草鱼鱼糜中的最佳添加量为6%;同时研究适宜添加量的海藻糖对草鱼鱼糜凝胶强度和微观结构的影响。发现海藻糖能有效保护冻藏期间草鱼鱼糜蛋白质,表现为延缓盐溶性蛋白的损失、总巯基含量的降低、Ca2+-ATP酶活力的降低和羰基的形成;其中,尤以6%添加量的草鱼鱼糜蛋白质变性程度最小,冻藏品质最佳,冻藏6个月后凝胶强度仍能达到AA级,微观结构较为紧实。综上所述,海藻糖的添加可能改变了草鱼鱼糜蛋白的结构,使其变得更稳定,从而表现出更好的冻藏稳定性,因此将其作为一种抗冻剂应用在淡水鱼糜的冻藏过程中,具有广阔的市场前景。
[1] 农业部渔业渔政管理局. 渔业统计年鉴[Z]. 北京: 中国农业出版社, 2016: 36-39.
[2] 伍芳芳, 林婉玲, 李来好, 等. 草鱼脆化过程中肌肉胶原蛋白、矿物质含量和脂肪酸组成变化[J]. 食品科学, 2015(10): 86-89.
[3] 杨京梅. 大宗淡水鱼原料特性研究[D]. 无锡: 江南大学, 2011: 4-7.
[4] 尹贝贝, 蒋爱民, 栗俊广, 等. 三种常见海水鱼鱼糜凝胶特性比较研究[J]. 食品与机械, 2014, 30(1): 25-28.
[5] 刘泽龙. 蛋白质氧化对肉及肉制品持水与水合特性的影响机理研究[D]. 无锡: 江南大学, 2012.
[6] ERASTO Mlyuka. 冷冻储藏与氧化对鲢鱼肌原纤维蛋白功能性质的影响[D]. 无锡: 江南大学, 2010.
[7] 李艳青, 孔保华, 夏秀芳, 等. 羟自由基氧化对鲤鱼肌原纤维蛋白乳化性及凝胶性的影响[J]. 食品科学, 2012(9): 31-35.
[8] 赵占西, 高敏, 朱天宇. 淡水鱼糜加工工艺与设备[J]. 食品与机械, 2003(5): 31-32.
[9] 陈洁, 李大鹏, 张志敏, 等. 草鱼不同部位肌肉营养成分、肌纤维特性以及脂肪代谢相关基因的表达[J]. 淡水渔业, 2017(2): 107-112.
[10] LI Shi-Jing, KING A J. Structural changes of rabbit myosin subfragment 1 altered by malonaldehyde, a byproduct of lipid oxidation.[J]. Journal of Agricultural & Food Chemistry, 1999, 47(8): 3 124-3 129.
[11] 张艳, 王圣开. 鱼肉蛋白质冷冻变性及抗冻剂的研究进展[J]. 肉类研究, 2008(12): 16-19.
[12] 青岛明月海藻集团有限公司. 肉制品无磷保水剂——海藻酸钠[J]. 食品工业科技, 2014, 35(5): 28.
[13] 肖丽蓉, 张友洪, 周安莲, 等. 海藻糖的研究与应用[J]. 中国蚕业, 2009(3): 8-11.
[14] 国家卫生计生委. 关于批准茶叶茶氨酸为新食品原料等的公告(2014年第15号)[EB/OL]. (2014-7-30)[2017-7-4]. http://www.nhfpc.gov.cn/sps/s7890/201407/d388b72707fa4e978bea 6a222b920cbf.shtml.
[15] 任小青, 庄桂, 廖劲松, 等. 海藻糖的生产与应用研究现状及其开发前景[J]. 郑州工程学院学报, 2001(1): 82-85.
[16] 袁勤生. 隐生生物中的典型化合物——海藻糖[J]. 中国生化药物杂志, 1999(1): 48-50.
[17] 李桂芹. 海藻糖的生物学功能及其应用[J]. 安徽农业科学, 2007(24): 7 724-7 725.
[18] 蒙健宗, 秦小明, 赵文报, 等. 海藻糖对冷冻罗非鱼片蛋白质变性作用的影响[J]. 食品工业科技, 2007(2): 214-216.
[19] 邓泽新. 冷冻草鱼块涂膜处理及其品质研究[D]. 长沙: 湖南农业大学, 2014: 35-36.
[20] PAN Jin-feng, SHEN Hui-xing, LUO Yong-kang. Changes in salt extractable protein and Ca2+-atpase activity of mince from silver carp (hypophthalmichthys mollitrix) during frozen storage: a kinetic study[J]. Journal of Muscle Foods, 2010, 21(4): 834-847.
[21] BENJAKUL S, SEYMOUR T A, MORRISSEY M T, et al. Physicochemical Changes in Pacific Whiting Muscle Proteins during Iced Storage[J]. Journal of Food Science, 1997, 62(4): 729-733.
[22] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International, 2003, 36(8): 787-795.
[23] 史树德, 孙亚卿, 魏磊. 植物生理学实验指导[M]. 北京: 中国林业出版社, 2011: 89-93.
[24] ARMENTEROS M, HEINONEN M, OLLILAINEN V, et al. Analysis of protein carbonyls in meat products by using the DNPH-method, fluorescence spectroscopy and liquid chromatography-electrospray ionisation-mass spectrometry (LC-ESI-MS)[J]. Meat Science, 2009, 83(1): 104-112.
[25] 中华人民共和国农业部. SC/T 3702—2014 冷冻鱼糜[S]. 北京: 中华人民共和国农业部渔业局, 2014: 3-7.
[26] 黄和, 王娜, 陈良, 等. 金鲳鱼鱼糜制品加工工艺优化[J]. 食品与机械, 2015, 31(6): 193-198.
[27] 陈海华, 薛长湖. 热处理条件对竹荚鱼鱼糜凝胶特性的影响[J]. 食品科学, 2010(1): 6-13.
[28] 张静雅. 白鲢鱼糜蛋白的冷冻变性机理及抗冻剂的应用研究[D]. 合肥: 合肥工业大学, 2012: 23-24.
[29] 胡耀辉, 郑微微, 李琢伟, 等. 海藻糖对防止鲤鱼鱼糜蛋白质冷冻变性的研究[J]. 食品科学, 2011, 32(9): 126-129.
[30] 秦小明, 蒙健宗, 宁恩创, 等. 海藻糖在冷冻罗非鱼鱼糜中的抗冻作用研究[J]. 食品工业科技, 2007(7): 79-81.
[31] 邓泽新, 廖泉, 吴卫国. 海藻糖对草鱼鱼糜肌原纤维蛋白冷冻变性作用的影响[J]. 农产品加工·学刊, 2014(7): 13-15.
[32] 周爱梅. 淡水鱼糜抗冻性能及凝胶特性改良的研究[D]. 广州: 华南理工大学, 2005: 81-82.
[33] LUND M N, LAMETSCH R, HVIID M S, et al. High-oxygen packaging atmosphere influences protein oxidation and tenderness of porcine longissimus dorsi during chill storage[J]. Meat Science, 2007, 77(3): 295-303.
[34] ZAKRYS-WALIWANDER P I, O' SULLIVAN M G, O' NEILL E E, et al. The effects of high oxygen modified atmosphere packaging on protein oxidation of bovine M. longissimus dorsi muscle during chilled storage[J]. Food Chemistry, 2012, 131(2): 527-532.
[35] JIANG Shan-zhong, HWANG D C, CHEN Ching-san. Effect of Storage Temperatures on the Formation of Disulfides and Denaturation of Milkfish Actomyosin ( Chanos chanos )[J]. Journal of Agricultural & Food Chemistry, 1988, 53(5): 1 333-1 335.
[36] 薛勇. 鳙鱼鱼糜抗冻变性剂及土腥味脱除方法的研究[D]. 青岛: 中国海洋大学, 2006: 103-112.
[37] 米顺利, 石君连, 王双龙, 等. 两种抗冻剂对罗非鱼鱼糜的凝胶性及抗冻性的影响[J]. 食品科技, 2012(3): 159-162.
[38] 王娜. 加工工艺对金鲳鱼鱼糜凝胶特性及鱼糜蛋白冷冻变性影响的研究[D]. 湛江: 广东海洋大学, 2015: 41-45.
[39] 林琳, 高艳艳, 吕顺, 等. 草鱼低温贮藏过程中的品质变化特性[J]. 食品科学, 2009, 30(24): 433-435.
[40] WELLS J A, WERBER M M, LEGG J I, et al. Inactivation of myosin subfragment one by cobalt(II)/cobalt(III) phenanthroline complexes. I: Incorporation of Co(III) by in situ oxidation of Co(II)[J]. Biochemistry, 1979, 18(22): 4 800-4 805.
[41] 权国波, 韩颖, 杨超, 等. 海藻糖抑制高浓度葡萄糖诱导的红细胞磷脂酰丝氨酸暴露、渗透脆性增高和膜脂质过氧化损伤的研究[J]. 中国实验血液学杂志, 2008(6): 1 442-1 446.
[42] HONG Zhuang, SAVAGE E M, SMITH D P, et al. Effect of Dry-Air Chilling on Warner-Bratzler Shear Force and Water-Holding Capacity of Broiler Breast Meat Deboned Four Hours Postmortem[J]. International Journal of Poultry Science, 2008,7(8): 743-748.
[43] 邓海萍, 陈奇, 李向红, 等. 不同电荷多糖添加物对鲢鱼鱼糜凝胶结构的影响[J]. 食品与机械, 2014, 30(3): 25-28.
[44] 尹贝贝, 蒋爱民, 栗俊广, 等. 几种添加物对巴浪鱼丸品质的影响[J]. 食品与机械, 2014, 30(5): 253-259.
Effects of trehalose on quality of grass carp surimi during frozen storage
SUZhao
HUQiang
LIShu-hong
DANJing
LIMei-liang
LINLing
BAIZhi-zi
YANGJuan
KEQin-qin
(CollegeofFoodScience,SichuanAgriculturalUniversity,Ya’an,Sichuan625014,China)
This paper conducts a study of the inhibitory effect of trehalose on the protein denaturation of grass carp frozen surimi. At first, salt-soluble protein, total sulfhydryl, Ca2+-ATPase activity and carbonyl group were monitored during the frozen-storage period (12 weeks). When the addition of trehalose was 6%, the inhibitory effect on protein denaturation was the best. Then, the determination of structure characteristics of the group with the addition amount (6%) was conducted after surimi was frozen for six months. Results: the gel strength of the group with best addition amount reached 3 026 g·mm, much higher than the control group (P<0.01). Scanning electron microscope found that ultrafine 3-dimentional network structureof surimi gel was firmer, more compacted and tougher. The trehalose (6%) has an inhibitory effect on the protein denaturation of grass carp frozen surimi,delays the reduction of frozen surimi quality, and has a good application prospect as a potential commercial surimi antifreeze.
grass crap surimi; trehalose; cryoprotectants; cryoprotective effects; surimi quality
四川省科技计划支撑项目(编号:2014NZ0003)
苏赵,男,四川农业大学实验师,大专。
李树红(1975—),女,四川农业大学副教授,博士后。 E-mail:lish@sicau.edu.cn
2017—05—07
10.13652/j.issn.1003-5788.2017.07.031

