油料作物及其油脂制品中草除灵残留量的检测
陈雯青
(上海必诺检测技术服务有限公司,上海 200436)
油料作物及其油脂制品中草除灵残留量的检测
陈雯青
(上海必诺检测技术服务有限公司,上海 200436)
为建立一种气相色谱法测定油料作物及其油脂制品中草除灵残留量的检测方法,以正己烷饱和的乙腈为提取试剂,用乙腈饱和的正己烷进行脱脂,再用弗罗里硅土小柱进行净化,采用具电子捕获检测器的气相色谱仪进行测定。结果表明:草除灵的线性关系良好,相关系数可达0.999,样品加标回收率为91.2%~122.7%、变异系数为2.23%~8.16%、方法检出限为0.005 mg/kg。该方法的前处理技术适用于油料作物及其油脂制品,能够准确、灵敏、简便、快速地测定草除灵残留量。
草除灵;气相色谱仪;油料作物;油脂制品
草除灵(benazolin ethyl),化学名称为4-氯-2-氧化苯并噻唑-3-基乙酸乙酯(C11H10ClNO3S),相对分子质量为271.7,别名有好实多、高特克、Cornox、Cwk、Ley Cornox 等,无色结晶,熔点79.2 ℃,20 ℃时在水中的溶解度为0.047%,在酸性和中性环境下稳定,在碱性条件下易分解,热稳定性好[1]。草除灵是一种选择性芽后有机环类除草剂,属中等毒性,具有内吸、传导作用[2],施药后植物通过叶片吸收输导到整个植物体,作用方式同2-甲-4-氯丙酸,相比药效发挥缓慢。其特点不仅在于对阔叶杂草有效,更重要的是对油菜有较高安全性。它在中国油菜田区被长期使用,在欧洲、南美洲等油菜产区也被广泛使用。
草除灵在长期使用过程中,在植株、土壤和水体中有一定的沉积,对环境造成污染,且污染物成分复杂、毒性大[3]。草除灵对人畜低毒,大鼠急性口服LD50>3 000 mg/kg,兔急性经皮LD50>2 000 mg/kg。GB 2763—2016《食品安全国家标准 食品中农药最大残留限量》中对草除灵的最大残留限量作出了规定:油菜籽中<0.2 mg/kg,但没有规定相应的检测标准,目前中国也没有检测草除灵残留量的标准。近年来,虽有文献[4-6]报道草除灵的液相、气相检测方法,但未见适用于油料作物及其油脂制品中草除灵残留量分析的报道。就食品检测而言,样品前处理技术是非常重要的环节,需要根据被检样品的状态、样品中杂质的理化性质、目标化合物的化学性质、目标化合物在样品中的存在形式、检测分析仪器方法等多种因素来考量,同时还要考虑该方法的准确度、灵敏度、精确度等方法学参数。
为探寻一种适用于油料作物及其油脂制品中草除灵残留量的测定方法,本研究拟用液液分配及吸附剂净化的前处理手段,结合具电子捕获检测器的气相色谱仪进行测定,通过考察提取试剂、吸附剂等条件对样品加标回收率的影响,以期为测定油料作物及其油脂制品中草除灵残留量提供一种快速、准确的检测方法。
1 材料与方法
1.1 试剂和材料
乙腈、正己烷、丙酮:色谱纯,美国西格玛公司;
试验用水:去离子水;
弗罗里硅土固相萃取小柱:1 g/6 mL,美国安捷伦科技公司;
草除灵标准对照品:纯度99.5%,德国Dr. Ehrenstorfer公司;
草除灵标准储备液(1 mg/mL):精确称取草除灵标准品25 mg,用乙腈溶解并定容到25 mL容量瓶中,摇匀后,在0 ℃以下避光保存6个月;
标准工作液:移取1.0 mL标准储备液于100 mL容量瓶中,用乙腈定容至刻度,得标准中间液,在0 ℃以下避光保存3个月,准确移适量取标准中间液,用乙腈配制成不同浓度系列的混合标准工作液(用时现配)。
1.2 仪器和设备
气相色谱仪:Agilent7890型,配电子捕获检测器,美国安捷伦科技公司;
高速冷冻离心机:Sorvall ST16R型,美国热电公司;
匀浆机:JJ-2型,金坛市城西峥嵘实验仪器厂;
漩涡振荡器:Basic Vortex Mixer型,美国Talboys公司;
旋转蒸发仪:IKA RV 10 digital型,德国艾卡集团。
1.3 试验方法
1.3.1 样品前处理 称取4 g油料作物的粉碎样品,样品中加入20 mL正己烷饱和的乙腈,在匀浆机中高速匀浆2 min,加入10 mL乙腈饱和的正己烷,剧烈振荡1 min,5 000 r/min离心5 min,弃去正己烷层。再加入10 mL乙腈饱和的正己烷,重复2次。准确吸取10 mL乙腈层,50 ℃水浴,旋转蒸发至近干,加入2.5 mL正己烷,盖上铝箔,待净化。
称取2 g油脂制品,加入10 mL乙腈饱和的正己烷,在漩涡振荡器上快速混匀以充分溶解油样,加入10 mL正己烷饱和的乙腈,于漩涡振荡器上混匀2 min,5 000 r/min离心5 min;用胶头吸管将乙腈层转入另一离心管;再用20 mL正己烷饱和的乙腈分别提取2次,合并乙腈层;加入10 mL乙腈饱和的正己烷,剧烈振荡1 min,弃去正己烷层。乙腈层50 ℃水浴,旋转蒸发至近干,加入2.5 mL正己烷,盖上铝箔,待净化。
将弗罗里硅土小柱依次用5.0 mL丙酮+正己烷(体积比为1∶9)、5.0 mL正己烷预淋洗,当溶剂液面到达柱吸附层表面时,立即倒入上述待净化溶液,用15 mL刻度离心管接收洗脱液,用3 mL丙酮+正己烷(体积比为1∶9)冲洗烧瓶后淋洗弗罗里硅土小柱,并重复2次。将盛有淋洗液的离心管置于氮吹仪上,在水浴温度50 ℃条件下,氮吹蒸发至小于2 mL,用正己烷定容至2.0 mL,在漩涡振荡器上混匀,移入自动进样器样品瓶中,制得待测液。
1.3.2 气相色谱分析条件 色谱柱:DB-5毛细管色谱柱(长度30 m×内径0.25 mm,膜厚0.25 μm);载气:高纯氮,纯度>99.99%;载气流速:1.0 mL/min;进样器温度:220 ℃;检测器温度:300 ℃;柱温箱温度: 初始温度100 ℃,以10 ℃/min 升温至200 ℃保持5 min,以15 ℃/min 升温至270 ℃保持20 min。
1.3.3 结果计算 试样中草除灵的含量按式(1)计算:

(1)
式中:
X——草除灵含量,mg/kg;
c——草除灵的浓度,μg/mL;
V——最终定容体积,mL;
m——试样质量,g。
2 结果与讨论
2.1 前处理方法选择
2.1.1 提取方法的选择 油料作物及其油脂制品的很多基质成分都和农药有相似的性质,传统溶剂无法将分析物和基质分开[7]。选用甲醇、二氯甲烷、乙醇、石油醚、乙腈5种传统溶剂及正己烷饱和的乙腈对油菜籽和菜籽油中的草除灵进行提取试验,结果发现:采用甲醇、二氯甲烷提取,提取液杂质较多,干扰草除灵的测定;采用乙醇提取,回收率稍差(70%~80%);采用石油醚提取,石油醚和油样互溶无法提取;采用乙腈提取,乙腈本身与油脂不相溶,无法与油脂充分接触,不能完全提取样品中的草除灵;采用正己烷饱和的乙腈作为提取试剂,正己烷既能很好地溶解脂肪,又能溶解脂肪中的草除灵,再结合乙腈不溶脂肪的特点,利用相似相溶的原理,能很好地将正己烷中的草除灵提取到乙腈中,并且可以有效消除大部分的脂质效应。同时,采用乙腈饱和的正己烷进行多次液液分配,以去除样品提取液中微量的脂类杂质。
2.1.2 净化方法的选择 弗罗里硅土作为氧化镁复合的极佳硅胶吸附剂(硅镁吸附剂),适用于从非极性基质中吸附极性化合物,具有高吸附容量、高灵敏度、方便耐用和稳定等优点[8]。本试验采用弗罗里硅土固相萃取小柱进行样品的净化,可以有效去除油菜籽等样品中37.5%~46.3%油脂,24.6%~32.4%蛋白质之外的1.0%左右的磷脂,以及芥酸等杂质。这些极性杂质在气相色谱法测定时容易产生较大的基质效应,有效的净化才能保证准确的分析数据。试验中选择丙酮+正己烷、丙酮+石油醚、乙酸乙酯+正己烷、乙酸乙酯+石油醚4种洗脱试剂,以不同配比混合后进行比较,结果见图1。由图1可知:相同配比下采用丙酮+正己烷洗脱效果最佳,而不同体积比的丙酮+正己烷中,体积比1∶9时洗脱效果最佳。
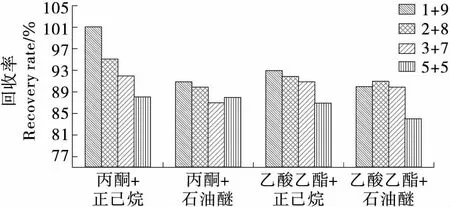
图1 洗脱试剂对洗脱效果的影响
2.2 仪器条件选择
本试验采用具电子捕获检测器的气相色谱仪分析草除灵残留量。电子捕获检测器利用一个放射源轰击物质组分,使物质离子逃逸之后再被检测,因此它仅对那些能俘获电子,具有电负性的化合物有信号,并且样品电负性越强,给出的信号越大[9]。草除灵的结构式为C11H10ClNO3S,在具电子捕获检测器的气相色谱仪上有很高的响应。分别采用恒温色谱分析和程序升温色谱分析进行试验,结果发现采用恒温色谱分析得到的峰形扁平,不利于定量分析,而采用程序升温色谱分析能得到较好的峰形。比较几种不同升温程序发现,采用初始温度100 ℃,以10 ℃/min升温至200 ℃保持5 min,以15 ℃/min 升温至270 ℃保持20 min的升温程序时,得到峰形最佳。在此仪器条件下,草除灵典型气相色谱图见图2(图中草除灵标准溶液浓度为0.05 μg/mL,草除灵-1和草除灵-2分别为草除灵的2个异构体)。

图2 草除灵典型气相色谱图
2.3 方法学验证
2.3.1 线性范围考察 将草除灵标准中间溶液制得为0.000,0.005,0.010,0.050,0.100,0.300 μg/mL的标准工作浓度,并进行测定。以标准溶液中被测组分峰面积为纵坐标,对照溶液的浓度为横坐标,绘制标准曲线(见图3),得到线性方程为y=66 864x+28.76,相关系数为0.999。
2.3.2 方法的灵敏度分析 将空白样品按相同步骤处理后,经测定表明空白样品对所测分析物无干扰。在空白样品中添加接近于空白值的浓度标样,重复测定得到平均信号。由基质空白所产生的仪器背景信号的3倍值的相应量来验证方法的灵敏度,草除灵的最低检测限(LOD)为0.005 mg/kg。
2.3.3 方法的准确度和精密度分析 选取油菜籽、菜籽油两类样品,按本研究确定的方法,分别对0.01,0.05,0.10 mg/kg 3个水平做回收率试验,各水平平行测定6次。空白样品和加标样品的气相色谱图见图4、5。加标回收试验结果见表1,由表1可知,回收率为91.2%~122.7%,变异系数为2.23%~8.16%,说明该方法准确度较高、精密度较好。
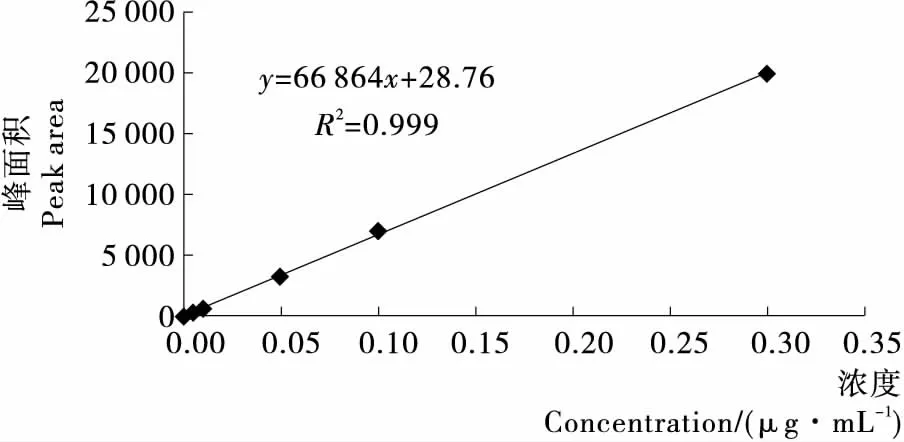
图3 草除灵标样浓度与峰面积的线性关系图

图4 空白样品的气相色谱图
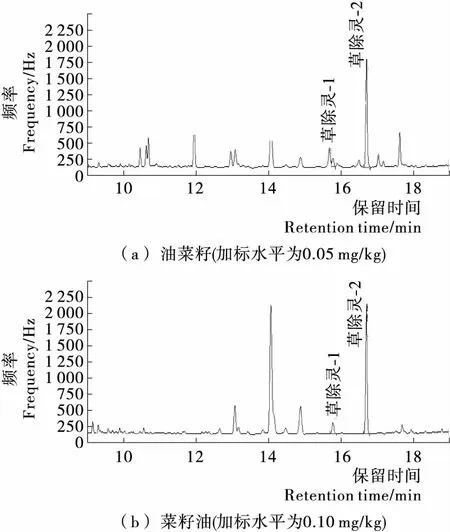
图5 加标样品的气相色谱图

样品添加量/(mg·kg-1)检出量/(mg·kg-1)回收率/%平均回收率/%变异系数/%0.010.0098^0.012398.2^122.7111.78.16油菜籽0.050.0489^0.052797.9^105.4101.62.590.100.0986^0.107898.6^107.8103.43.100.010.0097^0.011496.5^114.2105.66.91菜籽油0.050.0456^0.051391.2^102.695.74.580.100.0961^0.102196.1^102.198.42.23
2.4 实际样品测定
选取3种不同产地油菜籽、3种不同品牌菜籽油,采用本研究方法进行草除灵残留量的检测,结果见表2。由表2可知,草除灵残留量均低于GB 2763—2016中限量要求,说明测定的6种样品质量较好。
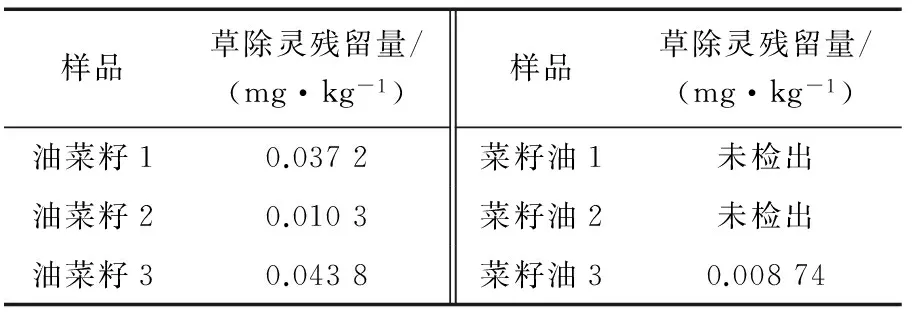
表2 草除灵残留量试验结果
3 结论
本试验建立了一种适用于油料作物及其油脂制品中草除灵残留量测定的方法,以正己烷饱和的乙腈为提取试剂,用乙腈饱和的正己烷进行脱脂,再用弗罗里硅土小柱进行净化,采用具电子捕获检测器的气相色谱仪进行测定,该方法前处理简单快速、成本低廉、净化完全,能够获得较好的回收率和较低的检出限,为测定油料作物及其油脂制品中草除灵残留量提供一种准确、灵敏、简便的检测方法。本试验研究过程中,采集样品的数量有限,还需要搜集不同产地的油菜籽和不同品牌的菜籽油作进一步的研究。
[1] 中华人民共和国工业和信息化部. HG/T 4468—2012 草除灵原药[S]. 北京: 化学工业出版社, 2013: 5.
[2] 孙惠青, 李义强, 徐广军, 等. 草除灵在油菜植株、油菜籽及土壤中残留分析方法研究[J]. 农药科学与管理, 2012, 33(8): 22-24.
[3] CAI Tian-ming, QIAN Li-hua, CAI Shu, et al. Biodegradation of Benazolin-Ethyl by strain Methy-loersatilis sp.cd-1 Isolated from Activated Sludge[J]. Curr Microbiol, 2011, 62: 570-577.
[4] 黄雪, 罗俊凯, 龚道新, 等. 高效液相色谱法测定土壤中草除灵和高效氟吡甲禾灵的残留量[J]. 农药学学报, 2013, 15(1): 125-128.
[5] 杨开莲, 谢承礼, 周岳明. 草除灵的气相色谱分析[J]. 云南化工, 2007, 34(1): 58-59.
[6] 魏翔. 草除灵的高效液相色谱分析[J]. 山东化工, 2003, 32(1): 30-31.
[7] 花锦, 张小燕, 杜利君. QuEChERS—超高效液相色谱—串联质谱法同时测定油料和植物油中77种农药残留量[J]. 食品安全质量检测学报, 2015, 6(5): 1 691-1 697.
[8] 吴琳, 刘四磊, 魏芳, 等. Florisil固相萃取法联用气相色谱测定油脂中sn-2位脂肪酸[J].中国油料作物学报, 2015, 37(2): 227-233.
[9] 何飞飞. 浅谈气相色谱检定中ECD的分析条件选择[J]. 价值工程, 2014(31): 304-305.
Benazolin residues detection in oil-bearing crops and its products
CHENWen-qing
(ShanghaiBinoTestingServiceCo.,Ltd,Shanghai200436,China)
A detection method was developed for benazolin residues in oil-bearing crops and its products. The oil-bearing crops and its products were extracted with acetonitrile saturated by n-hexane, degreased with n-hexane saturated by acetonitrile, and refined with Florisil SPE column in order to prepare test liquids. The test liquids were analyzed by gas chromatography with electron capture detector for getting the benazolin residues in oil-bearing crops and its products.The liner relation of benazolin was good and the correlation coefficient was 0.999.The recovery rates of benazolin were between 91.2%~122.7%. The variation coefficients were between 2.23%~8.16%. The limit of detection (LOD) of benazolin was 0.005 mg/kg. The pretreatment technology of the method is suitable for oil-bearing crops and its products. This method could be accurate, sensitive, simple and rapid determination of operating benazolin residues.
benazolin; gas chromatograph; oil-bearing crops; containing oil products
陈雯青(1983—),女,上海必诺检测技术服务有限公司工程师,本科。E-mail:bino_cwq@126.com
2017—05—04
10.13652/j.issn.1003-5788.2017.07.015

