基于纳米金与适配体的赭曲霉毒素A检测方法研究
吕 蕾
赵阳阳2,3
刘仁杰3
金永东2
郭志军1
(1. 延边大学农学院,吉林 延吉 133002;2. 中国科学院长春应用化学研究所,吉林 长春 130022;3. 吉林农业大学生命科学学院,吉林 长春 130118)
基于纳米金与适配体的赭曲霉毒素A检测方法研究
吕 蕾1
赵阳阳2,3
刘仁杰3
金永东2
郭志军1
(1. 延边大学农学院,吉林 延吉 133002;2. 中国科学院长春应用化学研究所,吉林 长春 130022;3. 吉林农业大学生命科学学院,吉林 长春 130118)
以赭曲霉毒素A适配体作为识别分子荧光素发射的荧光作为检测信号、纳米金作为荧光信号淬灭剂,建立一种高灵敏度的赭曲霉毒素A荧光检测方法。结果表明:该检测体系检测限达到10 nmol/L,在25~1 000 nmol/L浓度范围具有线性关系,相关系数为0.991,具有较好的实用性。该荧光检测法同传统方法相比,提高了检测效率,为更好地进行赭曲霉毒素A检测控制提供了技术支持。
纳米金;适配体;赭曲霉毒素A;生物传感器
赭曲霉毒素A(Ochratoxin A,OTA)是赭曲霉属和青霉属真菌产生的一种真菌毒素[1-2]。研究表明,OTA不仅具有肝脏和肾脏毒性[3],而且具有致癌[4]、致畸[5]、致突变[6]和免疫抑制作用[7]。联合国癌症研究组织也将其列为CLASS 2B类致癌物质[4]。OTA广泛存在于农作物、食品原料及食品中,严重威胁人类健康[8-10]。目前,中国OTA检测主要以传统仪器法为主,包括色谱法[10-11]、质谱法[12]、气相色谱法-质谱联用技术[13]、液相色谱-质谱联用技术[14]、高效液相色谱-荧光[15]等。这些传统的检测方法往往比较繁琐,检测周期长,且需要专业的操作人员等,在一定程度上限制了它们在OTA检测中的实际应用。因此,建立灵敏、高效、简便的OTA检测控制方法,对保障食品安全及人类健康具有重要意义。
适配体是一类在体外筛选的,能与目标物专一结合的单链寡聚核苷酸序列[16-18],在一定条件下能与靶物质高效地、特异性地识别结合。因此,在分析检测领域中具有良好的应用前景。与其他特异性识别元件特别是抗体相比,适配体具有独特的优势,例如:易获得,合成快速,成本低;亲和力高,特异性强;靶分子范围广;易修饰;性质稳定;分子量小,重复性强等[19]。由于适配体本质上只是一段寡核苷酸片段,并不具有信号转换的功能,将其用于检测各种靶物质时,与靶物质特异性的识别过程本身并不能产生可检测的信号。因此,需要经过合理设计和筛选后修饰,将核酸适配体对目标物的识别,转换成为易于检测的物理化学信号。
纳米材料因其具有独特的光、电、磁及化学性质,并且具有小尺寸效应、量子效应、表面效应。特别是纳米材料表面富含各种官能团且生物相容性好,能保持生物分子活性,使其在构建高灵敏、高通量、高稳定的生物传感器方面表现出巨大潜力。近年来,纳米材料被越来越广泛地用于构建灵敏、高效的化学和生物分析工具[20-22]。纳米金(AuNPs)因其易于合成以及其独特的性能,在催化[23]、传感[24]、电子[25]等领域得到广泛研究和应用。AuNPs可作为能量受体,通过荧光共振能量转移效应有效淬灭荧光。因此利用AuNPs进行荧光淬灭被应用于各种传感器的构建[26-27],但在OTA检测中以AuNPs作为淬灭剂鲜有报道。本研究拟利用荧光素(FAM)修饰OTA适配体,通过AuNPs对FAM的淬灭作用,将适配体对OTA的识别过程转换为荧光信号进行研究,旨在为OTA检测提供简便、高效的新方法。
1 材料与方法
1.1 材料与试剂
3’端修饰羧基荧光素的OTA适配体(5’-GAT CGG GTG TGG GTG GCG TAA AGG GAGCAT CGG ACA-FAM-3’):上海生工生物工程股份有限公司;
赭曲霉毒素A、柠檬酸钠、氯金酸、三羟甲基氨基甲烷(Tris):分析纯,美国Sigma公司;
盐酸、氯化钙、氯化钾:分析纯,北京化工厂;
葡萄酒:烟台张裕集团有限公司。
1.2 仪器与设备
荧光光谱仪:Fluoromax-4型,美国Horiba公司;
紫外可见分光光度计:UV-2600型,日本岛津公司;
透射电子显微镜:Hitachi 600型,日立公司;
电子天平:AL204型,梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 纳米金的制备 利用经典的柠檬酸钠还原氯金酸法制备AuNPs[28-29]。在搅拌、沸腾条件下,向50 mL浓度为1 mmol/L的氯金酸溶液中迅速注入5 mL浓度为1%的柠檬酸钠溶液,持续煮沸,搅拌15 min,溶液最终呈酒红色。移除热源,搅拌冷却至室温,10 000 r/min离心20 min,弃上清液,将沉淀重悬于超纯水中,4 ℃保存。
1.3.2 纳米金的表征 将离心重悬好的AuNPs超声3 min,用UV-vis在350~800 nm处测其吸光度值,根据其最大吸收峰位置可以表征AuNPs的粒径,并计算浓度。同时利用HRTEM对其粒径、均一性以及单分散性进行表征。
1.3.3 OTA检测原理 经FAM标记的适配体在激发波长为492 nm的条件下,FAM会发射荧光,具体原理见图1。当体系中不存在OTA时,FAM染料标记的适配体单链吸附到AuNPs表面,AuNPs与荧光染料分子之间产生荧光共振能量转移效应,使得适配体上标记的FAM荧光信号淬灭;反之当体系中存在OTA时,荧光标记的适配体与赭曲霉毒素A识别结合并形成折叠结构,该折叠结构能抵抗AuNPs的吸附,AuNPs与FAM染料分子之间不能产生荧光共振能量转移效应,使得荧光信号得以保留。因此,可以通过检测到的荧光信号强弱与体系中的OTA浓度的关系,实现OTA的定量检测。
1.3.4 纳米金浓度优化 AuNPs浓度是影响检测效果的重要因素,因此需要对其浓度进行优化。AuNPs浓度过低将导致游离的适配体标记的FAM染料分子荧光信号未被完全淬灭,使得背景过强影响检测效果。具体过程:取18支1.5 mL离心管,分别加入400 μL,pH 8.0 的10 mmol/L Tris-HCl缓冲溶液(含20 mmol/L CaCl2,5 mmol/L KCl),随后分别加入200 μL,200 nmol/L 适配体溶液,室温放置30 min,最后分别加入200 μL浓度为 0,2,4,6,8,10 nmol/L的AuNPs溶液(每个浓度做3个平行试验),室温放置1.5 h后进行荧光测定,所有过程均在避光条件下进行。
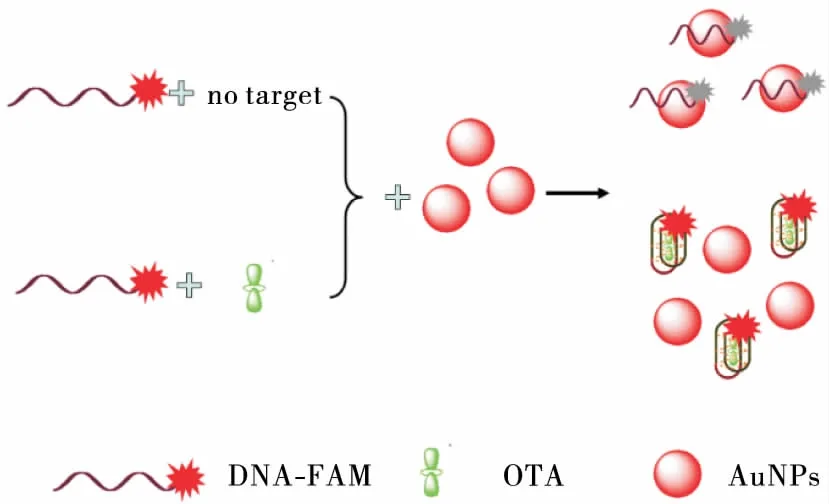
图1 基于AuNPs淬灭FAM-适配体选择性检测OTA的原理图
1.3.5 OTA定量检测 利用AuNPs对FAM标记的适配体荧光信号进行淬灭,通过检测其发射荧光信号的强弱可以实现对OTA的定量检测。由AuNPs与适配体浓度优化可知,最佳AuNPs浓度为2 nmol/L。因此在随后试验中,AuNPs浓度均为2 nmol/L。在本试验中,取27支1.5 mL离心管,每3支为一组平行样,共9组。分别向9组中加入400 μL 浓度为0,20,50,100,200,400,1 000,2 000,10 000 nmol/L的OTA溶液(均用上述pH 8.0的Tris-HCl配制),随后分别向每管中加入200 μL,200 nmol/L适配体溶液,室温静置30 min,再分别向每管中加入2 nmol/L的AuNPs溶液200 μL,室温放置1.5 h,操作在避光条件下进行。最后进行荧光测试,荧光光谱仪条件为:激发波长492 nm,发射波长范围500~630 nm,入射狭缝10 nm,出射狭缝10 nm,根据520 nm处的荧光信号强度检测OTA。
1.3.6 特异性检测 用荧光素标记的适配体检测OTA时,OTA的一些类似物如OTB、OTC等也可能会对结果产生影响。为验证该方法的特异性,设计如下试验:取24支1.5 mL 离心管,每3个一组,共8组,分别标号1~8号,首先向1号离心管中加入400 μL 上述缓冲液,2~8号离心管中分别加入400 μL均由上述缓冲溶液配置的1 000 nmol/L的AFB1、OTB、OTC、NAP、Warfarin、ZEN、OTA,随后每支离心管中都加入200 nmol/L 适配体溶液200 μL。室温静置30 min,再向每支离心管加入2 nmol/L AuNPs溶液200 μL,静置1.5 h,所有操作均需在避光条件下进行。最后进行荧光测试,测试条件同1.3.5。
1.3.7 实际样品检测 为了验证该方法的实用性,以红酒为对象进行检测体系的实用性考查。具体步骤:将1%的红酒加入到缓冲体系,用含1%红酒的缓冲体系将OTA标准溶液稀释成浓度为0,50,100,200,400,1 000,2 000 nmol/L的样品溶液,然后取21支1.5 mL离心管,每3个一组,共7组,标号为1~7。分别将上述不同标准浓度OTA的溶液分别取400 μL加入1~7号离心管中,然后加入200 nmol/L 适配体溶液200 μL,室温放置30 min,再向每支离心管加入2 nmol/L AuNPs溶液200 μL,静置1.5 h,所有操作均需在避光条件下进行。随后进行荧光测试,测试条件同1.3.5。
2 结果与讨论
2.1 纳米金的表征
采用柠檬酸钠还原氯金酸方法制备的AuNPs呈酒红色。利用UV-vis和HRTEM对其进行表征,结果见图2。在350~800 nm波长范围用UV-vis方法对其浓度进行表征,其最大吸收值在520 nm处[见图2(a)]。此方法合成的AuNPs粒子直径为13 nm左右,且其消光系数为2.7×108L/(mol·cm)[30],根据消光系数计算其原始浓度为11 nmol/L。通过透射电镜表征,结果显示该方法制备的AuNPs粒径均一,分散性好 [见图2(b)]。经过统计,其粒径集中分布在(13.5±3.0) nm,满足该试验的需要[见图2(c)]。

图2 AuNPs的表征
2.2 纳米金浓度的优化
AuNPs与FAM标记的适配体浓度比例在很大程度上影响到所构建检测体系的灵敏度,因此二者适当的浓度比非常重要。由图3可知,在适配体浓度为200 nmol/L的缓冲溶液中,荧光强度随AuNPs浓度的增加逐渐降低,当加入的AuNPs浓度到达2 nmol/L时,FAM修饰的适配体的荧光强度降低80%,之后AuNPs浓度对适配体荧光的淬灭效果没有显著影响,且过高的AuNPs浓度会降低传感器的灵敏度,因此选用2 nmol/L作为在后续试验中AuNPs的浓度。

图3 AuNPs浓度对荧光强度的影响
2.3 定量检测OTA
在0~10 000 nmol/L范围内取不同浓度的OTA做相关性研究,利用FAM标记的OTA适配体在520 nm处有最强荧光发射峰,对其进行测试,结果见图4。以浓度对数为横坐标,以520 nm处相对荧光强度(F-F0)/F0为纵坐标绘制曲线见图5(a)。由图5(b)可知,其线性范围是25~1 000 nmol/L,线性方程为:(F-F0)/F0=0.391 56 lgCOTA-0.505 35,相关系数为0.991。其检测限为能够对空白荧光信号产生影响的最低OTA浓度(10 nmol/L)。
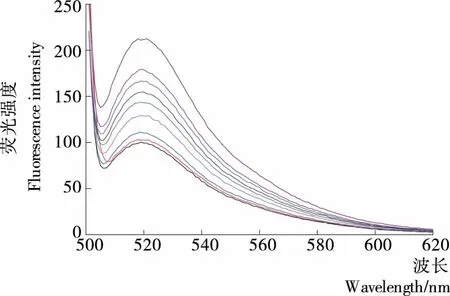
从下往上OTA浓度依次为0,20,50,100,200,400,1 000,2 000,10 000 nmol/L
图4 不同浓度OTA的荧光光谱
Figure 4 Fluorescence spectra obtained with different concentration of OTA

F. 在520 nm处含有OTA的各个样品的荧光强度F0. 空白在520 nm处的荧光强度
图5 OTA浓度变化与相对荧光强度的关系
Figure 5 Dependence of the variation of (F-F0)/F0on the concentration of OTA
2.4 方法特异性考查
由图6可知,当加入1 000 nmol/L 的OTA时,其相对荧光强度增加非常明显,但是当用1 000 nmol/L的其他类似物代替OTA时,其相对荧光强度没有出现明显的增加。说明构建的适配体-AuNPs传感器对OTA的检测具有高度的特异性。

图6 方法特异性考查
2.5 方法实用性考查
由图7可知,相对荧光强度随OTA浓度增加而增强,以520 nm处相对荧光强度为纵坐标,OTA浓度对数为横坐标绘制的校正曲线。该曲线具有良好的线性关系,相关系数为0.993,说明该传感器适用于实际样品检测。
3 结论
该研究利用标记有荧光素的核酸适配体与淬灭剂AuNPs构建了一种通过荧光信号变化进行OTA检测的方法。该方法具有操作简单、灵敏度高、选择性好等特点,在实际样品检测中表现出了较高的灵敏度,说明其在食品安全检测中具有较强的实用性。该试验建立的方法为真菌毒素检测提供了一种新的思路,同时也可为构建简便、快捷的适用于食品其他有害因子的检测方法提供参考。
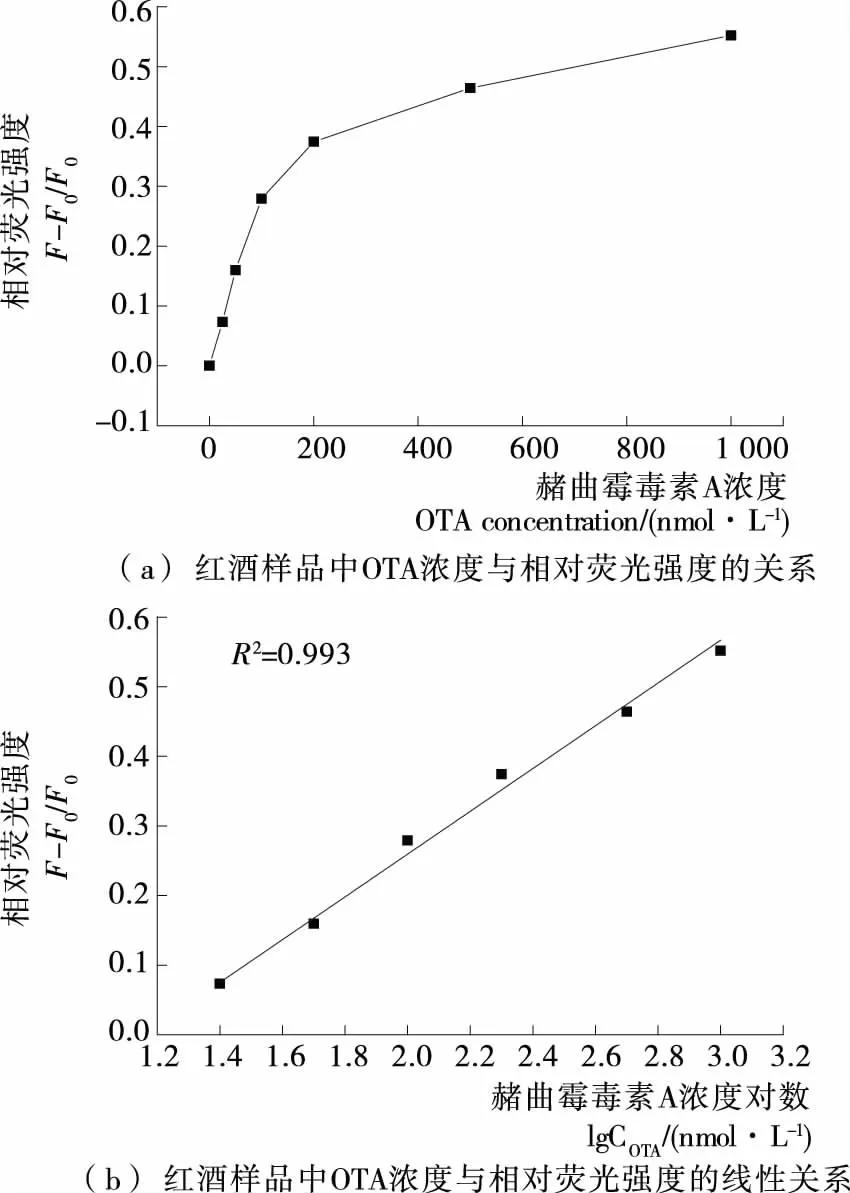
F. 加入不同浓度的OTA标准后,各个样品在520 nm处的荧光强度
F0. 未加入OTA标准溶液在520 nm处的荧光强度
图7 在1%红酒样品中OTA检测效果
Figure 7 Application of aptasensor for OTA determination in red wine samples
[1] AHMED N E, FARAG M M, SOLIMAN K M, et al. Evaluation of methods used to determine ochratoxin a in coffee beans[J]. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9 576-9 580.
[2] BREITHOLTZ A, OLSEN M, DAHLBCK Å, et al. Plasma ochratoxin A levels in three Swedish populations surveyed using an ion-pair HPLC technique[J]. Food Additives & Contaminants, 1991, 8(2): 183-192.
[3] OLIVEIRA S C B, DICULESCU V C, PALLESCHI G, et al. Electrochemical oxidation of ochratoxin A at a glassy carbon electrode and in situ evaluation of the interaction with deoxyribonucleic acid using an electrochemical deoxyribonucleic acid-biosensor[J]. Analytica Chimica Acta, 2007, 588(2): 283-291.
[4] IMPERATO R, CAMPONE L, PICCINELLIA L, et al. Survey of aflatoxins and ochratoxin a contamination in food products imported in Italy[J]. Food Control, 2011, 22(12): 1 905-1 910.
[5] LI Zeng-ning, ZHANG Xiang-hong, CUI Jin-feng, et al. Assessment on pollution of ochratoxin a in grain in China and its apoptosis effect on vitro-cultured human tubular kidney cells[J]. Journal of Biochemical and Molecular Toxicology, 2012, 26(4): 139-146.
[6] RACHED E, HOFFMANN D, BLUMBACH K, et al. Evalu-ation of putative biomarkers of nephrotoxicity after exposure to ochratoxin A In vivo and In vitro[J]. Toxicological Sciences, 2008, 103(2): 371-381.
[7] ROBINSON A L, LEE H J, RYU D. Polyvinylpolypyrrolidone reduces cross-reactions between antibodies and phenolic compounds in an enzyme-linked immunosorbent assay for the detection of ochratoxin A[J]. Food Chemistry, 2017, 214: 47-52.
[8] DUARTE S C, PENA A, LINO C M. A review on ochratoxin A occurrence and effects of processing of cereal and cereal derived food products[J]. Food Microbiology, 2010, 27(2): 187-198.
[9] LUHE A, HILDEBRAND H, BACH U, et al. A new approach to studying ochratoxin A (OTA)-induced nephrotoxicity: Expression profiling in vivo and in vitro employing cDNA microarrays[J]. Toxicological Sciences, 2003, 73(2): 315-328.
[10] 刘仁荣, 徐玲, 裘雪梅, 等. 基于赭曲霉毒素A模拟表位的无毒素ELISA方法[J]. 食品与机械, 2010, 26(6): 47-50.
[11] CIGIC I K, STRLIC M, SCHREIBER A, et al. Ochratoxin A in wine: Its determination and photostability[J]. Analytical Letters, 2006, 39(7): 1 475-1 488.
[12] TURNER N W, SUBRAHMANYAM S, PILETSKY S A. Analytical methods for determination of mycotoxins: A review[J]. Analytica Chimica Acta, 2009, 632(2): 168-180.
[13] BECERRA V, ODERMATT J. Detection and quantification of traces of bisphenol A and bisphenol S in paper samples using analytical pyrolysis-GC/MS[J]. Analyst, 2012, 137(9): 2 250-2 259.
[14] ROLAND A, BROS P, BOUISSEAU A, et al. Analysis of ochratoxin A in grapes, musts and wines by LC-MS/MS: First comparison of stable isotope dilution assay and diastereomeric dilution assay methods[J]. Analytica Chimica Acta, 2014, 818(25): 39-45.
[15] 傅武胜, 邱文倩, 郑奎城, 等. 药食两用类食品中赭曲霉毒素A的高效液相色谱—荧光检测方法[J]. 食品科学, 2011, 32(14): 298-302.
[16] ELLINGTON A D, SZOSTAK J W. Invitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346(6 287): 818-822.
[17] TUERK C, GOLD L. Systematic evolution of ligands by exponential enrichment-RNA ligands to bacteriophage-T4 DNA-polymerase[J]. Science, 1990, 249(4 968): 505-510.
[18] 吴世嘉, 聂雨, 张辉, 等. 基于KGdF4: Dy3+纳米材料检测土霉素的生物传感新方法[J]. 食品与机械, 2014, 30(6): 64-68.
[19] HE Yu, YE Tao, SU Min, et al. Hierarchical self-assembly of DNA into symmetric supramolecular polyhedra[J]. Nature, 2008, 452(7 184): 198-201.
[20] CHEN Yu-wen, SASIREKHA N. Preparation of NiFeB Nanoalloy Catalysts and Their Applications in Liquid-Phase Hydrogenation of p-Chloronitrobenzene[J]. Industrial & Engineering Chemistry Research, 2009, 48(13): 6 248-6 255.
[21] NIU Xin-shu, LI Hong-hua, LIU Guo-guang. Preparation, characterization and photocatalytic properties of REFeO3(RE=Sm, Eu, Gd)[J]. Journal of Molecular Catalysis A: Chemical, 2005, 232(1): 89-93.
[22] SHAO Xin, XUE Qun-ji, LIU Wei-min, et al. Tribological behavior of micrometer- and nanometer-Al2O3-particle-filled poly(phthalazine ether sulfone ketone) copolymer composites used as frictional materials[J]. Journal of Applied Polymer Science, 2005, 95(5): 993-1 001.
[23] HALLETT-TAPLEY G L, D'ALFONSO C, PACIONIN L, et al. Gold nanoparticle catalysis of the cis-trans isomerization of azobenzene[J]. Chemical Communications, 2013, 49(86): 10 073-10 075.
[24] GUO Ya-hui, WANG Xiong-tao, MIAO Bin, et al. An AuNPs-functionalized AlGaN/GaN high electron mobility transistor sensor for ultrasensitive detection of TNT[J]. RSC Advances, 2015, 5(120): 98 724-98 729.
[25] PRADO-GOTOR R, GRUESO E, PEREZ-TEJEDA P, et al. Free energy of binding of cationic metal complexes to AuNPs through electron-transfer processes[J]. Soft Matter, 2014, 10(42): 8 482-8 488.
[26] LU Qiu-jun, ZHAO Jiang-na, XUE Shan-yan, et al. A "turn-on" fluorescent sensor for ultrasensitive detection of melamine based on a new fluorescence probe and AuNPs[J]. Analyst, 2015, 140(4): 1 155-1 160.
[27] TU Yun-qiu, WU Ping, ZHANG Hui, et al. Fluorescence quenching of gold nanoparticles integrating with a conformation-switched hairpin oligonucleotide probe for microRNA detection[J]. Chemical Communications, 2012, 48(87): 10 718-10 720.
[28] FRENS G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J]. Nature-Physical Science, 1973, 241(105): 20-22.
[29] GRABAR K C, FREEMAN R G, HOMMER M B, et al. Preparation and Characterization of Au Colloid Monolayers[J]. Analytical Chemistry, 1995, 67(4): 735-743.
[30] JIN Rong-chao, WU Guo-sheng, LI Zhi, et al. What Controls the Melting Properties of DNA-Linked Gold Nanoparticle Assemblies?[J]. Journal of the American Chemical Society, 2003, 125(6): 1 643-1 654.
Study on detection method for ochratoxin A based on gold nanoparticle and aptamer
LULei1
ZHAOYang-yang2,3
LIURen-jie3
JINYong-dong2
GUOZhi-jun1
(1.AgriculturalCollege,YanbianUniversity,YanJi,Jilin133002,China; 2.ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,Changchun,Jilin130022,China; 3.CollegeofLifeScience,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
A high sensitivity fluorescence detection method for ochratoxin A (OTA) based on OTA aptamers and gold nanoparticle (AuNPs) was established, which employed OTA aptamers as recognition element and AuNPs to quench the fluorescence emission from fluorescein. The results indicated that the detection limit is 10 nmol/L and a linear relationship between the fluorescent intensity ratio and the logarithm of OTA concentration was plotted in the range of 25~1 000 nmol/L (R2=0.991). The detection method showed high feasibility and reliability. Compared with traditional method, this method greatly improved the detection efficiency and provided technical support for more effective identification of OTA.
gold nanoparticle; aptamer; ochratoxin A; biosensor
吉林省科技厅青年科研基金项目(编号:20160520047 JH);吉林省教育厅科学技术研究项目(编号:吉教科合字[2016]第252号);国家自然科学基金项目(编号:31360384, 31460423)
吕蕾,女,延边大学农学院实验师,博士。
金永东(1971—),男,中国科学院长春应用化学研究所研究员,博士。E-mail:ydjin@ciac.jl.cn 郭志军(1980—),男,延边大学农学院副教授,博士。 E-mail:guozhijunvip@163.com
2017—05—07
10.13652/j.issn.1003-5788.2017.07.012

