绿豆芽生产过程中微生物的生长、分布及消毒剂处理效果评价
罗 欣
傅 亮
郝天瑶
方良月
(暨南大学食品科学与工程系,广东 广州 510632)
绿豆芽生产过程中微生物的生长、分布及消毒剂处理效果评价
罗 欣
傅 亮
郝天瑶
方良月
(暨南大学食品科学与工程系,广东 广州 510632)
研究绿豆芽生产过程中微生物的生长情况及种类分布,采用2种不同类型的消毒剂进行处理及效果评价,并用16S rRNA方法对豆芽中主要微生物进行鉴定。结果表明,成品绿豆芽中的微生物总量为5.8×107CFU/g,微生物的种类主要为克雷伯氏菌(Klebsiella)、不动杆菌(Acinetobacter)、肠杆菌(Enterobacter)和假单胞菌属(Pseudomonas)等。有效氯浓度1 000~3 000 mg/L的NaClO处理芽菜30 min,菌落总数分别降至1.2×107~1.0×105CFU/g,而直接处理单独培养的模型对照组则平均降至2.3×104~1.0×103CFU/mL。25 mg/L AgNO3可使菌落总数降至3.8×105CFU/g,消毒效果同样差于模型对照组。扫描电子显微镜观察分析芽菜表面微生物可形成明显可见的生物膜,显著强化了细菌对消毒剂的耐受力。
绿豆芽;微生物;菌种鉴定;消毒剂;生物膜
绿豆芽在中国芽菜消费中占比最大,口感好,营养丰富[1]。芽菜以鲜活的形式上市,极富脆性,含有丰富的VC,是人们生活中不可缺少的食品原料。近年来,中国芽菜产业发展迅速,从作坊式发豆芽方式逐步转为工业化规模生产,出现了大量日产50~100 t的芽菜工厂。但目前,在中国的果蔬生产中,由于采摘不当,贮藏不善,运输不及时或生理病害及微生物污染的影响,往往导致20%~30%的损耗[2-3]。规模化生产后芽菜产业遇到了三大技术问题:① 芽菜生产多采用淋水保温(20~25 ℃)发芽方式,生产过程中极易出现团状、窝状式烂菜或大面积烂根问题,严重影响芽菜品质与产量;② 芽菜的保鲜期极短,常温下只有1~2 d,在低温冷藏条件下也只有3~5 d,严重制约了芽菜产能和销售半径,极大影响了企业效益;③ 有关芽菜的安全性问题频发[4]。2000年,美国爆发了由沙门氏菌污染的绿豆芽而引发的食源性疾病[5];2011年,德国爆发了肠出血性大肠杆菌污染芽菜事件,近30人死亡[6]。由于豆种含有天然内生菌,生产过程中进行保温淋水,生产周期长达4~7 d,芽菜本身也易受到机械性损伤导致汁液流出,这些条件都为微生物的生长及繁殖创造了良好条件。可以说,芽菜生产过程中的微生物问题直接影响了芽菜规模化生产后的质量及安全。因此,分析芽菜生产过程中微生物的生长、分布规律及对消毒效果进行评价成为解决上述3个技术问题的基础。
孔凡春等[7]利用臭氧控制微生物的生长以延长果蔬的货架期,但过度使用会导致脱色和风味变化。H.H.Jin等[8]研究了用ClO2和气调包装联合使用的方法杀灭绿豆芽中沙门氏菌和李斯特菌的效果,可降低原豆芽菜中的微生物数量,但会影响芽菜的质量和口感。M.L.Bari等[9]采用细菌素联合植酸柠檬酸等使用,以减少鲜切果蔬中李斯特菌数量。更有J.X.Ye等[10]使用噬菌体抑制苜蓿菜中沙门氏菌的生长及M.L.Bari等[11]研究了在低温条件下运用物理辐射的方法杀灭豆芽菜中李斯特菌。上述研究虽有一定的抑菌效果,但未从根本上认识芽菜与微生物之间的关系。
NaClO是鲜切果蔬和自来水消毒中常用的消毒剂[12],对微生物有很好的杀灭效果,按规定量使用具有安全高效的特点。另外,Ag+是一种无机消毒剂[13],广泛用于水和其它领域。在美国、加拿大等地被认为是一种安全的消毒剂,其作用机理是Ag+与微生物中巯基结合,使某些酶失活,从而达到杀菌或抑菌作用,当菌体被杀灭后Ag+又被释放出来,保持持续的消毒作用[14]。根据美国FDA 21 CFR 172.167条规定允许AgNO3在瓶装水中使用,并作为抗菌剂来防止水中微生物的污染;赵清凤等[13]采用AgNO3研究了对大肠杆菌和金黄色葡萄球菌的抗菌作用及机制,取得了一定的抗菌效果。
本研究拟讨论绿豆芽发芽过程中的微生物生长规律、种类的分布,初步探讨2种常见的消毒剂对芽菜消毒除菌的效果,并分析芽菜中微生物难以有效清除的原因,旨在为生产出优质、高产、安全和保鲜期更长的产品。
1 材料与方法
1.1 材料与仪器
绿豆:市售;
平板计数营养琼脂培养基(PCA)、营养肉汤等培养基:广东环凯微生物科技有限公司;
细菌基因组DNA提取试剂盒:天根生化科技有限公司。
电子天平:HR-120型,上海精密仪器厂;
电热恒温培养箱:HN-403型,上海邦西仪器科技有限公司;
超净工作台:SW-CJ-1BU型,苏州安泰空气技术有限公司;
蒸汽灭菌锅:YQX-SG46-280S型,上海博讯实业有限公司;
PCR仪:VERITI 2.0型,美国AB公司;
电泳仪:HE99型,美国通用电气公司;
凝胶成像系统:BOX EF型,美国基因有限公司;
豆芽机:DYJ-A01型,中山荣威电器厂;
扫描电子显微镜(SEM):TM3030型,日本日立有限公司。
1.2 试验方法
1.2.1 绿豆芽生长过程中菌落总数的测定 称取健康饱满的绿豆60 g,无菌水冲洗数次,除去表面灰尘、杂质。豆芽机用体积分数75%的酒精洗涤,臭氧柜内消毒3 h后无菌水洗净。绿豆放入豆芽机发芽,每隔8 h更换无菌水。根据不同发芽时间取样,按GB 4789.2—2010测定菌落总数。
1.2.2 绿豆芽中细菌分离与鉴定
(1) 细菌分离:取成熟完整的绿豆20 g,以有效氯浓度为3 000 mg/L的NaClO溶液浸泡豆种30 min,取出后用无菌水清洗3~5次后发芽,发芽4 d后用PCA平板培养基进行浓度梯度培养。选取菌落形态不同、菌落独立清晰、出现频率最高的10种菌进行单独纯化培养,纯化10次,得到菌种分别编号M1~M10。
(2) DNA提取:采用DNA提取试剂盒分别提取10种菌的DNA。
(3) 16S rRNA的PCR扩增:将提取的基因组作为模板进行PCR扩增[15],体系见表1。扩增引物为通用引物27F和1495R。扩增条件为:95 ℃预变性5 min,95 ℃变性1 min,55 ℃复性45 s,72 ℃延伸2 min,30个循环,最后72 ℃延伸10 min。

表1 PCR扩增体系
(4) PCR电泳检测:吸取4 μL PCR产物与1 μL DNA Loading Buffer混匀,在1%琼脂糖凝胶上点样,100 V电泳45 min[16]。结束后EB染色,用凝胶成像系统进行观察。
送至广州生工生物工程公司测序。测序结果提交至NCBI的GenBank数据库,与已知序列进行Blast比较,采用Neighbour-joining法用Mega 7.0软件进行系统发育树分析。确定与试验菌株亲缘关系最近的种属。
1.2.3 不同消毒剂常规处理新鲜绿豆芽
(1) 配制有效氯浓度为1 000,2 000,3 000 mg/L的NaClO 溶液,称取3份20 g的绿豆芽分别浸入不同浓度的NaClO溶液中,浸泡30 min。有效氯浓度以GB 19106—2013中碘量法确定。用无菌去离子水洗净直至NaClO不得检出。测量菌落总数,并进行感官评定。
(2) 配制浓度为5,15,25 mg/L的AgNO3溶液,另取3份20 g绿豆芽浸入不同浓度的AgNO3溶液,浸泡30 min。用无菌去离子水洗净至AgNO3残留不得检出。测量菌落总数,并进行感官评定。
以上试验至少进行3次平行,取平均值。另空白对照组用无菌水代替消毒液进行相同步骤的处理。
1.2.4 不同消毒剂单独处理绿豆芽中的细菌 取10 mL离心管多个,装入营养肉汤培养基10 mL,灭菌后分别接种已纯化好的M1~M10菌种。37 ℃培养至菌体浓度107CFU/mL 左右,冷藏备用。并测量菌落总数。
在装有菌液的离心管中分别加入NaClO和AgNO3,使浓度与1.2.3相同,室温下振摇30 min,测量离心管中的菌落数。作为模型对照。
1.2.5 感官评定 绿豆芽感官评价标准见表2。挑选10位评价员,按GB 19547—2004的要求对绿豆芽进行感官评价。

表2 绿豆芽感官评价标准
1.2.6 扫描电子显微镜(Scanning Electron Microscope, SEM)观察绿豆芽中菌的形态 取豆芽数根,在体积分数2.5%的戊二醛中浸泡2 h,用磷酸缓冲液清洗30 min,体积分数50%,70%,80%,90%浓度梯度的乙醇各清洗10 min,无水乙醇清洗30 min,醋酸异戊酯清洗30 min。临界点干燥法干燥,样品用导电胶固定在扫描电镜样品台上,喷金后观察[17]。
2 结果与分析
2.1 绿豆发芽过程中细菌总数生长规律
由图1可知,经无菌水洗净后的豆种,细菌总数为4.2×103CFU/g(3.62 lg CFU/g);避光淋水发芽12 h后,菌落总数增长到5.2×105CFU/g(5.72 lg CFU/g);24 h后菌落总数快速增长至3.0×107CFU/g(7.48 lg CFU/L);36 h后细菌总数增长趋势缓慢;96 h后芽菜中的菌落总数约为5.8×107CFU/g(7.76 lg CFU/L),说明芽菜发芽过程中,前期细菌快速繁殖,后期菌落总数保持相对稳定。最终芽菜中的细菌总数含量极高,对芽菜的安全和保鲜都带来了极大隐患。
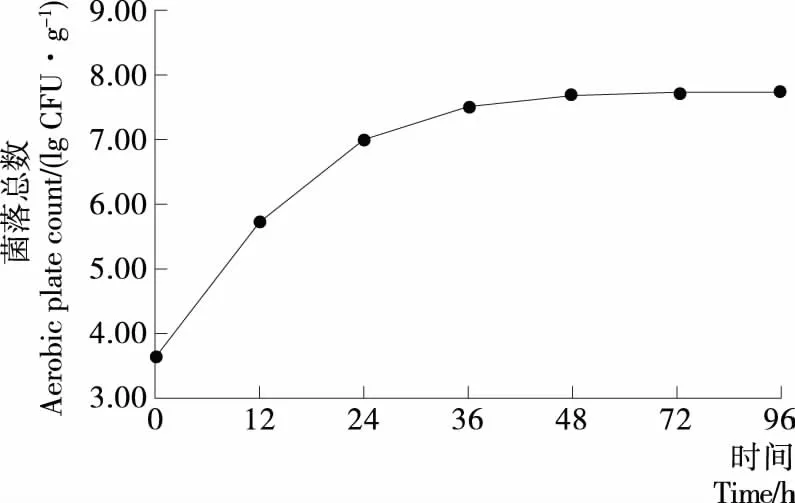
图1 绿豆发芽过程中细菌总数变化规律
2.2 绿豆芽细菌分离与鉴定
2.2.1 PCR电泳检测结果 根据1.2.2提取各组DNA后,紫外检测,可见清晰的PCR产物带。如图2所示,PCR产物带都处于同一直线上,介于Marker分子量1 000~2 000 bp,可推断该10种菌的PCR产物分子量约为1 400 bp。与空白相比产物单一无杂质。

M. DL2 000 DNA Marker M1~M10. 10种菌DNA经PCR后的产物
图2 PCR扩增后凝胶电泳图
Figure 2 The result of gel electrophoresis after PCR
2.2.2 绿豆芽中菌种种类分布 将M1~M10提取DNA测序后在NCBI的Genbank数据库中进行Blast比较,结果见表3。菌株M2、M7、M9属于克雷伯氏菌属(Klebsiella),其中肺炎克雷伯氏菌对人致病性较强,是重要的条件致病菌和医源性感染菌之一。菌株M5、M10属于埃希氏菌属(Escherichia),M1、M4属于不动杆菌属(Acinetobacter),M3属于假单胞菌(Pseudomonas),M6属于肠杆菌属(Enterobacter),M8属于假食酸菌(Pseudacidovorax)。其中肺炎克雷伯氏菌、铜绿假单胞菌和大肠埃希氏菌容易产生细菌生物膜。此前已有学者[18]提出生物膜的概念,认为自然界中99%的菌都可以附着于物体表面形成生物膜结构。
分别选取与M1~M10 10种菌相似的几种进行比对,将相似度高的几种序列通过MEGA7.0进行同源性分析并构建系统发育树。M1~M10 10种菌的发育树见图3。

表3 绿豆芽中微生物种类分布
2.3 消毒剂常规处理绿豆芽
由图4、5可知,新鲜豆芽中的原始菌落数为5.8×107CFU/g (7.77 lg CFU/g),水洗30 min后,菌落总数减少至4.8×107CFU/g(7.69 lg CFU/g)。本试验选取了1 000,2 000,3 000 mg/L的NaClO浸泡豆芽30 min,分别将豆芽中的菌落总数减少至1.2×107,2.9×105,1×105CFU/g。但绿豆芽中菌落数仍达到1×105CFU/g (5 lg CFU/g),远多于普通果蔬中的菌落数。经感官评价,3 000 mg/L的NaClO 处理绿豆芽会造成显著的化学性损伤,豆芽变软、变黄,汁液流失明显,货架期大大缩短。

图3 M1~M10 10种菌的系统发育树
采用不同浓度的AgNO3溶液清洗芽菜,结果表明5 mg/L的AgNO3溶液几乎没有消毒作用,15 mg/L的AgNO3溶液可以将菌落总数降低1.0~1.2 lg CFU/g,对豆芽消毒效果不显著。增加AgNO3浓度至25 mg/L,可将菌落总数降至3.8×105CFU/g(5.5 lg CFU/g),与对照相比降低了2.0~2.2 lg CFU/g,显示出Ag+具有一定的消毒效果,但效果次于NaClO。25 mg/L AgNO3溶液对豆芽外观有一定的影响,会使豆芽硬度和脆性降低。

图4 有效氯浓度的NaClO对绿豆芽的消毒效果

图5 AgNO3浓度对绿豆芽的消毒效果
2.4 消毒剂直接处理绿豆芽中细菌效果评价
由图6可知,2种消毒剂对每种菌的消毒效果明显,NaClO的消毒效果更优于AgNO3。3 000 mg/mL NaClO溶液可使离心管中的菌减少(4.5~5.5 lg CFU/mL),最后约剩1×103CFU/mL (3 lg CFU/mL)。特别是对M4Acinetobacterjunni的杀菌效果最强,最终残留量为2.9 lg CFU/mL。25 mg/mL AgNO3溶液处理,菌落数下降3 lg CFU/mL,相比于相同方法处理的新鲜绿豆芽,杀菌效果平均提高了2~3 lg CFU/g。说明存在于豆芽中的细菌比单独培养的模型对照组的同类细菌更难杀灭。
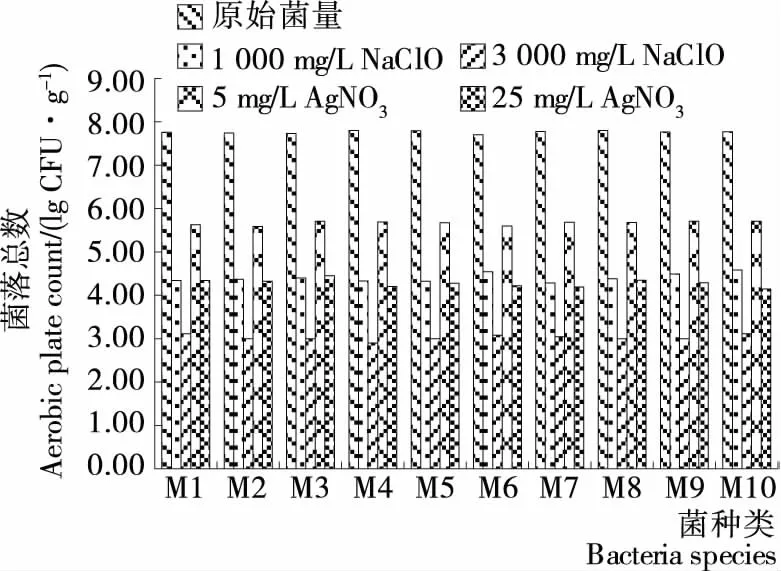
图6 不同消毒剂处理豆芽后菌落总数条形图
2.5 扫描电镜(SEM)观察结果
图7为子叶,大量菌体聚集在芽菜细胞表面。菌体与菌体之间,菌体与芽菜细胞之间多数呈丝状连接,丝状物分布广泛,局部区域丝状物连接成膜状。菌体表面也有大量的丝状或成膜状物覆盖、缠绕。图8为豆芽下胚轴,其表面微生物分布密集,数量远多于子叶部位。图8箭头所示部位是微生物已大量聚集。微生物之间和微生物与芽菜细胞之间也有大量的丝状物存在,丝状物的积累最后会成膜并包裹微生物。
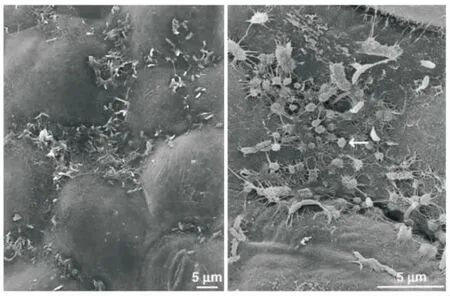
图7 绿豆芽子叶微生物SEM显微观察图

图8 绿豆芽下胚轴微生物SEM观察图
3 结论
绿豆芽中的微生物以克雷伯氏菌属和埃希氏菌属数量最多,二者均属于条件致病菌,处理不当将对人体健康造成危害。采用不同消毒剂进行浸泡消毒,可使豆芽中的细菌总数降低一定的数量,但仍然约有5 lg CFU/g。当采用同样的方法单独处理10种菌的培养物,最终可将的菌总数降到约3 lg CFU/mL,杀菌效果相比于含菌芽菜的处理有显著差异。通过扫描电镜直接观察豆芽表面微生物,可看到大量丝状物分布在微生物细胞之间,丝状物的积累形成厚实的膜状物,包裹着大量菌体。初步判断为细菌生物膜结构。
芽菜是一种较为脆弱的蔬菜,难以耐受高强度消毒剂的处理,而且微生物聚集成膜加大了消毒的难度。故为了有效降低芽菜的原始含菌量,温和有效地消除致病菌,而不破坏芽菜本身口感,提高芽菜的保鲜和安全性,需进一步探究其生物膜的特点及如何破坏芽菜表面导致细菌成膜的生物聚合基质。
[1] 李建英, 田中艳, 周长军, 等. 绿豆芽菜萌发条件及物质含量测定[J]. 黑龙江农业科学, 2010(7): 37-40.
[2] 雷昊, 谢晶. 新鲜蔬菜采后清洗、包装处理研究进展[J]. 食品与机械, 2016, 32(6): 215-219.
[3] 严灿, 刘升, 贾丽娥, 等. 蔬菜冷链物流技术研究进展[J]. 食品与机械, 2015, 31(4): 260-265.
[4] WEISS A, HERTEL C, GROTHE S, et al.Characterization of the cultivable microbiota of sprouts and their potential for application as protective cultures[J]. Systematic & Applied Microbiology, 2007, 30(6): 483-493.
[5] PIÉRARD D, GREVE H D, HAESEBROUCK F, et al. O157:H7 and O104:H4 Vero/Shiga toxin-producingEscherichiacoli, outbreaks: respective role of cattle and humans[J]. Veterinary Research, 2012, 43(1): 1-12
[6] 成黎. 新鲜蔬菜中的微生物污染危害、检测和控制方法研究进展[J]. 食品科学, 2015, 36(23): 347-352.
[7] 孔凡春, 陆胜民, 王群. 臭氧在果蔬保鲜和农残降解上的应用[J]. 食品与机械, 2003(5): 24-26.
[8] JIN H H, LEE S Y. Combined effect of aqueous chlorine dioxide and modified atmosphere packaging on inhibiting Salmonella Typhimurium and Listeria monocytogenes in mungbean sprouts[J]. Journal of Food Science, 2007, 72(9): 441-445.
[9] BARI M L, UKUKU D O, KAWASAKI T, et al. Combined efficacy of nisin and pediocin with sodium lactate, citric acid, phytic acid, and potassium sorbate and EDTA in reducing the Listeria monocytogenes population of inoculated fresh-cut produce[J]. Journal of Food Protection, 2005, 68(7): 1 381-1 387.
[10] YE Jian-xiong, KOSTRZYNSKA M, DUNFIELD K, et al. Control of Salmonella on sprouting mung bean and alfalfa seeds by using a biocontrol preparation based on antagonistic bacteria and lytic bacteriophages[J]. Journal of Food Protection, 2010, 73(1): 9-17.
[11] BARI M L, NAKAUMA M, TODORIKI S, et al. Effectiveness of irradiation treatments in inactivating Listeria monocytogenes on fresh vegetables at refrigeration temperature[J]. Journal of Food Protection, 2005, 68(2): 318-323.
[12] 许思笑, 马文娟. 人工模拟肠炎沙门氏菌在绿豆芽中的内化定殖能力及其消毒处理研究[J]. 现代食品科技, 2016(12): 93-98.
[13] 赵清风, 陈介南, 张林, 等. AgNO3对大肠杆菌和金黄色葡萄球菌的抗菌作用及机制[J]. 生物加工过程, 2011, 9(3): 52-56.
[14] 墙蔷, 倪红卫, 幸伟, 等. 银的抗菌作用机理[J]. 武汉科技大学学报, 2007, 30(2): 121-124.
[15] 刘重喜. 大豆根部内生放线菌的筛选、鉴定及其活性代谢产物研究[D]. 哈尔滨: 东北农业大学, 2013: 17-19.
[16] 费鹏, 白洪健, 程述震, 等. PCR-DGGE法分析婴儿肠道菌群多样性[J]. 食品与机械, 2013, 29(2): 60-63.
[17] FETT W F, COOKE P H. Scanning electron microscopy of native biofilms on mung bean sprouts[J]. Canadian Journal of Microbiology, 2003, 49(1): 45-50.
[18] BENDOUAH Z, BARBEAU J, HAMAD W A, et al. Biofilm formation byStaphylococcusaureus, andPseudomonasaeruginosa, is associated with an unfavorable evolution after surgery for chronic sinusitis and nasal polyposis[J]. Otolaryngology-Head and Neck Surgery, 2006, 134(6): 991-996.
Growth and distribution of microorganisms in the production of green bean sprouts and evaluation of disinfectant treatment
LUOXin
FULiang
HAOtian-yao
FANGLiang-yue
(DepartmentofFoodScienceandEngineering,JinanUniversity,Guangzhou,Guangdong510632,China)
The distribution of microbes in the process of green bean sprouts, and the treatment and effect of the two different types disinfectants were studied. The results showed that the total amount of microorganisms in the mung beans sprouts was 5.8 × 107CFU/g, and the microbial species were mainlyKlebsiella,Acinetobacter,EnterobacterandPseudomonas. The total amount of microorganisms in the mung bean sprouts was decreased to 1.0 × 105CFU/g when the effective chlorine concentration was 1 000~3 000 mg/L NaClO, while the model control group decreased to 1.0 × 103CFU/g. The effect of Ag+was worse than NaClO, but it also showed a similar law. Using the scanning electron microscopy(SEM)to observe the sprouts, the surface of microbes formed a visible biofilm, which significantly enhanced the tolerance of bacteria to disinfectants.
mung bean sprouts; microorganisms; identification of bacteria; disinfectant; biofilm
罗欣,女,暨南大学在读硕士研究生。
傅亮(1968—),男,暨南大学副教授,博士。 E-mail:tfuliang@jnu.edu.cn
2017—05—19
10.13652/j.issn.1003-5788.2017.07.011

