葡聚糖微柱离心法测定多西紫杉醇脂质体包封率影响因素考察
徐 缓, 韩 东,2, 汪晓婵, 高艺源, 王 倩, 孙 蕾
(1.辽宁师范大学 化学化工学院,辽宁 大连 116029; 2.大连市药品检验所,辽宁 大连 116029)
葡聚糖微柱离心法测定多西紫杉醇脂质体包封率影响因素考察
徐 缓1, 韩 东1,2, 汪晓婵1, 高艺源1, 王 倩1, 孙 蕾1
(1.辽宁师范大学 化学化工学院,辽宁 大连 116029; 2.大连市药品检验所,辽宁 大连 116029)
建立多西紫杉醇(Docetaxel,DOC)脂质体包封率的测定方法,利用高效液相色谱法测定DOC的含量.采用葡聚糖凝胶微柱离心法分离脂质体与DOC,系统考察不同因素对脂质体过柱率的影响,筛选最优方案进行DOC脂质体包封率的测定.结果表明:在1~60 mg/L的范围内DOC的浓度与峰面积线性关系良好(r=0.999 9).在离心力2 000 g、离心时间15 min、脂质体吸附20 min、预饱和脂质体用量150 μL、预饱和次数3次、脂质体上样量150 μL为测定DOC脂质体包封率的最佳条件.利用该方法测得DOC脂质体的包封率为(87.76±2.65)%,该方法简便快速,重复性好.
多西紫杉醇;脂质体;葡聚糖凝胶;微柱离心法;包封率
包封率是评价脂质体质量的重要指标之一,高包封效率可以避免后期分子生物学实验和动物实验对未包封药物和脂质体的进一步分离处理,此外,包封率测定存在误差会增加处方筛选阶段工作的烦琐性和不必要的浪费.因此准确的测定包封率的方法尤为重要.目前,葡聚糖微柱离心法以其分离速度快、对样品稀释倍数较小和操作简便等优点而备受关注[1-3],在利用葡聚糖微柱离心法测定脂质体包封率时通常会对游离药物过柱率、空白脂质体过柱率等进行考察,而脂质体吸附时间、空白脂质体对微柱的预饱和用量、微柱预饱和次数、离心时间、离心力等会影响包封率数值的因素少见详细的方法学考察.
紫杉醇因对乳腺癌、卵巢癌、肺癌等有良好的临床疗效[4],多西紫杉醇(Docetaxel,DOC)是紫杉醇的一种半合成产物,分子式为C43H53NO14,研究表明:与紫杉醇相比,DOC以较高的生物利用度、更为优异的广谱抗癌作用和更长的半衰期在临床上被广泛应用[5].由于DOC水溶性差,给药时需使用吐温80和乙醇作为复合溶媒助溶,该溶剂系统在使用时易引起许多不良反应,如过敏反应和溶血等[6],因此使用前需服用抗过敏药物,给患者带来极大的不便和痛苦.目前,以脂质体作为DOC的递送载体的研究较多[7-8],本研究以空白脂质体和DOC脂质体为模型,拟对上述影响脂质体包封率测定的因素进行综合评价,筛选出合适的测定DOC脂质体包封率的测定方法,为DOC脂质体包封率的测定提供参考.
1 实验部分
1.1 试剂与仪器
DOC(北京华奉联博科技有限公司);大豆磷脂(上海艾伟特科技有限公司);胆固醇(Biosharp公司,日本);曲拉通(Triton X100,国药集团化学试剂有限公司);葡聚糖凝胶(Sephadex G-25,北京梦怡美生物科技有限公司);氯仿、甲醇(Methanol)、磷酸二氢钠、磷酸氢二钠(天津市科密欧化学试剂有限公司).
FA1204B电子天平、752N紫外可见分光光度计(上海精密科学仪器有限公司);DF-101S恒温加热磁力搅拌器(予华仪器有限责任公司);JY92-2D超声波细胞破碎仪(宁波新芝生物科技有限公司);KQ5200B型高功率数控超声波清洗器(昆山市超声仪器有限公司);LC-100高效液相色谱仪(上海伍峰科学仪器有限公司);SC-05离心机(安徽中科中佳科学仪器有限公司);移液枪(Thermo Fisher Scientific,上海).
1.2 DOC含量测定方法的建立
1.2.1 DOC含量测定色谱条件 利用LC-100高效液相色谱仪采用外标法测定DOC的含量,色谱条件如下:色谱柱:C18反相色谱柱(200 mm×4.6 mm,5 μm,大连伊利特分析仪器有限公司);流动相:乙腈-水(55∶45,V∶V);检测波长:230 nm;流速:1 mL/min;进样量:20 μL;柱温:室温.
1.2.2 方法专属性实验 分别取0.1 mL空白脂质体和DOC脂质体,以甲醇稀释至5 mL,即可得到澄清溶液,过0.45 μm微孔滤膜,得到破乳的空白脂质体和DOC脂质体.分别移取20 μL甲醇、甲醇破乳的空白脂质体、DOC标准品溶液和甲醇破乳的DOC脂质体溶液,HPLC进样检测,记录样品峰面积.
1.2.3 DOC标准曲线的绘制 取适量DOC母液,甲醇逐级稀释得到1、10、20、30、40、50、60 mg/L 浓度的DOC标准溶液,进样20 μL检测样品峰面积,以浓度为横坐标、峰面积为纵坐标得到DOC的标准曲线.
1.2.4 精密度试验和回收率试验 移取适量DOC母液配制1、30、60 mg/L DOC溶液,于1 d中1、3、5、7、9 h进样检测得到日内的相对标准偏差(RSD)(n=3).另外于第1、2、3、4、5天进样测定峰面积计算日间RSD(n=3).分别移取适量1、30、60 mg/L的DOC溶液于2 mL容量瓶中,再分别向其中加100 μL空白脂质体,甲醇稀释至刻度后充分混匀,每个样品取20 μL进样检测(n=3),记录峰面积,根据外标一点法计算回收率.
1.3 脂质体的制备
薄膜分散的方法制备脂质体,称取m(大豆卵磷脂)∶m(胆固醇)=3∶1,置入茄形瓶内,加5 mL 氯仿(含或不含DOC,药脂比为1∶20,m∶m),于37 ℃水浴中减压旋转蒸发完全除掉溶剂.加入适量PBS(pH 7.4)手摇水化得到大单室脂质体,进一步利用细胞粉碎仪探头超生工艺(200 W/2 min、400 W/2 min、600 W/4 min)对粗分散脂质体进行处理后,利用0.45、0.22 μm的微孔滤膜整粒,分别得到空白脂质体和DOC脂质体,置于4 ℃冰箱备用.
1.4 葡聚糖凝胶柱测定DOC脂质体包封率的方法学考察
1.4.1 葡聚糖凝胶微柱的制备 取2.5 mL注射器去掉内芯,剪下合适大小的垫片垫入其中,将浸泡好(去离子水中室温浸泡24 h)的Sephadex G-25分少量多次加入其中,直至加满注射器并且下端不再有水流下,静置一段时间后放入低速离心机,离心力设定为1 000 g离心5 min,得到高度约2 cm的独立凝胶柱即可[2-3].
1.4.2 离心力对空白脂质体过柱率的影响 移取100 μL空白脂质体,逐滴加入到已预饱和的Sephadex G-25柱顶端,静置吸附20 min,然后以不同离心力(1 000、1 500和2 000 g)离心15 min,收集滤液于5 mL容量瓶中,以水定容利用紫外分光光度计在波长450 nm处测定吸光度,记为A;另移取空白脂质体100 μL,直接以水稀释至5 mL,在450 nm波长处测定吸光度,记为A0.利用公式(1)计算过柱率.

(1)
1.4.3 离心时间对空白脂质体过柱率的影响 移取100 μL空白脂质体2份,1份逐滴加到已预饱和的Sephadex G-25柱顶端,静置吸附10 min,设定离心力为2 000 g,离心不同时间(5、10、15、20、30 min)后收集溶液,去离子水洗涤离心管,洗液一并加入5 mL容量瓶定容,涡旋混匀,在波长450 nm处测定吸光度,记为A;另1份直接以水稀释至5 mL,在450 nm波长处测定吸光度,记为A0,利用公式(1)计算过柱率.
1.4.4 脂质体吸附时间的考察 将加满Sephadex G-25的微柱分成4组,移取100 μL空白脂质小心加于凝胶柱顶端,静置5 min,放置低速离心机中配平离心5 min,预饱和凝胶柱.另移取2份100 μL空白脂质体,其中,1份置于5 mL的容量瓶中定容,混匀,于紫外分光光度计在450 nm波长条件测定其吸光度,记为A0;另1份加至Sephadex G-25 微柱顶端,分别吸附不同时间(5、10、20、30 min),离心力设定为2 000 g,离心15 min,用移液枪将离心液小心转入5 mL的容量瓶中,洗涤离心管3次,洗液一并加入容量瓶,最后以去离子水定容,混匀,450 nm波长处测定其吸光度,记为A.利用公式(1)计算过柱率.
1.4.5 Sephadex G-25对空白脂质体的吸附 移取空白脂质体50、100、150、200 μL各2份.1份置于5 mL的容量瓶中定容,混匀,于紫外分光光度计450 nm波长处测定其吸光度,记为A0;另1份加至预饱和Sephadex G-25微柱的顶端,于2 000 g离心15 min后,将离心液转移至5 mL 容量瓶中,少量水洗涤离心管3次,洗液一并加入容量瓶,最后以水定容,充分混匀,450 nm波长处测定其吸光度,记为A,继续滴加100 μL PBS(pH 7.4)至Sephadex G-25微柱顶端,测定方法同上,重复洗涤5次,分别记录吸光度为A1、A2、A3、A4和A5.
1.4.6 预饱和空白脂质体用量考察 取体积为50、100、150、200 μL的空白脂质体各1份,小心滴加到Sephadex G-25柱顶端.上样后的Sephadex G-25柱静置5 min,其后以2 000 g离心力配平后离心3 min(预饱和凝胶柱).另取100 μL空白脂质体若干份,分别加到不同体积空白脂质体预饱和的Sephadex G-25柱顶端,静置5 min后放入离心机配平后2 000 g离心15 min,少量水洗涤离心管3次,合并洗液至容量瓶内,以水稀释至刻度,以紫外分光光度计在450 nm处测定其吸光度,记作A.另1份100 μL脂质体混悬液直接转移到5 mL容量瓶中定容,同法测定吸光度,记为A0,利用公式(1)计算过柱率.
1.4.7 空白脂质体预饱和Sephadex G-25柱次数的考察 取空白脂质体100 μL 2份:1份直接置于5 mL量瓶中,稀释至刻度,混匀,于450 nm波长处测定其吸光度,即为A0;另1份样品小心加至Sephadex G-25微柱的顶端,设定离心力为2 000 g,离心15 min.然后将管内液体小心转移至5 mL容量瓶中,去离子水洗涤离心管3次,合并洗液至容量瓶内,以水稀释至刻度,充分混匀,于450 nm波长处测定其吸光度,即为A.继续滴加空白脂质体100 μL至SephadexG-25微柱顶端,同法测定,重复上样空白脂质体5次,平行操作3次.
1.4.8 脂质体上样量对其过柱率的影响 移取体积为50、100、150 μL的空白脂质体各2份,1份小心滴加到已预饱和的Sephadex G-25柱顶端.将上样后的凝胶柱静置10 min,设定离心力为2 000 g,离心15 min,然后将管内的脂质体混悬液合并于5 mL容量瓶定容,在波长450 nm处测定吸光度,记为A.另1份脂质体混悬液直接以水稀释至5 mL,在450 nm波长条件下测定吸光度,记为A0.根据公式(1)计算空白脂质体的过柱率.
1.4.9 凝胶柱对DOC的吸附考察
取40、50、60 mg/L的DOC溶液各2份,移取100 μL不同浓度的DOC溶液以甲醇定容到5 mL,通过HPLC测定峰面积记为AP0.另取100 μL不同浓度的DOC溶液滴加到Sephadex G-25柱顶端.将上样后的Sephadex G-25柱静置适当时间,其后以2 000 g离心力配平后离心15 min,将离心管内的混合液以甲醇定容到5 mL,通过高效液相色谱测定峰面积记为AP(n=3),根据公式(2)计算游离DOC的过柱率.
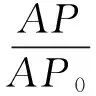
(2)
1.5 DOC脂质体包封率的测定
移取100 μL DOC脂质体2份.1份DOC脂质体直接定容到2 mL,涡旋混匀,移取20 μL进样,记录峰面积并计算浓度记为c0;另1份小心滴加到150 μL空白脂质体预饱和后的 Sephadex G-25柱顶端,缓慢滴液勿使脂质体混悬液冲散凝胶柱.上样后吸附20 min,设定离心力为2 000 g时间20 min,离心后将管内的混合液小心移入2 mL容量瓶中,洗涤离心管2~3次后定容,移取20 μL进样检测,记录峰面积并计算浓度记作c(n=3),根据公式(3)计算DOC脂质体包封率.
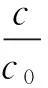
(3)
2 结果与讨论
2.1 DOC含量分析方法建立
2.1.1 方法专属性 由图1B可知,在230 nm检测波长下DOC的保留时间为5.31 min,峰形良好.根据甲醇(图1A)、空白脂质体(图1C)和DOC脂质体(图1D)色谱图判断溶剂和脂质体对DOC的含量测定无干扰.
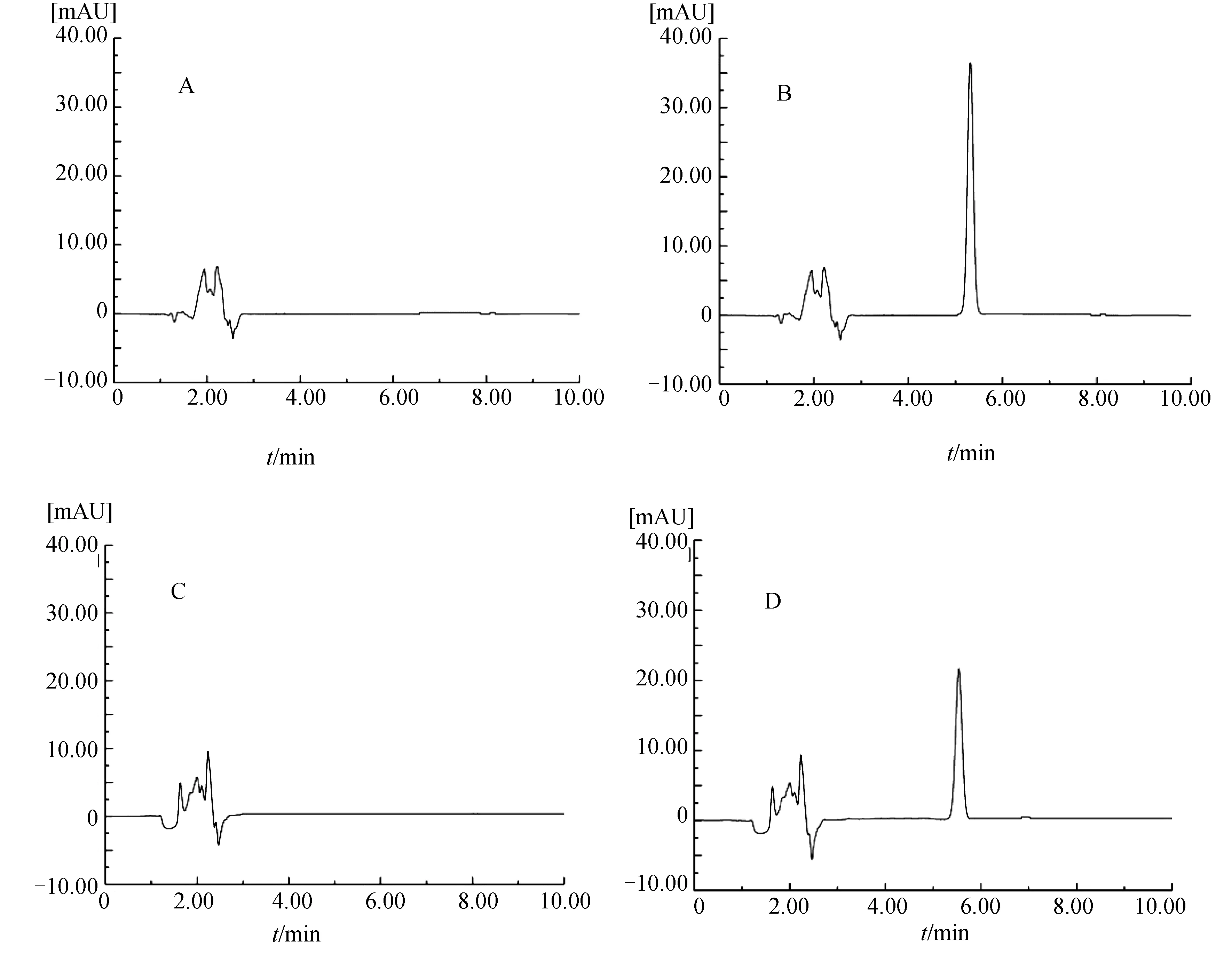
图1 DOC的HPLC专属性A 甲醇;B DOC溶液;C 空白脂质体;D DOC脂质体Fig.1 The HPLC specificity of DOCA Methanol;B DOC standard;C Blank liposomes;D DOC liposomes
2.1.2 DOC标准曲线的绘制 经计算DOC标准曲线回归方程为y= 17.069x+ 17.553(r= 0.999 9),DOC的浓度(x)和峰面积(y)呈线性相关,表明浓度在1~60 mg/L的范围内DOC的浓度和峰面积线性关系良好.
2.1.3 精密度和回收率试验结果 DOC溶液日间、日内RSD值均小于1%,符合含量测定要求.回收率试验结果表明:不同浓度DOC溶液回收率的RSD值均低于1%,证明脂质体DOC回收率良好.
2.2 葡聚糖凝胶微柱离心法测定DOC脂质体影响因素考察结果
2.2.1 不同离心力对空白脂质体过柱率的影响 不同离心力对空白脂质体过柱率的影响情况见表1,由表可知随着离心力的增加,空白脂质体的过柱率明显增加,当离心力提高到2 500 g时,Sephadex G-25微柱被严重破坏,为了尽量增加过柱率而不破坏凝胶柱,所以选择离心力为2 000 g.
2.2.2 不同离心时间对其过柱率的影响 不同离心时间对脂质体过柱率的影响情况见表2.由表可知随着离心时间增加,空白脂质体过柱率随之增加,离心时间为15 min过柱率接近100%,当离心时间超过20 min,过柱率变化不大,离心20 min后吸光度大于柱前的吸光度可能的原因是预饱和的脂质体也被离心下来导致吸光度数值远大于未过Sephadex G-25柱的空白脂质体的吸光度值.因此15 min的离心时间即可保证将全部脂质体吸脱下来.
表1 不同离心力对空白脂质体过柱率的影响(n=3)
Table 1 Passing rate of blank liposome under different centrifugal force(n=3)

离心力/g过柱率/%100054.55±2.23150069.70±3.752000104.04±5.78
表2 不同离心时间对空白脂质体过柱率的影响(n=3)
Table 2 Passing rate of blank liposome under different centrifugal time(n=3)
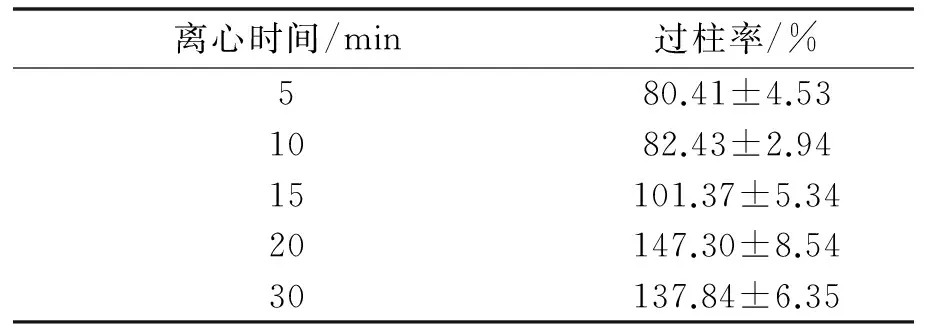
离心时间/min过柱率/%580.41±4.531082.43±2.9415101.37±5.3420147.30±8.5430137.84±6.35
2.2.3 药物在Sephadex G-25微柱吸附时间的考察 制备Sephadex G-25凝胶柱,考察脂质体吸附时间对空白脂质体过柱率的影响,结果见表3,由表可知空白脂质体过柱率随吸附时间的延长而增加,当吸附超过20 min时,空白脂质体的过柱率即可达到100%,故选择最佳的吸附时间为20 min.
2.2.4 Sephadex G-25对空白脂质体的吸附 Sephadex G-25对空白脂质体的吸附作用见表4.由表可知虽然Sephadex G-25柱对空白脂质体有一定的吸附性,但一次离心即可洗脱下94%以上的空白脂质体,上样量并未明显影响Sephadex G-25对空白脂质体的吸附行为.

表4 Sephadex G-25对空白脂质体的吸附考察(n=3)
2.2.5 预饱和Sephadex G-25柱的空白脂质体用量的考察 空白脂质体预饱和用量结果见表5,由表可知随着预饱和用量的增加,过柱率增加,当用量大于150 μL过柱率不再增加,Sephadex G-25柱对空白脂质体的吸附达到饱和,故预饱和用量选择150 μL.
2.2.6 空白脂质体预饱和凝胶柱次数的考察 预饱和次数实验结果见表6,由表可知预饱和3次时,吸光度值与未过柱的空白脂质体最接近,说明预饱和3次,Sephadex G-25柱对空白脂质体的吸附达到充分饱和,实验确定空白脂质体预饱和3次.

表5 空白脂质体预饱和Sephadex G-25用量考察(n=3)

表6 预饱和凝胶柱次数的考察(n=3)
2.2.7 空白脂质体上样量对其过柱率的影响 脂质体上样量的影响见表7,由表可知上样量对脂质体的过柱率有一定影响但并不明显,当脂质体上样量增加,过柱率随之略有增加,根据实验结果综合分析最终选择上样量为150 μL.

表7 空白脂质体上样量对其过柱率的影响(n=3)
2.2.8 游离DOC过柱率的考察 Sephadex G-25对DOC的吸附结果见表8,由表可知低、中、高3种浓度的DOC溶液过柱后过柱率均接近于0,表明葡聚糖凝胶柱对游离的DOC溶液有很好的截留作用并且与溶液浓度无相关性.

表8 DOC的过柱率(n=3)
2.3 DOC脂质体包封率的测定
根据以上优选结果,利用Sephadex G-25测定DOC脂质体的包封率,操作条件为:150 μL空白脂质体预饱和Sephadex G-25柱3次,上样150 μL,离心力设为2 000 g,离心时间15 min.最终测定的DOC脂质体的包封率为(87.76±2.65)%.
3 结 论
葡聚糖凝胶微柱离心法是利用分子筛原理,较小的分子在柱中停留时间比大分子停留的时间要长,于是小分子药物截留在葡聚糖凝胶的时间较长,粒径大的脂质体分子则从凝胶空隙先流入到离心管中,因此离心管中得到的脂质体混悬液是去除游离药物的载药脂质体[1].为了得到更准确的实验结果,收集离心管中的脂质体混悬液后洗涤离心管2~3次,合并洗液.
准确测定包封率的关键在于选择准确的测定方法,对离心力、离心时间、脂质体的上样量、吸附时间等影响包封率准确性的因素进行了系统的考察,最终确定最佳的测定DOC脂质体包封率的条件,得到精确并且重复性好的测定结果,使葡聚糖微柱离心法测定脂质体包封率更加规范和标准,为脂质体等纳米药物递送系统包封率的测定提供参考.
[1] 托尔钦林V P,魏西希V.脂质体[M].邓意辉,徐晖,译.北京:化学工业出版社,2007:21-22.
[2] 陈建霞,徐缓,于涛,等.微柱离心-紫外分光光度法测定超氧化物歧化酶模拟物脂质体的包封率[J].中国新药杂志,2011,20(10):928-931.
[3] 耿思聪,龚昊宇,许航,等.微柱离心法测定克拉霉素离子对脂质体注射液的包封率[J].中国药剂学杂志,2016,1(3):18-25.
[4] 赫春香,赵静,何长涛.紫杉醇与牛血清白蛋白的相互作用研究[J].辽宁师范大学学报(自然科学版),2010,33(4):465-468.
[5] CROWN J,O′LEARY M.The taxanes:an update[J].The Lancet,2000,355(9210):1176-1178.
[6] HOANG B,ERNSTING M J,MURAKAMI M,et al.Docetaxel carboxymeth ylcellylose nanoparticles display enhanced anti-tumor activity in murine models of castration-resistant prostate canver[J].International Journal of Pharmaceutics,2014,471(12):224-233.
[7] PEREIRA S,EGBU R,JANNATI G.Docetaxel-loaded liposomes:The effect of lipid composition and purification on drug encapsulation and in vitro toxicity[J].International Journal of Pharmaceutics,2016,514(1):150-159.
[8] NAIK S,PATEL D,SURTI N,et al.Preparation of PEGylated liposomes of docetaxel using supercritical fluid technology[J].The Journal of Supercritical Fluids,2010,54(1):110-119.
Studyonthethefactorsaffectingtheencapsulationefficiencyofdocetaxelliposomesbysephadexmicrocolumncentrifugationmethod
XUHuan1,HANDong1,2,WANGXiaochan1,GAOYiyuan1,WANGQian1,SUNLei1
(1.School of Chemistry and Chemical Engineering, Liaoning Normal University, Dalian 116029, China; 2.Dalian Institute for Drug Control, Dalian 116029, China)
A method for determining the encapsulation efficiency (EE) of Docetaxel (DOC) liposomes was established.The concentration of DOC was determined by high performance liquid chromatography (HPLC).The liposomes and DOC were separated by Sephadex microcolumn centrifugation.The different influencing factors of the passing rate of liposomes were investigated.The results showed that the HPLC method had good linearity in the range of 1~60 mg/L (r=0.999 9).The 2 000 g of centrifugal force,15 min of centrifugal time,20 min of liposomal adsorption,150 μL of pre-saturated amount,3 times of pre-saturation,150 μL of loading amount were identified as the optimal protocol to determine the EE of DOC liposomes and the results of EE was (87.76±2.65)%.This method is technically simple,rapid and reproducible.
docetaxel;liposomes;sephadex;microcolumn centrifugation;encapsulation efficiency
徐缓(1978- ),女,辽宁铁岭人,辽宁师范大学副教授,博士.E-mail:huan.xu1@163.com
R93.4
:A
2017-04-24
国家自然科学基金资助项目(81102394);辽宁省自然科学基金资助项目(20170540575);辽宁省大学生创新创业训练计划项目(201610165000015)
1000-1735(2017)03-0342-07
10.11679/lsxblk2017030342

