叶黄素与玉米黄质协同抗氧化活性的研究
,,,,
(1.大连海洋大学食品科学与工程学院,辽宁大连 116023;2.大连医诺生物有限公司,辽宁大连 116600)
叶黄素与玉米黄质协同抗氧化活性的研究
任丹丹1,2,张海丽1,王惜童1,薛凌云2,吴文忠2
(1.大连海洋大学食品科学与工程学院,辽宁大连 116023;2.大连医诺生物有限公司,辽宁大连 116600)
叶黄素和玉米黄质是人类眼睛中主要的类胡萝卜素,它们对预防眼部疾病具有重要作用。本文通过研究不同比例的叶黄素和玉米黄质在体内和体外的抗氧化活性,探讨其协同抗氧化活性,为复合类胡萝卜素产品的开发提供理论依据。通过DPPH自由基清除体系、FRAP法和ORAC法三种方法探讨了叶黄素和玉米黄质之间的体外协同抗氧化活性。通过建立ICR小鼠体内乙醇氧化损伤模型,考察叶黄素和玉米黄质在体内的协同抗氧化活性。结果表明:叶黄素与玉米黄质以1∶2比例存在时体外协同抗氧化效果最佳,2∶1效果较差。叶黄素/玉米黄质(1∶2)组在各个指标上显示出更强的体内抗氧化活性。
叶黄素,玉米黄质,协同抗氧化
类胡萝卜素是一类具有多个共轭双键的萜烯基团的化合物,迄今已发现了700多种类胡萝卜素。流行病学调查,动物体内实验及细胞实验结果均表明,类胡萝卜素具有较强抗癌、抗辐射和预防心血管疾病等作用[1]。类胡萝卜素的这些保护作用都直接或间接地与其抗氧化作用有关。有些类胡萝卜素在人体组织器官中发挥重要作用,如叶黄素和玉米黄质是视网膜黄斑的组成成分。临床研究发现摄入叶黄素可以提高黄斑的色素含量,而且能够提高老年性黄斑衰退症(AMD)病人的视力[2],由于叶黄素能够清除自由基并且能够吸收蓝光,进而可以预防白内障和防止对眼睛的损伤,而叶黄素与玉米黄质以适宜的比例存在,对视力的保护效果更好[3-4]。因此,研究叶黄素与玉米黄质的协同抗氧化效果对更进一步深入研究叶黄素与玉米黄质对视网膜的保护作用具有重要意义。本文将从体内外两个方面,研究不同比例叶黄素和玉米黄质产品的协同抗氧化活性,旨在为类胡萝卜素产品的开发应用提供理论依据。
1 材料与方法
1.1材料与仪器
叶黄素 冷水可溶(Cold water soluble,简称CWS);CWS5%微囊粉,玉米黄质CWS5%微囊粉,维生素E 大连医诺生物有限公司;SPF级雄性ICR小鼠 体质量18~22 g,80只,大连医科大学实验动物中心;BCA 蛋白浓度检测试剂盒、谷胱甘肽(GSH)试剂盒、蛋白质羰基(POC)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-PX)试剂盒、丙二醛(MDA)试剂盒 南京建成生物工程研究所;实验所用各种试剂及药品 国产分析纯。
FE20 pH计、AL204型电子天平 梅特勒-托利多仪器有限公司;SynergyH1酶标仪 美国博腾仪器有限公司;SHA-BA水浴恒温振荡器 金坛市顺华仪器有限公司;CR22G 型高速冷冻离心机 日立公司;低温高速离心机 Thermo Fisher公司;HH-4型显数恒温水浴锅 常州国华电器有限公司;PE Lambda25紫外可见分光光度计 PerkinElmer Co.。
1.2实验方法
1.2.1 类胡萝卜素对DPPH自由基的清除作用 参照熊双丽和恽祥慧[5-10]等报道的方法,稍加改动后应用于96孔板中。依次在酶标板的每孔中加入40 μL不同浓度维生素E或样品液和160 μL 0.12 mmol/L的DPPH乙醇溶液。在25 ℃条件下反应30 min后,在517 nm下用酶标仪测定其吸光度。采用样品溶剂代替样品作为对照组,无水乙醇替代DPPH溶液作为样品空白组。样品清除率计算公式如下:
DPPH自由基清除率(%)=[A0-(A1-A2)]/A0×100
式中:A0,A1,A2分别代表对照(不加样)、样品和样品空白(不加DPPH)测出的吸光度。
1.2.2 类胡萝卜素对铁离子的还原能力(FRAP) 参照Benzie和恽祥慧[6,11-13]等报道的方法,稍加改动后应用于96孔板中进行实验,即新鲜配制150 μL 2,4,6-三吡啶基三嗪(TPTZ)工作液与5 μL不同浓度FeSO4(0.1~1.6 mmol/L)的标准溶液混合于96孔板中,以蒸馏水作为空白对照,将96孔板置于酶标仪中振摇1 min后,在37 ℃下温育40 min,593 nm处测定其吸光度并绘制浓度与吸光度的标准曲线。以类胡萝卜素样品溶液代替FeSO4标准溶液即可测得样品吸光度值的变化,然后在标准曲线上求得FRAP值。样品的铁离子还原能力(FRAP值)以达到相同吸光度所需FeSO4的毫摩尔数表示。
1.2.3 类胡萝卜素的氧自由基吸收能力(ORAC) 参照李红艳和王晓宇[14-19]等报道的方法并稍加改动进行实验。在96孔板中依次加入25μL不同浓度的标准抗氧化剂(Trolox)溶液和150 μL荧光素钠盐溶液(0.0861 nmol/L),然后将96孔板放入荧光酶标仪中,用gene5软件编程操作,37 ℃预热10 min后,迅速加入AAPH溶液25 μL(153 mmol/L),持续振荡,在激发波长485 nm,发射波长538 nm下用荧光酶标仪测定。初始荧光强度值记为F0,每2 min测定一次各孔荧光强度(Fn),荧光衰减呈基线后停止(本实验与设定时间为2.5 h)。设定空白对照,即用缓冲液代替抗氧化剂作为对照(+AAPH)。
通过gene5软件将实验所得各微孔反应的荧光强度数据输出到Excel表格中进一步处理。各微孔不同时间点的绝对荧光强度数据与初始荧光强度(F0)的比值即为相对荧光强度fi;再根据以下公式计算衰减曲线下的面积及保护面积(NetAUC),以Trolox浓度为横坐标,保护面积NetAUC为纵坐标绘制标准曲线。
AUC=2×(f0+f1+…+fn-1+fn)-f0-fn
注:初始相对荧光强度即为f0,每隔2 min测定一次,相对荧光强度分别记为f0,f2…fn。
保护面积NetAUC=AUC抗氧化剂-AUC+AAPH
按照Trolox标准曲线的绘制中所述方法,以类胡萝卜素产品代替Trolox标准抗氧化剂溶液,测定一定浓度下保护面积。将样品在自由基作用下荧光衰退曲线的延缓部分面积(NetAUC)代入标准抗氧化物质Trolox的NetAUC与Trolox浓度所绘制的标准曲线,得出与各样品浓度的氧自由基清除能力等价的Trolox浓度,再转换成以μmol Trolox当量/g类胡萝卜素表示(μmol Trolox/g)即ORAC值。
1.2.4 类胡萝卜素对乙醇氧化损伤模型小鼠抗氧化作用 将70只雄性ICR小鼠随机分为7组,每组10只。分别为空白对照组,模型对照组,阳性对照组(天然VE),叶黄素CWS微囊粉、玉米黄质微囊粉、叶黄素与玉米黄质不同比例混合组,各组均用0.5% CMC-Na溶解。分组与剂量见表1。各组动物适应性喂养3 d后以基础饲料喂养,样品组每天分别灌胃不同剂型叶黄素产品和玉米黄质受试样品,连续灌胃30 d。末次灌胃后,模型对照组和各样品剂量组一次性灌胃50%乙醇12 mL/kg·BW,空白对照组灌胃等量蒸馏水,6 h后小鼠摘眼球取血,收集血液,颈椎脱臼处死小鼠。

表1 分组与剂量Table 1 The group and dosage
将小鼠血液在3500 r/min,4 ℃下离心10 min,取血清,用试剂盒测定血清中GSH、MDA含量以及GSH-PX、SOD活力。取肝右叶组织制成10% 肝组织匀浆,用试剂盒测定GSH、SOD、GSH-Px、MDA和蛋白质羰基各指标。
1.3数据处理

2 结果与分析
2.1对体外DPPH·清除效果比较
叶黄素与玉米黄质产品之间协同对DPPH·清除效果如表2所示。

表2 不同比例的叶黄素与玉米黄质组合对DPPH·清除效果Table 2 The scavenging DPPH· activity of lutein and zeaxanthin with different combination
注:通过LSD和Student-Newma-Keuls法进行多重比较,同列上标不同小写字母表示有显著差异(p<0.05),未标明字母表示组间无显著性差异(p>0.05)。表3、表4同。
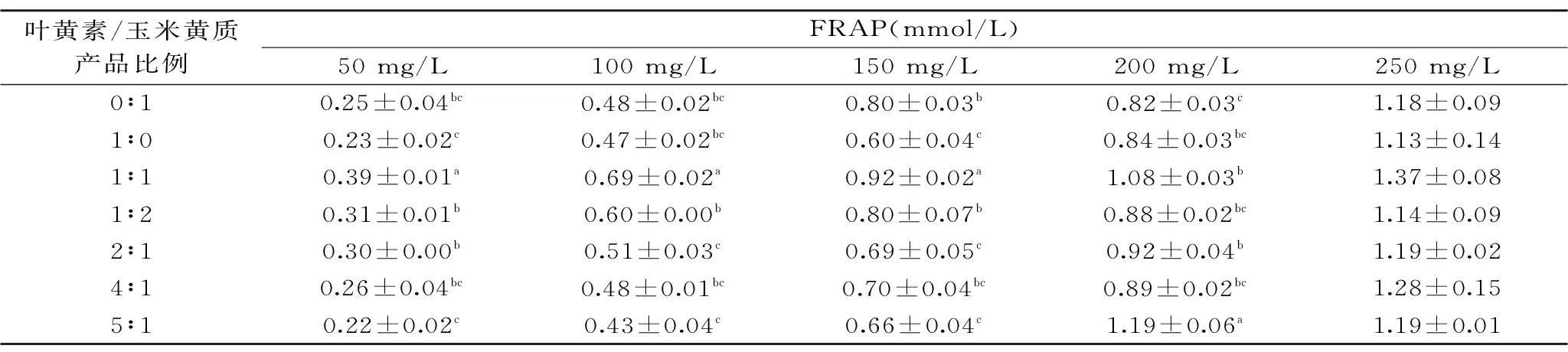
表3 不同比例的叶黄素与玉米黄质组合对铁离子的还原能力Table 3 The ferric reducing ability of lutein and zeaxanthin with different combination

表4 不同比例的叶黄素与玉米黄质组合ORAC值Table 4 The ORAC value of lutein and zeaxanthin with different combination
从表2中可看出,当叶黄素与玉米黄质分别以5∶1、4∶1、2∶1、1∶1和1∶2的比例组合存在时,均具有DPPH自由基清除能力。各组产品对DPPH自由基的清除效果随着浓度增加而增大。在同一水平浓度下,叶黄素与玉米黄质混合组的清除效果优于其单一产品的清除效果。综合不同比例及不同浓度的清除效果,叶黄素与玉米黄质产品以1∶2比例存在时,其DPPH·清除效果最佳,1∶1次之,2∶1较差。
2.2对铁离子还原能力比较
叶黄素与玉米黄质产品协同对铁离子还原能力的结果如表3所示。
从表3中可看出,当叶黄素与玉米黄质以不同比例混合时,均具有对铁离子还原的能力。各组产品对铁离子还原能力随浓度增加而增大,且混合组对铁离子还原能力优于其以单一产品。综合不同比例及不同浓度样品对铁离子还原效果,叶黄素与玉米黄质产品以1∶1比例存在时对铁离子还原能力最佳,1∶2次之,4∶1和5∶1较差。
2.3对氧自由基吸收能力的比较
叶黄素与玉米黄质产品协同对氧自由基吸收能力的结果如表4所示。
从表4中可看出,单一产品叶黄素与玉米黄质以及混合产品均具有较强的氧自由基吸收能力,但玉米黄质的氧自由基吸收能力明显高于叶黄素产品(p<0.05)。各混合比例组中,1∶2、4∶1与5∶1组的效果显著优于叶黄素产品(p<0.05),而这三组与玉米黄质相比,仅有1∶2组的效果具有显著性差异(p<0.05)。综合比较,叶黄素与玉米黄质产品以1∶2比例组合时,其ORAC值较高;而1∶1和2∶1组合的效果相对较差。
综合以上叶黄素与玉米黄质体外抗氧化的实验结果,在后续实验中,选用协同效果较好的1∶2组合,以及协同效果较差的2∶1组合进行动物体内实验。
2.4叶黄素和玉米黄质对ICR小鼠血清抗氧化水平的影响
叶黄素和玉米黄质对小鼠血清中各指标的影响见表5。
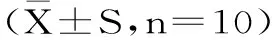
表5 各组产品对小鼠血清SOD、GSH、GSH-Px和MDA的影响Table 5 Effects of different carotenoids group on SOD、GSH、GSH-Px and MDA in mice serum(±S,n=10)
注:与空白对照组相比,a为差异显著(p<0.05),b为差异极显著(p<0.01);与模型对照组相比,A为差异显著(p<0.05),B为差异极显著(p<0.01)。表6同。

表6 各组产品对小鼠肝组织SOD、GSH、GSH-Px、MDA和PCO的影响Table 6 Effects of different groups on SOD、GSH、GSH-Px、MDA and PCO in mice liver tissue(±S,n=10)
从表5可看出,给予实验剂量(50%乙醇12 mL/kg·BW)乙醇造模,模型对照组与空白对照组相比,小鼠血清SOD和GSH-Px活性下降且差异极显著(p<0.01),GSH含量降低、MDA含量升高且差异极显著(p<0.01),由此说明乙醇氧化损伤模型造模成功。与模型组相比,各实验组均能显著降低小鼠血清MDA含量(p<0.01),增加GSH水平(p<0.01),同时还能增加小鼠体内的GSH-Px酶活(p<0.01)和SOD酶活(p<0.01),说明叶黄素、玉米黄质以及叶黄素与玉米黄质混合样品对乙醇氧化损伤ICR小鼠有较好的抗氧化作用。在叶黄素与玉米黄质混合组中,叶黄素/玉米黄质(1∶2)组显示出比叶黄素/玉米黄质(2∶1)更优越的抗氧化性能。
2.5叶黄素与玉米黄质产品对ICR小鼠肝脏抗氧化水平的影响
各组产品对ICR小鼠肝脏抗氧化水平的影响,如表6所示。
给予实验剂量(50%乙醇12 mL/kg·BW)乙醇造模,模型对照组与空白对照组相比,结果发现小鼠肝脏组织SOD和GSH-Px活性下降且差异极显著(p<0.01),GSH含量降低且差异显著(p<0.05),MDA和蛋白质羰基含量升高且差异极显著(p<0.01)。与模型组相比,各实验组均能降低小鼠组织MDA和PCO含量(p<0.01),增加GSH水平(p<0.01),同时还能够增加小鼠体内的GSH-Px酶活(p<0.05)和SOD酶活(p<0.01),表现出较好的体内抗氧化活性。在叶黄素与玉米黄质混合组中,叶黄素/玉米黄质1∶2组的抗氧化效果较好,优于单一形式存在的产品以及叶黄素/玉米黄质2∶1组,这与之前的体外抗氧化活性实验结果一致。
3 结论与讨论
视网膜内除含有很多对光敏感的化合物外,还含有如DHA等的易氧化底物。视网膜上的光敏物质在有光照刺激的情况下会发生氧化反应,生成对视网膜色素上皮细胞有毒性的物质,而该物质是老年性黄斑变性发生的主要因素之一。另外,视网膜内还分布着大量的毛细血管,这使得其氧浓度很高。晶状体聚焦可产生高强度、高能量的光线,而光线很容易在视网膜中诱发能与含双键分子(如DHA)发生反应的单线态氧自由基,二者发生后会进一步引发能使视网膜受到氧化损伤的脂质过氧化链式反应[20-21]。叶黄素和玉米黄质是视网膜黄斑的组成成分[22]。
叶黄素与玉米黄质在结构上互为同分异构体,差别仅为其中一个紫罗酮环的双键位置不同。叶黄素的这个双键形成烯丙基羟基末端,而玉米黄质中相应的双键则与相邻直链双键形成共轭体系。在抗氧化活性方面,两者在不同的抗氧化指标中效果有所不同,这可能与两者的活性基团及双键位置在氧化过程中所起到的作用不同有关。不同比例进行混合后,仍然呈现出不同的抗氧化效果,说明叶黄素与玉米黄质的抗氧化协同作用与其配比关系较大。本文研究了叶黄素与玉米黄质不同比例混合样品的体内外抗氧化效果。研究发现:叶黄素与玉米黄质以1∶2比例能发挥较好的协同抗氧化作用,对DPPH自由基的清除能力、铁离子还原能力及氧自由基吸收能力较高。在体内实验中,叶黄素/玉米黄质1∶2组体现出较好的抗氧化效果。该项研究结果为日后更进一步深入研究叶黄素与玉米黄质对视网膜的保护作用具有重要意义。
[1]孙玉敬,乔丽萍,钟烈洲,等. 类胡萝卜素生物活性的研究进展[J]. 中国食品学报,2012,12(1):160-163.
[2]Alves-Rodrigues A,Shao A. The science behind lutein[J]. Toxicology Letters,2004,150:57-83.
[3]任红,杨洋,史德芳. 叶黄素在功能性食品中的应用进展[J]. 食品研究与开发,2006,27(4):144-146.
[4]Nwachukwu I D,Udenigwe C C,Aluko R E. Lutein and zeaxanthin:Production technology,bioavailability,mechanisms of action,visual function,and health claim status[J]. Trends in Food Science & Technology,2016(49):74-84.
[5]熊双丽,卢飞,史敏娟. DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J]. 食品工业科技,2012(8):380-383.
[6]恽祥惠,邢丽娜,李云,等. 建立基于96 孔板检测的FRAP 法和DPPH法及其在橘核抗氧化活性研究中的应用[D]. 时珍国医国药,2014,5(5):1275-1278.
[7]Zhang Y,Fang H,Xie Q,et al. Comparative Evaluation of the Radical-Scavenging Activities of Fucoxanthin and Its Stereoisomers[J]. Molecules,2014,19:2100-2113.
[8]Floegel A,Kim D,Chung S,et al. Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods[J]. Journal of Food Composition and Analysis,2011,24:1043-1048.
[9]Dudonné S,Vitrac X,Coutière P,et al. Comparative Study of Antioxidant Properties and Total Phenolic Content of 30 Plant Extracts of Industrial Interest Using DPPH,ABTS,FRAP,SOD,and ORAC Assays[J]. J Agric Food Chem,2009,57:1768-1774.
[10]刘薇,刘彦霞,赵建,等. DPPH法测定保健食品脂溶性成份抗氧化能力的可行性研究[J]. 中国酿造,2011(4):86-89.
[11]Benzie I F F,Strain J J. The Ferric Reducing Ability of Plasma(FRAP)as a Measure of “Antioxidant Power”:The FRAP Assay[J]. Analytical Biochemistry,1996,239:70-76.
[12]陈玉霞,刘建华,林峰,等. DPPH和FRAP法测定41 种中草药抗氧化活性[J]. 实验室研究与探索,2011,30(6):11-14.
[13]卢引,尹震花,康文艺. FRAP 法微量模型的建立[J].食品工业科技,2013(5):312-313.
[14]李红艳. 紫色番茄中主要活性成分的组成及其抗氧化抗癌活性的研究[D]. 南昌:南昌大学,2012:93-99.
[15]王晓宇. 葡萄酒抗氧化活性及其检测方法的研究[D]. 杨凌:西北农林科技大学,2008:50-58.
[16]续洁琨,姚新生,栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报,2006,22(8):1015-1021.
[17]杨涛,吴辉辉,徐青,等. 抗氧化性能评价ORAC法及最新研究进展[J]. 食品工业科技,2009(7):352-356.
[18]Ou B,Chang T,Huang D,et al. Determination of Total Antioxidant Capacity by Oxygen Radical Absorbance Capacity(ORAC)Using Fluorescein as the Fluorescence Probe[J]. Journal of AOAC International,2013,96(6):1372-1377.
[19]曹亚兰,赵谋明,郑赛晶,等. 以ORAC 法为评价指标优化制备大豆抗氧化肽[J]. 食品与发酵工业,2011,37(10):73-77.
[20]卢臻. 维生素A、叶黄素和玉米黄质与视觉机能[J]. 生物学教学,2008,37(8):4-6.
[21]Bernstein P S,Li B,Vachali P P,et al. Lutein,zeaxanthin,and meso-zeaxanthin:The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease[J]. Progress in Retinal and Eye Research,2016,50:34-66.
[22]Mares J. Lutein and Zeaxanthin Isomers in Eye Health and Disease[J]. Annual Review of Nutrition,2016,36(1):571-602.
Studyonthesynergisticantioxidantactivityofluteinandzeaxanthin
RENDan-dan1,2,ZHANGHai-li1,WANGXi-tong1,XUELing-yun2,WUWen-zhong2
(1.College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China;2. Dalian Innobioactives Company Limited,Dalian 116600,China)
Lutein and zeaxanthin are major carotenoids in human eyes. They have very good effects to prevent eye disease. In this paper,antioxidant activity of lutein and zeaxanthininvivoandinvitrowere discussed,which provided a theoretical basis for the development of composite carotenoids products. Antioxidant activities of lutein and zeaxanthininvitrowere measured by methods including DPPH radical scavenging system,FRAP and ORAC. Synergistic antioxidant activities of lutein and zeaxanthininvivowere studied by the establishment of ethanol oxidation damage model using ICR mice. The results showed that the ratio of lutein and zeaxanthin 1∶2 had excellent antioxidant effectinvitro,while 2∶1 had poor effect. Group of lutein/zeaxanthin 1∶2 showed stronger antioxidant activitiesinvivo.
lutein;zeaxanthin;synergistic antioxidant
2017-02-20
任丹丹(1980-),女,博士,副教授,研究方向:海洋生物资源利用,E-mail:rdd80@163.com。
大连市企业博士后研究人员资助项目。
TS254.2
:A
:1002-0306(2017)17-0296-05
10.13386/j.issn1002-0306.2017.17.058

