丁香酚辅助鲜活草鱼处理和运输的剂量研究
,,, ,, ,,,
(1.浙江海洋大学,浙江舟山 316021;2.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室(广州),农业部渔业环境及水产品质量监督检验测试中心(广州),广东广州 510300)
丁香酚辅助鲜活草鱼处理和运输的剂量研究
方晓磊1,2,柯常亮2,*,李刘冬2,刘奇2,古小莉2,黄珂2,赵东豪2,黎智广2,莫梦松2
(1.浙江海洋大学,浙江舟山 316021;2.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室(广州),农业部渔业环境及水产品质量监督检验测试中心(广州),广东广州 510300)
药物辅助鲜活水产品转移和运输已经成为水产品流通过程中产品保活、保值的一种重要手段。文章通过静水式生物测试法,以丁香酚作为麻醉剂,研究不同药浴浓度处理下草鱼在麻醉阶段的行为特征和诱导时间,在清水复苏阶段的行为特征、复苏时间和复苏存活率,以探索满足商品规格的草鱼在捕捞、转移、处理和运输等收贮运环节操作所需要的最适剂量。结果显示,丁香酚浓度为40 mg·L-1的处理组中,实验草鱼在3 min内即可进入快速麻醉期,脱水10 min内依然保持麻醉状态,放入清水中7 min内即可复苏,适于草鱼的短时间转移操作;丁香酚浓度为10 mg·L-1的处理组中草鱼可长时间(24 h)处于深度镇静状态,鱼体可保持平衡,但停止游动,且触觉丧失,存活率100%,适合草鱼长时间运输操作。
草鱼,丁香酚,鱼用麻醉剂,活鱼运输,活鱼处理
草鱼是中国淡水养殖最大宗的经济鱼类,2015年总产量超过500 万t,占淡水养殖鱼类总产量的20.9%[1]。由于巨大的消费需求,鲜活草鱼长距离、长时间、高密度的运输已经成为常态。由于捕捞、转移和运输环节应激反应大,草鱼从产地到市场的链条中容易受伤感染,免疫力降低,导致总体存活率和个体完好率下降,是产品价值受到影响[2-3]。
药物辅助操作,可以有效缓解活鱼的应激反应,降低活鱼的死亡率[4]。丁香酚由于高效、安全、廉价,已经在一些国家作为渔业麻醉剂合法使用,用于辅助活鱼捕捞、分拣、称重、运输、转移、产卵、标记和其它操作[5-7]。日本规定丁香酚用海水或淡水稀释至1/5000~1/20000后,可用药浴的方式对鱼类和贝类进行麻醉,但是用药后分别须休药7 d和10 d,并制定了鱼体中丁香酚最大残留限量(50 μg·L-1)[5]。新西兰和南非允许丁香酚用于辅助渔业活动中各项操作,根据需要使用且不做限量要求[6-7]。虽然,丁香酚在中国还没有登记使用,但是学者已就丁香酚对斑马鱼、日本囊虾、俄罗斯鲟、鲻鱼、半滑舌鳎和大西洋鲑等多个水产品种的麻醉效果开展了一些前瞻性研究[8-13]。自“麻醉鱼”时间被报道出来后,相关部门于2015年对活鱼收贮运环节丁香酚的使用情况进行了摸底调查。结果显示,在生产实际中使用丁香酚辅助草鱼处理和运输的情况也时有发生。主要有两种使用方法,一是在关键操作环节(捕捞和转运)过程短时麻醉用药,让草鱼在1~3 min达到麻醉状态以便操作;二是运输过程低浓度下长时间镇静,降低草鱼的活动以降低损失和死亡率。目前的使用方法比较粗放,常导致过量用药或药效不足。然而,关于丁香酚对草鱼麻醉效果的研究尚未报道。因此,文章联系生产实际,以草鱼为对象研究了不同浓度丁香酚对草鱼的麻醉效果,探明了两种用药方式的适宜浓度,以期对实际生产有指导作用,为丁香酚的合理使用提供参考。
1 材料与方法
1.1材料与仪器
丁香油水门汀 上海医疗器械股份有限公司齿科材料厂生产,丁香酚含量>99.5%;乙醇(≥99.7%) 分析纯(AR),广州化学试剂厂。由于丁香酚难溶于水,因此在开展药浴实验时预先将丁香酚和无水乙醇按照体积比1∶9配制成乳浊液溶。
实验用草鱼(规格1.0~1.5 kg)采集自水产批发市场,以运鱼车运抵实验水池(3 m×4 m×1.5 m)暂养7 d,暂养期间剔除体表受伤、活力低和死亡的个体。药浴实验前24 h停止投喂饲料。
DYKS-YC035W型恒温热泵机 佛山市帝义电器热泵有限公司;YSI Professional Plus型便携式多参数水质分析仪 美国YSI集团。
1.2实验方法
1.2.1 实验条件 实验用水源自养殖池塘,预先置于室内储水池(3 m×4 m×1.5 m)中持续供氧,恒温热泵机(DYKS-YC035W,佛山市帝义电器热泵有限公司)调节池水温度(20±1) ℃,溶氧量>7 mg·L-1,pH7.6~7.8,通过YSI不间断监测上述水质指标。麻醉实验容器为120 L塑料水箱,预先用高锰酸钾溶液消毒、清水冲洗清洗处理。
1.2.2 鱼体生理行为观察 观察药浴处理组和对照组草鱼在呼吸频率、平衡性、刺激反应和游动行为等生理反应。呼吸频率通过事先录像观察一定时间,随后依照录像人为计数草鱼鳃盖的开合频率。鱼体的平衡性通过观察鱼身是否能够维持正常体位来判定,出现侧倾或翻转则视其无法维持平衡。以木棍触碰鱼体察看草鱼对外界刺激响应是否灵敏。游动行为的改变以单位时间内草鱼游动时间的长短确定。
1.2.3 短时间麻醉药浴实验 采用静水式生物测试法进行预实验[13-14],使用较大浓度范围麻醉实验草鱼,以确定药浴浓度(见表1)。移取相应体积的丁香酚于烧杯中,用无水乙醇配制成乳浊液后,倒入预先放入60 L水的水箱中配制成所需药浴处理浓度。共计60尾草鱼,每个处理随机选择放入10尾暂养草鱼,逐个开始药浴实验,观察不同药浴浓度下草鱼的的行为特征,同时记录草鱼麻醉时间。药浴观察30 min后,1~5处理组中的草鱼从水箱中麻醉的草鱼捞出空气暴露10 min,冲洗,放入清水中观察其复苏时的行为特征,记录复苏时间。如果实验过程(药浴麻醉过程和空气暴露过程)中草鱼出现停止呼吸或休克现象,立即放置到清洁水体中进行复苏。
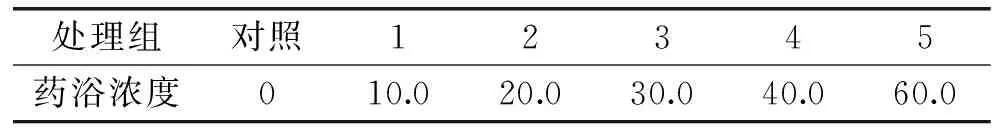
表1 短时麻醉药浴实验中丁香酚浓度(mg·L-1)Table 1 Eugenol concentrations in each bath group for fish anesthetic in short time(mg·L-1)
1.2.4 长时间镇静药浴实验 根据1.2.3麻醉浓度实验结果和活鱼麻醉生理行为表现,确定药浴浓度处理组(表2)。共计50尾草鱼,于每个处理组中随机选择暂养草鱼10尾于实验水箱中,持续观察24 h,记录实验个体状态和存活率。对于24 h内处于镇静状态且存活率为100%的处理组,继续暂养14 d 以观察和统计草鱼的摄食及死亡情况。
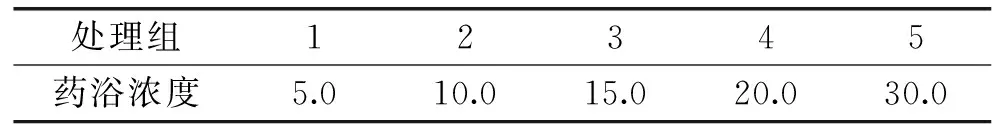
表2 长时间镇静药浴实验中丁香酚浓度(mg·L-1)Table 2 Eugenol concentrations in each bath group for fish sedation in long time(mg·L-1)
2 结果与分析
2.1短时间麻醉药浴

表3 不同麻醉诱导阶段草鱼的行为特征Table 3 Characteristic behaviors of grass carp in response to eugenol in different induction stages

表4 不同复苏阶段草鱼的行为特征Table 4 Characteristic behaviors of grass carp recovered in clean water in different stages
丁香酚麻醉活鱼的实验中,大多数鱼类在麻醉诱导过程中呼吸频率、平衡能力、游动状态等生理行为在不同的麻醉阶段存在较大差异,常被划分成不同的诱导阶段进行描述[13-16]。本实验将药浴期间丁香酚对草鱼的麻醉诱导状态划分成6个阶段,清水复苏期间根据草鱼生理恢复所表现的状态分为4个阶段(表3)。从麻醉和复苏的行为特征来看,草鱼在呼吸、平衡、游动和应激等方面表现出的特征与之前的研究基本一致。
麻醉诱导时间显示(表5),20 mg·L-1以下处理组,诱导时间较长且不能达到麻醉状态。20、30、40 mg·L-1处理组进入麻醉状态分别需要约10、5、3 min。30 mg·L-1和40 mg·L-1的麻醉效率高。而且,在空气中暴露时,40 mg·L-1处理组中的草鱼捞出后麻醉状态可以持续8~10 min。60 mg·L-1处理组中,草鱼快速达到深度麻醉期,处于休克状态,不适合用于草鱼的麻醉处理。
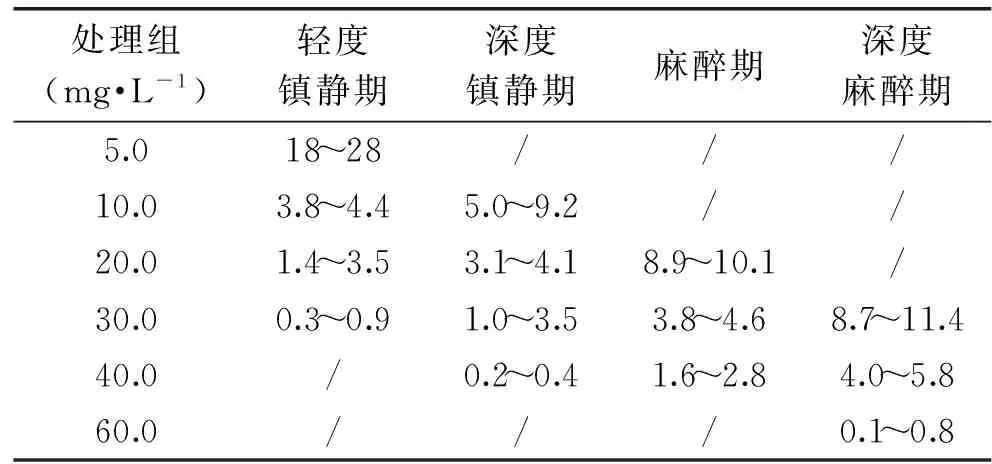
表5 不同处理组草鱼进入不同麻醉阶段的诱导时间(min)Table 5 Induction time for different stages of grass carp in response to eugenol in each treatment(min)
注:因应激期发生在草鱼刚投入溶液中5~15 s左右,时间极短故未在表中列出。
草鱼从水箱捞出、空气暴露后,冲洗放入净水箱中复苏,低浓度下未进入麻醉状态下的草鱼,行为变化特征不明显,很短时间内即恢复正常状态(表6)。30~40 mg·L-1处理组麻醉状态的草鱼6 min左右可恢复到正常状态。
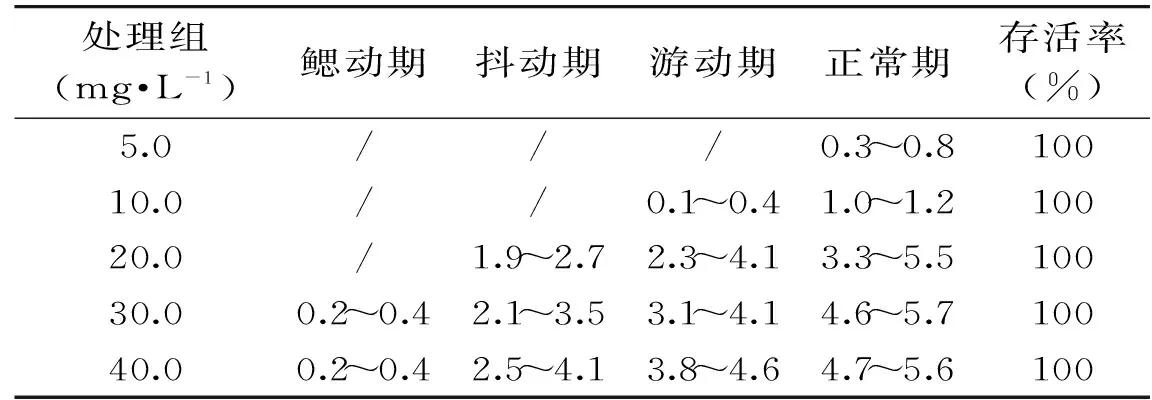
表6 不同处理组草鱼进入不同复苏阶段的时间(min)Table 6 Time of grass carp recovered in clean water in different stages(min)
2.2长时间镇静药浴
24 h药浴观察结果显示,5.0 mg·L-1和10.0 mg·L-1处理组中草鱼存活率100%,其它处理组出现不同程度的个体死亡,死亡率低于100%(表7)。
虽然存活率均达到100%,但是5.0 mg·L-1处理组和10.0 mg·L-1处理组中草鱼行为响应存在较大差异。5.0 mg·L-1处理组中的草鱼仅达到轻度镇静状态,且药浴10 h左右呼吸频率、平衡能力、游动状态等生理行为基本恢复正常,对外界刺激反应强烈。草鱼在丁香酚浓度10 mg·L-1时达到镇静状态,在水中停止游动,身体保持平衡,触觉基本丧失,处于与表3中第3阶段所述状态。后续暂养观察显示,草鱼放入清水后很快恢复正常,摄食正常,基本未出现死亡状况(第5 d死亡1条)。

表7 不同处理组草鱼药浴存活率Table 7 Surviving rate of grass carp bathed 24 hours in eugenol at different treatment
注:a:10 h鱼体恢复至正常期状态。
3 讨论
麻醉剂浓度过低,起不到抗应激作用不利于操作,过高活鱼容易休克,复苏率堪忧。因此,不同的操作需要选择不同的给药剂量,既利于生产操作,又能起到保活作用。
鲤鱼、虹鳟、罗非鱼、点鳍红眼脂鲤和彩虹鲨等鲜活水产品进行短时间操作时,研究人员推荐的丁香酚剂量分别为30~50、60,50~60、65、和200 mg·L-1[17-21]。因为,相应剂量可使对应的品种处于麻醉状态。处于麻醉状态的活鱼(表3),不仅鱼体失去平衡身体翻转静置于容器底部,丧失了响应外界刺激的能力,而且在其放入清水中后可以很快复苏。因此,麻醉状态最适宜在捕捞、分拣、称重、装运和转移等环节针对活鱼开展各项操作。本实验中1.0~1.5 kg规格的草鱼用40 mg·L-1剂量的丁香酚进行处理时,3 min内即可进入麻醉状态(表5),机体平衡、活动和反射等功能丧失,而且在8~10 min的脱水过程中草鱼还可保持麻醉状态,在清水中放置6 min左右即可复苏,存活率为100%。因此,实验规格的草鱼用40 mg·L-1的丁香酚处理,麻醉诱导速率快,复苏率高,适合辅助实际生产中草鱼起塘、称重、分级和装车等操作和转移环节的工作要求。
活鱼运输环节关注的重点与其它环节不同。运输过程中,活鱼长期暴露于丁香酚水溶液中且受到运输容器震动和噪声等影响,容易处于高度应激的状态[22]。因此,需要降低运输期间活鱼的应激反应,减少鱼体之间、鱼体与运输器具的接触,降低物理损伤。研究显示,活鱼处于深度镇静状态时,鱼体可保持平衡,而且不游动[13-15]。因此,个体与个体之间、个体与容器之间造成的物理损伤可降至最低。运输途中为保持鱼体存活率,还要降低鱼体生理代谢以保持水质洁净。因为在运输途中活鱼会会排放氨氮、消耗水体氧气,恶化水质不利于存活[23]。镇静状态可减缓鱼体的新陈代谢。研究表明,丁香酚的剂量使个体处于镇静状态时,黄腊鯵、亚鲟稚鱼、中华鲟幼鱼耗氧量和排氨量显著降低,大口黑鲈心脏输出量明显降低[14,24-26]。草鱼的实验结果显示(表7),10.0 mg·L-1时可使草鱼在24 h内可保持深度镇静状态。深度镇静状态的活鱼(表5),鱼体保持不动、应激反应小、代谢速率降低,不仅保持了水质洁净,还缓解了应激反应减少了鱼体的物理损伤。因此,实验规格的草鱼在运输时间在24 h内时应用10.0 mg·L-1的丁香酚辅助运输有利于保持草鱼的存活率和完好率。
4 结论
活鱼收贮运过程由于活体应激和水质恶化等原因常导致个体受损、免疫力下降和死亡,不仅大幅降低产品的价值,还扼制了产业的发展,抑制了产品供给和消费。因此,引入高效低毒、价格低廉的药物辅助活鱼操作、转移和运输可以助力产业发展。本文研究结果表明丁香酚浓度为40.0 mg·L-1时适合辅助实际生产中草鱼起塘、称重、分级、转移等操作,10.0 mg·L-1时适于辅助草鱼长时间(24 h)运输。已有研究表明丁香酚在虹鳟鱼和银鲈肌肉组织中可快速消除[27-28]。未来建议深入开展不同类水产品中丁香酚的残留消除研究,尤其是两种给药方式对药物残留量的影响,评估鱼体中丁香酚残留对人体的健康风险,探索丁香酚作为渔用麻醉剂的可行性、安全性,以填补国内渔用麻醉剂的空白,助力水产行业发展。
[1]农业部渔业局. 中国渔业统计年鉴[M]. 北京:中国农业出版社,2016.
[2]Husen M A,Sharma S. Efficacy of anesthetics for reducing stress in fish during aquaculture practices-a review[J]. Journal of science,engineering and technology,2014,10(1):104-123.
[3]梁养贤. 模拟长途运输中草鱼血液和水质变化研究[D].长沙:湖南农业大学,2008.
[4]Trushenski J T,Bowker J D,Cooke S J,et al. Sharon. Issues Regarding the Use of Sedatives in Fisheries and the Need for Immediate-Release Options[J]. Transactions of the American Fisheries Society,2013,142(1):157-169.
[5]農林水産省. 水産用医薬品の使用について第23 報[R/OL].(2016-7-26)[2016-4-27]. http://www.maff.go.jp/j/jas/kaigi/pdf/060726_bukai_e.pdf
[6]Ministry for Primary Industries of New Zealand. New Zealand(Maximum Residue Limits of Agricultural Compounds)Food Standards[S/OL].(2013-6-27)[2016-4-27].http://www.foodsafety.govt.nz/elibrary/industry/mrl-agricultural-compounds-amdt-2013.pdf.
[7]The Federal Register of Legislation of Australia Government. Australia New Zealand Food Standards Code-Standard 1.4.2-Maximum Residue Limits(Australia Only)[S/OL].(2013-9-5)[2016-4-27]. https://www.legislation.gov.au/Details/F2014C01358.
[8]陈德芳,汪开毓,廖国平,等. 丁香酚对斑马鱼麻醉效果的研究[J]. 水产科技情报,2013(4):31-36.
[9]蔡诤,董宏标,王军,等. 浓度和温度对丁香酚麻醉日本囊对虾效果的影响[J]. 海洋科学,2012,36(3):29-36.
[10]杨移斌,夏永涛,艾晓辉,等. 丁香酚对俄罗斯鲟的麻醉效果[J]. 中国渔业质量与标准,2016,6(1):17-21.
[11]周裕华,潘桂平,周文玉. 丁香酚对鲻鱼麻醉效果研究[J]. 水产科技情报,2016,43(6):332-334.
[12]李靖,刘宝良,王顺奎,等. 丁香酚对大西洋鲑麻醉效果的实验研究[J]. 海洋科学进展,2015,33(1):92-99.
[13]刘长琳,李继强,陈四清,等. 丁香酚麻醉半滑舌鳎成鱼的实验研究[J]. 渔业科学进展,2007,28(3):50-56.
[14]Cooke S J,Suski C D,Ostrand K G,et al. Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass(Micropterus salmoides)[J]. Aquaculture,2004,239(1-4):509-529.
[15]Cowing D,Powell A,Johnson M. Evaluation of different concentration doses of eugenol on the behaviour of Nephrops norvegicus[J]. Aquaculture,2015,442:78-85.
[16]Minouk P,Woojune H,Sooyeon I,et al. Anaesthetic efficacy and physiological responses to clove oil-anaesthetized kelp grouper Epinephelus bruneus[J]. Aquaculture Research,2008,39(8):877-884.
[17]Hajek G J,Kyszejko B,Dziaman R. The anaesthetic effect of clove oil on common carp,Cyprinus carpio L[J]. Acta Ichthyologica Et Piscatoria,2006,36(2):93-97.
[18]Wagner G N,Singer T D,McKinley RS. The ability of clove oil and MS-222 to minimize handling stress in rainbow trout(Oncorhynchus mykiss Walbaum[J]. Aquaculture Research,2003,34(13):1139-1146.
[19]Simões L N,Lombard D C,Gomide TM,et al. Efficacy of clove oil as anesthetic in handling and transportation of Nile tilapia,Oreochromis niloticus(Actinopterygii:Cichlidae)juveniles[J]. Zoologia,2011,28(3):285-290.
[20]Roubach R,Gomes L C,Fal F,et al. Eugenol as an efficacious anaesthetic for tambaqui,Colossoma macropomum(Cuvier).[J]. Aquaculture Research,2005,36(11):1056-1061.
[21]Hoseini S M,Rajabiesterabadi H,Tarkhani R. Anaesthetic efficacy of eugenol on iridescent shark,Pangasius hypophthalmus(Sauvage,1878)in different size classes[J]. Aquaculture Research,2015,46(2):405-412.
[22]Benovit S C,Gressler L T,Silva L L,et al. Anesthesia and transport of Brazilian flounder,Paralichthys orbignyanus,with essential oils of Aloysia gratissima and Ocimum gratiss simum. Journal of World Aquaculture Science,2012,43(6):896-900.
[23]周鑫. 草鱼对亚硝酸氮、氨氮和温度胁迫的生理响应[D].青岛:中国海洋大学,2012.
[24]张朝晖,丛娇日,王波,等.麻醉剂丁香酚对黄腊鯵耗氧的影响[J]. 2003,27(6):11-14.
[25]庄平,徐滨,章龙珍,等. MS-222和丁香酚对中华鲟幼鱼耗氧率与排氨率的影响[J]. 中国水产科学,2009,16(4):612-618.
[26]冯广朋,庄平,章龙珍,等. 麻醉剂丁香酚对西伯利亚鲟稚鱼耗氧率与幼鱼血液生化指标的影响[J]. 大连海洋大学学报,2010,25(2):113-118.
[27]Meinertz J R,Schreier T M,Porcher S T,et al. Depletion of eugenol residues from the skin-on fillet tissue of rainbow trout exposed to 14 C-labeled eugenol[J]. Aquaculture,2014,430:74-78.
[28]Kildea M A,Allan G L,Kearney R E. Accumulation and clearance of the anaesthetics clove oil and AQUI-STMfrom the edible tissue of silver perch(Bidyanus bidyanus)[J]. Aquaculture,2004,232(1-4):265-277.
ConcentrationsofeugenolassistingfortransportandhandlingofCtenopharyngodonidellus
FANGXiao-lei1,2,KEChang-liang2,*,LILiu-dong2,LIUQi2,GUXiao-Li2,HUANGKe2,ZHAODong-hao2,LIZhi-guang2,MOMeng-song2
(1.Zhejiang Ocean University,Zhoushan 316021,China; 2.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Laboratory of Aquatic Product Processing,Ministry of Agriculture,Laboratory of Quality and Safety Risk Assessment for Aquatic Product on Storage and Preservation,Ministry of Agriculture,Fishery Environment and Aquatic Products Quality Supervision and Testing Center(Guangzhou),Ministry of Agriculture,Guangzhou 510300,China)
Drugs in assistance of transport and handling of live aquatic products has been a vital way to increase their survival rate and keep the product value. To find the optimal dosage for market sizeCtenopharyngodonidellusin the operation of harvest,transferring,handling,and transport,the static bioassay method was employed to investigate behaviors and induction times of the fish treated by eugenol in anesthetic stages,and the behaviors,recovery time and survival rate in recovery stages. As the result showed thatCtenopharyngodonidelluswere quickly anaesthetized within three minutes bathed at the treatment of eugenol at 40 mg·L-1. The fish could keep in narcotism while exposing on air for ten minutes. They could recover within seven minutes in clean water. In the 10 mg·L-1treatment,Ctenopharyngodonidelluscould keep in the deep sedation for a long time. In this stage,though the body could keep equilibrium,but the fish were not mobile and lost stimuli response. The most important was the survival rate amounted to one hundred percent. According to the practical need in fish harvest,handling and transport,eugenol at 40 mg·L-1and 10 mg·L-1were opt for handling and transport ofctenopharyngodonidellusin the experimental size,respectively. This results could provide references for eugenol as fish anesthetic in assistance ofCtenopharyngodonidellustransport and handling.
Ctenopharyngodonidellus;eugenol;fish anesthetics;live fish transport;live fish handling
2017-03-10
方晓磊(1993-),男,硕士研究生,研究方向:食品安全与加工,E-mail:100755299@qq.com。
*通讯作者:柯常亮(1980-),男,硕士,副研究员,研究方向:水产品质量安全与风险评估,E-mail:kechangliang@scsfri.ac.cn。
国家农产品质量安全风险评估重大专项(GJFP201600902);中国水产科学研究院南海水产研究所中央级公益性科研院所基本科研业务费专项资金(2016TS15,2016TS22,2015TS18);农业部水产品加工重点实验室开放基金(NYJG201513)。
TS254.1
:A
:1002-0306(2017)17-0275-05
10.13386/j.issn1002-0306.2017.17.053

