STMN2的表达对颗粒细胞Ras-MAPK信号通路的影响
李 鹏
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319)
STMN2的表达对颗粒细胞Ras-MAPK信号通路的影响
李 鹏
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319)
目的:分析STMN2的表达对颗粒细胞Ras-MAPK信号通路的影响。方法:对雌性海兰褐壳蛋鸡颗粒细胞进行原代培养,使用腺病毒载体将STMN2过表达载体、STMN2-RNAi载体及空载体转染至颗粒细胞中,并设定对照组,提取转染后颗粒细胞的总RNA及总蛋白,采用实时荧光定量PCR及Western blot分别检测Ras-MAPK信号通路关键因子erk1、erk2、ras、elk-1、p-erk1、p-erk2的mRNA表达水平及蛋白表达水平。结果:与空载体组和对照组相比,STMN2过表达组中erk1、erk2和ras mRNA表达水平均极显著增加(p<0.01),elk-1 mRNA表达水平差异显著(p<0.05)。STMN2低表达组中erk1、elk-1 mRNA表达水平低于对照组和空载体组,且差异极显著(p<0.01),ras和erk2 mRNA表达水平差异显著(p<0.05),过表达组中,erk1、erk2、p-erk1、p-erk2和ras蛋白表达水平显著高于对照组和空载体组,且差异极显著(P<0.01),elk-1蛋白表达水平差异不显著。STMN2低表达组中erk1、erk2、p-erk1、p-erk2,elk-1、ras蛋白表达低于对照组和空载体组,且差异显著(p<0.05)。结论STMN2具有促进Ras-MAPK信号途径中各关键因子表达的作用,进一步促进卵泡颗粒细胞增殖。
STMN2 颗粒细胞 Ras-MAPK
有研究人员经过研究后发现,颗粒细胞在多种动物卵泡发育的过程中均发挥重要的促进和调节作用,所以很多研究人员也就对卵母细胞发育与颗粒细胞之间的关系进行了更多的深入研究,有研究人员发现Stathmin家族蛋白在促卵母细胞成熟方面具有重要的介导作用,而STMN2即为其中之一,STMN2蛋白具有高度的保守性,但其与细胞周期的调控显示出密切的关系,其通过磷酸化和去磷酸化对细胞的有丝分裂进行调控[2,3]。有研究人员发现,当颗粒细胞中STMN2蛋白的表达量有所升高后,会促进颗粒细胞的增殖,并且会对卵泡的发育发挥促进作用,而对细胞的增殖发挥重要调控作用的即为Ras-MAPK信号通路,为若STMN2在颗粒细胞中高度表达,可能会促进颗粒细胞的生长发育从而进一步促进卵泡的发育[4,5]。本研究对STMN2的表达对Ras-MAPK信号通路的影响进行研究,以探索和阐述卵泡发育的机理,为阐明卵泡发育与颗粒细胞的关系提供研究基础和思路。
1 材料与方法
1.1 材料
1.1.1 主要仪器
台式高速冷冻离心机(由长沙英泰仪器有限公司生产);细胞培养箱(由GS Laboratory Equipment公司生产);BHC-1360ⅡA/ B3型生物安全柜(由北京东联哈尔仪器制造有限公司生产);紫外分光光度计(由北京普西通用仪器有限责任公司生产);生物安全柜(由苏州苏净安泰有限公司生产);SmartSpecTMPlus核酸蛋白测定仪(由美国Bio-rad公司生产)。
1.1.2 主要试剂
RNA提取试剂盒(由北京博凌科为生物技术有限公司生产);荧光定量PCR试剂盒(由北京达科为生物技术有限公司生产);SDS-PAGE 凝胶电游试剂盒(由上海生工生物有限公司生产);反转录试剂盒(由Thermo scientific公司生产);培养液(Hyclone M199)(赛默飞世尔科技公司);胎牛血清(由浙江碧云天生物技术有限公司生产);Rabbit Anti-CDKN1A antibody、Rabbit Anti-ERK1 + ERK2 antibody、Rabbit Anti-phospho-ERK1 + 2(Thr183/185)antibody、Rabbit Anti-ELK-1 antibody;HRP标记羊抗兔二抗(由美国Bioworld公司生产);STMN2过表达腺病毒载体(由汉恒生物有限公司构建);STMN2-RNAi腺病毒载体(由上海生工生物有限公司构建);腺病毒空载体(由汉恒生物有限公司提供)。
1.1.3 实验动物
实验动物由黑龙江大庆某养鸡场提供,为健康的海兰褐壳蛋鸡,所有实验动物均为8月龄的雌鸡,实验动物共5只。
1.2 方法
1.2.1 蛋鸡卵泡颗粒细胞的培养
对实验动物进行颈静脉放血致死,取卵巢后观察卵泡形态和级别,选取选F1级卵泡进行后续实验,参考Gillbert等人[6]采取的颗粒细胞层剥离方法对卵泡颗粒细胞膜进行剥离。然后放置于0.75% NaCl溶液中进行清洗,用眼科手术剪将颗粒细胞膜充分的剪碎。将碎块加入到15 ml离心管中,并加入终浓度为12.5 μg/ml的Ⅰ型胶原酶,将离心管放置在37 ℃培养箱中5 min对颗粒细胞层进行消化。使用200目滤网对消化后的溶液进行过滤,将滤液加入到新的15 ml离心管中,放入台式离心机后以1000 g的离心力离心8 min,将上清液吸弃后,加入0.75% Nacl溶液再清洗3次,然后加入适量细胞培养基震荡重悬,将重悬后的溶液加入至细胞培养瓶中进行培养。
1.2.2 腺病毒转染蛋鸡卵泡颗粒细胞
将状态良好的颗粒细胞制备成细胞悬液,然后接种至6孔细胞培养板中,每孔中加入1 ml的细胞悬液,将6孔细胞培养板放置于5%的CO2,37 ℃恒温的细胞培养箱中进行培养。48 h后使用显微镜观察细胞生长情况,将6孔细胞培养板内细胞更换无血清培养液,以感染复数值(MOI)350 pfu/cell转染原代培养的蛋鸡卵泡颗粒细胞。于转染48 h后,在荧光倒置显微镜下观察细胞生长情况及腺病毒转染情况。
实验分为五组,分别为对照组、过表达空载体组、RNAi空载体组、STMN2过表达组,STMN2-RNAi组。
1.2.3 荧光定量PCR检测Ras-MAPK信号通路关键因子mRNA表达
使用RNA提取试剂盒提取腺病毒转染48 h后蛋鸡卵泡颗粒细胞的总RNA,使用反转录试剂盒对获得的RNA进行反转录,然后选GAPDH为内参,利用荧光定量PCR检测腺病毒转染后erk1、erk2、ras、elk-1、p-erk1、p-erk2的表达情况。
1.2.4 Western blot 检测Ras-MAPK信号通路关键因子蛋白表达
采用Western blot 检测Ras-MAPK信号通路erk1、erk2、ras、elk-1、p-erk1、p-erk2的蛋白表达情况,首先进行SDS-PAGE凝胶电泳,切下有目的条带的凝胶后,进行电转移至PVDF膜上,封闭后加入一抗作用8h,冲洗后加入二抗作用2h。冲洗后使用显色试剂盒进行显色。采用Bandscan软件对获得的图片进行灰度值分析,以评价Ras-MAPK信号通路各关键因子的蛋白表达水平。
1.3 统计分析
将实验获得的数据使用SPASS19.0软件进行处理,计量数据以均数±标准差(±s)表示,运用ANOVN对数据进行方差分析。
2 结果
2.1 腺病毒转染后的颗粒细胞
荧光倒置显微镜下观察,如图1。腺病毒转染48 h后,颗粒细胞生长状况良好,且转染率较高,可用于后续实验。详细情况见图1。

图1 腺病毒转染颗粒细胞(100×)
2.2 Ras-MAPK信号通路关键因子mRNA表达情况
应用荧光定量PCR仪对对照组、空载体组、过表达组、低表达组、空载体组的erk1、erk2、ras、elk-1 mRNA表达情况进行检测。结果显示;与空载体组和对照组相比,STMN2过表达组中erk1、erk2和ras mRNA表达水平均极显著增加(p<0.01),elk-1 mRNA表达水平差异显著(p<0.05)。STMN2低表达组中erk1、elk-1 mRNA表达水平低于对照组和空载体组,且差异极显著(p<0.01),ras和erk2 mRNA表达水平差异显著(p<0.05),详细结果见图2和图3。
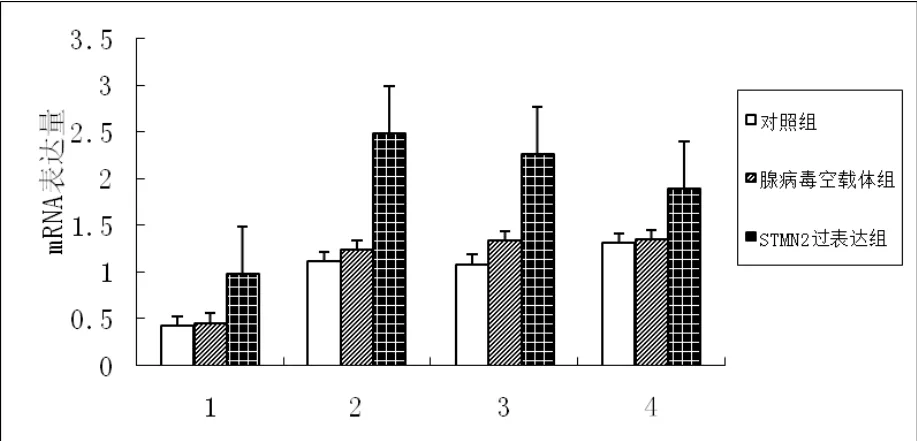
图2 不同组目的基因mRNA的表达情况
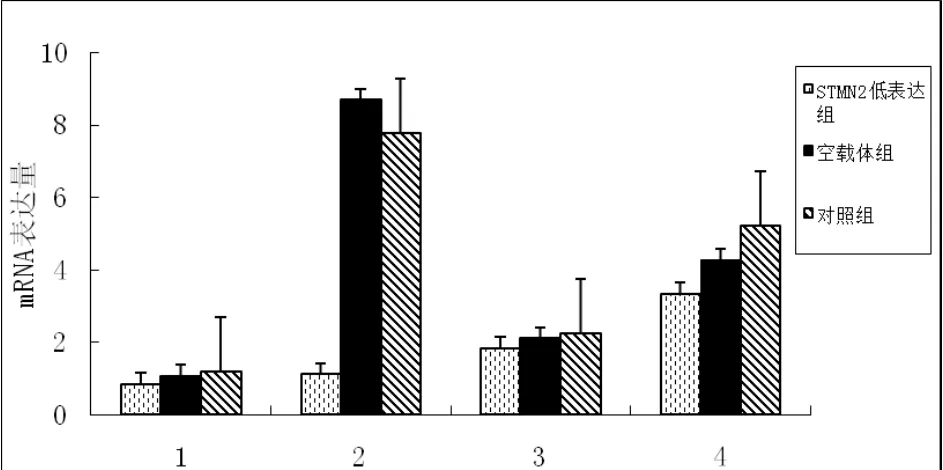
图3 不同组目的基因mRNA的表达情况
2.3 Ras-MAPK信号通路关键因子蛋白表达情况
使用Western blot 检测对照组、过表达空载体组、STMN2过表达组、STMN2低表达组、RNAi空载体组中目的蛋白与β-actin蛋白表达结果。过表达组中,erk1、erk2、p-erk1、p-erk2和ras蛋白表达水平显著高于对照组和空载体组,且差异极显著(P<0.01),elk-1蛋白表达水平差异不显著。STMN2低表达组中erk1、erk2、p-erk1、p-erk2,elk-1、ras蛋白表达低于对照组和空载体组,且差异显著(p<0.05),详细结果见图4、图5、表1和表2。
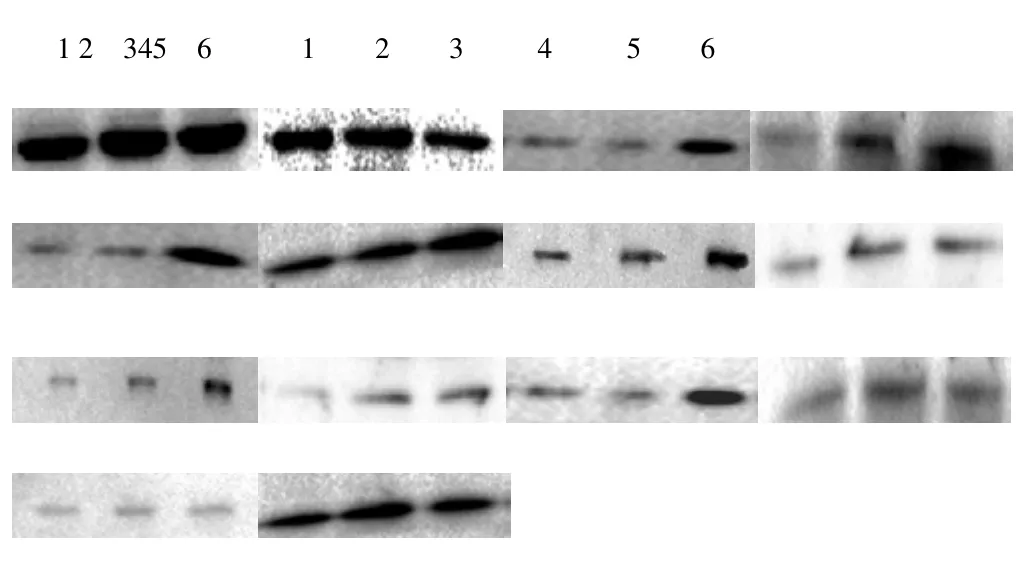
图4 Western blot检测目的蛋白erk1、erk2、ras、p-erk1、p-erk2和elk-1表达结果
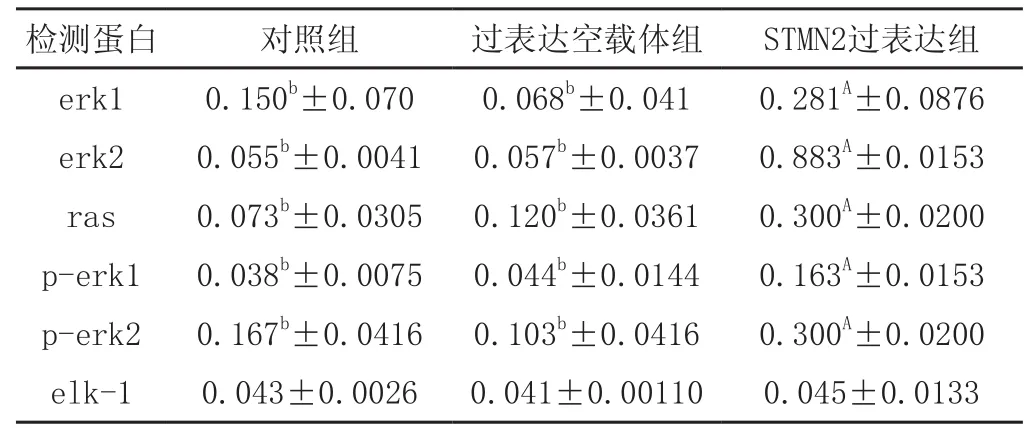
表1 不同目的蛋白过表达组表达数据分析结果
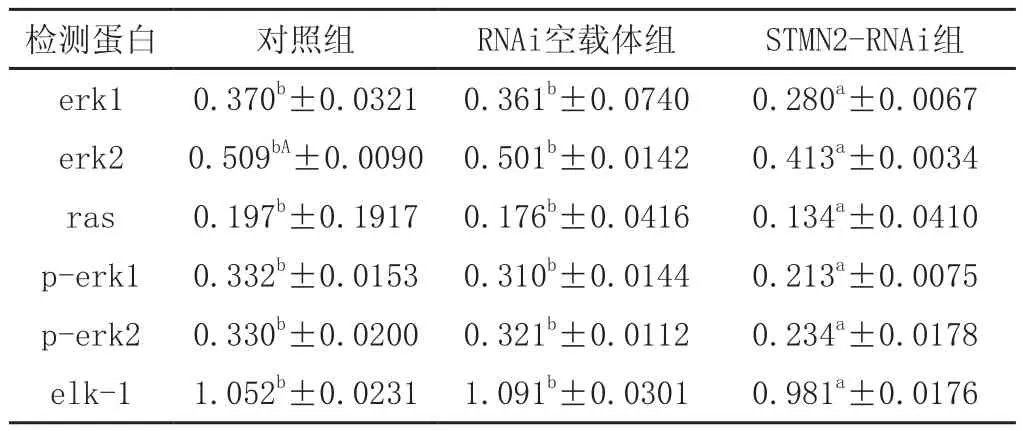
表2 不同目的蛋白RNAi组表达数据分析结果
3 讨论
有研究人员经过研究后发现,发育良好的卵母细胞卵泡液中BMP15的表达水平也较高,认为其与促进卵母细胞核质成熟呈现密切的相关性[3,4]。有很多相关研究表明,颗粒细胞对卵母细胞的质量具有重要的影响,而将颗粒细胞和卵丘细胞去除后,卵母细胞相对于有颗粒细胞和卵丘细胞包围的细胞相比,凋亡率明显增加,当在培养液中加入BMP15后即可缓解卵母细胞凋亡的情况。并且有研究BMP15 伴随着卵泡的生长发育对卵母细胞及其周围的体细胞发挥着重要的作用[5,6]。
颗粒细胞在卵泡发育的过程中发挥重要的促进和调节作用,也是卵母细胞成熟的重要标志物,其与内膜细胞的增殖分化共同作为促进卵泡发育和生长的重要因素,而STMN2蛋白对颗粒细胞及卵母细胞的细胞周期均发挥重要的调节作用,STMN2调控增殖能力强的细胞的有丝分裂,而一些增殖较慢或分化程度较高的细胞中STMN2蛋白的表达量却较低,例如一些癌细胞中STMN2即呈现高表达,所以很多研究人员希望通过STMN2蛋白攻克癌症[7]。所以我们认为STMN2蛋白对颗粒细胞的生长和发育同样具有调控作用。
当细胞所处的环境发生变化时,细胞内的很多信号通路即被激活,在细胞内及各细胞间传递各种相关信息。而当很多动物受到某些因素的刺激后,机体内的MAPK通路即被激活。MAPK家族主要包括四条信号通路[8],Ras-MAPK是MAPK家族中最具有代表意义的信号通路,在多种生物和细胞中均发挥重要的调控作用。
本研究中STMN2过表达后,会增加颗粒细胞中ras的mRNA和蛋白表达量,表明STMN2表达量提高后会促进Ras-MAPK通路中ras 的活化,从而激活通路下游的靶基因,对下游靶通路发挥调控作用。
本研究中,STMN2表达量升高后,会相应地提高erk1、erk2、p-erk1、p-erk2、elk-1的 mRNA表达水平及erk1、erk2、p-erk1、p-erk2的蛋白表达水平,从而表明,STMN2会激活下游ras-MAPK信号通。机体内不同的信号通路会存在不同的传导途径,如果几个通路中均包括同一基因或蛋白,那么几个通路会以这个基因或蛋白为连接点,相互交织成信号传导网络,而ras 即为这种在多个信号通路中均发挥关键性信息传导作用的蛋白。当细胞收到外界刺激信号后,胞内的RTKs(酪氨酸激酶受体)被激活,而激活后的RTKs与GRB2相结合,结合的方式可能是直接性的,也可能会是间接性的。RTKs与GRB2的结合体会转移至与ras 相邻的细胞膜上,这个转移过程需要SOS蛋白的促进和帮助,从而形成了SOS-ras复合体,而其中的GDP会被GTP所取代,当GDP与ras结合后即会激活ras,如果结合的GTP被水解成GDP,那么则会使ras 失活。当Ras蛋白被激活后,会激活下游通路,从而发挥生物学效应。
当ras 被激活后首先会促进raf1蛋白从胞浆转移至细胞膜上,然后,raf激酶会促进MAPK激酶的磷酸化,从而激发mek的活性,而mek则会激活erk1、erk2。活化后的erk 同样会激活elk-1、AP-1等与细胞增殖相关的各种因子。因为是几个信号通路交织在一起,所以有多种因子均可以激活raf,而且erk同样可以通过多种上游因子被激活[10,11]。从而我们也可以分析得出信号通路中上游基因与下游靶基因并非固定一一对应激活的关系,也很可能是多个上游基因激活一个下游靶基因,也可能是一个上游基因激活几个或多个下游靶基因[12]。本研究结果显示,通过shRNA干扰降低颗粒细胞中STMN2的表达量后,Ras-MAPK信号通路中erk1、erk2、p-erk1、p-erk2、elk-1、ras的m RNA 及蛋白表达量均明显下降,表明Ras-MAPK信号通路受到抑制,也证明了STMN2对于Ras-MAPK信号通路的信号传导具有调控作用。而Ras-MAPK信号通路则与细胞增殖密切相关,所以我们与可以推断,STMN2通过调控RAS-MAPK信号通路进而调控颗粒细胞的增殖,间接对卵母细胞的成熟发挥作用。
[1]沈浣.颗粒细胞与卵母细胞发育[J].国际生殖健康/计划生育杂志,2012,31(5):344-347.
[2]Roskoski R Jr. ERK1/2 MAP kinases:structure,function,and regulation[J].Pharmacol Res,2012,66(2):105-143.
[3]Nan L,Peng J,Wenjay D,et al.Sival supperesses epithelialmesenchymal transition and metastasis of tumor cells by inhibiting stathmin and stabilizing microtubules[J].Proc Natl AcadSci USA,2011,108(31):12851-12856.
[4]陈建勇,王聪,王娟,等. MAPK 信号通路研究进展[J].中国医药科学,2011,(8):32- 33.
[5]郭永娟,郑亚琳,张彩霞.MAPK信号通路在动物繁殖中的研究进展[J].中国畜牧兽医,2015,42(5):1268-1273.
[6]Gilbert AB,Evans AJ,Perry MM,et al.A method for sepa-rating the granulose cells,the basal lamina and the theca ofthe preovulatory ovarian follicle of the domestic fowl(Gallusdomesticus)[J].Reprod Fertil,1977,50(1):179-181.
[7]马发顺,吴秋菊.海兰褐蛋鸡产蛋前期的生产性能分析[J].中国动物保健,2014,16(12):15-17.
[8]李密.Stathmin与子宫蜕膜化关系的研究进展[J].国际妇产科学杂志,2012,39(3):228-238.
[9]马丽,张春庆. RNA干扰机制及应用研究进展[J].北方园艺,2012,(10):191-193.
[10]徐艳鹏,俞松.Ras 信号传导通路与肿瘤的关系[J].遵义医学院学报,2013,36(3):272-276.
[11]罗峰,谢琪璇,秋山泰身,等.调节卵子发育成熟的信号转导通路[J].生殖与避孕,2011,31(7);495-501.
[12]沈雁,吕宾,丁莺.ERK/MAPK信号转导通路与消化系肿瘤[J].胃肠病学,2011,16(2):115-118.

