检测侵染生姜的烟草花叶病毒ELISA的建立①
韦传宝 邓 辉
(皖西学院生物与制药工程学院,六安237012)
检测侵染生姜的烟草花叶病毒ELISA的建立①
韦传宝 邓 辉
(皖西学院生物与制药工程学院,六安237012)
目的:建立检测侵染生姜的烟草花叶病毒的ELISA方法。方法:用RT-PCR方法检测侵染生姜的烟草花叶病毒,挑选仅含烟草花叶病毒的生姜叶片,采用离心方法提取叶片中的烟草花叶病毒,通过12% SDS-PAGE 和5%~20%梯度SDS-PAGE二次制备电泳分离出烟草花叶病毒的外壳蛋白CP,将含CP的聚丙烯酰胺凝胶磨细后免疫小鼠,获得抗血清。用Western blot检测抗血清特异性,ELISA检测抗血清的结合性,通过亲和层析纯化抗血清中的IgG。以待测生姜叶片液为抗原包被,纯化的抗血清IgG为一抗,羊抗小鼠 IgG为二抗,建立检测侵染生姜的烟草花叶病毒的间接ELISA。结果:抗血清中的IgG仅仅与烟草花叶病毒的CP结合,并能够结合天然烟草花叶病毒颗粒。建立的ELISA对花叶病生姜叶片的检测结果与RT-PCR检测结果一致。结论:成功地建立了检测侵染生姜的烟草花叶病毒的ELISA方法。
烟草花叶病毒;生姜;ELISA方法
生姜(Zingiber officinale Rosc.)为姜科姜属多年生宿根草本植物,是集调味品、食品加工原料和药用为一体的蔬菜。我国是生姜生产和出口大国,随着生姜种植面积扩大,病毒性感染日趋严重。在全世界范围内,烟草花叶病毒(Tobacco mosaic virus,TMV)是侵染生姜并引起严重危害的病毒之一[1]。由于生姜采用无性繁殖,感染病毒逐年积累,危害也逐年加重,病毒病可导致生姜减产30%~50%,且影响品质[2]。目前还没有防治生姜病毒病的有效药物,解决病毒病的途径是通过适当的方法筛选出无病毒生姜进行繁育,建立种子基地,用无病毒良种栽培。
TMV是烟草花叶病毒属(Tobamovirus)的代表种,人们对TMV的研究已经有一个多世纪。TMV世界性分布,其寄主范围十分广,除危害烟草外,可侵染包括姜科、茄科、葫芦科等36科共310种植物。侵染生姜的TMV株系与侵染烟草的TMV基因组序列也有较大的差别[3]。TMV侵染后生姜的症状为花叶、斑块状褪绿或者黄化,苗期感染导致植株矮化,发病后期可产生坏死斑点。TMV基因组由1个单链、正性RNA组成,全长6 395 bp,有4个开放阅读框(ORF),第四个ORF编码了一个17.6 kD的外壳蛋白(CP)。
虽然检测植物病毒的方法有多种,但间接ELISA法是最方便的方法,而且成本也低,每次可以检测几十乃至上百个样品,是一种经济、实用的方法[4]。由于目前还没有建立能检测侵染生姜 的ELISA方法,脱毒生姜种苗的质量多通过目测或者指示植物方法确定,既缺乏科学性又费时[5]。本研究建立检测侵染生姜烟草花叶病毒的ELISA方法,有利于生姜病毒感染的检出。
1 材料与方法
1.1材料 Protein A-Red Sepharose(High Capaci-ty)购自BIOWORD公司;SDS-PAGE Middle Range Protein Molecular Weight Standards购自Gibco公司;GeneRulerTM1 kb DNA Ladder和病毒基因组提取试剂盒购自 MBI公司;羊抗小鼠 IgG(碱性磷酸酶共价结合)、4-硝基苯基磷酸二钠(p-NPP)、5-溴-4氯-3吲哚磷酸 (BCIP)和氮蓝四唑 (NBT)购自Sigma公司,分子量标准品;其他化学试剂均为分析纯。
1.2方法
1.2.1烟草花叶病毒的RT-PCR检测 侵染生姜的烟草花叶病毒的RT-PCR检测按照刘金亮等[6]的方法进行,大致程序是:用试剂盒提取病毒基因组,逆转录合成cDNA,用合成的引物PCR扩增CP基因,鉴定扩增产物。
1.2.2烟草花叶病毒单独侵染生姜叶片的获取 要制备侵染生姜的烟草花叶病毒的抗体,必须提取该病毒,因此必须获取大量由烟草花叶病毒单独侵染生姜病叶的叶片,为此,我们在生姜栽培区——六安市舒城县寻找大田栽培有花叶病症状的生姜,采集叶片进行烟草花叶病毒的RT-PCR检测确定单独被烟草花叶病毒侵染的大田,大量采集生姜病叶,超低温冰箱保存待用。
1.2.3从生姜叶片中提取烟草花叶病毒颗粒 按照韦传宝博士论文中使用的方法提取烟草花叶病毒颗粒,步骤如下:①匀浆 100 g病叶加400 ml预冷的0.5 mol/L磷酸钾缓冲液 (pH7.0,含0.1%巯基乙醇,0.01 mol/L EDTA),用均浆器均浆,双层纱布过滤获得叶汁。②去除叶绿素叶汁加入1/4体积的CCl4,剧烈搅拌5 min后,6 000 r/min离心20 min,去除沉淀的叶绿素,获得上清液。③病毒的初步沉淀 上清液加入0.1% Triton X-100,6% PEG6000,3% NaCl,搅拌30 min后,静置6 h。然后8 000 r/min离心10 min,弃上清,沉淀含病毒颗粒。④病毒的悬浮 沉淀用20 ml 0.5 mol/L磷酸钾缓冲液(pH7.0,含0.1%巯基乙醇,0.001 mol/L EDTA,0.5 mol/L尿素)悬浮后,8 000 r/min离心10 min,保留上清,沉淀再重复1次悬浮处理,合并二次上清液,弃沉淀,上清液含病毒颗粒。⑤病毒的超速离心沉淀 将上清液加到含10 ml 20%蔗糖垫的离心管上层,90 000 r/min离心90 min,弃上清液,沉淀含病毒颗粒。⑥病毒悬浮液获得 沉淀用2 ml蒸馏水悬浮,10 000 r/min离心5 min,上清液为病毒悬浮液,保留上清液,弃沉淀。
1.2.4提取后的病毒颗粒悬浮液的检测 提取的烟草花叶病毒颗粒悬浮液加2×SDS上样缓冲液,充分裂解后置100℃水浴加热10 min,离心(9 000 r/min)7 min,吸取上清液进行12% SDS-PAGE检测电泳,电泳后染色观察,如果病毒提取成功,在电泳图上17.6 kD处将会出现一个烟草花叶病毒CP蛋白条带。
1.2.5烟草花叶病毒外壳蛋白的提取 为了制备高纯度CP蛋白,采取2次制备电泳的方法纯化烟草花叶病毒外壳蛋白,第一次用12% SDS-PAGE制备电泳,第二次用5%~20%梯度SDS-PAGE制备电泳。取0.8 ml提取的烟草花叶病毒悬浮液,加0.8 ml 2×SDS上样缓冲液,充分裂解后置100℃水浴加热10 min,离心 (9 000 r/min)7 min,吸取上清液进行电泳。电泳完毕后,将凝胶置0.25 mol/L KCl 4℃染色 0.5 h,切下烟草花叶病毒外壳蛋白目的条带放入研钵磨细,加1.6 ml 1×SDS上样缓冲液萃取,离心后取上清液(含外壳蛋白)加入5%~20%梯度SDS-PAGE电泳槽进行第2次制备电泳。电泳完毕后,将凝胶置0.25 mol/L KCl 4℃染色0.5 h,切下主蛋白目的条带,分成4份,-30℃下保存。
1.2.6抗烟草花叶病毒血清的制备 将含烟草花叶病毒外壳蛋白的聚丙烯酰胺凝胶磨细后直接免疫小鼠,免疫过程大致如下:取1份含目的蛋白的凝胶和2 ml生理盐水于研钵充分研磨,注射4只小鼠(重18~22 g),第一次注射为腹腔和皮下两点注射,每个点注射0.25 ml磨细的样品悬浮液,后面3次注射都是1点腹腔注射,注射量0.5 ml。两次注射时间相隔7 d,第4次注射后第3天断头取血,离心收集血清。
1.2.7Western blot分析抗血清特异性 特异性是抗血清质量的一个重要标准,对于本研究而言,要求制备的抗血清中IgG仅仅与烟草花叶病毒的CP结合,与其他病毒蛋白质或者植物蛋白不结合。特异性的测定采用Western blot法[7],将纯化的烟草花叶病毒进行12% SDS-PAGE分离、转膜,一抗为制备的抗血清,二抗为与碱性磷酸酶共价结合的羊抗小鼠 IgG,BCIP/NBT显色,将符合条件的抗血清保存备用,其他血清弃之。
1.2.8ELISA检测抗血清结合性 制备的抗血清中的IgG要与天然烟草花叶病毒颗粒的外壳蛋白结合才能够用于检测病叶中的烟草花叶病毒。结合性是抗血清质量的另一个重要标准,对于本研究而言,要求制备的抗血清中IgG能够结合到天然烟草花叶病毒的外壳蛋白上。结合性的测定采用ELISA法[8],将分离的烟草花叶病毒悬浮液用包被液稀释,作为抗原包被到酶标板孔内,空白对照为包被液,制备的抗血清作为一抗与病毒颗粒抗原结合,二抗用1/10 000的羊抗鼠IgG-碱性磷酸酶,加底物p-Npp显色30 min后在酶标仪上测定OD405nm。保留合格的抗血清,其他弃之。
1.2.9IgG纯化 将合格的抗血清混合,测量抗血清体积,用(NH4)2SO4沉淀法除去大部分杂蛋白,初步提取抗血清中IgG。将IgG沉淀用缓冲液(0.01 mol/L Trs-HCl pH7.4)溶解并在缓冲液中透析去除大量的硫酸铵,然后使用对IgG有亲和性的亲和层析凝胶 Protein A Red Sepharose(Protein A 为亲和配体)进一步亲和层析纯化IgG,具体操作按照说明书进行。亲和层析洗脱后的IgG溶液经浓缩、对PBS透析、再浓缩后与甘油按照 1∶1混合,-20℃保存。按照徐宜为[8]的间接 ELISA法测定混合抗体的效价。
1.2.10建立检测TMV的ELISA 野外采集7块大田栽培发生花叶病的生姜叶片,1块健康的大田生姜叶片作为阴性对照(用RT-PCR确定未被TMV侵染),共8个样品。各取0.1 g干净叶片加1.0 ml包被液于研钵进行充分研磨,将叶汁转移到1.5 ml离心管内,3 000 r/min离心3 min,用上清液作为抗原包被酶标板,包被过液,按照常规间接ELISA方法进行操作[8]。制备的抗血清IgG作为一抗与病毒颗粒抗原结合,二抗用1/10 000的羊抗鼠IgG-碱性磷酸酶,加底物p-Npp显色30 min后在酶标仪上测定OD405nm。按照常规标准P/N(被测样品孔吸光度值/阴性对照孔吸光度值)≥2.1判断为阳性[8],说明样品孔含TMV病毒,比值越大说明病毒颗粒越多,比值低于2.1说明样品孔无TMV病毒。对8个样品同时进行了RT-PCR方法检测TMV,确定ELISA方法是否有效。
2 结果
2.1大田生姜病叶的RT-PCR检测结果 按照刘金亮等[1]的方法;经RT-PCR扩增侵染生姜的TMV的CP基因,用1%琼脂糖凝胶电泳检测PCR产物,从发病的生姜叶片中扩增到约570 bp的目的片段,该片段包含烟草花叶病毒的CP基因,还有一段不表达的基因片段,与预期片段大小一致(图1)。该叶片未检测出其他病毒的CP基因,因此发病田块确定为仅仅被TMV侵染的生姜,对应的病叶是本研究需要的病叶,大量采集备用。
2.2侵染生姜的TMV分离结果 提取的烟草花叶病毒颗粒12% SDS-PAGE 结果如图2,在17.6 kD处有一个TMV的CP蛋白条带,说明病毒提取成功。另一方面,从电泳图中可以看出提取的病毒颗粒悬浮液中还含有其他蛋白杂质,这些杂蛋白多数来自生姜叶片中的蛋白。这就是在纯化烟草花叶病毒CP蛋白时,需要先通过12% SDS-PAGE制备电泳,然后再通过5%~20%梯度SDS-PAGE制备电泳进一步纯化的原因。5%~20%梯度SDS-PAGE制备电泳还具有分子筛分离功能,在12% SDS-PAGE制备电泳中分离不开的蛋白质,在5%~20%梯度SDS-PAGE制备电泳中能完全分开。
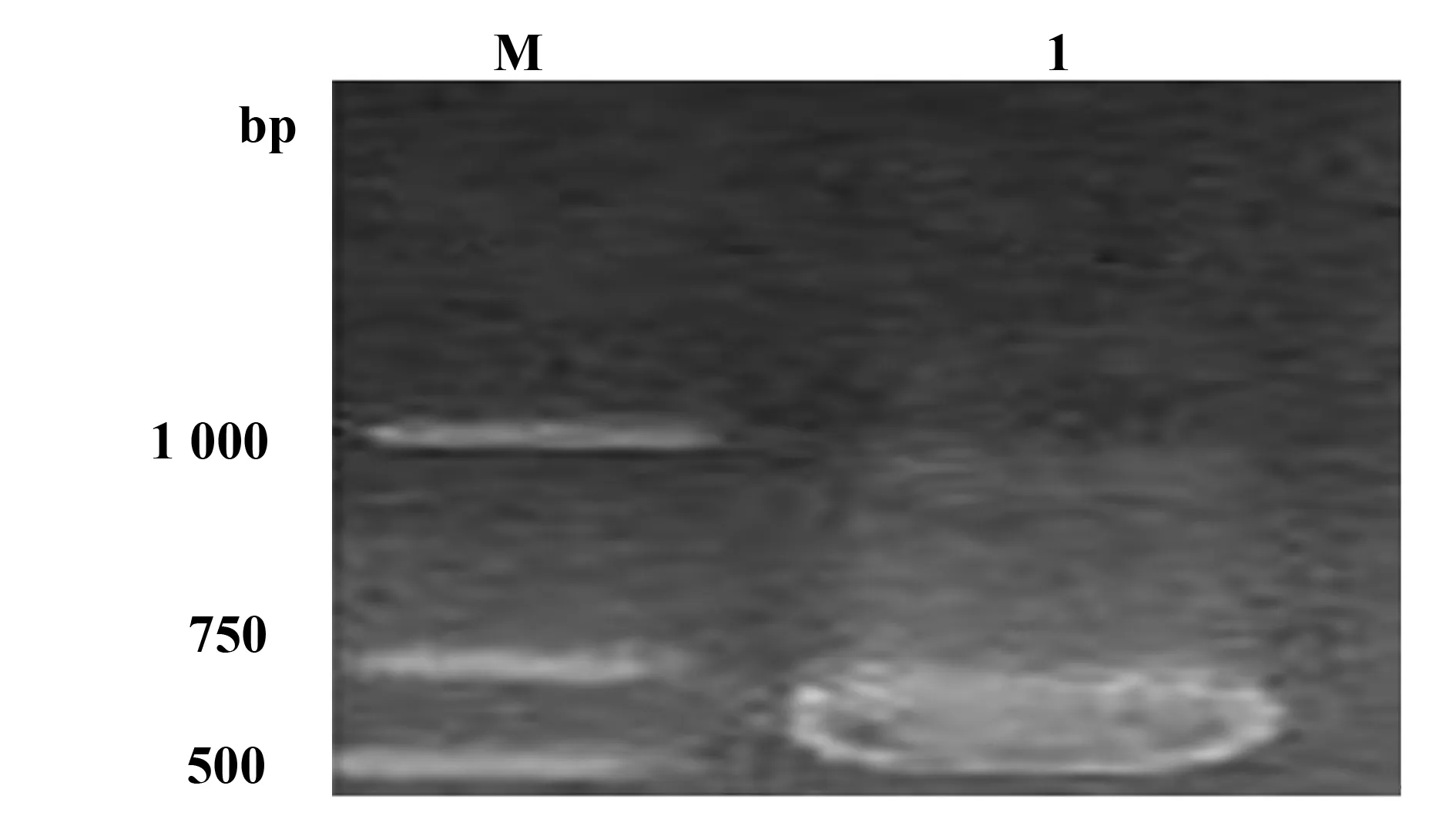
图1 侵染生姜的烟草花叶病毒CP基因RT-PCR扩增产物电泳结果Fig.1 RT-PCR amplification of TMV CP geneNote: M.Marker;1.TMV-CP.
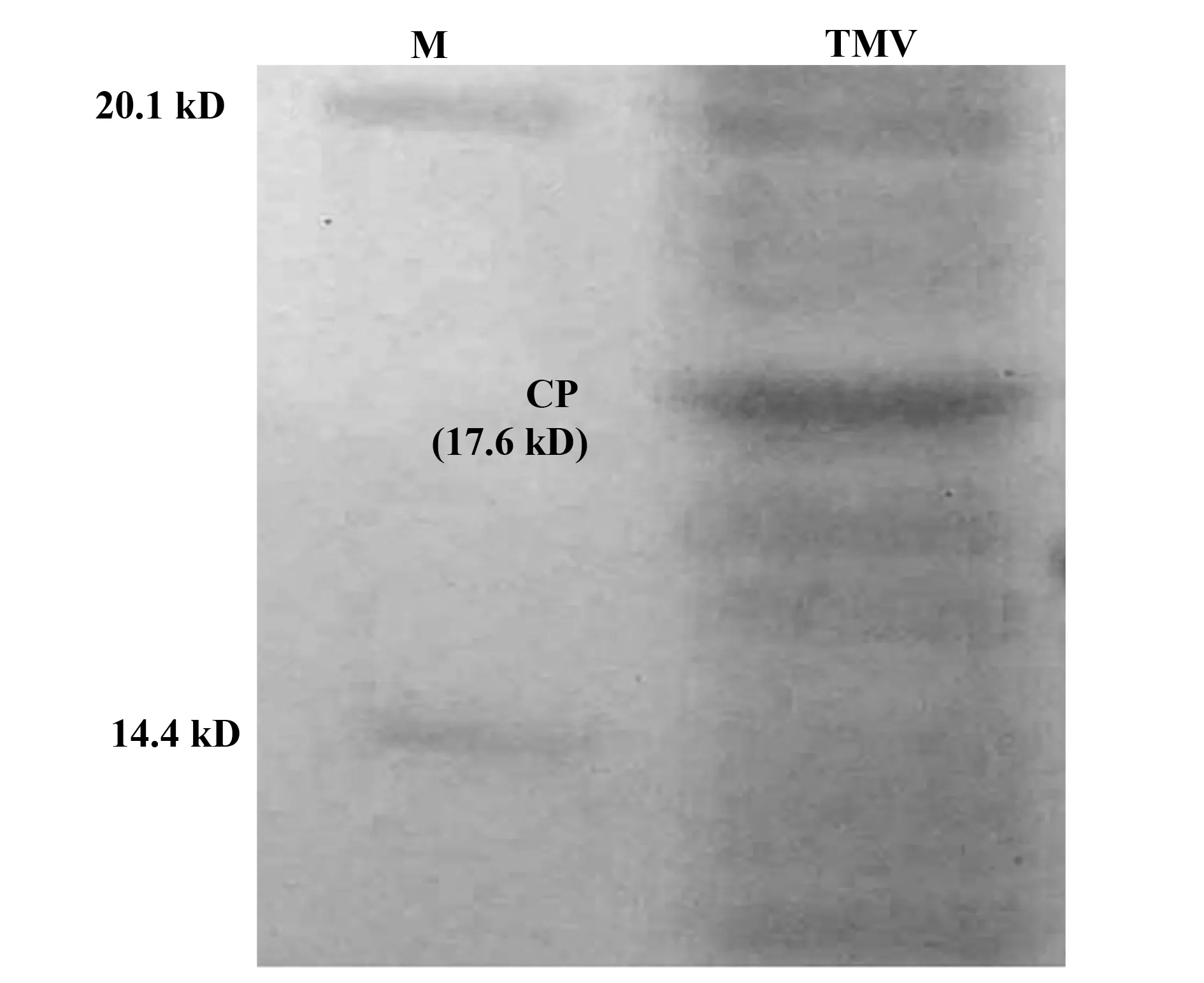
图2 提取的烟草花叶病毒悬浮液12% SDS-PAGEFig.2 12% SDS-PAGE for TMV suspensionNote: M.Protein marker;TMV.TMV suspension lane showing a CP band.
表18组抗血清的ELISA检测结果
Tab.1ELISAtestresultsforeightgroupsantiserumagainstTMVparticle

AntiserumNo.1No.2No.3No.4No.5No.6No.7No.8OD405nm1.351.261.441.561.241.661.321.58P/N8.218.019.359.668.239.298.359.12Testresult++++++++
表2提取的IgG对大田生姜TMV的检测及其与RT-PCR检测的比较
Tab.2TestresultsofTMVusingTMVanti-IgGandcomparisonwithRT-PC

LeavesNegativeCKNo.1No.2No.3No.4No.5No.6No.7ELISAtest(P/N)1.255.324.831.125.335.044.565.11TMVRT-PCRtestnegativepositivepositivenegativepositivepositivepositivepositive

图3 侵染生姜的烟草花叶病毒 CP抗血清的Western blot分析Fig.3 Western blot analysis of antiserum against TMV CPNote: M.Protein marker;1.Purified TMV particle;2.Healthy ginger leaf.
2.3抗血清的Western blot检测结果 本研究制备了8组抗血清,每组平均4只小鼠,同组的小鼠抗血清合并作为一个抗血清样品进行质量检测。8组抗血清的Western blot检测结果基本相同。图3是其中一组抗血清的 Western blot分析图,可以看出,制备的抗血清仅仅与CP特异性结合,与生姜叶片蛋白或者TMV其他蛋白无反应。8组抗血清的Western blot检测结果基本相同,说明该方法制备的抗血清质量稳定。
2.4抗血清的ELISA检测结果 本研究制备了8组抗血清,每组平均4只小鼠,同组的小鼠抗血清合并作为一个抗血清样品进行质量检测。8组抗血清的检测结果见表1。从表1数据可以看出8组抗血清的ELISA检测结果基本相同,说明该方法制备的抗血清质量稳定。
2.5样品的ELISA检测结果 8组抗血清经亲和层析分离,洗脱后的IgG溶液经浓缩、对PBS透析、再浓缩后获得3.5 ml IgG溶液,与甘油按照1∶1混合获得效价 1∶2 800的一抗。用大田生姜叶片的上清液作为抗原包,提取的IgG为一抗,羊抗小鼠 IgG为二抗,检测7个样品和1个阴性对照的TMV,并同时与RT-PCR方法检测结果比较(表2)。
从表2可以看出,用本研究制备的IgG建立的间接ELISA方法检测结果与RT-PCR检测的结果一致,说明本研究建立检测侵染生姜TMV的ELISA方法的有效性和可靠性。
3 结论
本研究用采用离心提取病毒的方法成功提取了生姜叶片中的TMV;建立了12% SDS-PAGE和5%~20% 梯度SDS-PAGE二次制备电泳纯化TMV外壳蛋白CP的方法。因制备电泳纯化的烟草花叶病毒外壳蛋白包含在聚丙烯酰胺凝胶中,不需要将聚丙烯酰胺去除,外壳蛋白从网状的聚丙烯酰胺凝胶中缓慢释放到动物体内,抗原在动物体内停留时间长,充分刺激免疫系统,聚丙烯酰胺凝胶替代了昂贵的福氏佐剂。故本研究将含烟草花叶病毒外壳蛋白的聚丙烯酰胺凝胶磨细后直接免疫小鼠,成功制备出合格抗血清。抗血清能够特异地结合烟草花叶病毒CP蛋白,说明二次制备电泳获得的CP蛋白非常纯,不含其他杂蛋白。ELISA检测说明抗血清中的IgG能够与天然的TMV外壳蛋白结合,即血清中的IgG能够结合天然TMV颗粒。通过亲和层析纯化出抗血清中的IgG,经过浓缩、透析、与甘油混合获得检测TMV的抗体,成功建立了检测侵染生姜TMV的ELISA方法,对其他植物病毒检测也有借鉴意义。
[1] 王 飞,姚明华.辣椒黄瓜花叶病毒RNA提取及RT-PCR体系建立[J].湖南农业科学,2009,48(4):776-777.
[2] 黄 科,刘奕清,陈泽雄,等.茎尖脱毒生姜组培苗病原检测研究[J].北方园艺,2011,(8):148-150.
[3] 韦传宝,姚厚军,杨 宇,等.侵染浙贝母的百合斑驳病毒CP基因的原核表达及抗血清制备[J].中药材,2011,34(8):1182-1186.
[4] 鲁宇文,沈嘉乐,韦传宝,等.洋葱黄矮病毒和韭葱黄条病毒外壳蛋白基因的原核表达及抗血清制备[J].科技通报,2006,22(5):638-641.
[5] 韦传宝,隗洋洋,杨 宇,等.侵染浙贝母的浙贝母病毒Y(FVY)CP基因的原核表达及抗血清制备[J].中药材,2011,34(10):1499-1502.
[6] 刘金亮,王凤婷,魏 毅,等.烟草花叶病毒南瓜分离物CP基因的克隆、序列分析及其原核表达[J].华北农学报,2010,25(5):6-10.
[7] Sambrook J,Fritsch EF,Maniatis T (1989).Molecular cloning:a laboratory manual[M].3rd ed.New York,USA:Cold Spring Harbor Laboratory,2001:20-180.
[8] 徐宜为编著.免疫检测技术[M].第3版.北京:科学出版社,1991:158-183.
[收稿2017-03-06 修回2017-05-05]
(编辑 张晓舟)
EstablishmentofELISAmethodfortestingtobaccomosaicvirus(TMV)infectingZingiberofficinaleRosc
WEIChuan-Bao,DENGHui.
BiologicalandPharmaceuticalEngineeringCollege,WestAnhuiUniversity,Liuan237012,China
Objective:In order to establish ELISA method for testing tobacco mosaic virus (TMV) infecting Zingiber officinale Rosc.Methods: Tobacco mosaic virus(TMV) infecting Zingiber officinale Rosc was tested by RT-PCR.Zingiber officinale Rosc leaves which only contained TMV were choiced.TMV particle was purified by centrifugation method.TMV CP was purified through preparation electrophoresis including 12% SDS-PAGE first and then 5%-20% gradient SDS-PAGE.Polyacrylamide gel contained TMV CP was ground into suspension.Mice were immuned with the suspension and antiserum was obtained.Antiserum quality was tested by Western blot and ELISA test.IgG was purified through affinity chromatography method.IgG solution was concentrated and dialyzed to a suitable concentration.The IgG then mixed with glycerol.Results: IgG in antiserum only combined with TMV CP protein and it could combine with nature TMV particle CP protein.Its quality was up to standard.Conclusion: Establishment of ELISA method for testing TMV infecting Zingiber offcinale Rosc is successfull by using this IgG.
Tobacco mosaic virus(TMV);Zingiber offcinale Rosc.;ELISA method
10.3969/j.issn.1000-484X.2017.09.016
①本文为安徽省教育厅自然科学重点项目(KJ2013A264,KJ2015A454)和安徽自然科学基金项目(1408085MC43)。
韦传宝(1961年-),男,博士,教授,硕士生导师,主要从事植物病毒和蛇毒蛋白的研究,同时就职于皖西学院抗体制备及其质量检测中心,E-mail:weichuanbao@sina.com。
Q785S436.421
A
1000-484X(2017)09-1355-05

