脂质体包埋脑源性神经营养因子靶向透过血脑屏障①
张桂红
(西安外事学院医学院,西安710077)
脂质体包埋脑源性神经营养因子靶向透过血脑屏障①
张桂红
(西安外事学院医学院,西安710077)
目的:对脂质体包埋脑源性神经营养因子进行一定的修饰,观察其透过血脑屏障的组织分布特点。方法:选取西安外事学院医学院进行实验的SD大鼠32只作为研究对象,随机数字法分为脂质体组(n=16)和对照组(n=16)。建立AD大鼠模型,对照组大鼠不给予任何处理,脂质体组经大鼠尾静脉注射10 μg/kg Tf-pGFAP-BDNF-PEG,分析脂质体包埋脑源性神经营养因子靶向脂质体透过血脑屏障的组织分布特点。结果:采用24mCi99mTC标记1 ml神经生长因子,取20 μl上柱分离后采集40~50管收集液,每管0.5 ml,测定放射性技术。将峰所在的8~17管收集液混合回收,结果显示神经营养因子标记率为98.9%。脂质体组第10、14天脑源性神经营养因子免疫阳性表达细胞数,显著高于对照组(P<0.05);脂质体组大鼠脑组织中神经营养因子的基因表达第14天时,显著高于对照组(P<0.05);脂质体组大鼠存在神经营养因子表达,并且神经营养因子表达水平显著高于对照组(P<0.05)。肉眼观察所采脑脊液清亮、无色、透明,且显微镜下未检出红细胞。脂质体组大鼠脑脊液便隐血胶体金检测结果显示阴性,对照组为阳性。结论:转铁蛋白联合聚乙二醇修饰的脂质体合并连接脑特异性启动子,能提高脂质体靶向性。
脂质体包埋;脑源性神经营养因子;血脑屏障;靶向治疗;免疫荧光染色;阿尔茨海默病
脑源性神经营养因子是一种小分子蛋白质,该蛋白质最早是德国神经生物学家从猪脑中分离出的,由脑组织合成,广泛存在于人体中枢神经系统中,且在皮层和海马中含量也相对较高。脑源性神经营养因子和其他蛋白质相比具有独特的生物学特性[1]:(1)毛细血管内细胞上缺少窗孔和吞饮小泡,但是内皮细胞中的线粒体却相对较多;(2)相邻的内皮细胞之间存在紧密的联系,它是由跨膜蛋白与细胞质辅助蛋白合成的一种复合物,形成细胞间最为紧密的连接[2-5]。
脂质体是一种新型的非病毒载体已经被广泛运用于体内大脑传递机制中。相关研究结果显示,将脂质体包裹的青霉素通过静脉途径注射到新西兰白兔中,与注射游离青霉素相比,前者脑组织中青霉素能够得到显著增加[6,7]。同时也有研究显示,脂质体能够转运一些抗肿瘤药物,如紫杉醇、阿奇霉素等[8,9]。体内实验结果显示,将阿奇霉素包裹在脂质体内水相中,脂质体能够增加大脑内阿奇霉素含量,但众多的研究显示脂质体的利用率相对较低[10,11]。同时,临床上对脂质体包埋脑源性神经营养因子向脂质体透过血脑屏障的组织分布尚缺乏报道[12,13]。
实验对脂质体包埋脑源性神经营养因子进行一定的修饰,观察其透过阿尔茨海默病大鼠血脑屏障的组织分布特点,为临床阿尔茨海默病的靶向治疗提供参考。
1 材料与方法
1.1材料
1.1.1实验动物 选取32只SD大鼠,清洁级,体质量(180±30)g,6~8周龄,雌雄随机,均由西安外事学院医学院提供,饲养严格遵守相关标准进行饲养,合格证号为许可证号:SYXK(陕)2011-0039,且相关处理符合《关于善待实验动物的指导下意见》中相关规则[14]。将32只SD大鼠采用随机数字表法分为脂质体组和对照组,每组16只。试验于2015年11月~2016年12月在西安外事学院医学院动物实验室完成。
1.1.2主要仪器和试剂 DMEM培养基,Gibco公司;兔抗鼠脑源性神经营养因子抗体,北京博奥森生物技术有限公司;总RNA提取试剂盒,德国QIAGEN公司;P-疏基乙醇,美国AMRESCO公司;引物合成,上海生工生物工程技术服务有限公司;倒置相差显微镜、荧光显微镜BX51,日本OLYPUMS公司;荧光定量PCR仪,西安天隆科技有限公司。
1.2方法
1.2.1靶向脂质体构建 Tf-pGFAP-BDNF-PEG、Tf-pCMV-BDNF-PEG及Tf-H2O-PEG在前期试验中已经合成完毕,本课题中直接使用[15]。
1.2.2脑源性神经营养因子靶向脂质体Tf-pGFAP-BDNF-PEG的制备 称取10 g豆磷脂,胆固醇以及其他膜材,加入20 ml氯仿,溶解后,加入4 ml 生理盐水,形成稳定乳剂在30℃水浴中减压蒸发,达到胶态后,滴加内水相,旋转帮助器壁上的凝胶脱落,并且在减压下继续蒸发,获得水性混悬液,采用探头式超声仪进行3 min超声,功率为30 W,常温下冷却,加入脂质制备混合悬液,在4℃下搅拌30 min获得脂质体混悬液。将获得的脑源性神经营养因子脂质体进行灭菌,并做成冷干制剂。
1.2.3阿尔茨海默病大鼠模型建立及处理 采用浓度为3.6%水合氯醛进行全身麻醉,待麻醉生效后进行消毒、铺巾。大鼠仰卧固定在手术台上,根据大鼠情况向腹腔内注射500 mg/(kg·d)浓度为5%的D-半乳糖生理盐水溶液,每天注射1次,连续注射30 d,大鼠从造模起连续给水、给药31 d,每天灌胃1次,3 ml/d,建立大鼠阿尔茨海默病模型[16,17]。采用一次性避暗回避试验行为学测试,测定大鼠近期学习记忆能力,判断阿尔茨海默病模型是否成功。如果行为测验变化明显,5 min内电击次数大于正常大鼠2倍,平均潜伏期小于对照组的20%,或者试验大鼠滞留时间低于300 s视为建模成功。对照组大鼠不给予任何处理,脂质体组经大鼠尾静脉注射10 μg/kg神经生长因子脂质体。两组大鼠建模10 d后给予抗生素预防感染,观察大鼠大体情况。
1.2.4组织提取 造模后8周采用4 ml/kg浓度为10%的水合氯醛对大鼠腹腔注射麻醉,将麻醉好的大鼠固定在手术台上,采用70%乙醇对大鼠腹腔进行消毒,分离组织,剪开胸骨,充分暴露心脏,采用镊子小心打开心包,滴加生理盐水,并夹闭胸主动脉,心包穿刺,冲洗后灌注固定液,待灌注完毕后迅速取脑,将其放置在浓度为4%多聚甲醛中进行固定,并将其放置在液氮中保存[18,19]。
1.2.5主要观察指标
1.2.5.1细胞组织学观察 造模后8周将获得的双侧脑组织,分别浸泡在浓度为70%、80%、90%梯度乙醇脱水,并将其放入温度为60℃石蜡中,完全置换组织中的透明剂,并将组织导入包埋器中,连续石蜡切片,切片厚度为3 μm,并将其放置在载玻片上,将切片放置在显微图像上进行采集,并进行阳性细胞计数[20,21]。
1.2.5.2两组大鼠脑源性神经营养因子mRNA的表达 造模后8周将提取的大鼠脑组织的RNA进行琼脂糖凝胶电泳,采用RT-PCR获得相关产物片断琼脂糖凝胶电泳分析,并在电泳图上进行基因条带图像分析[22,23]。
1.2.6观察两组大鼠脑组织中BNDF mRNA水平 造模后8周从-80℃中取出模板RNA,并将其放置在冰浴上,制作Real-time PCR反应液,启动PCR仪预热,根据PCR反应条件进行扩增、电泳,采用actin条带光密度比值表示各组RT-PCR水平[24,25]。
1.2.7脑脊液检查 造模后8周观察脑脊液标准检查结果。
1.3统计学处理 采用SPSS18.0软件对采集到的数据进行分析,其中符合正态分布的数据进行单因素方差分析,P<0.05表示差异存在显著统计学意义。
2 结果
2.1实验动物数量分析 纳入32只SD大鼠,随机分为两组,全部进行结果分析,中途无脱失。
2.2两组SD大鼠脑组织中神经营养因子含量比较 脂质体组经尾静脉注射10 μg脂质体后经过免疫荧光染色结果显示:脂质体包埋神经源性神经营养因子靶向脂质体均能够透过血脑屏障,但是在脑组织不同部位的神经营养因子不尽相同,镜下可见脑源性神经营养因子分布在皮质区,而海马区及白质区脑源性神经营养因子阳性表达不明显,同时脑源性神经营养因子在脑组织左右两侧表达并不明显,而在对照组中并未能检测到神经营养因子。采用24mCi99mTcm标记1 ml 神经生长因子,取20 μl上柱分离后采集 40~50管收集液,每管0.5 ml,测定放射性技术。将峰所在的8~17管收集液混合回收,结果显示神经营养因子标记率为98.9%。脂质体组第10、14天脑源性神经营养因子免疫阳性表达细胞数,显著高于对照组(P<0.05);脂质体组大鼠脑组织中神经营养因子的基因表达第14天时,显著高于对照组(P<0.05);脂质体组大鼠存在神经营养因子表达,并且神经营养因子表达水平,显著高于对照组(P<0.05)。肉眼观察所采脑脊液清亮、无色、透明,且显微镜下未检出红细胞。脂质体组大鼠脑脊液便隐血胶体金检测结果显示阴性,对照组则为阳性。提示:转铁蛋白联合聚乙二醇修饰的脂质体合并连接脑特异性启动子,能提高脂质体靶向性。
2.3神经生长因子标记率 采用24mCi99mTcm标记1 ml神经生长因子,取20 μl上柱分离后采集40~50 管收集液,每管0.5 ml,测定放射性技术。将峰所在的8~17管收集液混合回收,结果显示神经生长因子标记率为98.9%。见图1。
2.4两组大鼠不同时间段脑源性神经营养因子免疫阳性表达细胞数两组SD大鼠第5天、第7天脑源性神经营养因子免疫阳性表达细胞数差异无有统计学意义(P>0.05);脂质体组第10天、第14天脑源性神经营养因子免疫阳性表达细胞数,显著高于对照组(P<0.05),见表1。
从图2可以看出:脂质体组脑源性神经营养因子免疫阳性表达细胞数整体出现上升趋势,而对照组脑源性神经营养因子免疫阳性表达细胞数变化趋势不明显(P<0.05)。
2.5两组大鼠脑源性神经营养因子 mRNA的表达 本研究中,脂质体组大鼠脑组织中神经营养因子的基因表达与对照组在第7天时差异无统计学意义(P>0.05);脂质体组大鼠脑组织中神经营养因子的基因表达第14天时,显著高于对照组(P<0.05),见图3。
2.6两组大鼠脑组织中BNDF mRNA检查结果比较 本实验中,脂质体组大鼠中存在神经营养因子表达,并且神经营养因子表达水平显著高于对照组(P<0.05),见图4。

图1 两组SD大鼠脑组织中神经营养因子含量(×200)Fig.1 SD rat brain tissue in two neurotrophic factor levels (× 200)Note: A.Lipid group;B.Control group.
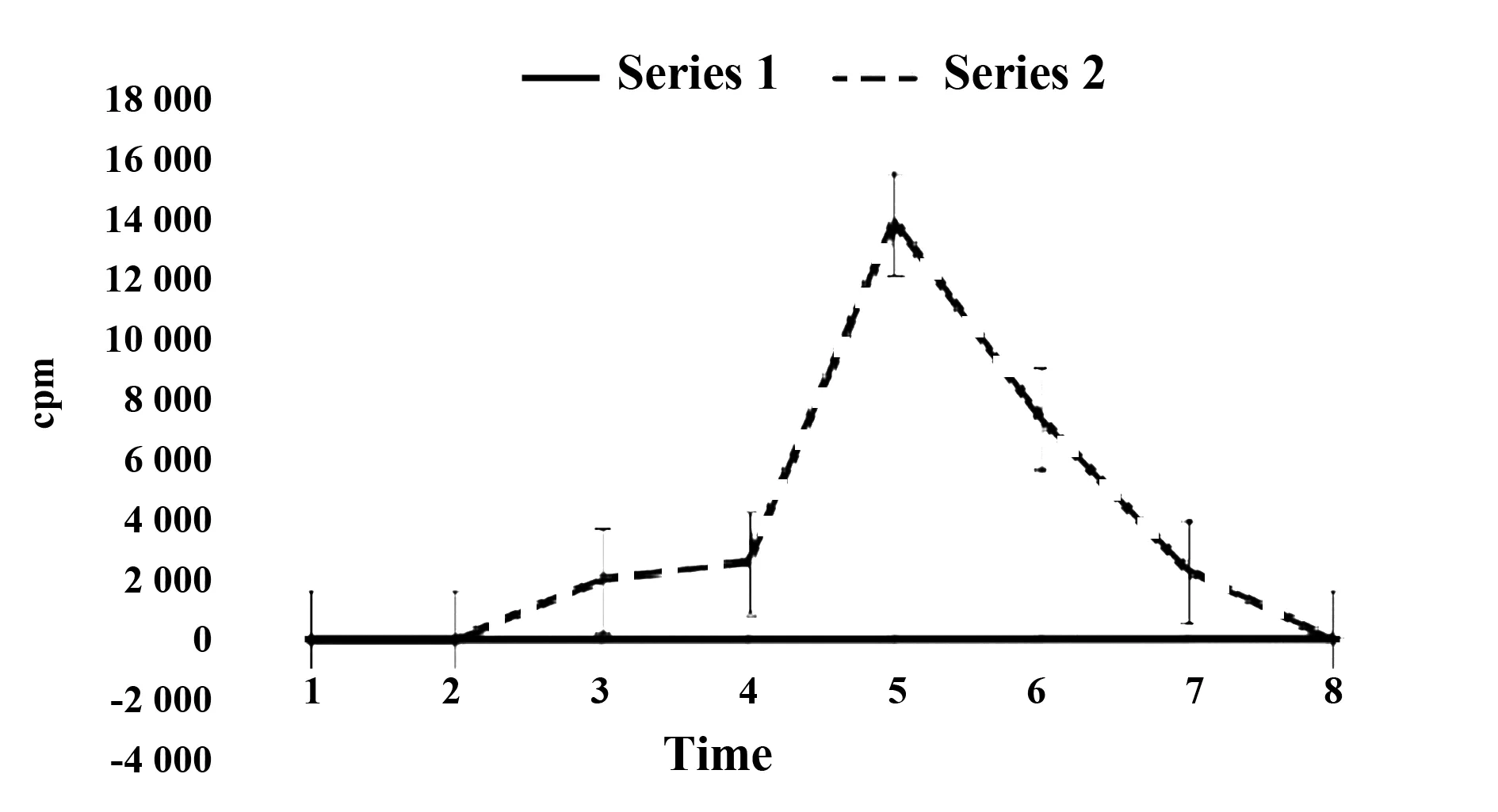
图2 神经营养因子标记率Fig.2 Neurotrophic factor marker rateNote: Series 1 is the control group with neurotrophic factor labeling;Series 2 is the experimental group of nerves Nutritional factor labeling rate.
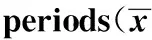

Groups5d7d10d14dLiposomegroup7.22±1.887.36±1.1315.35±1.3624.14±2.98Controlgroup7.11±1.018.08±1.138.13±1.257.17±1.68t0.391.3623.0419.88P>0.05>0.05<0.05<0.05

图3 两组大鼠不同时间段脑源性神经营养因子免疫阳性表达细胞数Fig.3 BDNF immunoreactive cells express two groups of rats in different time periodsNote: With the increase of time, the liposome group of brain-derived neurotrophic factor positive expression of cells.The number was significantly higher than the control group.
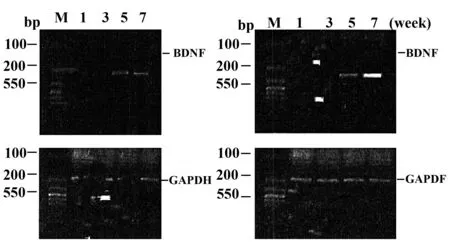
图4 两组大鼠造模后8周脑源性神经营养因子mRNA的表达Fig.4 Expression of two groups of rats eight weeks after modeling BDNF mRNANote: The left side shows corical brain-derived neurotrophic factor mRNA expression;expression of brain-derived neurotrophic factor mRNA in hippocampus of right.1-4,respectively,1,3,5,7 weeks.
2.7脑脊液标准检查 肉眼观察所采脑脊液清亮、无色、透明,且显微镜下未检出红细胞。脂质体组大鼠脑脊液便隐血胶体金检测结果显示阴性,对照组则为阳性。
3 讨论
神经营养因子属于神经营养因子家族,能在中枢神经系统以及周围神经系统中进行持续表达,促进机体神经元的存活[26,27]。同时,神经营养因子与中枢神经系统等多种疾病的发生、发展存在紧密的联系[28-39]。文献报道显示,神经营养因子其实含量相对较低,并且该因子含量能够从胎龄15 d到出生后2周逐渐增加,从而弥漫于脑部各个组织中[30,31]。阿尔茨海默病又称之为老年痴呆症,它主要是由于机体脑部组织发生损伤引起[32,33]。临床上,对于该疾病发病机制尚不完全知晓[34]。研究显示,患者发病后神经营养因子以及受体TrkB表达均出现相应的增加,能够对受损的脑部组织产生一定的保护[35,36]。但是,内源性神经营养因子含量相对较少,难以满足机体需要,且医学界并未能找到有效的组织来源[37,38]。
本实验中脂质体组经尾静脉注射10 μg脂质体后经过免疫荧光染色结果显示,包埋脑源性神经营养因子靶向脂质体均能够透过血脑屏障,但是在脑组织不同部位的脑源性神经营养因子不尽相同,而在对照组中并未能检测到脑源性神经营养因子。脂质体作为一种新型的药物载体,植入机体后能够透过血脑屏障进入脑部组织,并且能够实现药物的靶向给药。脂质体的特点:(1)脂质体属于是一种非病毒性载体,对于人体的毒性较小,不会产生免疫原性,且具备生物降解性[39];(2)脂质体作为载药载体制作相对方便,成本也比较低,能够进一步保护RNA或DNA避免酶的降解;(3)脂质体能够与细胞膜相互融合,进一步进入血脑组织。但是,脂质体植入机体后容易被网状内皮系统吞噬,使得周围携带的药物被周围组织吸收,并且在机体内的循环时间更短。脂质体包埋过程中可以采用转铁蛋白联合聚乙二醇进行修饰。转铁蛋白属于是一种由肝脏合成的糖蛋白,其具有较强的目的性和靶向性,能够具备高度表达作用,能够进一步保护机体内神经因子发挥作用,透过血脑屏障。通过转铁蛋白联合聚乙二醇修饰能够增加脂质体在体内靶向性和稳定性,更加有利于药物靶向植入大脑[40]。
脑源性神经营养因子是脑内分布最为广泛的神经营养因子,在中枢神经系统疾病的研究中已经取得阶段性进展。研究表明:脑源性神经营养因子能实现神经元的保护,能有效地降低机体内的炎症因子水平,能促进损伤神经元的修复和功能重塑,能参与脑缺血损伤的保护剂修复过程。对于正常人而言,机体内的炎症反应处于相对稳定的状态,当患者发生脑缺血后脑源性神经营养因子、TrKB受体表达含量将会进一步增加,能抑制疾病的发生、发展,缩小梗死面积,由此看出:脑源性神经营养因子对损伤后神经元具有神经保护作用,提示脑缺血后,脑源性神经营养因子能进一步增加,它是机体神经元缺血、缺氧后自我保护的重要条件之一,当患者发病后脑源性神经营养因子、受体水平均得到明显的提高,相关学者研究表明:将脑源性神经营养因子给予阿尔茨海默病大鼠模型后,发现阿尔茨海默病病情得到改善,同时有助于恢复患者感觉运动功能。提示脑源性神经营养因子具有抗细胞凋亡的作用,在调节神经和功能性神经功能恢复等方面具有重要的作用。
综上所述,转铁蛋白联合聚乙二醇修饰的脂质体合并连接脑特异性启动子,能够实现脑源性神经营养因子靶向脂质体透过血脑屏障组织分布,减少外周器官捕获,提高脂质体靶向性,可为阿尔茨海默病治疗提供依据。
[1] 沈 岚,林 晓,洪燕龙,等.大川芎方效应组分血浆及脑脊液 HPLC 特征指纹图谱研究 [J].中国中药杂志,2012,37(13):2017-2021.
[2] 熊耀坤,梁 爽,杜 焰,等.HPLC 法测定洋川芎内酯 I 的平衡溶解度和表观油水分配系数 [J].药物分析杂志,2012,32(9):1644-1647.
[3] 梁雪冰,吴 杰,赵国平,等.运用 HPLC 和 GC-MS研究开心散有效抗抑郁成分大鼠吸收情况 [J].辽宁中医杂志,2013,40(2):365-367.
[4] Krabbea G,Matyasha V,Pannasch U,etal.Activation of serotonin receptors promotes microglial injury-induced motility but attenuates phagocytic activity [J].Brain Behav Immun,2012,26(3):419-428.
[5] 任思冲,所起凤,杜文婷,等.槲皮素对血脑屏障的透过及胶质瘤 U251 细胞活性的影响 [J].四川大学学报(医学版),2010,41(5):751-754.
[6] Karnikm S,Wang L,Barch DM,etal.BDNF polymorphism rs6265 and hippocampal structure and memory per-formance in healthy control subjects[J].Psychiatry Res,2010,178(2):425-429.
[7] 何 丹,杜文婷,范雪娇,等.洋葱中黄酮类提取物对血脑屏障透过及神经保护作用研究 [J].中国中西医结合杂志,2011,31(12):1674-1679.
[8] Padowski JM,Pollack GM.Influence of time to achieve substrate distribution equilibrium between brain tissue and blood on quantitation of the blood-brain barrier P-glycoprotein effect [J].Brain Res,2011,1426(34):1-17.
[9] 王玉璘,王少峡,郭 虹,等.血脑屏障中 P-糖蛋白的调节机制 [J].中国药理学通报,2011,27(9):1196-1200.
[10] Leung JWC,Chung SSM,Chung SK.Endothelial endothelin-1 over-expression using receptor tyrosine kinase tie-1 promoter leads to more severe vascular permeability and blood brain barrier breakdown after transient middle cerebral artery occlusion [J].Brain Res,2009,1266(53):121-129.
[11] Martinsa T,Burgoynea T,Kenny BA,etal.Methamphetamine-induced nitric oxide promotes vesicular transport in blood-brain barrier endothelial cells [J].Neuropharmacology,2013,65:74-82.
[12] 王 欣,刘持年,王育虎,等.酸枣仁汤对大鼠脑组织、血中 NO、NOS 与 ET-1 的影响 [J].山东中医药大学学报,2009,33(2):152-153.
[13] Liu R,Zhang L,Lan X,etal.Protection by borneol on cortical neurons against oxygen-glucose deprivation/reperfusion:involvement of anti-oxidation and anti-inflammation through nuclear transcription factor κappa B signaling pathway[J].Neuroscience,2011,176:408-419.
[14] Pandeyg N,Dwivedi Y,Rizavih S,etal.Brain-derived neurotrophic factor gene and protein expression in pediatric and adult depressed subjects[J].Prog Neuropsy Chopharmacol Biol Psychiatry,2010,34(4):645-651.
[15] 陈丽萍,许崇涛.抑郁症患者认知功能的脑功能影像学研究进展[J].国际精神病学杂志,2012,15 (1):17-21.
[16] 周春英,顾永健.抑郁症认知功能研究的进展[J].国际精神病学杂志,2009,9 (4):206-210.
[17] 张玉梅,张志珺,沙维伟,等.抑郁症治疗前后执行功能及其与血清脑源性神经营养因子水平的关系[J].中国神经精神疾病杂志,2009,12(10):613-617.
[18] 周宏辉,张晓斌,沙维伟,等.抑郁症患者治疗前后的血清胶质源性神经营养因子水平及其与执行功能的关系[J].中国神经精神疾病杂志,2010,7(12):741-744.
[19] Miklowitz DJ.Delinquency,depression,and psychosis a-mong adolescents in foster care:what holds three heads together[J].J Am Acad Child Adolesc Psychiatry,2014,53(12):1251-1253.
[20] 邓方渝,王德燧,盛 莉.艾司西酞普兰治疗难治性抑郁症的临床研究[J].当代医学,2010,10 (27):150-151.
[21] Allen AT,Masher KN,Wani KA,etal.Coexpressed D1-and D2-like dopamine receptors antagonistically modulate acetylcholine release in caenorhaditis elegans[J].Genetics,2011,188(3):579-590.
[22] Toppmeyer D,Seidman AD,Pollak M,etal.Safety and efficiency of the multidrugresistance inhibitor Incel(biricodar,VX-710) in combination with paclitaxel for advanced breast cancer refractory to pacli taxel[J].Clin Cancer Res,2002,8(3):670-678.
[23] 陈生弟,王 刚,刘 军,等.帕金森病发病机制及诊治基础与临床研究进展[J].上海交通大学学报:医学版,2012,32(9):1221-1226.
[24] 陶 昕,孟祥志,孙 丽,等.MAPK 信号通路与神经损伤的研究进展[J].解剖学进展,2010,16(6):574-577.
[25] 孔 敏,巴茂文,刘振国.细胞外信号调节激酶通路在帕金森运动并发症的作用[J].中华神经科杂志,2009,42(5):67-70.
[26] 王 茜,张 辉,张作凤,等.p38/MAPK 对帕金森病 MPTP 模型小鼠NF-kB 和 COX-2 调控的研究[J].中国现代医学杂志,2012,22(28):15-20.
[27] Rita P,Teresa CO,Ana CR.Reprint of:revisiting oxidative stress and mitochondrial dysfunction in the pathogenesis of Parkinson disease-resemblance to the effect of amphetamine drugs of abuse[J].Free Radical Biol Med,2013,62(1):186-201.
[28] 关榆根,张建鹏.JNK 信号通路的激活在帕金森发病机制中的作用[J].生物技术通讯,2012,23(6):874-878.
[29] Craig R,Larkin A,Mingo AM,etal.P38/MAKP and NF-kappa B collaborate to induce interleulein-6 gene expression and release.Evidence for a cytoprotective autocrine signaling pathway in a cardiac myocyte model system[J].J Biol Chem,2000,275(31):23814-23824.
[30] Koda M,Kamada T,Hashimoto M,etal.Adenovirus vector-mediated ex vivo gene transfer of brain derived neurotrophic factor to bone marrow stromal cells promotes axonal regeneration after transplantation in completely transected adult rat spinal cord[J].Eur Spine J,2007,16(12):2206-2214.
[31] 刘 镇,宋银枝,古春花,等.心肾阳虚型心衰患者用真武汤治疗前后血浆 B 型钠尿肽与一氧化氮的变化[J].黑龙江医学,2012,36(6):407-408.
[32] 张明发,沈雅琴.甘草酸类和甘草黄酮类化合物对心脏保护作用的研究进展[J].现代药物与临床,2012,27(4):429-434.
[33] 吴志红,连晓芳,孟 岩,等.血清基质金属蛋白酶-9 与慢性心力衰竭相关性分析[J].疑难病杂志,2009,8(3):147-148.
[34] 魏 玲,苏 瑶,付 莉,等.老年慢性心力衰竭的多病因性及心衰类型分析[J].西南国防医药,2010,20(3):259-261.
[35] 李 云.脑卒中患者恢复期血清 BDNF 含量与抑郁发生的相关性分析 [J].中国实用神经疾病杂志,2012,15(20):6-8.
[36] 周德祥,徐 清,张 箐,等.无抽搐电休克治疗对抑郁症患者血清脑源性神经营养因子的影响[J].中国健康心理学杂志,2012,20(10):1456-1458.
[37] Ristevska-Dimitrovska G,Shishkov R,Gerazova VP,etal.Different serum BDNF levels in depression:results from BDNF studies in FYR Macedonia and Bulgaria[J].Psychiatr Danub,2013,25(2):123-127.
[38] 高致炳,徐清斌,徐文中,等.缺血预处理大鼠心肌组织 BDNF 表达及其意义[J].宁夏医科大学学报,2011,33(5):414-417.
[39] 郑耀富,殷 然,王梦洪,等.肝 X 受体通过调控 GLUT-4 减轻心肌缺血/再灌注损伤[J].中国病理生理杂志,2014,30(1):18-24.
[40] Li FJ,Hsu T,Li HX,etal.Protective effect and mechanism of lithium chloride pretreatment on myocardial ischemia-reperfusion injury in rats[J].Asian Pac J Trop Med,2014,7(9):744-748.
[收稿2017-02-21 修回2017-04-07]
(编辑 许四平 刘格格)
Liposome-encapsulatedbrain-derivedneurotrophicfactortargetsblood-brainbarrier
ZHANGGui-Hong.
Xi′anMedicineCollegeofForeignAffairs,Xi′an710077,China
Objective:To observe the characteristics of the tissue distribution of the blood brain barrier through the modification of the liposome encapsulated brain derived neurotrophic factor.Methods: A total of 32 SD rats were selected from Xi′an Medicine College of Foreign Affairs as the research object,and randomly divided into two groups (n=16) and control group (n=16).To establish a rat model of AD rats in the control group
no treatment,liposome group by rat tail vein injection of 10 μg/kg Tf-pGFAP-BDNF-PEG,analysis of liposome entrapped BDNF targeting liposomes through blood brain barrier tissue distribution characteristics.Results: 40-50 nerve growth factor (1 ml) was collected by using 24mCi99mTC and 20 L 0.5 ml was collected on the top of the column.The concentration of 8-17 tube in the peak was recovered,and the results showed that the labeling rate of neurotrophic factor was 98.9%.Liposome group for tenth days,14 days of BDNF immunoreactive cells,significantly higher than the control group (P<0.05);neurotrophic factor in brain tissue of rats in body lipid gene expression at day fourteenth,significantly higher than the control group (P<0.05);expression of neurotrophic factors in liposome group rat,and neurotrophic factor expression level was significantly higher than the control group (P<0.05).The cerebrospinal fluid was clear,colorless and transparent,and no red blood cells were detected under microscope.Liposome group in cerebrospinal fluid of rats with fecal occult blood detection results of gold colloid showed negative,while the control group was positive.Conclusion: The combination of transferrin and polyethylene glycol modified liposomes combined with brain specific promoter can improve the targeting of liposomes.
Liposome embedding;Brain derived neurotrophic factor;Blood-brain barrier;Targeted therapy;Immunofluorescence staining;Alzheimer′s disease
10.3969/j.issn.1000-484X.2017.09.004
①本文为陕西省教育厅基金项目(16JK2172)。
张桂红(1979年-),女,硕士,讲师,主要从事中枢神经系统退行性疾病发病机制及其防治研究,E-mail:hootban@126.com。
R575.5
A
1000-484X(2017)09-1296-06