榄香烯脂质体结合超声空化技术对裸鼠异位瘤的抑制作用及毒性评价
王建中,徐逸,刘鹏程,陈浩波
榄香烯脂质体结合超声空化技术对裸鼠异位瘤的抑制作用及毒性评价
王建中1,徐逸2,刘鹏程1,陈浩波1
(1.浙江中医药大学附属温州中医院 肿瘤内科,浙江 温州 325000;2.温州医科大学附属第一医院 药剂科,浙江 温州 325015)
目的:以榄香烯脂质体(EL)作为对照药物,评价EL结合超声空化技术在抗肿瘤疗效及降低不良反应中的作用。方法:建立大鼠胶质瘤C6细胞裸鼠皮下肿瘤模型并通过尾静脉注射方式给药,EL(浓度为 5 mg/mL)给药剂量为50 mg/kg(0.1 mL/10 g)。实验分5组(n=7):0.9%氯化钠溶液(空白对照)组、榄香烯
脂质体(EL)组、榄香烯脂质体+超声造影剂(EL+MB)组、榄香烯脂质体+超声(EL+US)组、榄香烯脂质体+ 超声造影剂+超声(EL+MB+US)组,每隔2 d给药1次,共给药3次,检测裸鼠肿瘤体积变化、肿瘤质量变化、体质量变化和血液白细胞数等指标,取肿瘤组织,HE染色观察肿瘤组织形态学变化,TUNEL试剂盒检测肿瘤细胞凋亡程度,观察超声造影剂联合超声对EL抗肿瘤的疗效与血液学毒性的影响。结果:与EL组比,EL+MB+US组对肿瘤体积增长的抑制作用强(P<0.05),裸鼠体质量变化小,肿瘤细胞凋亡程度增加,白细胞数降低量减小(P<0.05)。结论:与EL相比,EL+MB+US可以更有效地发挥对肿瘤生长的抑制作用,提高裸鼠生存质量,降低血液学毒性,可以作为一个新的肿瘤药物递送系统进一步开发研究。
榄香烯脂质体;超声;空化效应;药效学
榄香烯(elemene)是以β-榄香烯为主要成分,并含有少量γ-和δ-榄香烯及其他萜类化合物[1]。榄香烯脂质体(elemene liposome,EL)(注射液、口服乳)由于具有一定的靶向性和缓释性,提高了生物利用度,在一定程度上提高了榄香烯的安全性和治疗效率,因此替代了最初的榄香烯普通注射剂型,可是仍然存在药物用量大、注射液对静脉刺激产生炎症、口服生物利用度低等问题[2]。低频(1 MHz) 超声可有效发挥微泡(microbubbles,MB)的空化效应,超声定位空化技术可促进肿瘤组织药物吸收、提高靶向性及克服耐药性[3-4]。本研究主要是建立裸鼠肿瘤模型,以EL为对照,评价EL结合超声空化技术的体内抗肿瘤疗效,同时初步评价其对裸鼠的不良反应。
1 材料和方法
1.1 材料
1.1.1 药品、试剂和细胞株:EL为大连金港制药有限公司产品,脂质MB由温州医科大学药学院赠送,其他化学试剂均为分析纯,购自美国Alfa Aesar公司。大鼠胶质瘤C6细胞株购于中国科学院上海细胞库。细胞培养试剂及耗材购自美国Gibco公司。
1.1.2 主要仪器:超声系统(Acuson Sequoia 512C,德国Siemens公司),血细胞分析仪CA 620(Medonic,瑞典Boule Medical AB公司),独立送回风净化笼具IVC(苏州苏杭器材科技有限公司)。
1.2 方法
1.2.1 大鼠胶质瘤C6细胞裸鼠模型的建立与分组:选取5周龄雄性裸鼠40只(北京维通利华实验动物技术有限公司),动物使用许可证号:SCXK(京)2011-0012,于右侧腋下位置、皮下注射方式注射大鼠胶质瘤C6细胞悬液0.2 mL(每mL细胞悬液含有大鼠胶质瘤C6细胞2×107个),无菌环境中饲养。隔天测量1次裸鼠瘤体积,肿瘤平均体积达到100 mm3以上时,选择瘤体积在100 mm3左右的裸鼠35只作为实验动物。分为5组,每组7只,35只裸鼠的瘤体积值输入Excel表格中,由大到小顺序排列,在表格中计算调整,使5组裸鼠瘤体积均值接近[5]。
1.2.2 处理方法:5组裸鼠通过尾静脉注射方式给药,EL给药剂量50 mg/kg(EL中药物浓度为5 mg/ mL)。每隔2 d给药1次,共给药3次,具体实验分组设置及给药方案见表1。
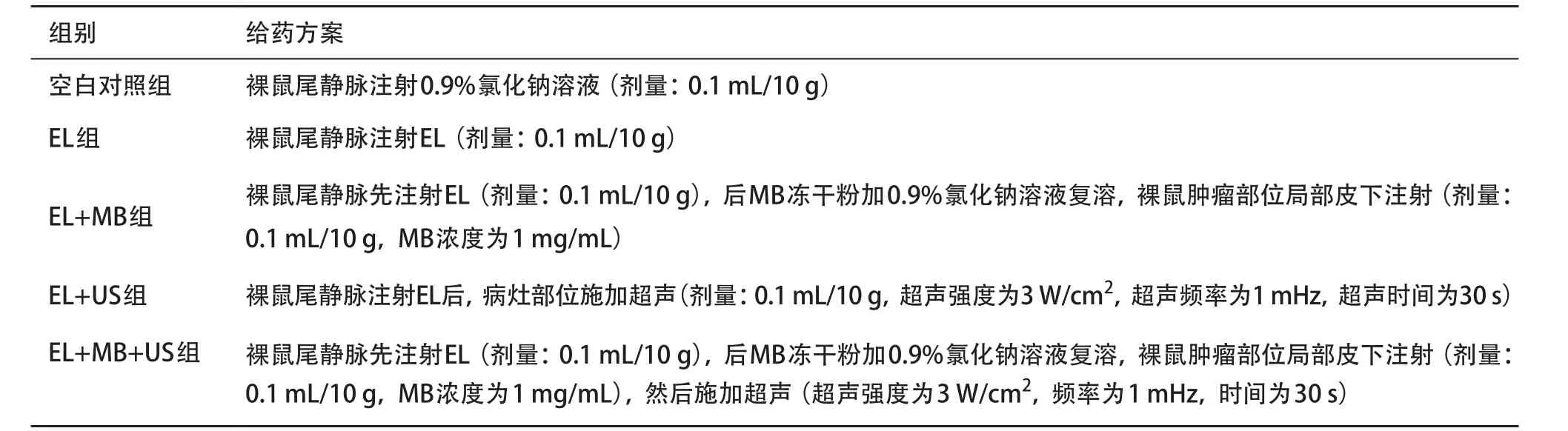
表1 实验分组及给药方案
1.2.3 肿瘤生长抑制评价:给药后每隔1 d测量裸鼠的瘤体积,计算肿瘤的体积相对生长率,最后1次给药后测定肿瘤最终体积,计算最终的肿瘤的体积
相对生长率,然后将瘤体从裸鼠体内剥离,称重,计算肿瘤的瘤重相对生长率。肿瘤体积计算公式:V=(l1+l2)×(w1+w2)2/16,其中l1和l2分别表示肿瘤的2次长轴测定值,w1和w2分别表示肿瘤的2次短轴测定值。第n次给药的肿瘤体积相对生长率=[(Vn- V初始)/(V′n-V′初始)]×100%,其中V和V′分别表示各实验组和空白对照组的肿瘤体积测量值。肿瘤总体体积相对生长率=[(V最终-V初始)/(V′最终-V′初始)]× 100%,肿瘤总体重量相对生长率=(W最终/W′最终)× 100%,其中W最终和W′最终分别表示各实验组和空白对照组最后1次给药后的肿瘤重量测量值。
1.2.4 动物的生存状况评价:以体质量相对增长率 作为动物生存状况的评价指标,记录给药过程中裸 鼠的体质量变化,计算各组实验前后体质量增长率, 体质量相对增长率=(W最终体质量/W′最终体质量)×100%,其 中W最终体质量和W′最终体质量分别表示各实验组和空白对照组的裸鼠最终体质量测量值。
1.2.5 HE染色观察移植瘤病理及TUNEL凋亡实验:将备用的各组裸鼠移植瘤于体视显微镜下观察,组织切成2 mm×2 mm左右小块,放入4%甲醛中固定 24 h,经石蜡包埋后切片,厚度为5 µm,HE染色做常规病理检查,观察移植瘤组织坏死程度。TUNEL凋亡检测:取各组裸鼠移植瘤石蜡切片,按照罗氏(Roche)公司TUNEL试剂盒操作方法,脱蜡、水合→细胞通透→加TUNEL反应液→加converter-POD→与底物DAB反应显色→光学显微镜计数并拍照。
1.2.6 血液毒性初步评价:在处死动物前,眼眶取血,依据CA620血细胞计数仪操作说明及指南,每只裸鼠收集20 μL全血用于细胞计数,初步评估血液系统不良反应。
1.3 统计学处理方法 采用SPSS13.0统计软件进行检验分析。计量资料以形式表示,多组间比较采用单因素方差分析。P<0.05为有差异有统计学意义。
2 结果
2.1 C6肿瘤生长抑制实验 动物接种后1周左右可 见明显豆粒大小肿块,2周以上瘤体积接近100 mm3, 肿瘤处皮肤与正常部位皮肤无差异,皮下肿瘤组织呈突出隆起的结节状,质硬,边缘清晰。瘤体处于腋下位置。
2.1.1 肿瘤体积相对生长率测定实验:各实验组相对于空白对照组每天的肿瘤体积相对生长率曲线见图1,从第4天开始,除空白对照组外,各实验组均能明显地不同程度抑制肿瘤的体积增长;EL组、EL+MB组、EL+US组肿瘤体积相对生长率差异无统计学意义(P>0.05),提示在对应超声强度及MB存在下,对EL的抗肿瘤效果并没有影响;EL+MB+US组对肿瘤的抑制作用要强于EL+MB组、EL+US组和EL组 (P<0.05)。
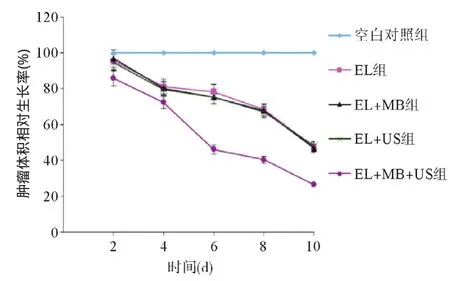
图1 给药过程中各组肿瘤体积相对生长率曲线
2.1.2 肿瘤重量相对生长率测定实验:与空白对照组比,各实验组均能够显著抑制肿瘤的重量增长(P<0.05);EL+US组、EL+MB组与EL组比较,对肿瘤重量的抑制作用差异无统计学意义(P>0.05);EL+ MB+US组与EL组、EL+MB组、EL+US组比,对肿瘤重量的抑制作用显著增强,差异均有统计学意义(P<0.05),见图2。
2.2 动物生存状况
2.2.1 动物活体外观观察:各实验组和空白对照组接种大鼠胶质瘤C6细胞后,观察瘤体的生长情况及肿瘤的生长对小鼠活动的影响发现,空白对照组肿瘤增长迅速,皮下肿瘤组织呈非常明显的结节状突起,瘤体积硕大,给小鼠的正常活动造成了严重影响。尽管小鼠总的体质量没有下降,但是身体正常组织呈现一定程度的消瘦迹象。EL+MB+US组给药后肿瘤生长较空白对照组缓慢,瘤体积较小,小鼠的正常活动基本没有影响,但身体正常组织由于药物的不良反应也呈现一定的消瘦迹象。
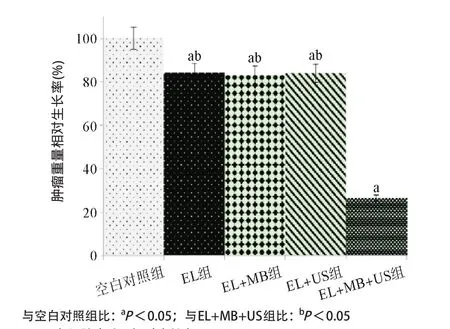
图2 各组肿瘤重量相对生长率
2.2.2 小鼠的体质量测量与比较:在给药结束后,对各组小鼠的体质量进行测量,发现除空白对照组体质量明显增加外,各实验组均出现了明显的体质量下降(P<0.05),EL组、EL+MB组、EL+US组之间差异无统计学意义(P>0.05),EL+MB+US组与其他实验组比较差异均有统计学意义(P<0.05),见图3。
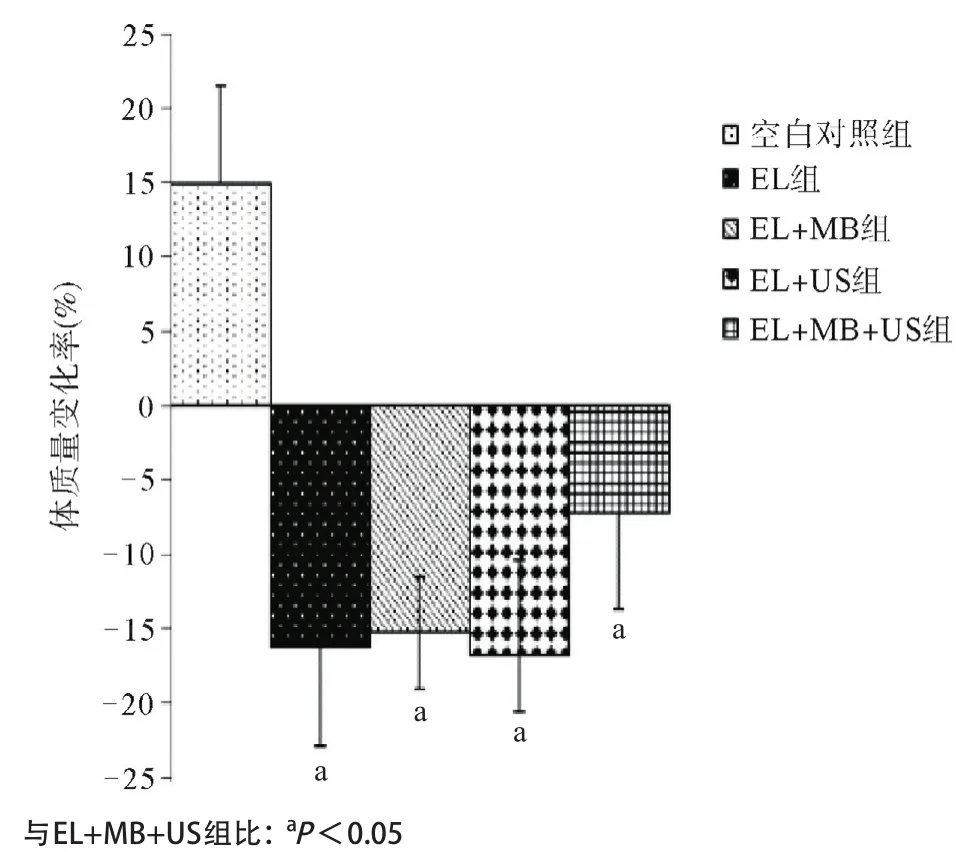
图3 各组给药前后体质量增长率
2.2.3 HE染色观察移植瘤病理及TUNEL凋亡实验:空白对照组由紧密堆积的肿瘤细胞组成,因肿瘤的快速生长导致一些肿瘤坏死区,各实验组肿瘤组织凋亡率均高于空白对照组,肿瘤组织中均出现广泛的核收缩和碎片,提示发生不同程度坏死,其中EL+ MB+US组坏死程度最高,EL组、EL+MB组和EL+US组也可见肿瘤坏死组织,但坏死面积小于EL+MB+US组,见图4。TUNEL凋亡实验结果同时验证,与空白对照组相比,EL+MB+US组中肿瘤组织细胞凋亡率最高;EL组、EL+MB组和EL+US组肿瘤组织中肿瘤组织细胞凋亡率也明显高于空白对照组,但凋亡程度此3组相差不大,见图5。
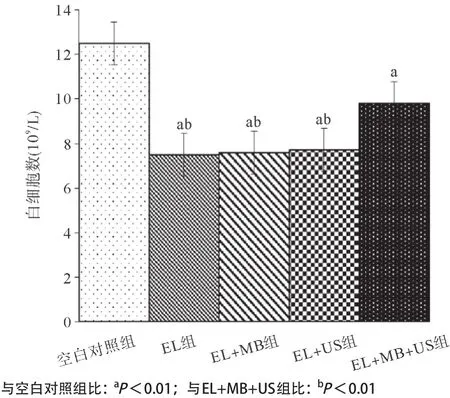
2.2.4 血液系统不良反应初步评价:与空白对照组比,实验组白细胞计数降低,差异有统计学意义(P<0.01)。EL+MB+US组与其他治疗组比白细胞减少的程度均显著减弱,差异有统计学意义(P<0.01),见图6。
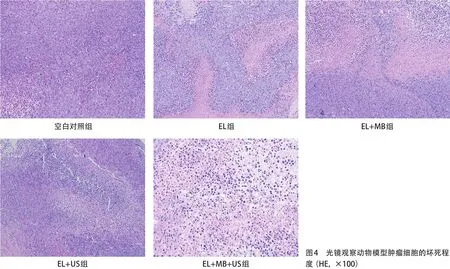
图4 光镜观察动物模型肿瘤细胞的坏死程度(HE,×100)
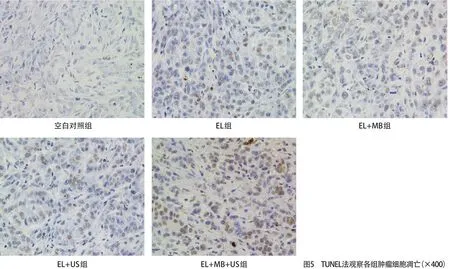
图5 TUNEL法观察各组肿瘤细胞凋亡(×400)
3 讨论
本研究通过建立裸鼠异位瘤模型,结合物理靶向(超声空化)技术,观察EL的疗效与不良反应。在本课题组的前期研究中,已探索了作用于裸鼠的安全超声参数,超声频率为14 MHz,超声时间为 10 s,间隔1 s超声3次[6]。前期体外细胞实验研究显示,EL+MB+US组体外仍保留较好的抗肿瘤细胞的活性,对大鼠胶质瘤C6细胞的半抑制浓度(IC50)为 130.5 μg/mL,低于EL的220.8 µg/mL。
由于机体的生理特征以及肿瘤的异质性,递送系统从给药到靶点发挥作用需要克服多重生理及病理屏障,包括血液肿瘤组织细胞和胞内转运等屏 障[7]。对于脑部疾病治疗,需要克服血脑屏障,因此挑战更大。神经胶质瘤是颅内常见肿瘤,治疗手段有限,预后极差[8]。近年来为克服药物递送屏障提出的很多新思路与新方法,为设计克服肿瘤生理病理屏障的递送系统实现对药物的有效递送和肿瘤的高效安全治疗也有很多理论和实践参考,超声空化技术因为其安全性和精准定位性得到研究者重视,近年来取得较多进展[10-11]。榄香烯本身存在非水溶性、稳定性差、生物利用度低等缺点,近些年科研工作者尝试研制多种新型榄香烯制剂,以期开发出更多可以应用于临床、安全性好、治疗疾病类型广、治疗效率高的榄香烯新型制剂[2-3]。
本研究成功建立了人大鼠胶质瘤C6细胞皮下接种裸鼠肿瘤模型,通过裸鼠肿瘤体积变化、肿瘤重量变化、体质量变化和血液中白细胞数等指标的检测,考察了EL+MB+US与EL在治疗肿瘤中的差异,发现EL+MB+US相比单纯EL可以提高治疗效果,改善动物生存质量。
EL+MB+US对大鼠胶质瘤C6细胞接种的皮下肿瘤模型显示了很强的肿瘤抑制作用,实验过程中未观察到明显的EL相关不良反应。分析其原因推断如下:首先,本研究选择低强度超声,单纯超声对于肿瘤细胞孔径影响较小,不能促进EL进入肿瘤细胞,而MB在超声作用下爆破,增强了空化效应,促进了EL进入肿瘤细胞;其次,MB中的所含成分泊洛沙姆本身也具有一定的生物效应[12],具有一定的增敏作用,在肿瘤组织内部可在一定程度上抑制细胞外排泵的外排,这可能由于在MB爆破后体现出这种作用,单纯MB发挥作用不明显;此外,研究发现泊洛沙姆具有调节凋亡信号的能力[6],进而促进肿瘤细胞的凋亡。总而言之,EL+MB+US可以有效地提高肿瘤的治疗效率,超声结合微泡对于肿瘤靶向治疗具有研究意义。
[1] 谢恬, 李铖璐, 王淑玲, 等. 榄香烯脂质体系列靶向抗癌天然药物基础研究进展[J]. 中国中西医结合杂志, 2014, 34 (4): 507-512.
[2] CHEN J J, DUAN Y Y, HUANG M. Synthesis of 13-betaelemene ester derivatives and evaluation of their antioxidant activity in human umbilical vein endothelial cells[J]. Chin J Nat Med, 2015, 13(8): 618-627.
[3] ZHAO Y Z, LIANG H D, MEI X G, et al. Preparation, characterization and in vivo observation of phospholipid-based gas-filled microbubbles containing hirudin[J]. Ultrasound Med Biol, 2005, 31(9): 1237-1243.
[4] ZHAO Y Z, LIN Q, WONG H L, et al. Glioma-targeted therapy using Cilengitide nanoparticles combined with UTMD enhanced delivery[J]. J Control Release, 2016, 224: 112-125.
[5] 马源, 陈俊杰, 陈成水, 等. STAT1基因转染对人肺腺癌裸鼠移植瘤生长的影响[J]. 温州医学院学报, 2013, 43(7): 461-463.
[6] ZHAO Y Z, LU C T, ZHOU Z C, et al. Enhancing chemotherapeutic drug inhibition on tumor growth by ultrasound: an in vivo experiment[J]. J Drug Target, 2011, 19(2): 154-160.
[7] 朱雁林, 傅红兴, 周伟忠, 等. 雷帕霉素栓剂的制备及质量评价[J]. 温州医科大学学报,2014, 44(2): 148-150.
[8] 陈渊, 王伟, 涂明, 等. siRNA靶向沉默成纤维细胞激活蛋白α对胶质瘤细胞U87增殖的影响[J]. 温州医科大学学报, 2014, 44(4): 241-244.
[9] LU J J, DANG Y Y, HUANG M, et al. Anti-cancer properties of terpenoids isolated from Rhizoma Curcumae-a review[J]. J Ethnopharmacol, 2012, 143(2): 406-411.
[10] 丁尚伟, 黄晓宇, 姚梦云, 等. 超声靶向转染缺氧诱导因子干扰基因治疗大鼠肝癌的研究[J]. 华中科技大学学报(医学版), 2014, 43(1): 12-16.
[11] FIDLER I J. Biological behavior of malignant melanoma cells correlated to their survival in vivo[J]. Cancer Res, 1975, 35(1): 218-224.
[12] MINKO T, BATRAKOVA E V, LI S, et al. Pluronic block copolymers alter apoptotic signal transduction of doxorubicin in drug-resistant cancer cells[J]. J Control Release, 2005, 105(3): 269-278.
(本文编辑:赵翠翠)
Evaluation of the inhibitory action and toxicity of elemene liposome combining ultrasound cavitation on the ectopic tumor of the nude mice model
WANG Jianzhong1, XU Yi2, LIU Pengcheng1, CHEN Haobo1.
1.Department of Oncology, Wenzhou Traditional Chinese Medicine Hospital Affiliated to Zhejiang Chinese Medicine University, Wenzhou, 325000; 2.Department of Pharmacy, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To evaluate the inhibitory action and toxicity of elemene liposome (EL) combining ultrasonic cavitation on the entopic tumor for the nude mice model. Methods: The inhibitory efficacy was studied using C6 cells bearing armpit tumor model. Mice were assigned to 5 groups (n=7) as follows: group 1 for saline, group 2 for EL, group 3 for EL+MB, group 4 for EL+US and group 5 for EL+MB+US. Mice were administered via tail vein at the dosage of 50 mg/kg amount to 0.1 mL/10 g (injection solution/mice weight), 1 time per 2 d, 3 times in all. Tumor volume, tumor weight change, body weight growth rate were all measued. The white blood cell count (WBC) at the end point was also tested. Results: Compared with EL, EL+MB+US showed higher tumor growth inhibition, fewer mice body weight change and white blood count change (P<0.05) in the armpit tumor model. Conclusion: With better anti-tumor activity and lower blood toxicity, EL+MB+US may be developed as a new cancer targeted delivery system.
elemene liposome; ultrasound; cavitation effect; pharmacodynamics
R739.41
A
10.3969/j.issn.2095-9400.2017.08.005
2016-09-15
浙江省中医药科技计划项目(2014ZB112)。
王建中(1971-),男,浙江温州人,主任医师,硕士。

