肉用绵羊超数排卵效果实例分析
郭延华,万鹏程,刘长彬
(省部共建绵羊遗传改良与健康养殖国家重点实验室/新疆农垦科学院畜牧兽医研究所,新疆石河子 832000)
肉用绵羊超数排卵效果实例分析
郭延华,万鹏程,刘长彬
(省部共建绵羊遗传改良与健康养殖国家重点实验室/新疆农垦科学院畜牧兽医研究所,新疆石河子 832000)
【目的】超排胚胎移植技术是提高绵羊遗传潜力的一项重要应用技术,但影响供体超数排卵的因素很多,也需要大量数据支持。【方法】以影响供体超排的因素做回顾性调查分析,从激素来源、肉羊品种、日粮水平、年龄、超排间隔和超排剂量等6个方面观察对供体超排的影响。【结果】国产FSH超排效果与进口FSH差异不显著(P>0.05),肉羊品种间无显著差异性(P>0.05),年龄对供体超排反应影响显著(P<0.05),营养对供体的超排反应显著(P<0.05),供体以短间隔超排重复利用获得胚胎数量最多,增加超排剂量能显著改善超排反应(P<0.05),但对重复利用供体差异不明显(P>0.05)。【结论】对超排反应有影响的因素分为显著的和不显著的因素,显著的因素包括年龄、营养、超排间隔、超排剂量,而不显著的因素为品种。
绵羊;超排胚胎移植;超排反应;影响因素
0 引 言
【研究意义】目前我国绵羊的地方品种42个,而新疆绵羊的地方品种有13个,居全国之首,但为了提高肉用性能、实现高效集约化以及风味的同质化,需要引进萨福克、道赛特、特克赛尔、杜泊等几个知名肉羊品种进行杂交改良,良种的引进尤其是胚胎移植技术在种源上起到了关键作用。【前人研究进展】在超排胚胎移植技术中,供体对超排促性腺激素的应答水平是影响超数排卵数量和质量的关键因素,但对供体促性腺激素的应答水平具有影响作用的因素主要包括两类[1,2],即供体的品种、年龄、营养水平与超排次数和促性腺激素的种类(不同激素)、促性腺激素来源(厂家和动物来源)、超排剂量、超排程序等。为了提高胚胎移植效率,研究人员开展了广泛、系统而深入的研究[1,2],并且已经达到商业化生产阶段。【本研究切入点】但在实际生产过程中,各个地区的受限因素并不相同,也就造成胚胎移植成功率不尽相同。目前有关于供体的受限因素各文献报道不尽相同,且需要系统详尽的追溯研究。以实践中收集的大量数据资料进行回顾性分析,以影响肉羊超排产生胚胎的潜力,展开数据分析,【拟解决的关键问题】以期充分发挥供体的潜力,提高肉羊遗传资源,为肉羊品种改良奠定基础。
1 材料与方法
1.1 材 料
供体羊:供体母羊由澳大利引进的黑头萨福克和白头萨福克、杜泊和道赛特,年龄为8月龄以上或成年母羊,健康无繁殖疾病,试验基地为克拉玛依肉羊研究所与昌吉华牛天俊生物技术有限公司。
描述方式参照文献[3],高营养日粮组总量为3.5 kg/只,日粮结构为青贮1.5 kg、苜蓿草0.5 kg,玉米0.3 kg,玉米秸秆1.2 kg,微量元素为六旺饲料企业生产舔食砖自由舔食;普通营养日粮组总量为2.5 kg/只,日粮结构为青贮1.5 kg、苜蓿草0.5 kg、精料和微量元素为大北农羊用全价哺乳料0.5 kg;低营养日粮组总量为2.0 kg/只,日粮结构为青贮1.5 kg,苜蓿粉0.5 kg,无玉米补充,微量元素为食盐和微量骨粉。
1.2 方 法
1.2.1 超排激素药品
超排药物 FSH由加拿大(每支400 mg/20 mL,批号F10244-10140),中科院(每支20 mL/10 mg,批号:150403),宁波激素(每支100 IU,生产批号B160109-B160112)生产。孕酮海绵栓为宁波激素制品有限公司生产(42 mg/支),PMSG由宁波激素制品有限公司生产(1 000 IU/支,生产批号150310-150311),胚胎保存液(ICP bio New Zealand),冲胚液为含0.3%BSA的PBS(GBICO)液。
1.2.2 供体羊的超排与冲胚
供体羊埋植孕酮栓进行集中同期发情,在埋植孕酮栓的第12 d开始进行超排处理,采用剂量逐日递减法处理3.5 d,每天上下午各肌肉注射1次。在执行超排程序第6针时撤栓,撤栓同时肌肉注射PMSG 500 IU,撤栓后观察并记录发情情况。将发情的母羊在次日进行子宫角输精。供体羊发情配种(第0 d)的2~3 d,由输卵管收集2~8细胞期胚胎或配种的6 d从子宫角收集致密桑葚胚/囊胚。图1
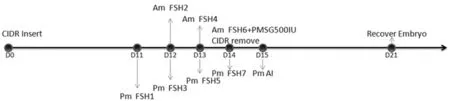
图1 体内胚回收程序
Fig.1 Protocol to recover In Vivo embryos
1.3 数据处理
采用SPSS19.0统计软件进行差异显著性分析。P<0.01 为差异极显著;0.01
2 结果与分析
2.1不同来源促卵泡素对供体黄体应答的影响
研究表明,在黄体平均数方面FSH药品F检验中科院组与加拿大FSH组差异不显著(P>0.05)。在胚胎平均数方面,F检验结果显示中科院组与加拿大FSH组差异不显著(P>0.05)。标准差显示中科院组个体反应适中,加拿大FSH组个体反应较小。表1
2.2不同品种供体对超数排卵的应答水平影响
研究表明,在黄体平均数方面,方差检验不同品种肉羊组间,黑头萨福克与白头萨福克品种差异不显著(P>0.05),白头杜泊与陶赛特品种差异不显著(P>0.05),但陶赛特与两个萨福克品种差异显著(P<0.05)。在胚胎平均数方面,各品种肉羊组差异不显著。表2
2.3同一促性腺激素剂量对不同年龄供体超排反应的影响
研究表明,青年羊组和成年羊组的黄体平均数T检验存在显著差异性(P<0.05),但同等FSH 剂量对青年羊的超排效果优于成年羊的超排效果;青年羊组和成年羊组的胚胎平均数存在显著差异性(P<0.05),青年羊组的胚胎数高于成年羊组的胚胎数。青年羊组的黄体平均数量和胚胎平均数标准差都高于成年羊组的标准差。表3
表1 不同来源促卵泡素下供体超排反应
Table 1 Effect of different FSH source on superovulatory response in sheep
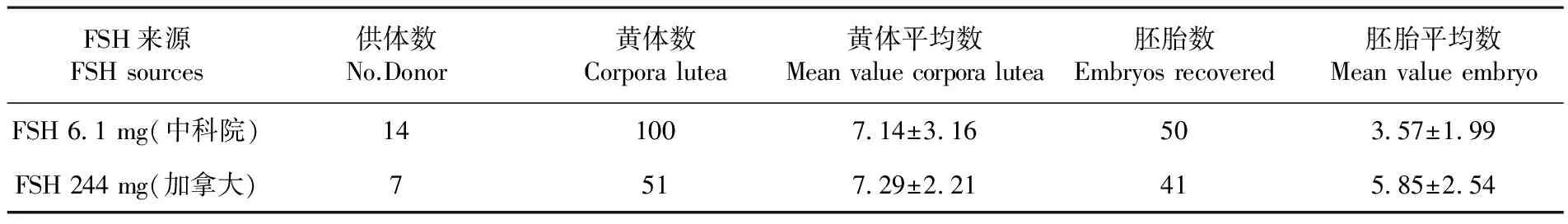
FSH来源FSHsources供体数No.Donor黄体数Corporalutea黄体平均数Meanvaluecorporalutea胚胎数Embryosrecovered胚胎平均数MeanvalueembryoFSH6 1mg(中科院)141007 14±3 16503 57±1 99FSH244mg(加拿大)7517 29±2 21415 85±2 54
表2 FSH下不同品种肉羊超排反应
Table 2 Effect of same dose FSH on superovulatory response in sheep among different breeds
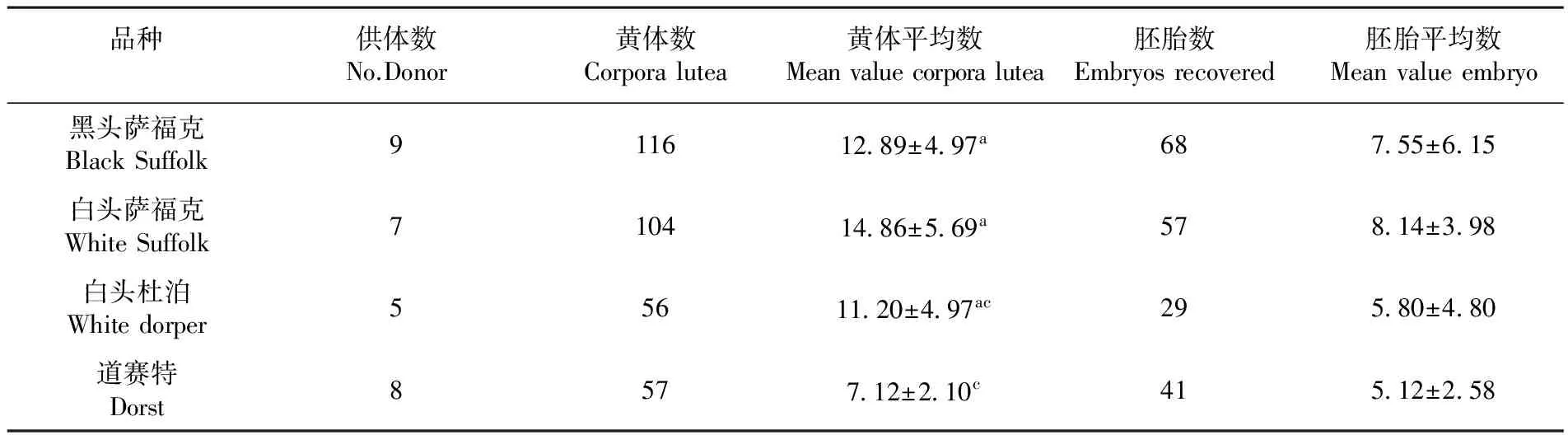
品种供体数No.Donor黄体数Corporalutea黄体平均数Meanvaluecorporalutea胚胎数Embryosrecovered胚胎平均数Meanvalueembryo黑头萨福克BlackSuffolk911612 89±4 97a687 55±6 15白头萨福克WhiteSuffolk710414 86±5 69a578 14±3 98白头杜泊Whitedorper55611 20±4 97ac295 80±4 80道赛特Dorst8577 12±2 10c415 12±2 58
表3 同一剂量下不同年龄供体超排反应
Table 3 Ability of superovulatory response on the same FSH dosage between young and adult ewe
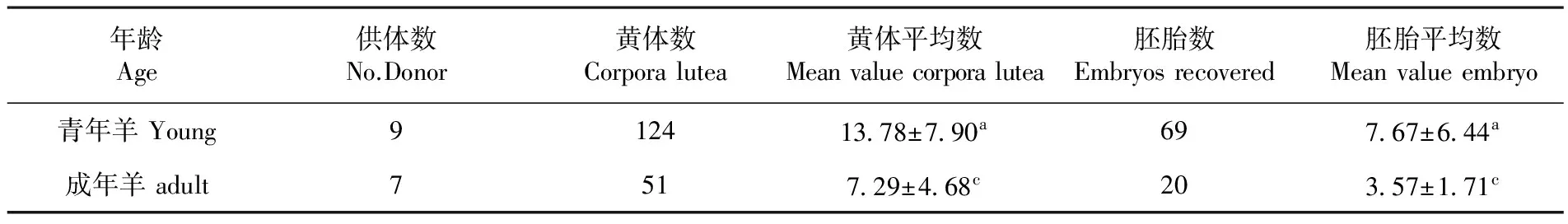
年龄Age供体数No.Donor黄体数Corporalutea黄体平均数Meanvaluecorporalutea胚胎数Embryosrecovered胚胎平均数Meanvalueembryo青年羊Young912413 78±7 90a697 67±6 44a成年羊adult7517 29±4 68c203 57±1 71c
2.4不同基础日粮对供体回收胚胎的水平影响
研究显示,在黄体平均数方面,方差检验自制饲料高营养水平组与自制饲料低营养水平组和配合饲料组差异显著(P<0.05),而自制饲料低营养水平组和配合饲料组差异不显著(P>0.05)。在胚胎贡献率方面,方差检验自制饲料高营养水平组、自制饲料低营养水平组和配合饲料组差异不显著(P>0.05)。表4
表4 不同基础日粮下供体超排反应
Table 4 The ability of superovulatory response on different ration requirement of donor
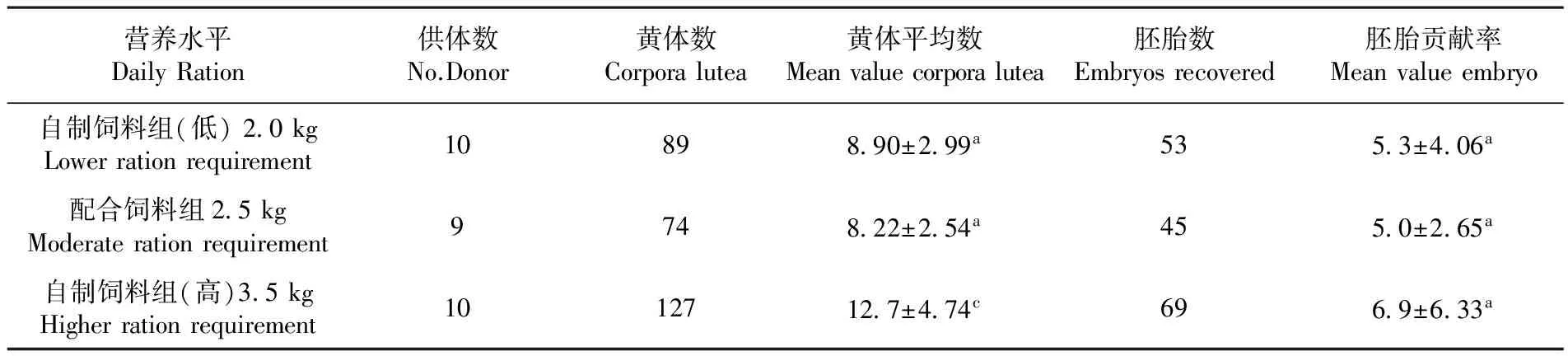
营养水平DailyRation供体数No.Donor黄体数Corporalutea黄体平均数Meanvaluecorporalutea胚胎数Embryosrecovered胚胎贡献率Meanvalueembryo自制饲料组(低)2 0kgLowerrationrequirement10898 90±2 99a535 3±4 06a配合饲料组2 5kgModeraterationrequirement9748 22±2 54a455 0±2 65a自制饲料组(高)3 5kgHigherrationrequirement1012712 7±4 74c696 9±6 33a
2.5 超排次数对供体生产胚胎的影响
研究表明,在黄体平均数方面,方差检验使用间隔1年3次组各组差异不显著(P>0.05),使用间隔1年1次各组差异不显著(P>0.05);在平均贡献率方面,T检验使用间隔1年3次各组与使用间隔1年1次各组差异显著(P<0.05),年贡献率差异极显著(P<0.01)。在胚胎平均数方面,方差检验使用间隔1年3次组第1次与第2差异不显著(P>0.05),但与第三次差异极显著(P<0.01),使用间隔1年1次组各组差异不显著(P>0.05);在平均贡献率方面,T检验使用1年3次组各组与使用1年1次组各组差异不显著(P>0.05),但年均贡献率差异极显著(P<0.01)。表5
2.6促性腺激素不同剂量对供体生产胚胎的影响
对供体超排使用不同剂量促性腺激素剂,在不同分组的独立样品T检验结果表明,450 IU 组和500 IU组在黄体平均数方面差异极显著(P<0.01)。在胚胎平均数方面差异不显著(P>0.05),但500 IU组高于450 IU组。在同一分组中,持续跟踪调查的配对样本T检验结果表明,244和296 mg组在黄体平均数方面差异不显著,但有下降的趋势,在胚胎平均数方面有下降趋势,差异极显著(P<0.01)。表6
表5 超排次数下超排反应
Table 5 The effect of Superovulation times on superovulatory response
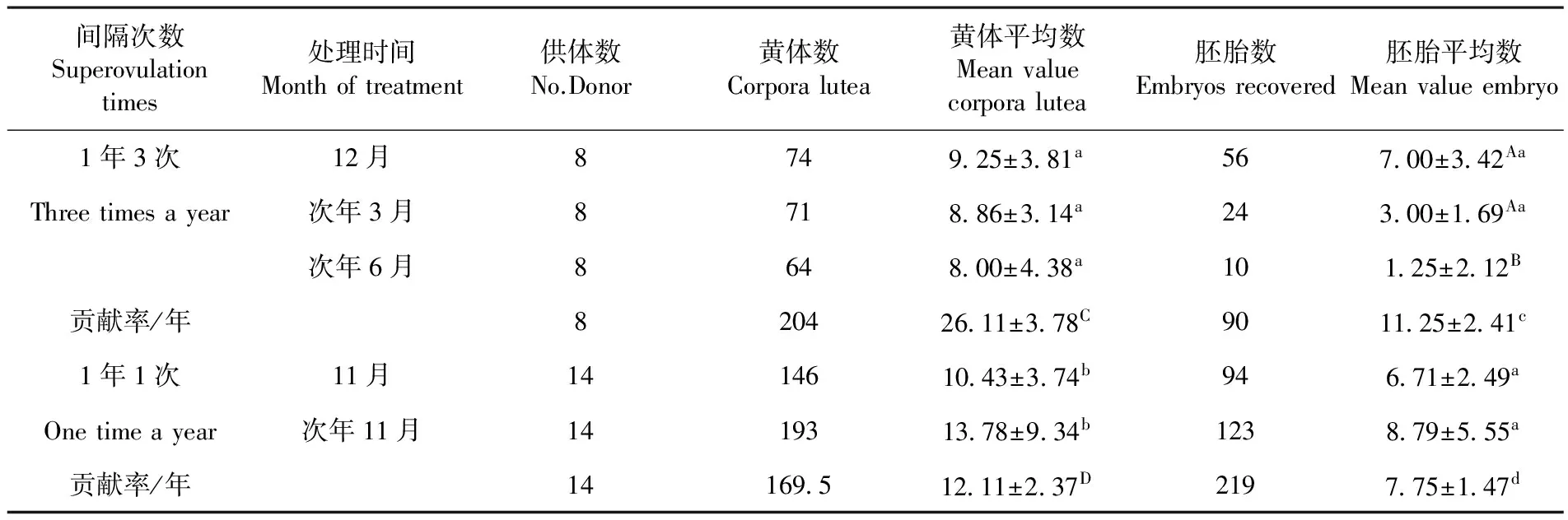
间隔次数Superovulationtimes处理时间Monthoftreatment供体数No.Donor黄体数Corporalutea黄体平均数Meanvaluecorporalutea胚胎数Embryosrecovered胚胎平均数Meanvalueembryo1年3次12月8749 25±3 81a567 00±3 42AaThreetimesayear次年3月8718 86±3 14a243 00±1 69Aa次年6月8648 00±4 38a101 25±2 12B贡献率/年820426 11±3 78C9011 25±2 41c1年1次11月1414610 43±3 74b946 71±2 49aOnetimeayear次年11月1419313 78±9 34b1238 79±5 55a贡献率/年14169 512 11±2 37D2197 75±1 47d
表6 不同促性腺激素剂量下供体超排变化
Table 6 The effect of different FSH dosage on superovulatory response
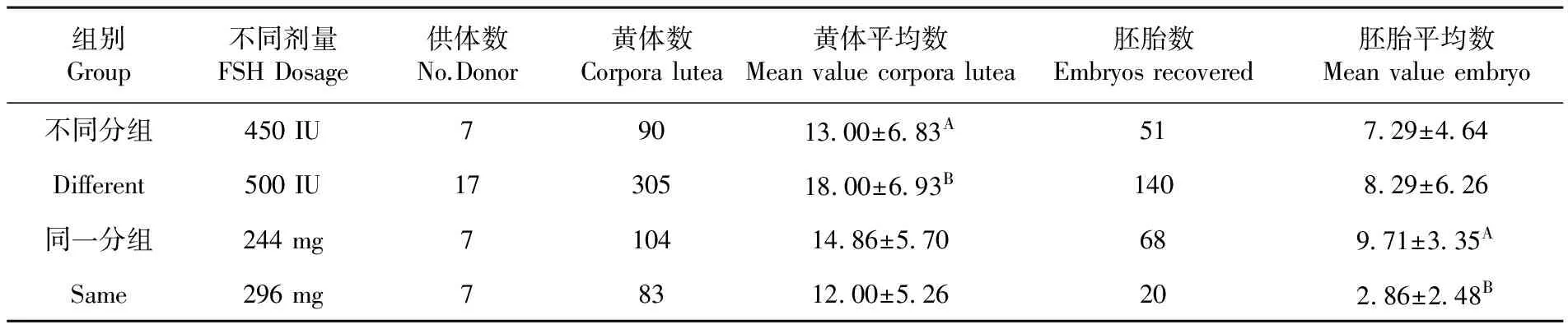
组别Group不同剂量FSHDosage供体数No.Donor黄体数Corporalutea黄体平均数Meanvaluecorporalutea胚胎数Embryosrecovered胚胎平均数Meanvalueembryo不同分组450IU79013 00±6 83A517 29±4 64Different500IU1730518 00±6 93B1408 29±6 26同一分组244mg710414 86±5 70689 71±3 35ASame296mg78312 00±5 26202 86±2 48B
3 讨 论
3.1 不同来源促性腺激素对供体超排的影响
供体超排使用的药物按照产地来源和动物源性来源区分具有很大的差异性,每种促卵泡素因提纯方法、批次都会对不同供体和个体产生差异性。研究结果表明,在黄体平均数方面,中科院组FSH与加拿大FSH组的黄体水平差异不显著,这表明,中科院FSH药品与加拿大FSH药品在剂量和效果上基本接近,国产激素也能获得接近进口激素的超排效果,这与郭鹏程[4]、陈童等[5]的研究结果比较一致。在绵羊超排报道中,加拿大Bioniche Follitropin-V羊常用剂量为10~15 mL(20 mg/mL),中科院FSH使用剂量为4.5~10 mg不等。早期研究[6]认为不同产地FSH处理供体获得的可用胚数量并不相同,这主要是FSH产品以质量或国际单位作为单位而无法统一。因此认为中科院产FSH与加拿大产FSH在产品性价比上具有优势。
3.2 不同品种供体对超排排卵的应答水平
促性腺激素对不同品种肉羊的超排效果研究发现,不同品种肉羊对超排反应是具有差异性的。在黄体平均数方面,白头萨福克羊组>黑头萨福克羊组>白头杜泊羊组>道赛特羊组,其中道赛特羊组与萨福克组差异是显著的;在回收胚胎平均数方面,规律同上,但差异不显著,这表明促性腺激素对不同品种肉羊的超排效果是有差异的。在品种间的超排效果上韩丽娟等[1]认为无品种差异性,实验结果除了道赛特组,其余组别无显著差异性,但胚胎回收数结果趋向与鲁俊等[7]研究结果一致,以萨福克品种超排效果最好。因此,该结果除了对萨福克品种的超排具有一定参考意义之外,对于其余各品种或者同类品种肉羊为了提高超排效果,能否采用增加剂量需要进一步研究。
3.3 不同年龄供体对超排排卵的应答水平
无论是青年母羊还是成年母羊,在促性腺激素超排作用下形成的红体,试验结果显示平均数差异不显著,但青年羊组红体平均数仍然高于成年羊组,红体数量代表着排卵数,因此,在排卵数量方面,青年羊组也高于成年羊组。K.F. Breuel等[8]认为供体超排排卵率和胚胎回收率是受到年龄影响的,实验结果与K.F. Breuel的观点比较一致。早期的研究认为,不同年龄的动物对同种剂量的激素反应不同,年龄较小的动物超排效果较好,这种差异主要是青年期动物的卵巢对促性腺激素较为敏感,成年期较为稳定,高龄期超排较差。因此,超排期间成年羊超排剂量应当高于青年羊组,这在张立[9]和包花拉[10]等的研究中也得到了较好的实验证实。相对于供体年龄[11],FSH剂量适当对老龄供体排卵率、受精率和可用胚率都会产生积极影响,但对幼龄青年动物却会产生负面影响,促性腺激素FSH的促卵泡发育主要作用于窦状卵泡,Pritpal S. Malhi等[12]研究老龄母牛2~5 mm的卵泡比青年子女牛的卵泡数量少,超排过后≥6 mm的卵泡数量也极显著低于子女牛的卵泡数,因此,成年和老龄动物相比于幼龄动物需要更多剂量的FSH作用于更小直径的卵泡进行发育排卵。FSH剂量的持续增加,造成卵泡发育排卵后形成的卵巢红体表面积超出输卵管伞的包被范围不仅显得没有意义,而且会引起卵巢囊肿,人工诱导穿刺形成出血也更容易形成卵巢与输卵管粘连、卵巢与子宫粘连等问题而影响后续供体的利用。因此,FSH超排剂量的依据是考虑年龄情况下的卵巢窦状卵泡活动情况以及输卵管伞的表面积。
3.4 不同营养水平的供体对超排的应答水平
供体的营养水平和体况是影响超排反应的重要因素,从实验结果上看,低日粮自配饲料组和中等日粮配合饲料组的供体平均黄体数没有差异,但显著低于高日粮自配饲料组的平均黄体数。说明日粮总量对供体的超排反应影响是极显著的。在供体羊的饲料营养中,除了粗饲料、青绿饲料、青贮饲料、矿物质饲料、维生素饲料和添加剂等6类饲料差异较小之外,蛋白饲料和能量饲料是影响供体超排的主要因素。发现供体的排卵水平差异主要来自于能量饲料玉米的差异,尤其是低日粮自配饲料组冲胚阶段存在大量的未排大直径卵泡且有卵巢囊肿的现象,这与J.A. Abecia[13]等的研究结果相似,认为是超排前至超排阶段,供体营养不良形成了较多的卵泡,且超排受精后形成的可用胚数量显著降低。从供体营养水平对排卵数量和后期胚胎质量的影响方面考虑,高日粮水平中,提高蛋白日粮量[14]会因为血尿中高氮含量影响子宫氨基酸代谢水平从而不利于胚胎的发育,而高能量日粮也会因为高碳水化合物的摄入降低受精率和胚胎质量。Yaakub H等[15]通过给肉牛日粮3 kg精料基础上补加额外精料,发现黄体数量降低,而且胚胎数量也发生下降。那么自由采食和降低采食量会产生什么影响,A.T. Grazul-Bilska等[16]发现这种做法会改变血清中胰岛素和17-β (E2)的水平,虽然不会影响排卵后的受精,但会降低后期胚胎的发育数量。仅从黄体数量水平上能够看出高日粮水平形成的黄体数量较少,而低日粮水平形成的黄体数量较多,且两种日粮水平的改变虽然都能提高血清IFN-τ水平,但PGF2α水平却比正常组低,这就使PGF2α不能加快子宫内膜上皮绒毛细胞的活动,造成已排卵的移行速度减慢,造成受精胚胎的比率下降,从而造成胚胎在早期2~8细胞阶段低水平的卵裂差异性,并逐渐造成胚胎发育迟缓而不利于胚胎移植。为了提高排卵数量和质量,S Freret等[17]得到结论14个月龄的小牛在超排前至超排阶段高日粮水平饲喂一个阶段后,超排期间短期的限饲不仅不会影响排卵率[18],而且能提高胚胎的数量和质量,该做法具有一定的参考意义,实验结果也表明,高日粮能够明显改善供体的超排效果。
3.5 不同超排次数的供体对超排的应答水平
供体的重复超排按照间隔时间可以分为短间隔和长间隔,实验结果以短间隔60 d为基础重复超排,供体的黄体平均数差异不显著,但随着季节变化有降低的趋势,而胚胎平均数显示逐渐降低形成极显著的差异水平,通过回顾性分析发现这种结果归因于供体卵巢-输卵管-子宫的粘连冲胚失败所致。长间隔以供体母羊产过一胎再进行超排为处理方式,结果显示黄体平均数差异不显著,胚胎平均数差异不显著,这与Bari等[19]的研究结果一致,因此通过一个产羔周期,供体表现出较好的超排反应和胚胎回收性。通过比较短间隔与长间隔的黄体平均数和胚胎平均数,发现短间隔更能够提高供体的利用率,而长周期能降低供体的卵巢-输卵管-子宫的黏连性,因此为了提高供体的利用率,冲胚过程中供体的黏连性问题是短周期方案最值得关注的问题。重复超排的短周期间隔,各学者看法不一,但间隔过短不仅会降低卵巢对促性腺激素的反应,而且严重影响胚胎回收率,这在M.M. Bruno-Galarraga[20]关于胚胎回收率的多因素线性回归分析中得到证实,因此,具有较高正相关系数的黄体数,即卵巢对促性腺激素的应答排卵率是MOET的关键。同时供体羊处理间隔75 d,胚胎回收率不仅下降,而且胚胎质量也发生下降,但发情期会逐渐延长,因此短间隔时间以更长间隔如80~120 d为基础,进一步观察回收胚胎的质量以确定短间隔时间。在长间隔重复超排方面,F.Bari等[19]认为随着供体年龄的推移也有逐年下降的趋势,但卵巢对促性腺激素的应答和排卵率仍是高相关因素。为了缩短间隔时间,提高卵巢对FSH的应答水平,更换不同动物(羊源)提取FSH激素不失为一个选择[21],有研究人员通过增加FSH剂量以促进供体的利用率和提高胚胎数量[2],这也是多数学者比较认同的做法。MI Cueto等[22]认为在繁殖季节对供体羊超排回收胚胎能获得较为理想的结果,这与研究结果比较一致,如果供体仅用于IVP生产,则可以不考虑季节性因素。
3.6 不同促性腺激素剂量对供体超排的影响
通过试验研究发现,同在一管理环境水平下均是成年羊的两组群体,增加超排促性腺激素剂量,能够显著的增加供体黄体数量,而且胚胎数量也有所提高,因此,适当的增加超排剂量以获得更多数量的胚胎具有可行性,但这也会增加风险性。第一种风险是高数量的排卵效应能否获得高质量的胚胎和着床妊娠效应,需要进一步研究;第二种风险是造成大量的红体反应,卵巢与红体表面积超过输卵管伞表面积,即伞包裹不住超排的卵巢势必引起伞、输卵管、子宫角和子宫体等结缔组织的粘连,这就会降低供体的重复利用数量。而供体利用质量方面,通过回顾性分析追踪年内重复利用的供体,对供体增加促性腺激素超排剂量研究发现,超排次数短周期方案中的供体黄体数量有下降的趋势,而且胚胎回收率也有下降的趋势,而且差异是极显著的,这就说明增加促性腺激素对首次使用的供体增效明显,尤其是[4、12]育成羊阶段,而对连续使用的供体增效不明显,且会降低胚胎回收率。为了避免供体重复超排效果降低,认为M.P.Boland等[23]和K.Fernie等[24]的观点可行之外,即羊源FSH超排获得可移植胚数比猪源的高,还可考虑更换使用不同产地的FSH以提高超排效果。为了提高胚胎回收率,防止卵巢等结缔组织的粘连是关键之处,对于增加促性腺激素剂量并未随之显著增加黄体数量的供体,除了采用长方案提高供体利用率之外,更换促性腺激素物种来源或适当延长短方案超排间隔以降低供体对促性腺激素产生的耐受性,提高剂量增效性也是一种方法。此外,目前在实际生产中有一种较为提倡的做法就是根据供体体重制定促排剂量,即随着体重增加而增加超排剂量,韩丽娟等[1]通过试验结果发现这并没有直接的显著正相关性,但给出参考值即FSH剂量与体重比值在3.4~4.0能够获得较为理想的结果,因此,在考虑对供体增加超排剂量时,不仅需要看供体的粘连,同时还要考虑供体进行过哪种重复利用性,在确定超排剂量与方案。
4 结 论
通过试验比较供体在激素来源、供体品种、营养水平、年龄、超排间隔和超排剂量等方面的差异,结果表明,国产中科院FSH 6.1 mg超排效果等同于加拿大产FSH 244 mg的超排效果。肉羊品种在超排效果方面表现为黑头萨福克、白头萨福克、黑头杜泊品种间无显著差异性,但有下降的趋势,以黑头萨福克效果最显著,而道赛特超排效果最差。使用相同剂量FSH时,青年羊比成年羊的超排反应效果显著。肉羊3.5 kg日粮营养和2.5 kg日粮营养能显著改善供体的超排反应。为充分发挥肉羊遗传资源潜力,获得更多数量的胚胎,供体以短间隔超排重复利用获得胚胎数量最多。增加FSH超排剂量能显著改善超排反应,但对重复利用供体不显著。
超排程序期间不考虑肉羊品种差异,日粮总量维持在2.5 kg以上,青年羊FSH使用剂量降低,成年羊使用加拿大FSH剂量为244 mg或中科院生产FSH 6.1 mg效果相同,提高供体胚胎回收数应采用短间隔超排,提高供体利用年限应采用长超排间隔,提高超排效果首次可增加超排剂量,但重复利用供体除外。
References)
[1] 韩丽娟.肉用绵羊胚胎移植技术研究[D].哈尔滨:东北农业大学硕士论文,2007.
HAN Li-juan. (2007).Studyontheembryotransferinmeatsheep[D]. Master Thesis. Northeast Agricultural University, Harbin. (in Chinese)
[2]权富生,山羊和绵羊超数排卵及规模化胚胎移植技术研究[D].杨凌:西北农林科技大学博士论文,2010.
Quan Fu-sheng.(2010).Superovulationandlarge-scaletransferembryoingoatsandsheep[D]. PhD Thesis. Northwest A&F University, Yangling.(in Chinese)
[3]王峰,黄春华,张东,等. 多种因素对牛超数排卵效果影响的研究[J]. 中国农学通报,2013,29(17):19-24.
WANG Feng, HUANG Chun-hua, ZHANG Dong, et al. (2013).Study on Effects of Multi-factors on Superovulation in Cattle [J].ChineseAgriculturalScienceBulletin, 29(17):19-24.(in Chinese)
[4]郭鹏程.羊胚胎移植同期发情和超数排卵应用技术的研究[D].哈尔滨:东北农业大学硕士论文,2007.
GUO Peng-cheng.(2007).Theresearchofsheepembryotransfersynchronizationofestrusandsuperovulationtechnicalapplication[D]. Master Thesis. Northeast Agricultural University, Harbin.(in Chinese)
[5]陈童.萨福克肉羊胚胎移植关键技术的研究与应用[D],石河子:石河子大学硕士论文,2013.
CHEN Tong.(2013).TheresearchandapplicationofkeyembryotransfertechnologyinSuffolksheep[D]. Master Thesis. Shihezi University, Shihezi. (in Chinese)
[6]付静涛,朱士恩,余文莉,等.影响绵羊、山羊超数排卵极胚胎移植效果因素分析[J].中国农业大学学报,2005,(5):64-67.
FU Jing-tao, ZHU Shi-en, YU Wen-li, et al.(2005).Factors on superovulation and embryo transfer efficiency in goat and sheep [J].JournalofChinaAgriculturalUniversity, (5):64-67.(in Chinese)
[7]鲁俊. 肉羊繁殖生物技术应用研究[D].长春:吉林大学硕士论文,2008.
LU Jun.(2008).Exploratorydevelopmentonthemultiplicationbiotechnologyofmuttonsheep[D].Master Thesis. Jilin University, Changchun.(in Chinese)
[8] Breuel, K. F., Baker, R. D., Butcher, R. L., Townsend, E. C., Inskeep, E. K., & Dailey, R. A., et al. (1991). Effects of breed, age of donor and dosage of follicle stimulating hormone on the superovulatory response of beef cows.Theriogenology, 36(2): 241-255.
[9]张立.牛羊胚胎工程技术产业化研究与应用[D]. 杨凌:西北农林科技大学硕士论文,2005.
ZHANG Li. (2005).Researchandapplicationforindustrializationofembryoengineeringtechnologyincattleandsheep[D]. Master Thesis. Northwest A&F University, Yangling. (in Chinese)
[10]包花拉.绵羊胚胎移植技术推广研究与应用[D].呼和浩特:内蒙古农业大学硕士论文,2013.
BAO Hua-la.(2013).Applicationandpopularizationofembyotransfertechniqueinsheep[D]. Master Thesis Inner Mongolian agricultural, Huhhot. (in Chinese)
[11] Lerner, S. P., Thayne, W. V., Baker, R. D., Henschen, T., Meredith, S., & Inskeep, E. K., et al. (1986). Age, dose of fsh and other factors affecting superovulation in holstein cows.JournalofAnimalScience,63(1): 17-183.
[12] Malhi, P. S., Adams, G. P., Mapletoft, R. J., & Singh, J. (2008). Superovulatory response in a bovine model of reproductive aging.AnimalReproductionScience, 109(1-4): 100-109.
[13] Abecia, J. A., Forcada, F., Palac铆N, I., S谩Nchezprieto, L., Sosa, C., & Fern谩Ndezforen, A., et al. (2015). Undernutrition affects embryo quality of superovulated ewes.Zygote, 23(1): 116-124.
[14] Wiltbank, M., Guerra, A. G., Carvalho, P. D., Hackbart, K. S., Bender, R. W., & Souza, A. H., et al. (2014). Effects of energy and protein nutrition in the dam on embryonic development.AnimalReproduction, 11(3):168-182.
[15] Yaakub, H., O'Callaghan, D., & Boland, M. P. (1999). Effect of type and quantity of concentrates on superovulation and embryo yield in beef heifers.Theriogenology, 51(7):1,259-1,266.
[16] Grazul-Bilska, A. T., Borowczyk, E., Bilski, J. J., Reynolds, L. P., Redmer, D. A., & Caton, J. S., et al. (2012). Overfeeding and underfeeding have detrimental effects on oocyte quality measured by in vitro fertilization and early embryonic development in sheep.DomestAnimEndocrinol, 43(4):289-298.
[17] Freret, S., Grimard, B., Ponter, A. A., Joly, C., Ponsart, C., & Humblot, P. (2006). Reduction of body-weight gain enhances in vitro embryo production in overfed superovulated dairy heifers.Reproduction, 131(4): 783-794.
[18] Nogueira, D. M., Eshtaeba, A., Cavalieri, J., Fitzpatrick, L. A., Gummow, B., & Blache, D., et al. (2017). Short-term supplementation with maize increases ovulation rate in goats when dietary metabolizable energy provides requirements for both maintenance and 1.5 times maintenance.Theriogenology, (89): 97-105.
[19] Bari, F., Khalid, M., Wolf, B., Haresign, W., Murray, A., & Merrel, B. (2001). The repeatability of superovulatory response and embryo recovery in sheep.Theriogenology, 56(1):147-155.
[20] Bruno-Galarraga, M. M., Cueto, M., Gibbons, A. E., Pereyra-Bonnet, F., Catalano, R., & Gonzalez-Bulnes, A. (2014). Repeatability of superovulatory response to successive fsh treatments in merino sheep.SmallRuminantResearch, 120(1): 84-89.
[21] Cognie, Y. (1999). State of the art in sheep-goat embryo transfer.Theriogenology, 51(1): 105-116.
[22] Cueto, M. I., Gibbons, A. E., Pereyra-Bonnet, F., Silvestre, P., & González-Bulnes, A. (2011). Effects of season and superovulatory treatment on embryo yields in fine-wool merinos maintained under field conditions.ReproductioninDomesticAnimals, 46(5): 770-775.
[23] Mihm, M., Baguisi, A., Boland, M. P., & Roche, J. F. (1994). Association between the duration of dominance of the ovulatory follicle and pregnancy rate in beef heifers.JournalofReproduction&Fertility, 102(1): 123-130.
[24]Fernie, K., Dingwall, W. S., Mckelvey, W.A.C. & Fitzsimons, J. (1993). Superovulation in the ewe: the effect of source of gonadotropin, season, breed and age.Animalproduction, 56(3):433.
ARetrospectiveSurveyAnalysisofSuperovulationinMuttonSheep
GUO Yan-hua, WAN Peng-cheng, LIU Chang-bin
(StateKeyLaboratoryofSheepGeneticImprovementandHealthyProduction/InstituteofAnimalHusbandryandVeterinary,XinjiangAcademyofAgriculturalandReclamationSciences,ShiheziXinjiang832000,China)
【Objective】 Multiple ovulation and embryo transfer ( MOET ) is an important applied technology to improve the genetic potential of sheep. There are many factors that affect donor superovulation, and a large amount of data is needed to support it.【Method】A retrospective survey about the factors such as Follicle stimulating hormone resource, breed, daily ration, age, superovulation interval and dosage were analyzed and summarized between superovulation responses in our application for mutton sheep.【Result】The results showed that domestic FSH was equal to Canadian FSH in superovulation response (P>0.05), different breeds of mutton sheep had no significant difference in superovulation response (P>0.05); It was remarkable between youth and adult in the superovulation response (P<0.05); It was the same to ration supply(P<0.05). The donor
the largest number of embryos when repeatedly superovulated by short internal, the increased FSH dosage impacted superovulation response signivicantly in mutton sheep (P<0.05), but continuous repeatedly superovulation had no obvious effect (P>0.05).【Conclusion】In conclusion, the influencing factors could be divided into remarkable and indistinctive factors. Age, daily ration, superovulation interval and dosage can be relegated to the remarkable factors and breed can be classified to the indistinctive factors.
sheep; embryo transfer; superovulatory response; influencing factor
Liu Chang-bin(1977-),male, native place: Yucheng, Henan. Associate Researcher, research field: Bovine and ovine embryo engineering.(E-mail)406271412@qq.com
10.6048/j.issn.1001-4330.2017.08.022
2017-03-06
兵团院士基金“绵羊高效MOET生产及受体处理程序优化研究”(2013BB023),兵团科技攻关与成果转化计划项目“新品种选育与种质资源创新(超细毛羊)”(2016AC027),国家自然科学基金项目“基于羔羊体外成熟卵母细胞转录组分析及核质成熟相关机制研究”(31160460)
郭延华(1983-),男,新疆喀什人,助理研究员,硕士,研究方向为动物遗传育种与繁殖,(E-mail)guoyanhuatlr@sohu.com
刘长彬(1977-),男,河南虞城人,副研究员,研究方向为牛羊胚胎工程,(E-mail)406271412@qq.com
S826.9+2
:A
:1001-4330(2017)08-1550-09
Supported by: Academician Fund of XPCC "Optimization of High Efficiency MOET Production and Receptor Processing in Sheep" (2013BB023); Project of Tackling Key Scientific Problems and Achievements Transformation "Breeding of New Varieties and Innovation of Germplasm Resources (Superfine Wool Sheep)" (2016AC027) and National Natural Foundation of China "Study on the Transcriptome Analysis and Cytoplasmic Maturation of Lamb Mature Oocytes in Vitro" (31160460)

