2株番茄早疫病拮抗菌的分离筛选与拮抗作用研究
杨蓉,杨文琦,张峥,詹发强,侯敏,侯新强, 包慧芳,王宁,龙宣杞
(1. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091;2. 新疆大学生命科学与技术学院,乌鲁木齐 830046)
2株番茄早疫病拮抗菌的分离筛选与拮抗作用研究
杨蓉1,杨文琦1,张峥2,詹发强1,侯敏1,侯新强1, 包慧芳1,王宁1,龙宣杞1
(1. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091;2. 新疆大学生命科学与技术学院,乌鲁木齐 830046)
【目的】从新疆昌吉、焉耆、喀什、乌苏、吉木萨尔五地多年种植番茄的农田土壤样品,进行拮抗菌的筛选,选取对番茄早疫病菌(Alternariasolani)有具有较强抑菌活性的菌株。【方法】采用平板分离培养法从加工番茄的根际土壤中分离拮抗菌,平板对峙培养实验进行初筛和复筛,根据培养特征、菌体形态及16S rDNA系统发育分析进行初步鉴定,显微观察法观察拮抗菌对病原菌菌丝生长的拮抗作用,盆栽法测定相对防效。【结果】共分离得到90株细菌菌株,初筛得到对番茄早疫病菌有明显拮抗作用的细菌,复筛选取2株抑制作用显著的细菌(J2-2、J2-4),并初步鉴定为芽孢杆菌属(Bacillus)的萎缩芽孢杆菌(Bacillusatrophaeus)和枯草芽孢杆菌(Bacillussubtilis)的近似种;显微镜下观察到2株拮抗菌的发酵液对番茄早疫病菌丝有明显的致畸作用;在盆栽试验中,拮抗菌发酵液对番茄早疫病菌的相对防效可达到35%以上。【结论】筛选到的2株拮抗菌对番茄早疫病菌表现出较好的拮抗作用,对番茄早期病害的生物防治具有一定的应用价值。
番茄早疫病;分离;筛选;鉴定
0 引 言
【研究意义】番茄种植过程中常见的真菌性病害番茄早疫病、晚疫病、番茄灰霉病、叶霉病、番茄枯萎病等,其中番茄早疫病[Alternariasolani(Ellis et Martin)Jones et Grout .](也称为轮纹病),较为常见,在番茄的苗期和成株期发病,危害较大,严重影响到番茄光合产物的积累以及果实的形成,给人们的生产和健康造成危害。番茄早疫病的防治措施一般以化学农药为主,对土壤生态结构造成破坏,存在环境污染和农药残留问题,而生物防治具有无毒、高效、成本低等优点,成为防治番茄早疫病的新途径和研究热点。研究从根际土壤中筛选拮抗菌,为番茄早疫病的生物防治提供材料,以期减少农药的使用量,提高番茄品质。【前人研究进展】番茄早疫病的病原菌为茄链格孢菌[A.solani( Ell Martin). sorauer],属半知菌亚门链格孢属真菌,能引起多种作物病害,如马铃薯早疫病、甘蓝黑斑病、苹果斑点落叶病、梨黑斑病、梨黑斑病烟草赤星病等。有关采用拮抗菌来进行各种植物病害的生物防治比较常见,王杏芹[1]等针对甜瓜细菌性斑点病和甜瓜角斑病筛选到对有明显拮抗作用的拮抗菌;刘淑芳[2]等筛选到两株的拮抗菌表现出较好的对苹果炭疽病原菌的拮抗作用;李伟杰等[3]分离筛选得到的拮抗细菌对番茄青枯病有拮抗作用;张洪涛等[4]筛选出高抗棉花黄萎病的细菌。研究表明,利用拮抗菌进行植物病害的生物防治的机理主要是通过竞争、拮抗,交叉保护、寄生或捕食和诱导植物产生抗性等途径[5]。不同的微生物对病原菌的拮抗机制有所不同,即使是同一种微生物,其作用机制也可能同时有很多种。如芽孢杆菌就有竞争位点、拮抗病原菌和诱导植物抗性等抑菌机制[6],同时有些微生物还能够促进植物生长或者提高营养利用率。【本研究切入点】新疆土壤类型多样,光热资源丰富,是世界上适宜种植番茄的地区之一。因此,利用资源优势,新疆番茄加工业迅速发展,加工番茄种植面积逐年扩大,成为中国番茄加工业主要的生产地区,总产量占到世界产量的9.6%,番茄酱也成为新疆重要的出口创汇产品[7],中国成为仅次于美国、意大利的世界上第三个番茄酱生产及出口大国[8]。但随着加工番茄连年种植,多种土传性病害对作物的危害日益加重[9],其中番茄早疫病引起落花、落叶、落果和断枝,对加工番茄的产量影响很大,严重时甚至减产50%以上[10],而且病果内含有的毒素能够导致人患血液病,危及健康[11]。研究筛选对番茄早疫病菌具有较强抑菌特性菌株。【拟解决的关键问题】研究对采自新疆昌吉、焉耆、喀什、乌苏、吉木萨尔五个地方多年种植番茄的农田土壤样品,进行拮抗菌的筛选,选取具有较强抑菌活性的菌株,并采用形态特征及16S rDNA序列测定及系统发育分析方法对筛选得到的菌株进行初步鉴定;分析拮抗菌发酵液对番茄早疫病菌的拮抗作用,为进一步的应用研究奠定基础,为番茄早疫病的生物防治提供新的选择。
1 材料与方法
1.1 材 料
1.1.1 病原菌
由中国农业微生物菌种保藏中心(ACCC)提供的番茄早疫病菌(Alternariasolani)。
1.1.2 采集根际土样
2016年6月,在昌吉、焉耆、喀什、乌苏、吉木萨尔的加工番茄种植地中(C、J、Y、W、K分别代表昌吉、吉木萨尔、焉耆、乌苏、喀什土样),采集幼苗根系和根际土,牛皮纸袋保存后,带回试验室,用无菌剪刀剪取番茄幼苗根部,放入盛有100 mL无菌水的500 mL三角瓶中,室温下以180 r/min的转速震荡30 min,制成均匀的土壤悬液。
1.1.3 筛选培养基[12]
马铃薯葡萄糖培养基(PDA),细菌培养基(LB);
1.1.4 仪器与试剂
MSSPX-250型培养箱, SW-CJ-1F B型双人单面净化工作台,MLS-3020高压蒸汽灭菌锅,E360K离心机,HWY-100恒温振荡培养仪。Bio-Rad Mode 200/2.0型电泳仪,Eppendorf No:5345型PCR仪,United-Bio型凝胶成像仪,TaKaRa Biotechnology 的PCR预混液,其余试剂选用分析纯试剂。
1.2 方 法
1.2.1 拮抗菌的分离和筛选
1.2.1.1 梯度稀释分离法
先采用梯度稀释分离法获得根际土壤悬液的稀释液:将番茄根际土样10 g放入90 mL灭菌水的三角瓶中,振荡20 min 后静置20~30 s,即为10-1稀释液,然后通过梯度法分别稀释成10-2到10-6的稀释液。再采用平板涂布法进行分离培养:各取0.1 mL 的稀释液(10-3、10-4、10-5、10-6)分别涂布于PDA 和LB培养基上,分别于32和37℃培养,待培养基上长出分离物,对长出的菌落分离纯化进行划线,最后划线斜面保存备用。
1.2.1.2 平板对峙法[13]筛选拮抗菌
采用平板对峙法进行筛选:番茄早疫病菌经PDA培养基斜面活化后备用。将分离出的拮抗菌株用LB液体培养基振荡培养后,制成菌悬液,于PDA培养基周围4点接种4 μL,32℃下继续培养1 d,待四周菌落长至1 cm左右,在平板盖上加入三氯甲烷1 mL,将平板放置4℃冰箱过夜。次日取出平板,用打孔器制备番茄早疫病菌的菌饼,置于上述的PDA培养基平板中央,并撤换平板盖。放入28℃培养5 d。根据有无抑菌圈及抑菌带的大小,判断其拮抗效果,初选得到拮抗菌株,并对其进行二次对峙实验,从中筛选出拮抗能力较强的菌株以备后续实验。
1.2.2 拮抗菌的形态学观察
将菌株在LB固体培养基平板上培养2 d,进行形态学观察。
1.2.2.1 形态学观察
菌落形状、颜色、透明度、边缘形状、生长培养形状等特征。
1.2.2.2 镜检
准备干净的载玻片,滴一滴无菌水,将平板上的单菌落挑少量涂在载玻片上,使其完全涂开,然后从火焰上干燥固定,用结晶紫染液染1 min,水洗2~3次,晾干。显微镜油镜下观察菌体的形态、是否有芽孢。
1.2.3 优势PGPR菌的16S rDNA序列扩增与分析
选择LB平板上培养2 d的少量单菌落,挑入盛有25 μL无菌水的离心管中,100℃下8~10 min,迅速置冰浴中5 min,10 000 r/min离心处理5 min,4℃保存,上清液备用[14]。
根据细菌的16S rDNA序列设计PCR扩增引物,正向引物为:5'-TCCTCCGCT TATTGATATGC-3';反向引物为:5'-CAAACTTGGTCATTAGAGGA-3'。
PCR扩增反应体系为50 μL,组分如下:24 μL premix Taq,引物各1 μL,模板 2 μL,无菌水 22 μL。扩增条件为:94℃ 4min;94℃ 30 s,55℃ 90 s,72℃ 30 s,循环为30个;72℃ 7 min。得到的PCR扩增产物(约 1 500 bp)经琼脂糖凝胶(1%)电泳分离,然后直接进行双向测序,测序由上海生物工程技术服务有限公司合成。
将测序得到的16S rDNA序列与GenBank数据库中的核苷酸序列进行BLAST 分析,获取相近的16S rDNA序列,采用ClustalX软件和 MEGA 4.1 中的Neighbor-joining 法来构建拮抗菌的系统进化树。
1.2.4 拮抗菌发酵液对番茄早疫病菌的抑制作用[15]
1.2.4.1 对病菌菌丝抑制作用的显微观察
将番茄早疫病菌点接在PDA平板中央,培养2 d,在平皿四周等距离(2.5 cm)处放置含有拮抗菌株发酵液的滤纸片,28℃恒温培养6 d,镊取早疫病菌菌落边缘的菌丝于在载玻片上,在显微镜下观察其菌丝的形态变化并拍照。
1.2.4.2 盆栽试验测定防效
综上所述,高龄STEMI患者常合并糖尿病、高血压、血脂异常等危险因素,易发生无痛性的心肌梗死;冠状动脉以侧支建立、多支病变、显著钙化、重度狭窄、复杂病变及弥漫病变为主。
对于经过初筛和复筛得到的1-2株高效的拮抗菌,采用盆栽试验法测定其拮抗菌株发酵液对番茄早疫病的防治作用。在装土的营养钵中播种加工番茄种子(市售),当幼苗长至 4~5片真叶时,取生长一致的植株,用无菌剪刀损伤幼苗根部,然后放入早疫病菌悬液中30 min,移栽到盆中,再灌根加入 20 mL 供试拮抗菌的发酵液。每个处理设10个重复,空白对照为清水灌根处理。在 25℃下保湿培养 48 h 后,观察发病情况,7 d 后调查发病率和病情,计算病情指数和相对防效。
病情调查中采用十字测量法测量每个病斑直径,以病斑大小作为病害分级标准。病害分级标准如下:
0 级:叶片上无病斑;
1 级:病斑面积占叶片的 1/4 以下;
2 级:病斑面积占叶片的 1/4-1/2;
3 级:病斑面积占叶片的 1/2-3/4,近一半小叶枯死;
4 级:病斑面积占叶片的 3/4 以上,一半以上或全部小叶枯死;
相对防效(%)=[(对照病情指数-处理病情指数)/对照病情指数] ×100%。
2 结果与分析
2.1 拮抗菌的分离
经平皿培养,得到可分离细菌。根据菌株的分离来源对菌株进行编号,从中得到细菌90株:C1-1、C1-2、C1-3、C1-4、C1-5、C1-6、C1-7、C1-8、C2-1、C2-2、C2-3、C2-4、C2-5、C2-6、C2-7、C2-8、J1-1、J1-2、J1-3、J1-4、J1-5、J1-6、J1-7、J1-8、J2-1、J2-2、J2-3、J2-4、J2-5、J2-6、J2-7、J2-8、Y1-1、Y1-2、Y1-3、Y1-4、Y1-5、Y1-6、Y1-7、Y1-8、Y2-1、Y2-2、Y2-3、Y2-4、Y2-5、Y2-6、Y2-7、Y2-8、Y3-1、Y3-2、Y3-3、Y3-4、Y3-5、Y3-6、Y3-7、Y3-8、W1-1、W1-2、W1-3、W1-4、W1-5、W1-6、W1-7、W1-8、W2-1、W2-2、W2-3、W2-4、W2-5、W2-6、W2-7、W2-8、K1-1、K1-2、K1-3、K1-4、K1-5、K1-6、K1-7、K1-8、K2-1、K2-2、K2-3、K2-4、K2-5、K2-6、K2-7、K2-8。
2.2 拮抗细菌筛选
2.2.1 拮抗细菌初筛
从番茄根际土样中共分离出90株细菌,采用平板对峙法,根据有无抑菌圈判断其是否具有拮抗作用,初步筛选出对番茄早疫病菌具有一定拮抗能力的菌株。图1
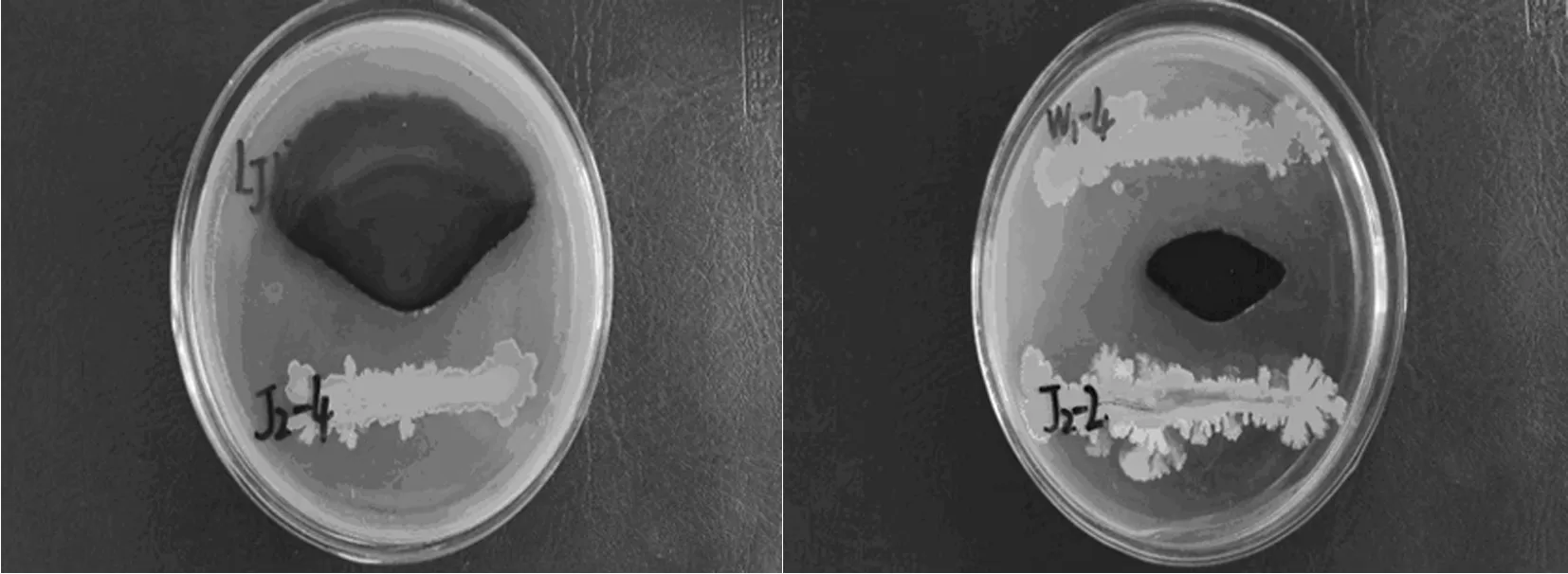
图1 平板对峙试验初筛
Fig.1 Paired culture for preliminary screening
2.2.2 拮抗细菌复筛
对具有拮抗作用的菌株进行二次对峙实验,筛选出拮抗能力较强的菌株以备后续实验。复筛选取2株具有良好拮抗番茄早疫病菌作用的细菌分离物,分别为J2-2和J2-4,培养5d其能够明显地抑制番茄早疫病菌菌丝的生长,经多次实验验证两株菌的抑菌效果较为稳定。图2
2.3 菌落形态特征
复筛得到的拮抗菌菌株的菌落形态特征。表1,图3

图2 平板对峙试验复筛
Fig.2 Paired culture for second screening
表1 拮抗菌的培养特征及细胞形态
Table 1 Morphology of the colony and cell of antagonistic bacteria

菌株菌落特性及细胞形态J2-2菌落中小型,呈不规则圆形,边缘不整齐,折皱,表面干燥不光滑,白色菌落,菌落直径1-3mm,菌体杆状,大量芽孢,芽孢中生。J2-4菌体中小型,圆形,边缘矫正器,有环状凸起,中间凹陷,表面平滑,乳白色,菌落直径0 5~3mm,菌体杆状,有芽孢,芽孢中生。
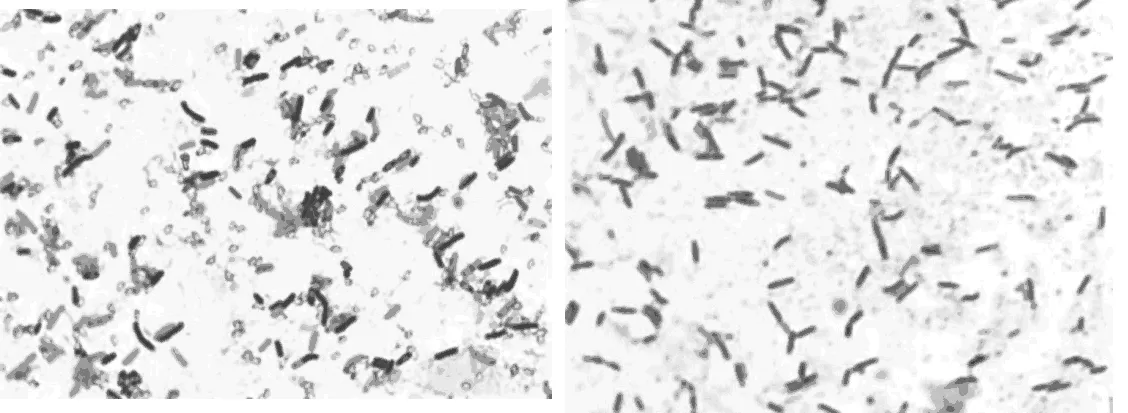
图3 显微镜下的菌体形态
Fig.3Morphologyofbacteriacellundermicroscope
2.4 PCR扩增及系统发育分析
菌株J2-2和J2-4 16S rDNA PCR研究表明,扩增条带片段大小约为1 600 bp,与预计大小相当,扩增的样品整齐度较高,目标条带清晰,无杂带。
对所筛选的菌株J2-2和J2-4进行16s rDNA基因序列分析,结果显示同属于芽孢杆菌属(Bacillus)在EZbiocloud中进行检索,利用MEGA5.0软件对菌株16S rDNA序列跟同源性较高的几株菌株的核酸序列进行Neighbor-joining法构建进化树(图5)。结果表明,J2-2和J2-4菌株与芽孢杆菌属(Bacillus)的序列同源性达到99.9%。因此,将J2-2和J2-4初步鉴定为萎缩芽孢杆菌(Bacillusatrophaeus)和枯草芽孢杆菌(Bacillussubtilis)。图4
2.5拮抗菌发酵液对番茄早疫病菌的抑制作用[15]
从拮抗细菌与早疫病病菌对峙的平板中抑菌圈边缘挑取病菌菌丝,观察发现挑出的菌丝,发现其在形态上发生了明显的变化,菌丝多处都出现了溢缩,破裂的现象,有的部位还发生了畸变。扭曲变形、变粗、菌丝严重交联并产生卵形或近圆形的厚垣饱子等现象,说明拮抗菌发酵液中具有抗菌活性成分,对病菌的菌丝有致畸作用。对照组没有变化。图6
通过盆栽试验,测定出拮抗菌发酵液对病情的相对防效达到35%以上。表2,图7

图4 菌落16s rDNA PCR 结果(1:J2-2,2:J2-4)
Fig.4 The result of 16S rDNA PCR of colony(1: J2-2, 2: J2-4)
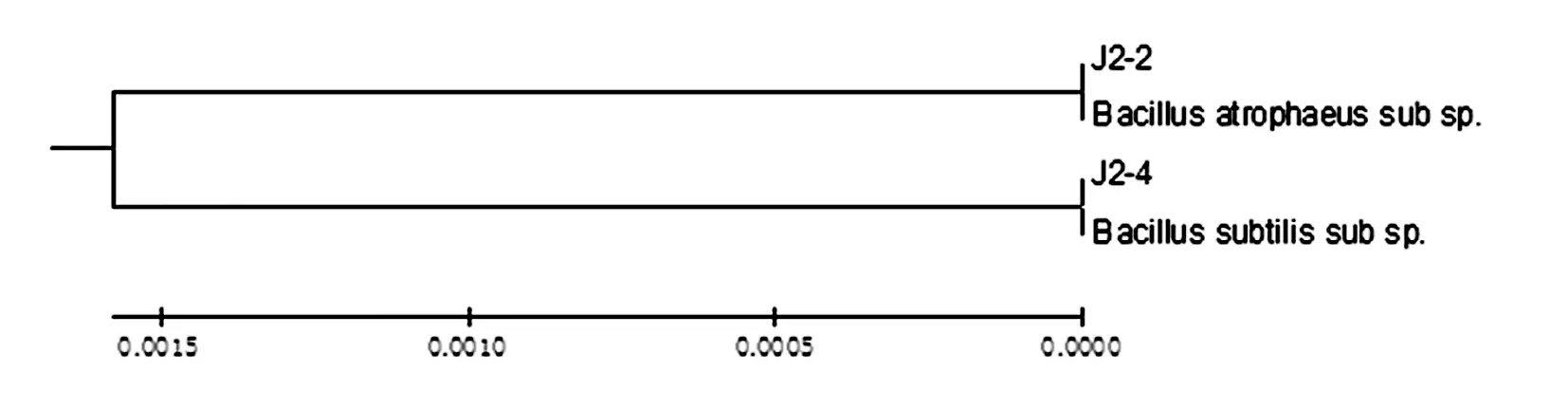
图5 J2-2和J2-4 16SrDNA基因序列进化树
Fig.5 16SrDNAcladogramofJ2-2andJ2-4
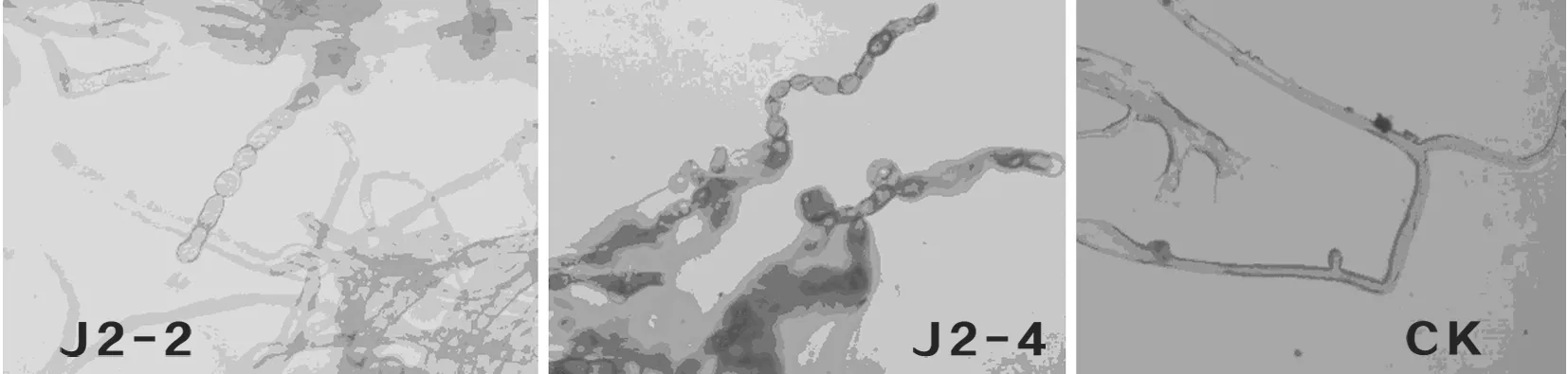
图6 拮抗菌发酵液对番茄早疫病菌菌丝的影响
Fig.6 The effect of fermentation broth of antagonistic bacteria on A. solani mycelium
表2 拮抗菌发酵液对番茄早疫病的防效作用(盆栽试验)
Table 2 The control effect of fermentation broth of antagonistic bacteria on A. solani(pot incubation test)

处理Treated病情指数Diseaseindexes防治效果/%EfficacyJ2-25 17235 4J2-44 82839 65

图7 盆栽试验
Fig.7 Pot incubation test
3 讨 论
3.1 在我国的新疆、宁夏和内蒙古等加工番茄主产区,加工番茄早疫病普遍发生,该病在番茄上的发病率达到30%,严重时可以达到50%以上,造成很严重的经济损失[10]。而且病果内含有的毒素能够导致人患血液病,危及健康[11]。番茄早疫病的危害十分严重,迫切需要高效和安全的防治措施,特别是生物防治措施,如利用拮抗菌来进行防治。
3.2 拮抗菌中芽孢杆菌在植物病害生物防治方面的应用十分广泛,因产生内生芽孢[16],易于繁殖,与别的拮抗菌相比,芽孢杆菌抗逆性强,在土壤中的定殖能力强,适应环境能力强,对于拮抗菌制剂的实际生产有重要意义,具有很大的开发利用价值。马平[17]等分离得到的枯草芽孢杆菌NCD-2,在温室和田间中对番茄早疫病的防治效果显著,田间防效达70%以上。研究对从新疆不同区域的土样中分离90株细菌,经过初筛和复筛,得到2株拮抗能力强的菌株,经过初步鉴定为萎缩芽孢杆菌(Bacillusatrophaeus)和枯草芽孢杆菌(Bacillussubtilis),在盆栽试验中,对番茄早疫病其发酵液表现出了较好的防效,其价值期待进一步深入研究。研究从本地生境中分离得到的拮抗菌,适应本地的生长环境及气候特点,对于防治本地的番茄早期病害、提高作物产量、同时减少农药使用量以及构建良好的生态环境具有积极的作用。
3.3 研究中的芽孢杆菌发酵液对于番茄早疫病的抑菌效果较好,但模拟对峙实验只针对植物体外,拮抗菌在自然环境下的拮抗能力能否持续?能否在土壤中定植?尚需要开展进一步的应用研究。
4 结 论
4.1 实验中分离得到对番茄早疫病的拮抗作用的细菌90株,经过复筛,获得拮抗能力较高的菌株2株,初步鉴定为萎缩芽孢杆菌(Bacillusatrophaeus)和枯草芽孢杆菌(Bacillussubtilis)。
4.2 对拮抗菌发酵液的抑菌作用进行了观察和测定。显微观察发现,拮抗菌和病原菌在平板上共培养时,病菌的菌丝从形态上发生了明显的变化,菌丝多处都出现了溢缩,破裂的现象,有的部位还发生了畸变,如变粗、扭曲变形、菌丝严重交联并产生卵形或近圆形的厚垣孢子等现象,说明拮抗菌发酵液中具有抗菌活性成分,对病菌的菌丝有致畸作用。盆栽试验表明,对于早疫病菌胁迫下的番茄幼苗,拮抗菌发酵液的相对防效达到35%以上。
4.3 拮抗菌发酵液在盆栽试验防治效果比较好,但其在田间生产中的实际表现还需要做进一步的验证试验和应用研究。
References)
[1] 王杏芹,史应武,刘文玉,等.甜瓜细菌性斑点病拮抗菌的分离与筛选[J] .新疆农业科学,2008,(1) :4-6.
WANGXing-qin,SHIYing-wu,LIUWen-yu,etal.(2008).IsolationandScreeningofBiocontrolStrainsofMuskmelonBacterialSpotDisease[J]. Xinjiang Agricultural Sciences, (1) :4-6.
[2] 刘淑芳,檀根甲,李娜,等.苹果采后炭疽病高效拮抗菌的筛选与应用[J] .安徽农业大学学报,2007,34(1):111-116.
LIUShu-fang,TANGen-jia,LINa,etal. (2007).Screeninghigh-efficientbiocontrolbacteriumofBacillussubtilisbyionimplantationanditsapplicationagainstpostharvestanthracnoseonapplefruit[J]. Journal of Anhui Agricultural University,34(1):111-116.
[3] 李伟杰,姜瑞波.番茄青枯病拮抗菌X10 的鉴定和田间应用[J] .中国土壤与肥料,2007,(5):60-63.
LIWei-jie,JIANGRui-bo. (2007).IdentificationandfieldapplicationofantagonisticstrainX10againsttomatobacterialwilt[J]. Soil and Fertilizer Sciences in China, (5):60-63.
[4] 张洪涛,于频频.(2007). 棉花黄萎病高效拮抗菌XJUL-6 的筛选鉴定及其特性研究[J].微生物学报,2007,(6) :7-9.
ZHANGHong-tao,YUPin-pineta1.CharacteristicsandidentificationofanAntagonisticXJUL-6AgainstCottonVerticilliumWilt[J]. ActaMicrobiologicaSinica, (6) :7-9.
[5]JohnM.Whipps. (2001).Microbialinteractionsandbiocontrolintherhizosphere[J]. Journal of Experimental Botany, 52(3):487-511.
[6] 林福呈,李德葆.枯草芽孢杆菌(Bacillussubtilis)S9 对植物病原真菌的溶菌作用[J] .植物病理学报,2003,33(2):174-17.
LINFu-cheng;LIDe-bao. (2003).Cell-lyticeffectofBacillussubtilisonplantfungalpathogens[J]. ActaPhytopathologicaSinica,33(2):174-17.
[7]张君玲. 新疆番茄出口加工业现状问题及战略对策现代商贸工业[J]. 设施农,2010,(12): 87-88.
ZHANGJun-ling. (2010).Xinjiangtomatoexportprocessingindustrystatusandthestrategiccountermeasuresforthemodernbusinessindustry. Facility agriculture, (12): 87-88.
[8]庞胜群,王祯丽,张润,等. 新疆加工番茄产业现状及发展前景[J]. 中国蔬菜,2005,(2): 39-41.
PANGSheng-qun,WANGZhen-Li,ZHANGRun,etal. (2005).Processingtomatoindustrypresentsituationanddevelopmentprospectinxinjiang[J]. China Vegetables, (2): 39-41.
[9]崔元玗,杨华,孙晓军,等. 新疆加工番茄主要病害发生[J]. 新疆农业科学, 2004, 41(3): 160-163.
CUIYuan-yu,YANGHua,SUNXiao-jun,etal.(2004).OccurrenceandDamageofImportantDiseasesofProcessingTomatoinXinjiang[J]. Xinjiang Agricultural Sciences, 41(3): 160-163.
[10] 董金皋,李树正主编.植物病原菌毒素研究进展(第一卷).北京:中国科学技术出版社,1997:222-226.
DONGJin- ,LIShu-zheng. (1997).AdvancesofresearchonthePlantPathogenicToxin.Beijing.ScienceandtechnologyofChinapress:222-226.
[11] 朱宗源,黄晓敏,吕云华.上海郊区番茄品种的抗早疫病性鉴定.上海农业学报,1987,3(1):31-43.
ZHUZong-yuan,HUANGXiao-min,LUYun-hua. (1987).Evaluationoffiftytomatovarietiesinshanghaisuburbsforresistancetoearlyblightdisease. ActaAgriculturae Shanghai, 3(1):31-43.
[12]沈萍,范秀容,李广武.微生物学实验(第三版)[D]. 高等教育出版社.
SHENPing,FANXiu-rong,LIGuang-wu. Microbiology experiment (the third edition) [D].HigherEducationPress.
[13]张璐,丁延芹,杜秉海,等. 黄瓜枯萎病病原拮抗细菌DS-1菌株鉴定及其生防效果研究[J]. 园艺学报,2010, 37 (4): 575-580.
ZHANGLu,DINGYan-qin,DUBing-hai,etal.(2010).IdentificationandBiocontrolEffectsofAntagonisticBacteriumDS-1StrainAgainstFusariumoxysporumf.sp.cucumerinum[J]. ActaHorticulturaeSinica, 37 (4): 575-580.
[14]李国媛. 秸秆腐熟菌剂的细菌种群分析及其腐熟过程的动态研究[C].北京: 中国农业科学院, 2007.
LIGuo-yuan. (2007). Study on Baeteria Communities of straw-decomposing inoculant and the dynamic change in the pcocess of fermentation[C].BEIJING:ChineseAcademyofAgriculturalSciences.
[15]汪茜,胡春锦,柯仿钢,等. 生防菌株1404的鉴定及其对采后柑橘炭疽病的防治效果[J]. 微生物学报, 2010, 50 (9): 1 208-1 217.
WANGQian,HUChun-Jin,KEFang-gang,etal.(2010).Characterizationofabacterialbiocontrolstrain1404anditsefficacyincontrollingpostharvestcitrusanthracnose[J]. ActaMicrobiologicaSinica, 50 (9): 1,208-1,217.
[16] 权春善,王军华,徐洪涛,等. 一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J]. 微生物学报, 2006, 46(1):7-12.
QUANChun-shan,WANGJun-hua,XUHong-tao,etal. (2006).IdentificationandcharacterizationofaBacillusamyloliquefacienswithhighantifungalactivity[J]. ActaMicrobiologicaSinica, 46(1):7-12.
[17] 李社增,鹿秀云,马平,等. 防治棉花黄萎病的生防细菌NCD-2的田间效果评价及其鉴定[J].植物病理学报, 2005, 35(5): 451-455.
LIShe-zeng,LUXiu-yun,MAPing,etal. (2005).EvaluationofbiocontrolpotentialofabacterialstrainNCD2againstCottonVerticilliumwiltinfieldtrials[J]. Actaphytopathologicasinica, 35(5): 451-455.
IsolationandScreeningfor2StainsofAntagonisticBacteriaagainstAlternariasolaniofTomatoandStudyonAntagonisticEffect
YANG Rong1,YANG Wen-qi1,ZHANG Zheng2,ZHAN Fa-qiang1,HOU Min1,HOUXin-qiang1, BAOHui-fang1,WANG-Ning1,LONG Xuan-qi1
(1.InstituteofMicroorganismApplication,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China; 2.CollegeofLifeSciences&Technology,XinjiangUniversity,Urumqi830046,China)
【Objective】 Screening for bacteria againstAlternariasolaniotomato from rhizosphere of processing tomato.【Method】Isolating antagonistic bacteriafrom rhizosphere of processing tomatoby culture on medium plate, preliminary screening and second screening are carried on by paired culture, preliminary identification is based on morphological characteristic, phylogenetic analysis of 16S rDNA, antagonistic effect of fermentation broth against mycelium ofA.solaniis observed under microscope,relative control effect of fermentation brothof antagonistic bacteria is observed by pot incubation test.【Result】90trains of antagonisticbacteria have been isolated,from them, 3 strainsofbacteriahave been screened by preliminary screening while 2 strains by second screening with obvious antagonistic effect (J2-2, J2-4), and then the two stains were preliminary identified as allied species ofBacillusatrophaeusandBacillussubtilis, teratogenic effect of fermentation brothagainst pathogenic mycelium has been observed under microscope, the relative control effect of fermentation broth has been determined above 35% in pot incubation test.【Conclusion】The result shows that the two isolates with significant antagonistic effect toA.solanicould provide potential solution for biological control of early blighttomato.
Alternariasolani(tomato); isolation; screening; identification
LONG Xuan-qi(1969-),,(E-mail)longxq_xj@sina.com
10.6048/j.issn.1001-4330.2017.08.016
2017-04-08
新疆维吾尔自治区科技成果转化专项资金项目“设施农业多价复合菌剂的示范推广”(201554113);新疆农业科学院青年基金项目“新疆加工番茄早疫病拮抗菌的分离与筛选”(xjnkq-2015027)
杨蓉(1981-),女,新疆人,助理研究员,硕士,研究方向为土壤微生物,(E-mail)Lingxuan2519@126.com
龙宣杞(1969-),女,四川人,研究员,硕士生导师,研究方向为土壤微生物与微生态学,(E-mail)longxq_xj@sina.com
S188
:A
:1001-4330(2017)08-1496-09
Supported by: Special funds for the transformation of scientific and technological achievements of Xinjiang (201554113); Demonstration and Extension on Multiple Bacteria Preparation in Facility Agriculture;Academy of Agricultural Sciences Fund for Yong Scientists Fund (xjnkq-2015027) , Isolation and Screening of Antagonistic BacteriaagainstAlternariasolaniof Processing Tomato in Xinjiang.

