壳聚糖载体加载碱性成纤维细胞因子诱导成年大鼠骨髓间充质干细胞分化为神经细胞的研究*
李曼丽,杨朝阳,李晓光
(1.北京航空航天大学生物与医学工程学院 北京 100191;2.首都医科大学基础医学院 神经生物学系 北京 100069)
壳聚糖载体加载碱性成纤维细胞因子诱导成年大鼠骨髓间充质干细胞分化为神经细胞的研究*
李曼丽1,杨朝阳2,李晓光1
(1.北京航空航天大学生物与医学工程学院 北京 100191;2.首都医科大学基础医学院 神经生物学系 北京 100069)
目的利用生物材料在体外将骨髓间充质干细胞诱导为神经元样细胞。方法利用全骨髓贴壁培养法提取骨髓间充质干细胞,并利用细胞表面抗原CD45和CD90进行鉴定。分为3组,单纯壳聚糖组、加载了碱性成纤维细胞因子(bFGF)的壳聚糖组和单纯bFGF组。分别在3和7 d时利用免疫荧光细胞化学检测神经干细胞标记蛋白Nestin、幼稚神经元标记蛋白Tuj-1等指标的表达情况。结果加载了bFGF的壳聚糖处理细胞时,细胞在第3天出现了大量的Nestin阳性细胞,虽然在其他两组中也出现了Nestin阳性细胞,但加载了bFGF的壳聚糖组比其他两组多,且差异有统计学意义(P<0.05)。同样的,在诱导7 d时,Nestin和Tuj-1双阳性的细胞在加载了bFGF组中的比例要比其他两组要多,且差异有统计学意义(P<0.05)。结论加载有bFGF的壳聚糖能够将成年大鼠骨髓间充质干细胞高比例诱导分化为神经元样细胞。为骨髓间充质干细胞自体移植治疗神经退行性疾病和中枢神经系统提供了理论和实验依据。
壳聚糖;碱性成纤维细胞因子;骨髓间充质干细胞;神经分化
壳聚糖为脱乙酰甲壳素,来源广泛。壳聚糖由于游离氨基的存在,其反应活性比甲壳素强[1]。由于其价格低廉,具有良好的生物性能并且组织相容性和生物降解性良好[2],逐渐在组织工程中广泛应用。碱性成纤维细胞因子(basic fibroblast growth factor,bFGF)由154个氨基酸组成,为FGF家族的一员,对促血管形成、诱导胚胎发育、促进神经生长等功能有广泛的作用,并在体内广泛分布,其生物活性要比酸性成纤维细胞生长因子(acid fibroblast growth factor,aFGF)大近 10 倍[3]。有研究证实,bFGF 能够促进神经干细胞分化为神经元、胶质细胞等神经细胞。
笔者之前的研究证实加载了NT-3的壳聚糖能够缓释NT-3诱导内源性神经干细胞的增殖并迁移到脊髓损伤区修复脊髓损伤并改善其运动功能[4-5]。笔者也研究了壳聚糖加载bFGF后对神经干细胞分化的影响,结果显示壳聚糖加载了bFGF后诱导分化为神经细胞的比例要比单纯的壳聚糖和单纯的bFGF的比例提高[6]。
神经干细胞不能用于自体移植,可能会导致免疫排斥和伦理问题,而骨髓间充质干细胞易于获取,可以取自自体,避免了上述问题,近年来已经成为了细胞移植的热门资源。本文主要研究壳聚糖加载bFGF诱导骨髓间充质干细胞向神经细胞分化。
1 材料与方法
1.1 材料
实验动物:成年Wistar大鼠,220 g左右。SPF级,首都医科大学实验动物部提供,许可证号:SYXK(京)2013-0004。
试剂:壳聚糖和bFGF(美国Sigma公司),Nestin和Tuj-1(美国Millipore公司),山羊抗兔或山羊小鼠荧光二抗(美国Invitrogen公司),Hoechst33342(美国Sigma公司),逆转录试剂盒(北京全式金生物技术有限公司)。
1.2 方法
1.2.1 成年骨髓间充质干细胞提取6%水合氯醛0.6 ml/100 g腹腔注射麻醉。75%酒精浸泡60 s,放置于冰上。采用无菌手术器械,剪开皮肤、肌肉暴露股骨和胫骨,利器剪断置于含1%青链霉素的PBS中,体式显微镜下剥除残余肌肉和筋膜等,洗掉油脂和浮血,清洗3次后,注射器吸取2 ml含10%FBS的DMEM将骨髓冲出于含8 ml培养基的10 cm平板中。注射器吹打将细胞吹散,于湿润的37℃、5%二氧化碳CO2培养箱中培养为P0代。
1.2.2 成年骨髓间充质干细胞培养传代 P0代培养24 h后全换液,之后2~3 d全换液,待细胞生长至80%~90%融合进行传代,传代时先用PBS洗涤细胞2次,2 ml 0.25%胰酶消化,收集细胞,1 000 r/min离心5 min,将细胞平均分到2个平板中,相同条件下传至P3代以待下一步处理。
解析本地区的中考卷要从“类”着手,再将“类”分成若干个小类,那么每小类相当于类中的一个“点”,通过对每个小类命题的解析,引导学生思考每小类之间的不同点,寻求小类命题的共同点,由小类到大类的归纳中抽象出质的东西.
1.2.3 骨髓间充质干细胞鉴定 将P3代细胞以1×105个/cm2密度种植于6孔板中,待细胞贴壁后,去除培养基,用PBS洗3遍。每孔加入含EDTA的胰酶0.5 ml消化2 min,加入等体积胰酶终止消化,收集细胞到EP管中,1 000 r/min离心5 min,弃上清,加入1ml PBS洗1次,同样1000r/min离心5 min,弃上清加入荧光标记Ⅰ抗(PE-Cy5-labeled anti-Rat CD45/FITC-labeled anti-Rat CD90)平均每 106个细胞加1μl,冰上孵育40 min后,PBS洗涤1次,5 min,上机检测。
1.2.4 骨髓间充质干细胞诱导分化 P3代细胞以1×105个/cm2密度种植于放置有多聚赖氨酸包被过盖玻片的6孔板中。24 h后待细胞贴壁,每孔分别添加不同的诱导剂:10 mg/ml壳聚糖,单纯bFGF组向培养基中加入20 ng/ml bFGF,bFGF-壳聚糖载体组向培养基中加入10 mg/ml加载有bFGF的壳聚糖。每2~3 d半量换液1次。
1.2.5 逆转录聚合酶链反应(RT-PCR)检测 Trizol法提取全RNA,用含有去除基因组DNA的gRemover的逆转录试剂盒将RNA逆转录为cDNA,之后以cDNA为模板,Nestin正向引物:GAGGACCAGG AGGCATGTAG,反向引物:TCTTCTGGAGACCTCAGG GA;GAPDH 正向引物:AGGTCGGTGTGAACGGATT TG,反向引物:TGTAGACCATGTAGTTGAGGTCA。
1.2.6 免疫荧光染色 PBS洗3次,5 min/次。4%的多聚甲醛4℃固定40 min。PBS洗掉多聚甲醛,并用0.3%TritonX-100破膜5 min。之后1%正常山羊血清(NGS)于37℃中孵育30 min。加入相应一抗,浓度分别为 Nestin 1∶100 Tuj-1 1∶100,37℃孵育2h,PBS洗掉多余一抗后加入Alexa594和Alexa 488标记的山羊抗兔或山羊小鼠荧光二抗(1∶300),37℃孵育1 h。PBS洗掉多余二抗后,Hoechst33342(1∶1 000)染核。去离子水洗掉多余染料,50%PB甘油封片后BX51荧光显微镜成像。
1.2.7 图像分析 DP Controller中成像并随机选取20个视野拍照,分别计数阳性细胞数。
1.3 统计学方法
2 结果
2.1 骨髓间充质干细胞原代培养和传代生长状态
骨髓间充质干细胞原代培养时细胞贴壁后形状不规则且细胞数目较少,待生长1~2 d后,细胞开始有小的突起进而其形态变为长梭形。细胞传代后,依然保持长梭形的形态但增殖速度明显增加。见图1。
2.2 骨髓间充质干细胞鉴定结果
利用骨髓间充质干细胞在塑料制品中的贴壁性,采用全细胞贴壁法,去除不贴壁细胞。传代3次后流式细胞术鉴定细胞表面抗原。经鉴定,95%以上的细胞为CD45-/CD90+细胞。即95%以上为骨髓间充质干细胞。见图2。
2.3 骨髓间充质干细胞分化为神经干细胞
图1 骨髓间充质干细胞正常形态 (×200)
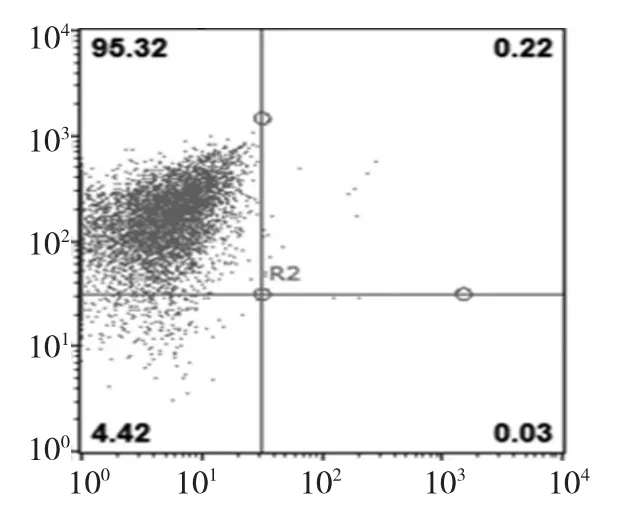
图2 细胞表面抗原流式细胞术鉴定结果
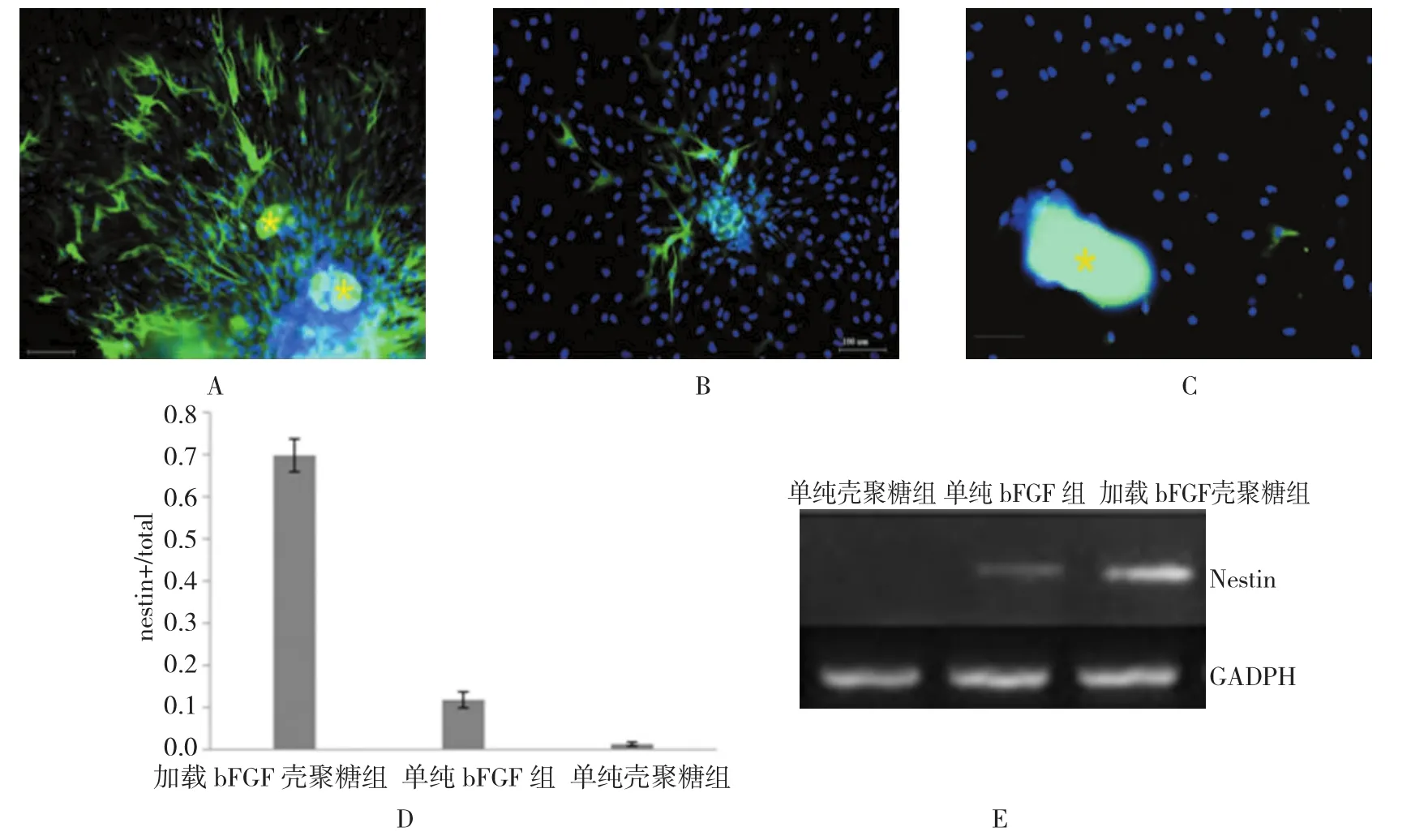
图3 各组N est i n表达情况
如图3所示,诱导1 d后,加载bFGF的壳聚糖组中能够看到细胞开始有突起,细胞形态开始向神经细胞形态发展。在单纯壳聚糖组中细胞形态基本没有变化,单纯bFGF组中细胞形态也发生了变化,但变化不明显(见图2)。诱导3 d后,这种变化进一步加剧,即单纯壳聚糖诱导细胞几乎没有Nestin+细胞,但单纯bFGF和加载有bFGF的壳聚糖诱导细胞时,Nestin+细胞更多,细胞突起更长。RT-PCR也能够检测到诱导3 d后在加载了bFGF的壳聚糖组中Nestin的RNA表达水平要比单纯bFGF组的表达量高,单纯壳聚糖组中几乎没有Nestin的表达。并且表达Nestin的细胞聚集成团状,形成类神经球的结构。
2.4 骨髓间充质干细胞由神经干细胞继续分化为幼稚神经元
为了验证这些具有神经干细胞特征的细胞是否能够进一步向神经细胞分化,本研究增加了诱导时间,在诱导7 d时检测幼稚神经元标记蛋白Tuj-1和神经干细胞标记蛋白的共标情况。结果发现,在加载有bFGF的壳聚糖组,能够检测到大量Nestin+和Tuj-1+双标细胞。在单纯bFGF组能够检测到双标细胞但是数量不多。单纯壳聚糖组没有检测到双标细胞。见图4。
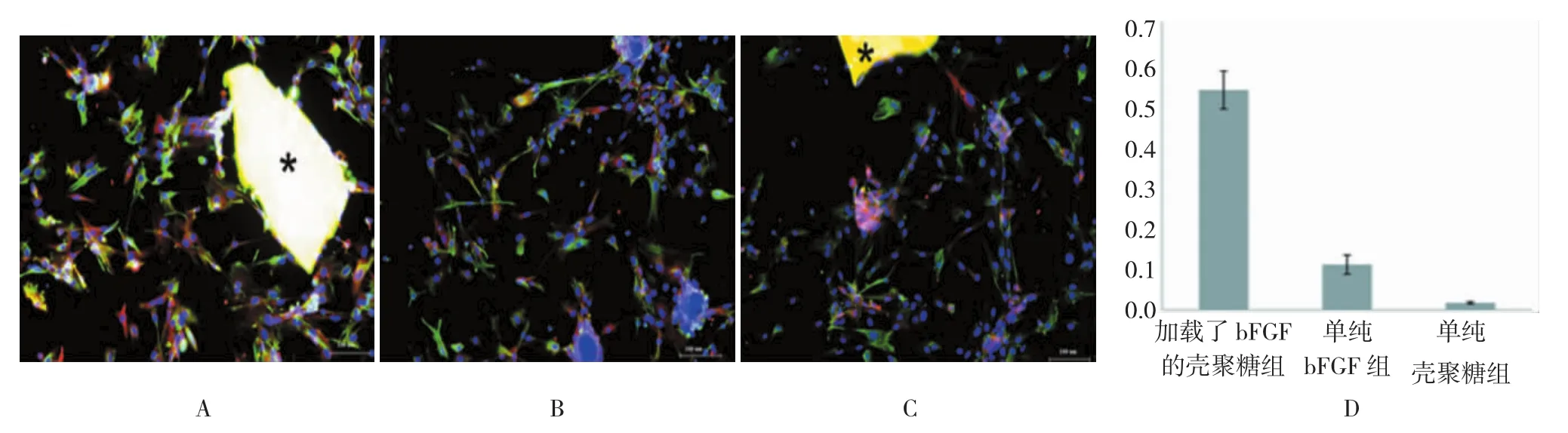
图4 各组神经干细胞向幼稚神经元分化情况
3 讨论
神经退行性疾病是目前危害人类健康和生活质量的疾病之一。神经退行性疾病主要是由于神经细胞损伤、凋亡、崩解或是传导通路受阻造成的。为了解决这些问题,研究者们致力于研究补充损失的神经细胞。为此,细胞诱导分化成为了研究热点。
神经干细胞作为神经细胞的祖细胞,就是分化为神经细胞,这其中包括神经元和神经胶质细胞。但是,成年动物内源性NSCs主要位于海马齿状回颗粒细胞下层、侧脑室下区、脊髓中央管室管膜区[6-8],细胞资源较少,且不适宜自体移植。这样就涉及免疫排斥和伦理问题,并具有成瘤风险。骨髓间充质干细胞临床上易于获得并对患者创伤较小能够自体移植,不涉及免疫排斥和伦理问题,最近已经成为了细胞移植的明星细胞。
壳聚糖为去乙酰化的甲壳素,在自然界中来源广泛[9]。具有游离的氨基使其具有更强的反应活性。壳聚糖具有良好的生物组织相容性,能够在体内降解[10],在生物材料中研究较广泛。笔者之前的研究证实,壳聚糖在结合NT-3后能够在培养体系中缓释14周以上[11-13]。解决了生长因子半衰期短,给药方式不适合临床等问题。
本研究采用了全骨髓贴壁法提取骨髓间充质干细胞,骨髓间充质干细胞在塑料制品中具有贴壁的性质,全骨髓贴壁法能够去除大部分的其余细胞。利用流式细胞术通过检测细胞表面抗原95%的细胞为CD45-/CD90+细胞。说明此方法能够得到较高纯度的骨髓间充质干细胞。为下一步的诱导分化做出了准备。
诱导1 d后,单纯壳聚糖组形态与正常的BMSC相似。说明BMSC不经过诱导处理并不能够自发的分化为神经干细胞。而加载了bFGF的壳聚糖组和单纯bFGF组的细胞形态发生了变化,细胞开始有了少量突起,单纯bFGF组类似,说明在短时间内单纯bFGF和加载了bFGF的壳聚糖组可能在诱导效果上类似,主要是因为单纯bFGF在短时间内还能够保持一定的浓度和效用。
诱导3 d后,单纯壳聚糖组还是没有变化,单纯bFGF组和加载了bFGF的壳聚糖组诱导效果出现了差异。加载了bFGF壳聚糖组的Nestin表达要比单纯壳聚糖组多,同样细胞形态也均发生了变化,说明诱导3 d时加载了bFGF的壳聚糖组的诱导效果要比单纯壳聚糖组明显,可能是由于将bFGF加载到壳聚糖中,能够使bFGF缓慢释放,具有持续的诱导效果。本课题组先前的报道显示加载了NT-3的壳聚糖具有缓释NT-3的效果,并且缓释时间能够持续14周[13]。同样说明骨髓间充质干细胞在向神经细胞分化的过程中是先分化为神经干细胞,形成神经球状细胞后,才进行下一步分化。待诱导7 d后,细胞出现了Nestin和Tuj-1双标细胞,更说明了这些新生的诱导来的幼稚神经元是经神经干细胞分化来的。同样,3组诱导结果还是有差异的。MSC在经加载了bFGF的壳聚糖的诱导,持续的bFGF的释放导致MSC受到持续的bFGF的诱导,更多的细胞分化为了幼稚神经元。单纯bFGF在体内的降解较快,半衰期只有几分钟,所以单纯bFGF组中只有少量的Nestin和Tuj-1双标细胞。而单纯壳聚糖组由于缺乏诱导因素,只有极少量的细胞甚至是没有细胞能够分化为Nestin和Tuj-1双标细胞。
本文结合了本课题组之前的研究,将bFGF加载到壳聚糖中研究其对骨髓间充质干细胞的诱导情况。扩展了壳聚糖缓释细胞因子的种类。证明了壳聚糖不仅能够缓释NT-3,同样也能够缓释bFGF。并且能够达到很好的诱导效果。为将壳聚糖缓释细胞因子应用于临床奠定了基础。另外,本实验主要针对MSC,对于自体移植给药都是很大的创新。为修复神经退行性疾病及中枢神经系统损伤开辟了新思路。
[1]孙璠,徐民,李克让.甲壳素和壳聚糖在离子液体中的溶解与改性[J].化学进展.2013,25(5):823-837.
[2]DHIMAN H K,RAY A R,PANDA A K.Characterization and evaluation of chitosan matrix for in vitro growth of MCF-7 breast cancer cell lines[J].Biomaterials,2004,25(21):5147-5154.
[3]张悦,胡杨,沈玉凤.bFGF/BMP-2转染大鼠骨髓干细胞体内成牙的研究[J].口腔医学研究,2016,32(3):239-243.
[4]YANG Z,ZHANG A,DUAN H,et al.NT3-chitosan elicits robust endogenous neurogenesis to enable functional recovery after spinal cord injury[J].Proc Natl Acad Sci,2015,112(43):13354-13359.
[5]DUAN H,GE W,ZHANG A,et al.Transcriptome analyses reveal molecular mechanisms underlying functional recovery after spinal cord injury[J].Proc Natl Acad Sci,2015,112(43):13360-13365.
[6]王聪,杨朝阳,段红梅,等.碱性成纤维细胞生长因子-壳聚糖载体诱导神经干细胞向神经元分化并形成突触的研究[J].中国康复理论与实践,2015,21(4):406-411.
[7]GAGE F H.Mammalian neural stem cells[J].Science,2000,287(5457):1433-1438.
[8]ZHAO C M,DENG W,GAGE F H.Mechanisms and functional implications of adult neurogenesis[J].Cell,2008,132(4):645-660.
[9]王雯静,桑秋章,邵宇,等.基于甲壳素的手性分离材料[J].材料导报,2016,30(1):53-60.
[10]PUVANESWARY S,TALEBIAN S,RAGHAVENDRAN H B,et al.Fabrication and in vitro biological activity of βTCP-Chitosan-Fucoidan composite for bone tissue engineering[J].Carbohydr Polym,2015,10(134):799-807.
[11]LI X G,YANG Z Y,ZHANG A F.The effect of neurotrophin-3/chitosan carriers on the proliferation and differentiation of neural stem cells[J].Biomaterials,2009,30(2009):4978-4985.
[12]MO L H,YANG Z Y,ZHANG A F,et al.The repair of the injured adult rat hippocampus with NT-3-chitosan carriers[J].Biomaterials,2010,31(2010):2184-2192.
[13]YANG Z Y,DUAN H M,MO L H,et al.The effect of the dosage of NT-3/chitosan carriers on the proliferation and differentiation of neural stem cells[J].Biomaterials,2010,31(2010):4846-4854.
(张蕾 编辑)
Differentiation of bone marrow mesenchymal stem cells of adult rat into nerve cells induced by chitosan carrier loaded with bFGF*
Man-li Li1,Zhao-yang Yang2,Xiao-guang Li1
(1.Department of Biomedical Engineering,School of Biological Science and Medical Engineering,Beihang University,Beijing 100191,China;2.Department of Neurobiology,School of Basic Medical Sciences,Capital Medical University,Beijing 100069,China)
ObjectiveTo inducein vitrodifferentiation of bone marrow mesenchymal stem cells into neuron-like cells by biological material.MethodsUsing bone marrow adherent characteristic,bone marrow mesenchymal stem cells were extracted.Then the cells were identified by cell surface antigens CD45 and CD90.The cells were divided into three groups namely pure chitosan,chitosan-loaded bFGF group and bFGF group.The expressions of neural stem cell marker Nestin and neuron-like cell marker Tuj-1 were evaluated using immunocytochemical method on the 3rd and 7th d respectively.ResultsThe proportion of Nestin-positive cells in the bFGF loaded group on the 3rd day was significantly higher than that in the other two groups(P<0.05).Similarly,the proportion of Nestin and Tuj-1 double positive cells in the bFGF loaded group was significantly higher than that in the other two groups on the 7th day of induction(P<0.05).ConclusionsbFGF-loaded chitosan can induce differentiation of bone marrow mesenchymal stem cells of adult rat into neuron-like cells at a high proportion,which provides a theoretical and experimental evidence for autologous transplantation in the treatment of neurodegenerative diseases and centralnervous system injury.
chitosan;bFGF;BMSC;neuronal differentiation
R-332
A
10.3969/j.issn.1005-8982.2017.13.001
1005-8982(2017)13-0001-05
2016-12-16
国家国际科技合作专项项目(No:2014DFA30640)
李晓光,E-mail:lxgchina@sina.com;Tel:010-83950083

