铬(Cr6+)胁迫对不同基因型小麦种子萌发及幼苗抗氧化和渗透调节的影响
徐维杰,王庆亚,杨文嘉,孙建云,戴廷波
(1.南京农业大学生命科学学院,江苏南京 210095; 2.南京农业大学农学院,江苏南京 210095)
铬(Cr6+)胁迫对不同基因型小麦种子萌发及幼苗抗氧化和渗透调节的影响
徐维杰1,王庆亚1,杨文嘉1,孙建云1,戴廷波2
(1.南京农业大学生命科学学院,江苏南京 210095; 2.南京农业大学农学院,江苏南京 210095)
为明确小麦种子萌发对Cr6+胁迫响应的品种间差异及其Cr6+耐性差异的生理机制,以耐Cr6+品种扬麦16和Cr6+敏感品种豫麦51为材料,研究了不同浓度的Cr6+(0、10、50、100、150 μmol·L-1)处理对种子萌发、α-淀粉酶活性、幼苗生长、活性氧水平、抗氧化酶活性和渗透调节物质含量的影响。结果表明,10 mol·L-1Cr6+处理下,小麦种子的萌发过程未受到明显影响。随着Cr6+处理浓度的进一步增加,小麦种子发芽势、发芽率、根长逐渐下降,扬麦16受抑制的程度较豫麦51轻;种子α-淀粉酶活性、根系可溶性蛋白和可溶性糖含量呈现先升后降的趋势;根系游离脯氨酸、丙二醛、O2-· 和H2O2含量逐渐升高。相同浓度Cr6+处理下,扬麦16的种子α-淀粉酶活性、根系可溶性糖和游离脯氨酸含量显著高于豫麦51,而根系丙二醛、O2-· 和H2O2的含量显著低于豫麦51。在Cr6+胁迫下,小麦根系SOD、POD、APX和GR的活性总体上呈现先升后降的趋势。在高浓度Cr6+(150 mol·L-1)处理下,扬麦16 的种子α-淀粉酶、根系SOD、POD、APX和GR活性受抑制程度均明显小于豫麦51。
小麦;Cr6+;萌发;抗氧化;渗透调节
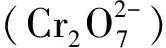
小麦是世界第三大农作物,其产量和品质备受人们的关注。研究表明,不同植物种类之间以及同一种类植物不同品种间对铬的耐性都存在差异[7-8]。目前,铬胁迫对植物种子萌发的影响已有报道。张黛静等[9]研究发现,0~25 mg·L-1Cr3+可促进小麦种子萌发,但随着Cr3+浓度的进一步升高,小麦的根长、芽长和根系活力均呈下降趋势。Dotaniya等[10]研究表明,当环境中铬浓度达到100 mg·L-1时,小麦种子萌发率与对照相比下降了37%。杨文玲等[11]的研究结果显示,当铬离子浓度达到50 mg·L-1时,小麦幼苗株高和干物质积累量显著下降,脯氨酸大量积累。Samantary等[12]研究得出,当Cr6+浓度为96~192 mol·L-1时,铬敏感型绿豆萌发率明显下降,而耐铬型绿豆萌发率却没有受到显著影响。
目前,关于Cr6+对不同小麦品种种子萌发的影响及其耐性机理的研究相对较少。本实验以耐Cr6+性不同的2个小麦品种为材料,研究了Cr6+胁迫对小麦种子萌发、根芽生长、种子α-淀粉酶活性、根系MDA含量、H2O2含量、O2-· 含量和渗透调节物质含量以及抗氧化酶活性的影响,探讨小麦种子萌发对Cr6+胁迫应答的品种间差异及其生理生化机制,以期为小麦耐Cr6+品种的选育提供理论支持和依据。
1 材料与方法
1.1 试验材料
根据前期试验对107个小麦品种的筛选结果[以10 mol·L-1Cr6+胁迫10 d后苗期地上部干重抑制率(SPR)和地上部铬含量(SCC)为主要耐Cr筛选指标,将所有小麦品种进行分类],从中选择扬麦16(Cr6+耐性品种,SPR=4.57%,SCC=9.63 mg·kg-1DW)和豫麦51(Cr6+敏感品种,SPR=31.43%,SCC=30.81 mg·kg-1DW)作为供试材料。
1.2 试验方法
选择大小一致、颗粒饱满的小麦种子,用20%双氧水消毒10 min后,用蒸馏水冲洗干净,将种子(腹沟朝下)均匀排列在铺有双层滤纸的直径9 cm培养皿中,每皿100粒,然后进行铬处理。铬处理浓度以Cr6+浓度计,分别为0、10、50、100、150 μmol·L-1(试验浓度设计参考卢志红等[13]的报道略作修改),每个处理设置3个重复(每皿为一个重复)。Cr6+以重铬酸钾(K2Cr2O7)形式添加到去离子水(ddH2O)中。放入光照培养箱避光萌发48 h后正常光照,昼夜温度分别为22/18 ℃,每隔12 h补充一次处理液。每天记录发芽数(种子萌发以胚根达到种子长度一半为标准),种子萌发的第3天统计发芽势并测定种子 α-淀粉酶活性;第7天统计发芽率,测量根长、芽长,并取小麦幼苗根系测定其他生理生化指标。
1.3 测定项目与方法
1.3.1 种子发芽相关指标的测定
每天定时统计发芽数,以下列公式计算种子发芽势和发芽率。
发芽势=(第3天发芽种子数/供试种子数)×100%
发芽率=(第7天发芽种子数/供试种子数)×100%
第7天每个培养皿内随机取10株幼苗统计根长和芽长,以平均值计为每个重复的根长和芽长。
1.3.2 生理生化指标的测定
采用3,5-二硝基水杨酸(DNS)法[14]测定萌发3 d的小麦种子α-淀粉酶活性。采用蒽酮比色法[15]测定根系可溶性糖的含量。采用考马斯亮蓝G-250法[16]测定根系可溶性蛋白的含量。采用酸性茚三酮法[16]测定根系游离脯氨酸的含量。采用硫代巴比妥酸法[17]测定根系丙二醛的含量。
抗氧化酶提取: 取0.5 g根尖部分,加5 mL酶提取液[pH 7.8的磷酸缓冲液,20%甘油,1 mmol·L-1EDTA,1 mmol·L-1抗坏血酸(AsA),1 mmol·L-1还原型谷胱甘肽(GSH),5 mmol·L-1MgCl2,1 mmol·L-1二硫苏糖醇(DTT)],冰浴研磨,4 ℃冷冻离心(10 000 r·min-1,20 min),取上清液。
抗坏血酸过氧化物酶(APX)活性的测定:取0.1 mL提取液,加入2.75 mL反应液(pH 7.0的磷酸缓冲液,0.30 mmol·L-1AsA,0.13 mmol·L-1EDTA-Na2)和0.15 mL H2O2,290 nm波长下比色测吸光值。谷胱甘肽氧化酶(GR)活性测定:取0.1 mL提取液,加入2 mL反应液(pH 7.8的磷酸缓冲液,5 mmol·L-1MgCl2,0.5 mmol·L-1GSSG)和0.2 mL 1.5 mmol·L-1NADPH,340 nm紫外和可见光双重光源下比色侧吸光值。超氧化歧化酶(SOD)活性测定采用氯化硝基四氮唑蓝(NBT)光化还原法[18]。过氧化物酶(POD)活性测定采用愈创木酚法[19]。O2-· 含量测定采用Mohan等[20]的方法。H2O2含量测定采用H2O2试剂盒法。
1.4 数据处理
用Microsoft Excel 2010对数据进行整理,用SPSS 19.0软件进行方差分析和显著性检验。
2 结果与分析
2.1Cr6+胁迫对小麦种子发芽率、发芽势、根长和芽长的影响
与CK相比,10 μmol·L-1Cr6+处理下,2个小麦品种的种子发芽率和发芽势均有所提高,但与CK无显著性差异(表1)。当Cr6+浓度为50 μmol·L-1时,2个品种的种子发芽率和发芽势均下降,其中,豫麦51的两个指标与CK差异显著,而扬麦16与CK差异不显著。当Cr6+浓度进一步升高时,2个品种的种子发芽率和发芽势均显著下降,至150 μmol·L-1Cr6+处理时,两个指标在品种间差异均显著。
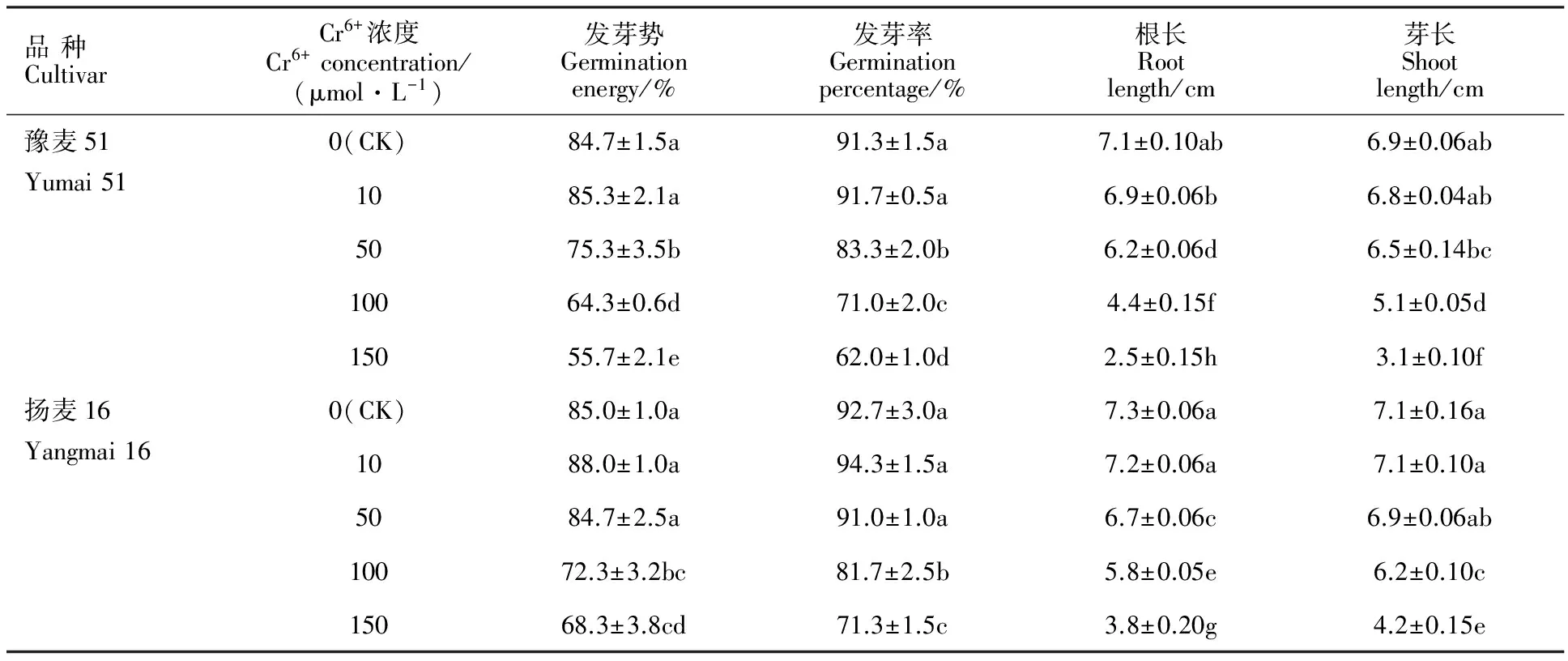
表1 铬(Cr6+)胁迫对小麦种子萌发的影响Table 1 Effect of Cr6+ stress on germination of two wheat varieties
同列数据后不同小写字母表示处理间差异显著(P<0.05)。表2和表3同。
Different small letters within the same column indicate significant difference among the treatments at 0.05 level.The same in table 2 and table 3.
Cr6+胁迫下,小麦主根缩短、变粗、弯曲,不定根丛生,呈现明显的抑制畸形。与CK相比,2个品种根和芽的长度分别在10 μmol·L-1Cr6+和50 μmol·L-1Cr6+处理下未受到显著影响。随着Cr6+浓度的进一步升高,两品种根和芽的伸长生长显著受抑。当Cr6+浓度达到150 μmol·L-1时,扬麦16和豫麦51芽的生长抑制率分别为40.8%和55.1%,根的生长抑制率分别为47.9% 和64.8%。这表明高浓度的Cr6+对根的伸长生长抑制效应大于芽。在相同浓度Cr6+处理下,扬麦16种子萌发中根和芽的生长受Cr6+抑制作用明显小于豫麦51,表现出较强的耐Cr6+性。
2.2Cr6+胁迫对小麦种子萌发过程中α-淀粉酶活性的影响
在小麦种子萌发过程中,α-淀粉酶活性随着Cr6+浓度的升高呈先升后降的趋势(图1),2个品种的表现略有差异。与CK相比,10 μmol·L-1Cr6+处理时豫麦51的种子α-淀粉酶活性略有增加,而随着Cr6+浓度的进一步提高,α-淀粉酶活性显著下降,至150 μmol·L-1Cr6+处理时,α-淀粉酶活性仅为CK的37.7%。10~50 μmol·L-1Cr6+处理下,扬麦16的种子α-淀粉酶活性显著高于CK,且在10 μmol·L-1Cr6+处理下达到最大值,随着Cr6+浓度的进一步提高,α-淀粉酶活性逐渐下降,至150 μmol·L-1Cr6+处理,其α-淀粉酶活性为CK的70.7 %。相同浓度的Cr6+(0μmol·L-1Cr6+除外)处理下,扬麦16的种子α-淀粉酶活性显著高于豫麦51。
2.3Cr6+胁迫对小麦幼苗根系MDA、H2O2、O2-·含量的影响
Cr6+胁迫后2个小麦品种根系的MDA、H2O2和O2-· 含量均增加(表2),而且除10 μmol·L-1Cr6+处理外,其余Cr6+浓度处理与CK的差异均显著。在100~150 μmol·L-1Cr6+胁迫下,豫麦51根系MDA、H2O2和O2-· 的含量均已显著高于扬麦16。

图柱上不同小写字母表示处理间差异显著(P<0.05)。下图同。

表2 Cr6+胁迫对小麦幼苗根系MDA、H2O2和O2-·含量的影响Table 2 Effect of Cr6+ stress on MDA,H2O2 and O2-· content in roots of wheat seedlings
2.4Cr6+胁迫对小麦幼苗根系抗氧化酶活性的影响
从图2可以看出,与CK相比,2个品种根系SOD和POD活性均随着Cr6+处理浓度的增加呈先升后降趋势,在100 μmol·L-1Cr6+处理下,其SOD和POD活性达到最大值。在150 μmol·L-1Cr6+处理下,豫麦51 的SOD和POD活性显著下降,但仍显著高于CK,而扬麦16的酶活性略降。相同浓度Cr6+处理下,扬麦16根系的SOD和POD活性均显著高于豫麦51。
同时,与CK相比,10 μmol·L-1Cr6+处理下,扬麦16幼苗根系APX活性略有升高,而豫麦51 APX活性显著下降,随着Cr6+处理浓度的进一步提高,2个小麦品种的APX活性均显著上升,且在100 μmol·L-1Cr6+处理时达到最大值,至150 μmol·L-1Cr6+处理时,两品种的APX活性均显著下降,但扬麦16的APX活性仍显著高于CK,而豫麦51的APX活性已低于CK。相同Cr6+(除0 μmol·L-1和50 μmol·L-1外)处理下,扬麦16根系的APX活性均显著高于豫麦51。
另外,与CK相比,2个小麦品种根系GR活性均随着Cr6+处理浓度的增加呈先升后降的趋势。在50 μmol·L-1(豫麦51)和100 μmol·L-1(扬麦16)Cr6+处理时,2个品种根系的GR活性达到最大值,至150 μmol·L-1Cr6+处理时,其GR活性显著下降,但仍显著高于CK。相同Cr6+(除50 μmol·L-1外)处理下,扬麦16根系的GR活性均显著高于豫麦51。
2.5Cr6+胁迫对小麦幼苗根系中渗透性调节物质含量的影响
与CK相比,2个小麦品种根系的可溶性糖含量均随着Cr6+处理浓度的增加呈先升后降的趋势(表3)。在10 μmol·L-1Cr6+处理时,其可溶性糖含量均达到最大值,随着Cr6+处理浓度的进一步提高,2个品种可溶性糖含量均显著下降,至100 μmol·L-1Cr6+处理时,豫麦51和扬麦16均已显著低于CK。相同浓度Cr6+处理下,扬麦16的可溶性糖含量均显著高于豫麦51。
同时,与CK相比,10 μmol·L-1Cr6+处理下,2个小麦品种可溶性蛋白的含量略有升高,Cr6+浓度为50 μmol·L-1时,豫麦51的可溶性蛋白含量已显著高于CK,而扬麦16的含量略有下降,随着Cr6+处理浓度的进一步提高,2个品种的含量均降低,至150 μmol·L-1Cr6+处理时,2个品种的含量已显著低于CK。相同浓度Cr6+(除50 μmol·L-1外)处理下,2个品种间可溶性蛋白的含量没有显著差异。另外,随着Cr6+处理浓度的增加,2个品种根系中游离脯氨酸含量均呈上升趋势。相同浓度 Cr6+处理下,扬麦16游离脯氨酸含量均显著高于豫麦51,品种间差异显著。
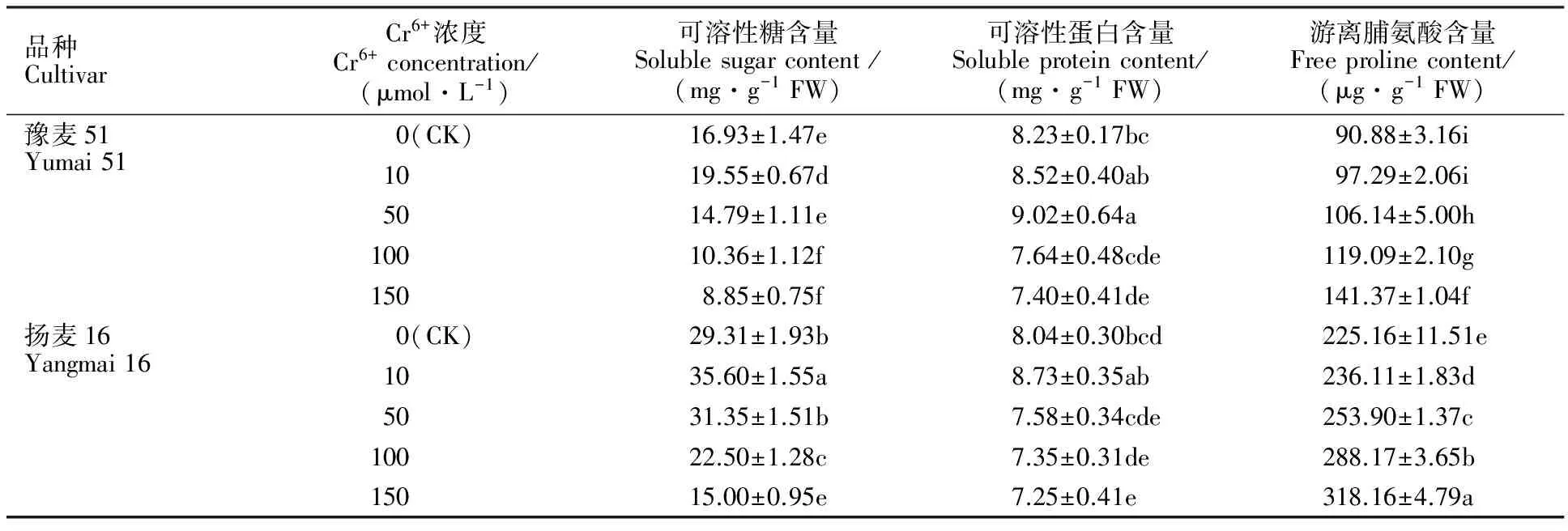
表3 Cr6+ 胁迫对小麦渗透性调节物质含量的影响Table 3 Effect of Cr6+ stress on osmotic adjustment substance contents in roots of wheat seedlings
3 讨 论
种子的萌发情况可快速反映外界环境胁迫对植物产生毒害的程度[21]。本试验结果显示,低浓度Cr6+(10 μmol·L-1)未显著影响小麦种子的发芽率、发芽势、根和芽的伸长生长。中、高浓度(50、100和150 μmol·L-1)Cr6+处理下,小麦种子的发芽率、发芽势及根的伸长生长均明显受抑,这表明较高浓度的Cr6+胁迫对小麦种子萌发和幼苗生长有明显的毒害作用。这与王丽燕等[22]得出的重金属胁迫影响小麦种子萌发的结论一致。Cr6+抑制小麦根系生长的主要方式是通过抑制根尖细胞分裂和伸长并使细胞分裂周期变长,破坏组织结构,进而导致根系吸收水分和营养物质能力下降[23]。而Cr6+对小麦根系生长的抑制作用导致根系对水分和矿质元素的吸收以及转运的能力下降,最终使得小麦幼苗高度降低[24]。试验中我们还发现,Cr6+对根伸长生长的抑制程度明显大于芽。这可能是由于根系与Cr6+直接接触,从而受到直接的毒害作用;另外,根系吸收的Cr6+又会诱导根系合成乙烯,而过量的乙烯对细胞具有很强的毒害作用,这也是小麦根系受Cr6+毒害的程度大于芽的重要原因之一。有研究表明,Cr6+还会使根系细胞壁多糖组分中的羟基和自由羧基变多,从而固定更多的Cr6+,使Cr6+向地上部转移量减少,因而减轻了Cr6+对小麦地上部的毒害[25]。与豫麦51相比,Cr6+胁迫处理对扬麦16种子萌发的影响较轻,这表明扬麦16对Cr6+具有较强的耐性。
种子萌发需要充足的物质和能量供应。小麦种子中的主要贮藏物质是淀粉,通过淀粉酶水解淀粉生成可溶性糖,进而完成种子萌发过程中物质和能量的供给[26]。因此,淀粉酶活性高低与小麦种子萌发紧密相关。在本试验中,与CK相比,10 μmol·L-1Cr6+处理显著增加了扬麦16种子α-淀粉酶的活性,这可能是因为较低浓度重金属处理会促进种子萌发过程中控制淀粉酶合成的基因提前表达[27]。而在50~150 μmol·L-1Cr6+处理下,2个小麦品种 α-淀粉酶活性均显著下降,这可能是由于Cr6+进入到萌发的种子中,通过取代α-淀粉酶中的Ca2+或者使Ca2+与α-淀粉酶分离,从而使淀粉酶活性降低[28]。淀粉酶活性的下降限制了胚发育过程中糖分的正常供应,从而抑制了小麦种子的萌发[29]。同一浓度Cr6+处理(0 μmol·L-1除外)下,扬麦16的 α-淀粉酶活性均显著高于豫麦51,说明了扬麦16在Cr6+胁迫条件下能够保持相对较高的α-淀粉酶活性,从而能更好地获得能量供应,完成种子的萌发过程。
重金属胁迫下植物代谢的改变是由于其对酶活性或者代谢物质产生了直接影响,或者产生了活性氧(ROS)导致膜脂过氧化,而膜脂过氧化是氧化损伤的重要原因。作为膜脂过氧化的产物,丙二醛(MDA)的含量是衡量细胞膜脂受损伤程度的重要指标[30]。植物体内的SOD是植物细胞抵御活性氧自由基伤害的第一道防线,主要负责清除细胞内的O2-·[30]。SOD活性的升高会大量减少O2-·,但是会增加H2O2,而其他抗氧化酶(POD、APX、GR等)负责清除SOD产生的H2O2,从而形成了完整的抗氧化系统。本试验中,与CK相比,在低浓度(10 μmol·L-1)Cr6+处理下,扬麦16和豫麦51根系中H2O2和O2-·以及MDA含量无显著变化,而SOD、POD、APX、GR活性均有不同程度的变化,表明低浓度Cr6+会激活小麦抗氧化系统,及时清除体内产生的多余ROS。随着Cr6+处理浓度升高,H2O2、O2-·和MDA的含量呈上升的趋势,表明较高浓度的Cr6+胁迫处理打破了抗氧化系统的平衡,进而产生了Haber-Weiss反应,加剧了膜脂过氧化作用[31]。另外,高浓度 (150 μmol·L-1)Cr6+处理下,耐Cr6+品种扬麦16根系中的H2O2、O2-·和MDA的含量均显著低于豫麦51。抗氧化酶活性及ROS含量结果表明扬麦16具有更强的清除活性氧的能力,减轻了Cr6+胁迫对自身造成的氧化损伤。
渗透调节是植物适应重金属胁迫的重要机制之一[32]。植物为了适应重金属胁迫,体内会大量合成和积累可溶性糖、可溶性蛋白、游离脯氨酸、甜菜碱等渗透调节物质,以保持细胞和组织渗透平衡[32]。在本试验中,与CK相比,低浓度(10 μmol·L-1)Cr6+处理下,2个小麦品种的可溶性糖含量增加,表明低浓度Cr6+会促进胚乳中所贮存的淀粉分解,从而使可溶性糖含量上升。中高浓度(50、100、150 μmol·L-1)Cr6+处理下,2个小麦品种的可溶性糖含量均显著下降,这可能是由于淀粉酶、麦芽糖酶活性受到了抑制,阻碍了淀粉和麦芽糖的分解作用[33]。有研究指出,在重金属胁迫处理下,植物体内游离脯氨酸含量会逐渐升高[34]。本试验结果显示,随着Cr6+处理浓度的升高,2个小麦品种游离脯氨酸含量均持续上升,并且扬麦16在相同浓度Cr6+处理下游离脯氨酸积累量均显著高于豫麦51。脯氨酸含量的升高可能是由于逆境胁迫促进了脯氨酸的合成(主要通过谷氨酸途径)或是由于脯氨酸的氧化降解减弱所致[35]。
综上所述,与Cr6+敏感品种豫麦51相比,耐Cr6+品种扬麦16在Cr6+胁迫条件下,萌发的种子中具有较高的α-淀粉酶活性,保证了萌发过程中所需的能量供应。幼苗根系中的可溶性糖和游离脯氨酸含量相对较高,可以更好地保持体内细胞与组织的渗透平衡,维持稳态;幼苗根系具有较高的抗氧化酶活性,能够及时清除体内产生的多余活性氧,降低活性氧对质膜造成的伤害,以维持细胞质膜的稳定性和完整性。
[1] 郭红叶,张海敏,田中伟,等.小麦幼苗铬吸收的基因型差异及耐性机理[J].麦类作物学报,2015,35(10):1386.
GUO H Y,ZHANG H M,TIAN Z W,etal.Genotypic differences of chromium absorption and tolerance mechanism to chromium stress in wheat seedlings [J].JournalofTriticeaeCrops,2015,35(10):1386.
[2]POSADA O M,TATE R J,GRANT M H.Toxicity of cobalt-chromium nanoparticles released from a resurfacing hip implant and cobalt ions on primary human lymphocytesinvitro[J].JournalofAppliedToxicology,2015,35(6):614.
[3]KATZ S A,SALEM H.The biological and environmental chemistry of chromium [J].Wiley&Sons,1994,89(95):117.
[4]SHAIKH I R,RAFIQUE A S,SHAIKH A A,etal.Phytotoxic effects of heavy metals parveen rajjak (Cr,Cd,Mn and Zn) on wheat (TriticumaestivumL.) seed germination and seedlings growth in black cotton soil of Nanded,India [J].ResearchJouranlofChemicalSciences,2013,3(6):14.
[5] 骆和东,吴雨然,姜艳芳.我国食品中铬污染现状及健康风险[J].中国食品卫生杂志,2015(6):717.
LUO H D,WU Y R,JIANG Y F.The contamination situation of chromium in food and risk assessment in China [J].ChineseJournalofFoodHygiene,2015(6):717.
[6]NAZ A,MISHRA B K,GUPTA S K.Human health risk assessment of chromium in drinking water:a case study of Sukinda Chromite Mine,Odisha,India [J].ExposureandHealth,2016,8(2):253.
[7] 王爱云,黄姗姗,钟国锋,等.铬胁迫对3种草本植物生长及铬积累的影响[J].环境科学,2012,33(6):2028.
WANG A Y,HUANG S S,ZHONG G F,etal.Effect of Cr(Ⅵ) stress on growth of three herbaceous plants and their Cr uptake [J].EnvironmentalScience,2012,33(6):2028.
[8] 吕金印,齐 君,王 帅,等.不同基因型普通白菜对铬胁迫的生理响应及铬吸收差异[J].中国蔬菜,2012,1(24):55.
LÜ J Y,QI J,WANG S,etal.Differences of chrome absorption and physiological responses of different genotypic pakchoi to chrome stress [J].ChinaVegetables,2012,1(24):55.
[9] 张黛静,姜丽娜,邵 云,等.铬胁迫下三种基因型小麦萌发和抗氧化酶差异的研究[J].华北农学报,2009,24(6):69.
ZHANG D J,JIANG L N,SHAO Y,etal.Differential responses in germination and antionxidant enzymes of three wheat cultivars to chromium stress [J].ActaAgriculturaeBoreali-Sinica,2009,24(6):69.
[10]DOTANIYA M L,DAS H,MEENA V D.Assessment of chromium efficacy on germination,root elongation,and coleoptile growth of wheat (TriticumaestivumL.) at different growth periods [J].EnvironmentalMonitoring&Assessment,2014,186(5):2957.
[11] 杨文玲,岳丹丹,李冠杰,等.铅铬胁迫对小麦种子萌发及幼苗脯氨酸含量的影响[J].生物技术通报,2015(12):110.
YANG W L,YUE D D,LI G J,etal.The effects of lead and chromium stresses on seed germination and proline content in wheat seedlings [J].BiotechnologyBulletin,2015(12):110.
[12]SAMANTARY S.Biochemical responses of Cr-tolerant and Cr-sensitive mung bean cultivars grown on varying levels of chromium [J].Chemosphere,2002,47(10):1065.
[13] 卢志红,赵小敏,朱美英.铬Cr6+对水稻种子萌发及幼苗生长的影响[J].中国土壤与肥料,2008(3):60.
LU Z H,ZHAO X M,ZHU M Y.Effect of chromium(Cr6+)on rice seed germination and seeding growth [J].SoilandFertilizerSciencesinChina,2008(3):60.
[14] 王学奎.植物生理生化实验原理和技术(第二版)[M].北京:高等教育出版社,2006:174.
WANG X K.Principles and techniques of plant physiological biochemical experiment(2nd edition) [M].Beijing:Higher Education Press,2006:174.
[15]JIA W,ZHANG J.Stomatal movements and long-distance signaling in plants [J].PlantSignalingandBehavior,2008,3(10):772.
[16]BRADFORD K J,SHARKEY T D,FARQUHAR G D.Gas exchange,stomatal behavior,and δ13C values of the flacca tomato mutant in relation to abscisic acid [J].PlantPhysiology,1983,72(1):245.
[17] 张志良,瞿伟菁,李小方.植物生理学实验指导(第4版) [M].北京:高等教育出版社,2008:208-209.
ZHANG Z L,QU W J,LI X F.Experimental guide for plant physiology(4nd edition) [M].Beijing:Higher Education Press,2008:208-209.
[18] 李合生,孙 群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:165-167.
LI H S,SUN Q,ZHAO S J.Principles and techniques of plant physiological biochemical experiment [M].Beijing:Higher Education Press,2000:165-167.
[19]JIAO C,YANG R,ZHOU Y,etal.Nitric oxide mediates isoflavone accumulation and the antioxidant system enhancement in soybean sprouts [J].FoodChemistry,2016,204:373.
[20]MOHAN M A V,PATNAIK A R,PANDA B B.Oxidative biomarkers in leaf tissue of barley seedlings in response to aluminum stress [J].Ecotoxicology&EnvironmentalSafety,2012,75(1):16.
[21]RAJJOU L,DUVAL M,GALLARDO K,etal.Seed germination and vigor [J].PlantBiology,2012,63(63):507.
[22] 王丽燕,郑世英.镉、铅及其复合污染对小麦种子萌发的影响[J].麦类作物学报,2009,29(1):146.
WANG L Y,ZHENG S Y.Effect of cadmium,lead and their combined pollution on seed germination of wheat [J].JournalofTriticeaeCrops,2009,29(1):146.
[23]SUNDARAMOORTHY P,CHIDAMBARAM A,GANESH K S,etal.Chromium stress in paddy:(i) nutrient status of paddy under chromium stress; (ii) phytoremediation of chromium by aquatic and terrestrial weeds [J].ComptesRendusBiologies,2010,333(8):597.
[24]BARCELO J,POSCHENRIEDER C.Plant water relations as affected by heavy metal stress:A review [J].JournalofPlantNutrition(USA),2008,13(1):1.
[25]SHANKER A K,CERVANTES C,LOZA-TAVERA H,etal.Chromium toxicity in plants [J].EnvironmentInternational,2005,31(5):739.
[26]ZHANG H,WANG M J,HU L Y,etal.Hydrogen sulfide promotes wheat seed germination under osmotic stress [J].RussianJournalofPlantPhysiology,2010,57(4):532.
[27]KALAI T,KHAMASSI K,SILVA J A T D,etal.Cadmium and copper stress affect seedling growth and enzymatic activities in germinating barley seeds [J].ArchivesofAgronomy&SoilScience,2014,60(6):765.
[28]OLTEANU Z,OPRICA L,TRUTA E,etal.Changes induced by two chromium-containing compounds in antioxidative response,soluble protein level and amylase activity in barley seedlings [J].AnaleleStiintificeAleUniversitatiiAlexandruIoanCuzaDinia,2012,13(3):41.
[29]DOTANIYA M L,MEENA V D,DAS H.Chromium toxicity on seed germination,root elongation and coleoptile growth of pigeon pea (Cajanuscajan) [J].LegumeResearch-AnInternationalJournal,2014,37(2):227.
[30] 常云霞,徐克东,张小芳,等.外源水杨酸对Hg2+胁迫下小麦幼苗生长及生理的影响[J].麦类作物学报,2014,34(4):540.
CHANG Y X,XU K D,ZHANG X F,etal.Effects of salicylic acid on the growth and physioligical property of wheat seedings under Hg2+stress [J].JournalofTriticeaeCrops,2014,34(4):540.
[31]DAUD M K,MEI L,VARIATH M T,etal.Chromium (VI) uptake and tolerance potential in cotton cultivars:effect on their root physiology,ultramorphology,and oxidative metabolism [J].BiomedResearchInternational,2014,2014(2):975946.
[32]PANDEY V,DIXIT V,SHYAM R.Chromium effect on ROS generation and detoxification in pea (Pisumsativum) leaf chloroplasts [J].Protoplasma,2009,236(1-4):85.
[33]SUTHAR B,PANSURIYA J,KHER M M,etal.Biochemical changes under chromium stress on germinating seedlings ofVignaradiata[J].NotulaeScientiaBiologicae,2014,6(1):77.
[34] 杨汉波,胡 蓉,王春艳,等.重金属Pb2+、Cd2+胁迫对青稞幼苗抗氧化能力的影响[J].麦类作物学报,2010,30(5):842.
YANG H B,HU R,WANG C Y,etal.Effects of heavy metals Pb2+and Cd2+on antioxidative ability of hulless barley seedings [J].JournalofTriticeaeCrops,2010,30(5):842.
[35] 杨献光,梁卫红,齐志广,等.植物非生物胁迫应答的分子机制[J].麦类作物学报,2006,26(6):158.
YANG X G,LIANG W H,QI Z G,etal.Molecular mechanisms of plant responses to abiotic stresses [J].JournalofTriticeaeCrops,2006,26(6):158.
EffectofChromium(Cr6+)StressonSeedGermination,Anti-oxidationandOsmoticAdjustmentinSeedlingofDifferentGenotypesofWheat
XUWeijie1,WANGQingya1,YANGWenjia1,SUNJianyun1,DAITingbo2
(1.College of Life Science,Nanjing Agricultural University,Nanjing,Jiangsu 210095,China;2.College of Agriculture,Nanjing Agricultural University,Nanjing,Jiangsu 210095,China)
In order to clarify the response to Cr6+stress of different genotypes of wheat and its tolerance mechanism,Yangmai 16 (Cr6+tolerance) and Yumai 51 (Cr6+sensitivity) were used to study the influence of different concentration of Cr6+(0,10,50,100 and 150 μmol·L-1) treatments on seed germination,seedling growth,activities of α-amylase during seed germination,antioxidant enzymes,the level of oxidative stress and osmotic regulator contents change in the seedling roots. The results showed that with the increase of Cr6+concentration,the germination potential,germination percentage,length of root and shoot of two wheat varieties were gradually inhibited,and the decreases in Yangmai 16 were less than those in Yumai 51; comparing to control treatment,the activity of α-amylase and content of soluble protein and soluble sugar was first increased and then declined; while content of proline,malondialdehyde,O2-· and H2O2were gradually increased. Under the same concentration of Cr6+treatment,the activity of α-amylase,and content of soluble sugar and proline of Yangmai 16 were significantly higher than that in Yumai 51,while content of MDA,O2-· and H2O2of Yangmai16 were significantly lower than that in Yumai 51. Comparing to control treatment,the activity of SOD,POD,APX and GR in the roots of two wheat cultivars were generally increased first and then decreased with the increase of Cr6+concentration. Furthermore,under 150 μmol·L-1Cr6+concentration,the activity of α-amylase,SOD,POD,APX and GR of Yangmai 16 were less inhibited than Yumai 51.
Wheat; Chromium (Cr6+) ; Germination; Anti-oxidationt; Osmotic adjustment
时间:2017-08-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170808.0911.030.html
2017-02-21
2017-03-13
E-mail:2014116031@njau.edu.cn
孙建云(E-mail:sunjianyun@njau.edu.cn)
S512.1;S311
: A
:1009-1041(2017)08-1112-08

