小黑麦杂交F1代真假杂种的ISSR标记鉴定及遗传多样性分析
郭建文,李冬梅,田新会,杜文华
(1.草业生态系统教育部重点实验室/中-美草地畜牧业可持续研究中心,甘肃兰州 730070; 2.甘肃农业大学草业学院,甘肃兰州 730070; 3.甘肃农业大学植物保护学院,甘肃兰州 730070)
小黑麦杂交F1代真假杂种的ISSR标记鉴定及遗传多样性分析
郭建文1,2,李冬梅1,2,田新会3,杜文华1,2
(1.草业生态系统教育部重点实验室/中-美草地畜牧业可持续研究中心,甘肃兰州 730070; 2.甘肃农业大学草业学院,甘肃兰州 730070; 3.甘肃农业大学植物保护学院,甘肃兰州 730070)
为了给ISSR标记技术应用于小黑麦杂种鉴定提供参考,利用ISSR标记对小黑麦品系P1和P2有性杂交得到的F1代群体进行分子鉴定,同时结合田间表型调查结果对F1代群体进行遗传多样性分析。结果表明,66个杂交F1代单株中,52个为真杂种,其中,5个单株无主茎、未结实,1个生长后期死亡。14条ISSR引物对46个正常结实真杂种扩增的多态性条带百分率为61.19%,其中,UBC822的多态性条带百分率为100%,UBC808和UBC815的多态性条带百分率均为75%。F1代群体和父母本的遗传相似系数为0.62~0.94,说明杂交后代产生了丰富的遗传变异。聚类分析将杂交F1代群体和父母本在阈值0.748处分为3大类群,第1类群包括1份材料(父本,P1),第2类群包括1份材料(母本,P2),第3类包括46个杂交F1代单株;杂交F1代与父母本的遗传距离较远,先与母本聚为一类,之后与父本聚为一类。田间调查结果表明,7个性状中,除株高偏向于父本外,分蘖数、有效分蘖数、穗长、小穗数、穗粒数和穗粒重均偏向于母本,与父本的差距较大,这与ISSR分析结果基本相吻合。
小黑麦;杂交F1代;杂种鉴定;遗传多样性;ISSR
小黑麦(Triticale Wittmack)是由小麦属(Triticum)和黑麦属(Secale)植物经有性杂交和杂种染色体加倍而形成的新物种。小黑麦按用途分为粮用型、饲用型和粮饲兼用型,具有一定的生态修复功能[1],在盐碱地修复中突显出较高的生态及经济价值[2]。在我国安徽、新疆、甘肃、黑龙江、河北、四川、江苏等地均有种植。小黑麦根据倍性分为十倍体、八倍体、六倍体和四倍体,饲用型小黑麦大多为六倍体[3]。小黑麦为自花授粉植物,父母本性状优劣和亲缘关系远近对杂交F1代表现和杂种优势有很大影响[4],同时,育种技术也有一定作用[5]。
植物品种的纯度测试大多数以观测表观形态特征为主,具有简单直观、经济方便等优点,但表观形态特征受环境影响较大,观测工作量大,周期长[6]。而且,随着骨干亲本的集中使用,相近品种之间的形态学差异也越来越小,因此,利用形态学特征对品种进行鉴定也越来越难[7]。随着SSR、ISSR、SLAF和RAPD等分子标记技术的逐渐完善和DNA指纹技术的发展,为品种特异性、一致性和稳定性测试,提供了新方法[7]。周 强等[8]利用SSR标记对小麦的主要矮秆基因进行了分子鉴定;黄成志等[9]为提高杂交水稻鉴定效率,通过SSR分子标记鉴定了种子的真伪与纯度;林春晶等[10]总结了DNA分子标记技术对杂交种纯度鉴定的应用及特点;羊杏平等[11]研究表明,ISSR和RAPD标记对西瓜杂交种的纯度检测具有重要意义。ISSR标记是基于SSR发展起来的一种新型分子标记技术,具有无需预先知道基因组序列信息、快速、稳定、多态性丰富、重复性强及成本低等优点[12-13],已被广泛应用于植物种质资源鉴定和亲缘关系分析[14-16]。
目前,国内外对小黑麦的研究较多,但大都集中在常规育种[17-18]、饲草产量及品质[19-20]和种子产量[21-22]等方面,尚未有杂交F1代群体杂种鉴定等方面的研究报道。本研究拟对小黑麦2个新品系有性杂交得到的F1代群体进行ISSR分析,以甄别真假杂种,同时结合田间表型调查结果对F1代群体进行遗传多样性分析,为ISSR标记技术应用于小黑麦杂种鉴定提供参考。
1 材料与方法
1.1 试验地概况
试验地为甘肃省临洮县农校农场(103°87′E,35°37′N),海拔1 892 m,降水量562 mm,无霜期153 d,年平均气温7.0 ℃(最高气温为34.6 ℃,最低气温为-29.5 ℃),有灌溉条件,土壤为黑麻土,有机质含量2.52%,pH 7.66,有效氮47.13 mg·kg-1,有效磷3.47 mg·kg-1,有效钾174.95 mg·kg-1。
1.2 试验材料
父本(P1)和母本(P2)为甘肃农业大学利用常规育种技术和系谱法选育形成的性状稳定的六倍体小黑麦品系(AABBRR)。父本抗锈病,株高较高,但分蘖数较少,单株生物量较低;母本分蘖数多,单株生物量较高,但感锈病,株高矮。66个杂交F1代单株为P2和P1经有性杂交得到的66粒F0代种子点播而得,编号为1-1~1-66。
1.3 试验方法
1.3.1 试验材料种植及管理
将父母本和F0代种子于2014年3月8日种植于临洮县农校农场的杂交后代圃中,行长1 m,每行播种30粒种子,行距20 cm,播种深度3~4 cm。播种前施尿素109 kg·hm-2,过磷酸钙3 015 kg·hm-2。试验期间及时中耕除草,拔节期和抽穗期各灌水1次。
1.3.2 小黑麦杂交F1代全基因组DNA提取
小黑麦F1代群体出苗后20 d插竹竿做好标记,然后分别剪取父母本和66个杂交F1代单株的幼嫩叶片约2 g。剪取时用酒精和蒸馏水擦拭叶片表面灰尘,以减少杂质污染,用锡箔纸包装标记后置于液氮中速冻,储存于-80 ℃冰箱中备用。基因组DNA提取方法参照改进CTAB法[23]。用1%琼脂糖凝胶对DNA质量进行检测,并用紫外分光光度计测定DNA浓度。最后将DNA稀释为50 ng·μL-1,置于-20 ℃冰箱中备用。
1.3.3 ISSR引物的筛选及ISSR-PCR反应
本研究所用ISSR引物为项目组前期从适于禾本科植物ISSR-PCR反应的64条引物中筛选出的、适宜于小黑麦多样性分析的谱带清晰稳定、重复性好、多态性高的14条引物(表1)[24]。反应体系(20 μL):2 μL 10×PCR buffer(不含Mg2+),1.9 mmol·L-1Mg2+,0.2 mmol·L-1dNTPs,TaqDNA聚合酶2 U,引物0.65 μmol·L-1,ddH2O 12.8 μL。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,52~56 ℃(依引物不同而不同)退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸7 min。PCR 产物保存于4 ℃,并于24 h内电泳检测。扩增产物经1.5%琼脂糖凝胶电泳检测后,凝胶成像仪上观察并照相保存图像。
1.3.4 小黑麦杂交F1代田间表型鉴定
于成熟期,对父母本及其F1代群体进行田间表型测定。测定时,从F1代群体中选择正常结实的46个真杂种单株,并按照田间标记,给每个单株挂好标牌,然后从父母本中分别随机选取10个单株。将上述单株连根拔起,带回实验室,测定株高、分蘖数、有效分蘖数、穗长、小穗数、穗粒数和穗粒重。
1.4 数据统计与分析
小黑麦父母本和杂交F1代ISSR电泳图谱中的每一个条带代表一个引物的结合位点。按照电泳图谱中相同迁移位置上条带的有无进行数据统计,有条带的赋值为“1”,无条带的赋值为“0”,建立数据表格。人工读带的原则:只记录容易分辨的条带,忽略模糊不清的条带。同一引物在F1代单株中不同迁移位置的条带总数,即为该引物的扩增总条带数,每个单株在同一迁移位置都出现的条带位点数即为共有条带数,多态性比率=(总条带数-共有条带数)/总条带数×100%。
利用POPGENED[25]计算遗传相似性系数、多态性比率和遗传距离(遗传距离=1-遗传相似性系数)。用NTsys-2软件[25]对统计结果进行聚类分析,生成亲缘关系聚类树状图。根据F1代与父母本的遗传距离选择合适的阈值进行分类[6,26]。
2 结果与分析
2.1 小黑麦杂交F1代单株ISSR-PCR鉴定结果
利用14条ISSR引物分别对小黑麦杂交F1代和父母本基因组DNA进行PCR扩增,结果发现,52株杂交后代单株具有父本特征带,其中39株仅具备父本特征带,13株杂交后代同时具备父本和母本的特征带。说明66个小黑麦杂交F1代单株中,52个为真杂交种,14个(编号为1-10、1-18、1-28、1-29、1-30、1-33、1-35、1-36、1-47、1-48、1-49、1-50、1-65、1-66)为假杂交种。52个真杂种中,单株1-23在生长后期死亡,单株1-58、1-59、1-60、1-63、1-64无主茎、未结实,因此进行多样性分析和表型鉴定时,上述6个单株未作为试验材料。
2.2小黑麦杂交F1代真杂种的ISSR-PCR多态性分析
14条引物对46个F1代真杂种和父母本的扩增片段大小不同,250~2 000 bp之间均有分布。其中,引物UBC822对试验材料的扩增图谱见图1。从电泳图中可以看出,小黑麦杂交F1代和父母本材料扩增条带清晰,多态性较好。
小黑麦杂交F1代真杂种和父母本ISSR分析所用引物最佳退火温度及扩增结果见表1。14条引物扩增出清晰可辨的条带共110条,其中多态性条带68条,平均多态性条带4.86条,多态性条带比率为61.19%;各引物扩增出的总条带数不同,在5~12条之间,多态性条带数在3~9条之间,多态性比率在37.50%~100%之间。
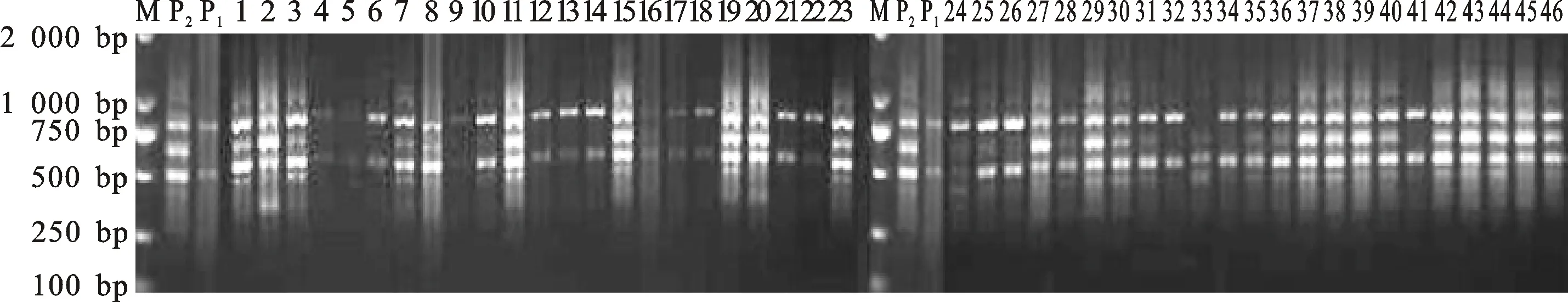
M:核酸分子量标准DL2000;P1:父本;P2:母本;1~46:小黑麦杂交F1代单株。
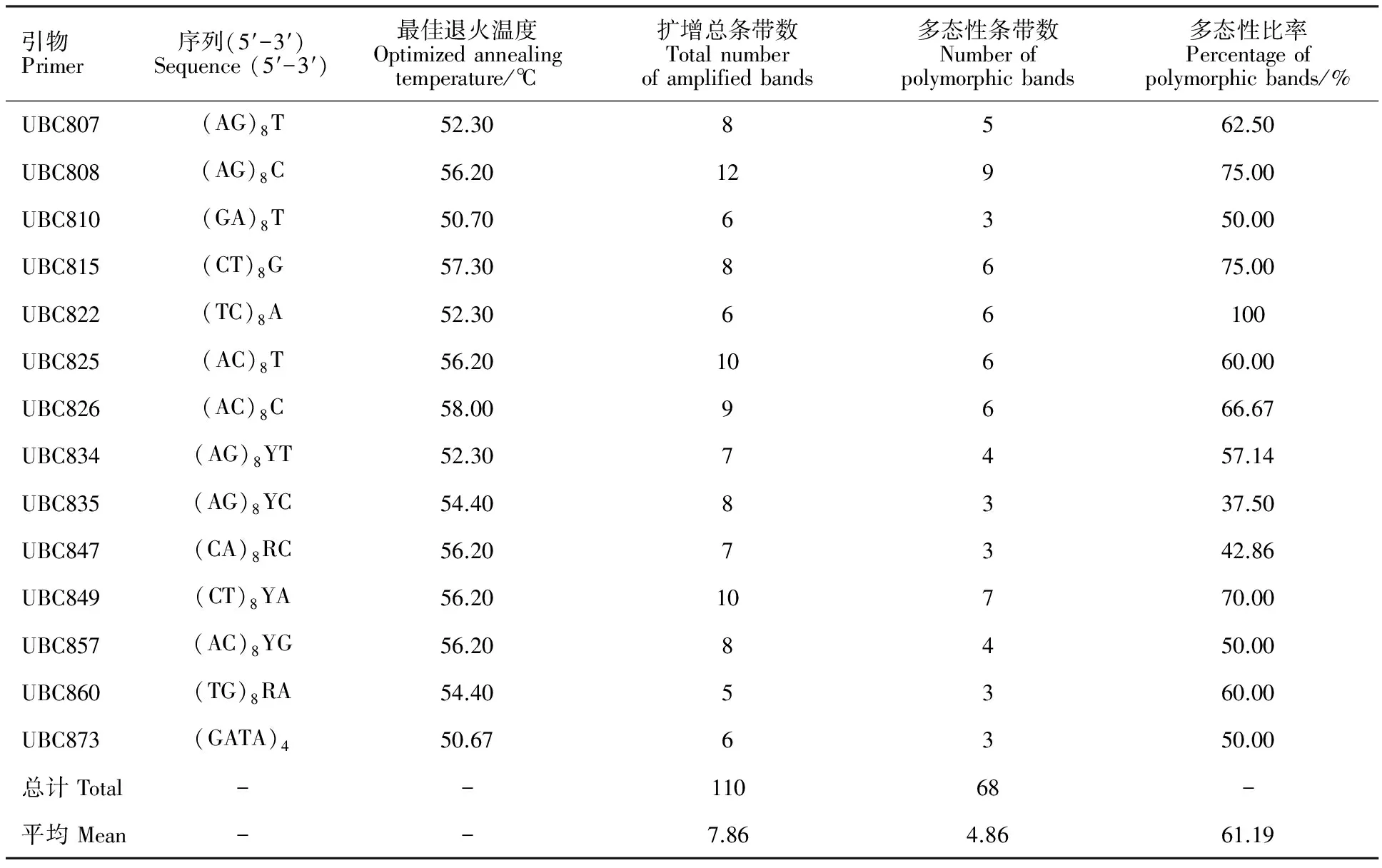
表1 小黑麦杂交F1代和父母本ISSR分析所用引物信息和扩增结果Table 1 Primer sequences and amplified results of ISSR analysis on triticale F1 generation and their parents
2.3 小黑麦杂交F1代真杂种的遗传相似性分析
以小黑麦46个F1代真杂种单株和父母本的扩增条带为原始数据矩阵,得到遗传相似系数。从相似性矩阵(表略)看,遗传相似系数的变化范围为0.62~0.94,其中父母本的遗传相似系数为0.68,杂种1-6与父本的遗传相似系数最小(0.62),杂种1-13和杂种1-51的遗传相似系数最大(0.94);杂交后代与父本的遗传相似系数介于0.62~0.76之间,与母本的遗传相似系数介于0.63~0.78之间。说明供试F1代材料间的遗传差异大,具有丰富的遗传多样性,为选育小黑麦新品种奠定了良好的基础。
2.4 小黑麦杂交F1代真杂种的聚类分析
根据ISSR扩增得到的遗传相似系数矩阵,用NTsys-2软件按UPGMA法对小黑麦F1代真杂种和父母本进行聚类分析,构建ISSR聚类分析树状图(图2)。从树状图看出,小黑麦46个F1代真杂种单株和父母本的遗传距离在0.70~0.94之间,在遗传距离为0.748处将48份材料分为3大类,第1类群包括1份供试材料,为父本(P1),第2类群包括1份供试材料,为母本(P2),第3类包括46个F1代单株。46份杂种F1代先聚集成一类,后与母本(P2)聚为一类,最后与父本(P1)聚在一起,说明46个F1代单株的表型性状大多偏向于母本。
2.5 小黑麦杂交F1代的表型鉴定结果
田间调查结果(表2)表明,46个F1代正常结实真杂种单株的株高、分蘖数、有效分蘖数、穗长、小穗数、穗粒数和穗粒重均有一定程度的分离,各个性状的均值均高于父母本,表现出明显的杂种优势。7个性状中,除株高偏向于父本外,其他性状偏向于母本,与父本的差距较大。
3 讨 论
杂交或辐射诱变后代变异植株或突变体的检测,大多是通过形态变化来确定,但形态变化容易受环境影响,有很多假杂种难以及时去除,不易准确鉴定杂交后代性状的变异,从而影响选择效果[27]。乔燕春等[28]利用RAPD标记对枇杷杂交F1代进行了鉴定,认为杂交后代中有父本特征带或后代中出现新带型则为真杂种。张平湖等[29]和韩 燕等[30]分别利用SSR标记和SNP标记对花生杂交F1代进行了鉴定,认为杂交F1代花生如果具有父母本的特征带型即为真杂种。刘俊睿等[31]利用SSR标记对小豆杂交F1代进行了鉴定,认为F1代如果具有父母本特征带则为真杂种。本试验利用ISSR标记,通过比对F1代66个单株与父母本特征条带的差异,证明52个单株具有父本的1条或多条特征带,为真杂交种。
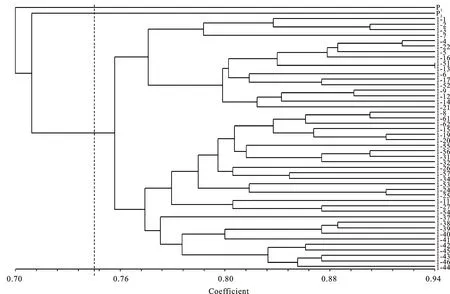
图2 小黑麦杂交F1代和父母本的聚类树状图
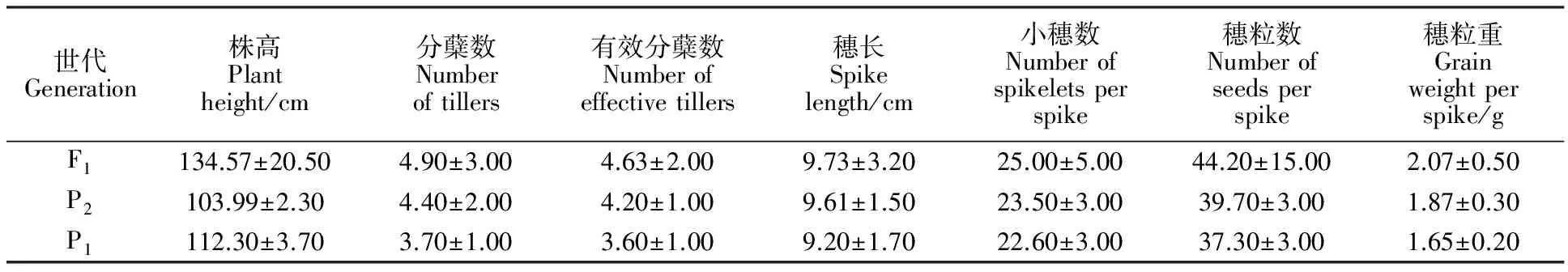
表2 小黑麦杂交F1代单株与父母本农艺性状的比较Table 2 Comparison of the agronomic characteristics between F1 generation of triticale and their parents
F1代各性状值为46个F1代单株的平均值,父母本各性状值为10个单株的平均值。
Data for the F1generation were the average of 46 plants of F1generation, and data for the parents were the average of 10 plants.
如果小黑麦父母本基因型纯合,则F1代群体不存在遗传多样性。本研究对F1代进行分子鉴定时发现确实存在遗传多样性,从而说明父母本的基因型并没有完全纯合。合适的ISSR分子标记引物可以将亲缘关系比较近的材料区分开,并进行聚类[27]。刘永财等[32]利用8条ISSR引物共获得新麦草84个扩增位点,其中多态性位点72个,多态性比率85.7%。马艳明等[33]研究表明,11条ISSR引物的多态性信息含量变化范围较大(60.1%~94.1%),具有较强的品种区分能力,是研究小麦遗传多样性的有效分子标记技术之一。与此相似,本试验用14条ISSR引物对小黑麦46个杂交F1代真杂种单株和父母本进行亲缘关系分析表明,14条引物扩增的多态性条带百分率为61.19%。说明ISSR标记用于研究小黑麦杂交F1代群体的遗传多样性时具有较高的多态性。
本研究得出,小黑麦46个F1代真杂种单株和父母本的遗传相似系数变化范围较大,为0.62~0.94,说明小黑麦杂交F1代具有较丰富的遗传变异性[34]。杂种1-6与父本的遗传相似系数最小,具有较大的杂种优势,出现优良变异的概率很大[35]。本试验父母本的遗传相似系数为0.68,高于部分杂交后代和亲本的相似系数,这可能与父母本间的亲缘关系有关。父本P1为JRCT61和JRCT400杂交选育形成的小黑麦品系,母本P2为DH265和AT315杂交选育的小黑麦品系,上述4个小黑麦品种均引自澳大利亚,他们可能具有一定亲缘关系,这有待于进一步查证。
ISSR聚类分析树状图表明,46个杂交F1代单株离母本的亲缘关系较近,这与田间表型鉴定结果相吻合,说明本试验ISSR鉴定和田间表型鉴定结果的一致性较好[34]。
本研究为小黑麦遗传图谱构建的前期工作,后期通过对小黑麦草产量和种子产量相关QTL定位,可以明确优异性状在染色体上的具体位置,为基因克隆和转基因等分子辅助育种奠定基础[36]。
[1] 孙建勇.不同类型小黑麦产量和品质的形成及其调控[D].扬州:扬州大学,2004:1-3.
SUN J Y.Yield and quality formation in different types of triticale and their regulation [D].Yangzhou:Yangzhou University, 2004:1-3.
[2] 何江峰,赵萌莉,郑轶慧,等.小黑麦的饲用特性及其在草地生态中的应用前景[J].中国草地学报,2012,34(1):101-102.
HE J F,ZHAO M L,ZHEN Y H,etal.Forage characteristics and application perspective of triticale in grassland ecology [J].ChineseJournalofGrassland,2012,34(1):101-102.
[3] 周福平,孙黛珍,王曙光,等.六倍体小黑麦种质资源遗传多样性分析[J].华北农学报,2006,21(6):33.
ZHOU F P,SUN D Z,WANG S G,etal.Characterizing the genetic diversity of a group of hexaploid triticale [J].ActaAgriculturaeBoreali-Sinica,2006,21(6):33.
[4] 王瑞清,闫志顺,李 诚,等.小黑麦种子外观品质性状的遗传研究[J].麦类作物学报,2007,27(1):44.
WANG R Q,YAN Z S,LI C,etal.Genetic analysis of some kernel exterior quality traits in triticale [J].JournalofTriticeaeCrops,2007,27(1):44.
[5] 孙 娜,石培春,魏凌基,等.小黑麦花药培养力的遗传模式分析[J].麦类作物学报,2009,29(3):378.
SUN N,SHI P C,WEI L J,etal.Genetic control analysis of triticale anther culture response [J].JournalofTriticeaeCrops,2009,29(3):378.
[6] 李超汉,刘 莉,刘 翔,等.基于SSR标记的5个西瓜新品种纯度鉴定及特异性分析的研究[J].中国农学通通报,2015,31(33):178.
LI C H,LIU L,LIU X,etal.Seed purity detection and distinctiveness analysis of 5 new watermelon hybrid varieties on SSR markers [J].ChineseAgriculturalScienceBulletin,2015,31(33):178.
[7] 吴则东,江 伟,马龙彪.分子标记技术在农作物品种鉴定上的研究进展及未来展望[J].中国农学通通报,2015,31(33):173.
WU Z D,JIANG W,MA L B.Research progress and future prospects of molecular marker technology applied in crop variety identification [J].ChineseAgriculturalScienceBulletin,2015,31(33):173.
[8] 周 强,袁中伟,欧俊梅,等.四川小麦主要矮秆基因的分子鉴定[J].麦类作物学报,2015,35(12):1625.
ZHOU Q,YUAN Z W,OU J M,etal.Molecular identification of the main dwarfing genes in wheat varieties in Sichuan [J].JournalofTriticeaeCrops,2015,35(12):1625.
[9] 黄成志,黄文章,严明建,等.利用SSR分子标记鉴定杂交水稻真伪与纯度[J].安徽农业科学,2009,37(8):3437.
HUANG C Z,HUANG W Z,YAN M J,etal.Identification of true or false and purity of hybrid rice with SSR molecular marker [J].JournalofAnhuiAgriculturalSciences,2009,37(8):3437.
[10] 林春晶,张春宝,董英山.DNA分子标记在作物杂交种纯度鉴定中的应用[J].分子植物育种,2015,13(3):702.
LI C J,ZHANG C B,DONG Y S.Application of DNA molecular marker techniques in hybrid seeds purity identification of crop [J].MolecularPlantBreeding,2015,13(3):702.
[11] 羊杏平,刘 广,侯喜林,等.利用RAPD和ISSR 2种分子标记鉴定西瓜杂交种的遗传纯度[J].江苏农业学报,2010,26(6):1317.
YANG X P,LIU G,HOU X L,etal.Evaluation of genetic purity of watermelon hybrid (Citrulluslanatus) using RAPD and ISSR molecular markers [J].JiangsuAgriculturalSciences,2010,26(6):1317.
[12] 吴清韩,庄东红,朱 慧,等.凤凰单丛茶树资源遗传多样性的ISSR分析[J].热带作物学报,2015,36(3):499.
WU Q H,ZHUANG D H,ZHU H,etal.Genetic diversity of Fenghuang-Dancong tea plant germplasms by ISSR markers [J].ChineseJournalofTropicalCrops,2015,36(3):499.
[13] 李金博,高丽华,周美亮,等.15个白三叶品种的ISSR和ITS遗传多样性分析[J].草业科学,2016,33(6):1148.
LI J B,GAO L H,ZHOU M L,etal.ISSR and ITS analysis on genetic diversity of 15 white clover cultivars [J].PrataculturalScience,2016,33(6):1148.
[14] 靳晓丽,田新会,杜文华.基于ISSR分子标记的鹰嘴豆遗传多样性分析[J].中国草地学报,2015,37(3):19.
JIN X L,TIAN X H,DU W H.Genetic diversity analysis on chickpea based on ISSR markers [J].ChineseJournalofGrassland,2015,37(3):19.
[15] 张 雪,刘青松,师文贵,等.25份无芒雀麦种质资源遗传多样性的ISSR分析[J].中国草地学报,2014,36(3):104.
ZHANG X,LIU Q S,SHI W G,etal.Analysis of genetic diversity of 25 Bromus inermis accession based on ISSR [J].ChineseJournalofGrassland,2014,36(3):104.
[16] NOR A I,RAFII M Y,MAHMUD T M M,etal.Molecular markers:a potential resource for ginger genetic diversity studies [J].MolecularBiologyReports,2016,43(12):1347.
[17] GRABOVETS A I,POPOVA O G.Breeding of winter triticale for use in confectionery production [J].RussianAgriculturalSciences,2015,41(6):411.
[18] GRABOVETS A I,ANDREEV N R,KROKHMAL A V,etal.Problems of breeding triticale with a high grain starch content and its use [J].RussianAgriculturalSciences,2013,39(5):399.
[19] SHCHIPAK G V,TSUPKO Y V,SHCHIPAK V G.Bread-making qualities of the cultivars of winter hexaploid triticale [J].RussianAgriculturalSciences,2013,39(2):95.
[20] 宋 谦,田新会,杜文华.甘肃省高寒牧区小黑麦新品系的生产性能[J].草业科学,2016,33(7):1367.
SONG Q,TIAN X H,DU W H.Studies on production performance of new triticale lines in alpine pastoral areas of Gansu [J].GrasslandScience,2016,33(7):1367.
[21] 褚孝莹,李 晶,李馨园.开花期叶面喷施赤霉素对小黑麦旗叶光合及产量的影响[J].麦类作物学报,2011,31(6):1136.
CHU X Y,LI J,LI X Y,etal.Effect of spraying GA3at flowering stage on photosynthesis of flag leaf and yield of triticale [J].JournalofTriticeaeCrops,2011,31(6):1136.
[22] 李冬梅,田新会,杜文华.5个小黑麦新品系的种子产量及产量构成因素分析[J].草地学报,2016,24(1):241.
LI D M,TIAN X H,DU W H.Studies on the seed yield and yield components of 5 triticale lines [J].ActaAgrestiaSinica,2016,24(1):241.
[23] 易庆平,罗正荣,张青林.植物总基因组DNA提取纯化方法综述[J].安徽农业科学,2007,35(25):7790.
YI Q P,LUO Z R,ZHANG Q L.Advances of genome DNA extraction and purification in plants [J].JournalofAnhuiAgriculturalScience,2007,35(25):7790.
[24] 赵雅姣.基于ISSR标记的小黑麦遗传多样性分析及在甘肃省临洮地区的生产性能研究[D].兰州:甘肃农业大学,2015:14-15.
ZHAO Y J.Studies on the genetic diversity of triticale and productivity in Lintao region of Gansu province [D].Lanzhou:Gansu Agricultural University,2015:14-15.
[25] 朱建平,殷瑞飞.SPSS在统计分析中的应用[M].北京:清华大学出版社,2007:103-125.
ZHU J P,YIN R F.The application of SPSS in statistical analysis [M].Beijing:Tsinghua University Press,2007:103-125.
[26] 兰 刚,董军刚,孟 倩,等.油菜杂交种合油杂2号纯度鉴定的SSR引物筛选[J].西北农业学报,2012,21(9):76.
LAN G,DONG J G,MENG Q,etal.Screening of SSR markers for purity test of hybrid rapeseed cultivar heyouza No.2 [J].ActaAgriculturaeBoreali-OccidentalisSinica,2012,21(9):76.
[27] 王文恩,包满珠,张俊卫,等.狗牙根辐射诱变后代变异植株的形态特征比较和ISSR分析[J].草业科学,2009,26(12):144.
WANG W E,BAO M Z,ZHANG J W,etal.Analysis on the morphological characters and ISSR of the variant plant ofCynodondactylon[J].PrataculturalScience,2009,26(12):144.
[28] 乔燕春,林顺权,何小龙,等.普通枇杷种内和种间杂种苗的RAPD鉴定[J].果树学报,2010,27(3):389.
QIAO Y C,LIN S Q,HE X L,etal.Identification of intraspecific and interspecific hybridizations in Loquat(Eriobotrya) using RAPD molecular markers [J].JournalofFruitScience,2010,27(3),389.
[29] 张平湖,刘冠明.花生杂交F1代真假杂种SSR标记鉴定体系的建立[J].广东农业科学,2009(10):50.
ZHANG P H,LIU G M.Construction of identification technology program for peanut hybrid with SSR markers [J].GuangdongAgriculturalSciences,2009(10):50.
[30] 韩 燕,马登超,刘译阳,等.利用特异性SNP位点鉴定花生杂交F1代真假杂种[J].山东农业科学,2016,48(4):16.
HAN Y,MA D C,LIU Y Y,etal.Identification of true F1peanut hybrid with specific SNP locus [J].ShandongAgriculturalSciences,2016,48(4),16.
[31] 刘俊睿,谢梦娇,闫 龙,等.SSR分子标记鉴定小豆F1真假杂种[J].北京农学院学报,2014,29(1):5.
LIU J R,XIE M J,YAN L,etal.Identification of F1hybrid in adzuki bean(Vignaangularis) by SSR markers [J].JournalofBeijingUniversityAgriculture,2014,29(1):5.
[32] 刘永财,孟 林,张国芳,等.新麦草种质遗传多样性的ISSR分析[J].华北农学报,2009,24(5):107.
LIU Y C,MENG L,ZHANG G F,etal.Genetic diversity analysis of 15Psathyrostachysjunceagermplasm resources by ISSR molecular marker [J].ActaAgriculturae,2009,24(5):107.
[33] 马艳明,李斯深,范玉顶,等.黄淮麦区小麦品种(系)的ISSR位点遗传多样性分析[J].植物遗传资源学报,2006,7(1):13.
MA Y M,LI S S,FAN Y D,etal.Genetic diversity of ISSR loci for wheat cultivars of Huang-Huai winter wheat region [J].JournalofPlantGeneticResources,2006,7(1):13.
[34] 杨松杰,杨武云.人工合成六倍体小麦后代衍生群体遗传多样性检测[J].分子植物育种,2008,6(2):268.
YANG S J,YANG W Y.Detection of genetic diversity in synthetic hexaploid wheats and their backcross-derived lines using SSR markers [J].MolecularPlantBreeding,2008,6(2):268.
[35] 匡 猛,杨伟华,张玉翠,等.棉花杂交种纯度的SSR标记检测及其与田间表型鉴定的相关性[J].作物学报,2011,37(12):2304.
KUANG M,YANG W H,ZHANG Y C,etal.Cotton hybrid purity tested by SSR markers and its correlation with the phenotype identification in field [J].ActaAgronomicaSinica,2011,37(12):2304.
[36] 李冬梅.饲草型小黑麦的遗传图谱构建及草产量和抗锈病相关基因的QTL定位[D].兰州:甘肃农业大学,2016:46-47.
LI D M.Constructions on linkage genetic map and QTL mapping for forage yield and rust resistance related traits in triticale [D].Lanzhou:Gansu Agricultural University,2016:46-47.
PurityIdentificationandGeneticDiversityStudiesontheF1HybridGenerationofTriticale
GUOJianwen1,2,LIDongmei1,2,TIANXinhui3,DUWenhua1,2
(1.Key Laboratory of Grassland Ecosystem, Ministry of Education/Sino-U.S.Centers for Sustainable Development of Grassland and Animal Husbandry, Lanzhou, Gansu 730070, China; 2.College of Grassland Science, Gansu Agricultural University, Lanzhou, Gansu 730070, China; 3.College of Plant Protection, Gansu Agricultural University, Lanzhou, Gansu 730070, China)
In order to provide reference for the mutation identification and selection of parents, ISSR markers were used to identify the hybrid F1generation of new triticale lines P1and P2.Besides, the genetic diversity of F1population was studied based on the field investigation results.The results showed that, among 66 F1plants, 52 were true hybrids, and 46 plants were used as the experimental materials in this study because the rest of six plants did not grow normally.The amplification percentage was 61.19% for 46 F1hybrid plants while using 14 ISSR primers, among which, amplification percentage was 75% for the primer UBC808 and UBC815, and 100% for the primer UBC822.For 46 F1plants and their parents, the genetic similarity coefficient ranged from 0.62 to 0.94, which proved that the hybrid offspring produced abundant genetic variation.Cluster analysis showed that the 46 F1plants and their parents were classified into 3 categories, which were male parent, female parent and their F1generation, respectively.The F1generation was firstly clustered with the female and then with the male, which demonstrated that the F1population had closer relationship with the female parent than that with the male parent.The results of field investigation showed that the F1population was significantly different from male parent in seven traits, such as the number of tillers and effective tillers, spike length, the number of spikelet and seeds, and grain weight per spike, except plant height, which is consistent with the results of ISSR analysis.
Triticale; F1hybrid generation; Purity identification; Genetic diversity; ISSR
时间:2017-08-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170808.0911.010.html
2016-11-09
2017-05-31
国家自然科学基金项目(31360577);现代农业产业技术体系建设专项资金项目(CARS-40-09B)
E-mail:724318633@qq.com(郭建文);1058197897@qq.com(李冬梅,与第一作者同等贡献)
杜文华(E-mail:duwh@gsau.edu.cn)
S512.4;S330
: A
:1009-1041(2017)08-1031-07

