昆明动物园孔雀源大肠埃希菌毒力基因及耐药基因检测
吴海滨,杨 娟,周杰珑,刘安荣,杨 超,吴培福*
(1.西南林业大学生命科学学院,云南昆明 650224;2.昆明动物园,云南昆明 650224)
兽医临床
昆明动物园孔雀源大肠埃希菌毒力基因及耐药基因检测
吴海滨1△,杨 娟1△,周杰珑1,刘安荣2,杨 超1,吴培福1*
(1.西南林业大学生命科学学院,云南昆明 650224;2.昆明动物园,云南昆明 650224)
为研究孔雀源大肠埃希菌毒力基因和耐药基因的流行特征,从昆明动物园采集孔雀粪样,从中分离鉴定大肠埃希菌,并对12种毒力基因及22种耐药基因进行检测。结果表明,从孔雀粪样中共分离鉴定出38株大肠埃希菌,分离菌traT基因携带率为100%;tsh基因携带率最低,为2.63%。未检出氨基糖苷类药物的耐药基因aac(3)-Ia、β-内酰胺类药物的耐药基因OXA、SHV,其余耐药基因均呈阳性,其中磺胺类耐药基因阳性率为7.89%~34.21%,四环素耐药基因阳性率为50%~57.89%,氨基糖苷类耐药基因阳性率为10.53%~50%,氯霉素类耐药基因阳性率为42.11%~71.05%,β-内酰胺类耐药基因阳性率为42.11%~63.16%,喹诺酮类耐药基因阳性率为13.16%~68.42%。研究结果可为孔雀大肠杆菌病的预防提供理论支持和实践借鉴。
孔雀;大肠埃希菌;毒力基因;耐药基因
孔雀不仅可供观赏,经过人们的开发后,在保健、食用领域都有广泛的利用,与人们关系密切。随着孔雀养殖业的发展,孔雀大肠杆菌病的流行日趋严重。由于大肠埃希菌(Escherichiacoli)血清型众多[1],极易产生耐药性,使大肠杆菌病的防治越来越困难,经常会给养殖户造成重大经济损失。因此,本研究在分离鉴定孔雀粪便大肠埃希菌的基础上,对分离株毒力基因的流行病学特征及耐药基因携带率进行研究,可为孔雀大肠杆菌病的防控提供理论指导。
1 材料与方法
1.1 材料
孔雀粪样,2016年7月采集于昆明动物园,共38个粪样;伊红美蓝培养基、LB固体培养基、蛋白胨、牛肉粉、氯化钠,昆明硕阳科技有限公司产品。
1.2 方法
1.2.1 大肠埃希菌生化试验 利用微生物的生化特性鉴定大肠埃希菌。生化试验包括:糖发酵试验(葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖)、明胶液化试验、硫化氢试验、吲哚(靛基质)试验、甲基红(MR)试验、VP试验、枸橼酸盐利用试验、尿酶试验、淀粉水解试验、硝酸盐还原试验。
1.2.2 大肠埃希菌PCR鉴定
1.2.2.1 DNA提取 PCR鉴定(Uid和16 S rRNA基因)所用引物参见文献[2-3]。通过煮沸法提取大肠埃希菌基因组DNA,取分离株纯培养物经10 000 r/min 4℃离心5 min;弃上清液,用200 μL ddH2O使菌体悬浮;于100℃水浴12 min,立即放置到冰浴中冷却12 min,然后10 000 r/min 4℃离心5 min,取上清作为DNA模板,并对12种毒力基因及22种耐药基因携带情况进行PCR检测。12种毒力基因包括feoB、traT、fimA、fyuA、irp-2、iroN、iucC、tsh、iutA、iss、cvaC和papC,其扩增引物及参数参考文献[4];22种耐药基因包括磺胺类耐药基因(sul1、sul2、sul3),四环素类耐药基因(tetA、tetB),氨基糖苷类耐药基因(aacC2、aacC4、aadAl、aadA2、aac(3)-Ia、aac(3)-IIa、aph(3)-IIa),氯霉素类耐药基因(Catl、CmlA、Flor),β-内酰胺类耐药基因(CTX-M、SHV、OXA、TEM),喹诺酮类基因Gyra(QRDR)、QnrS,其他基因Aac(6,)-Ib-cr。扩增引物及参数参考文献[5]。引物由铂尚生物技术有限公司合成。
1.2.2.2 分离株PCR鉴定 反应采用25 μL体系,10×Reaction buffer 2.5 μL,10 μmol/L 上游引物2 μL,10 μmol/L下游引物2 μL,2.0 mmol/L dNTP 2.5 μL,25 mmol/L MgCl22 μL,Template 2.5 μL,2.5 U/μLTaq0.25 μL,ddH2O 11.25 μL。PCR反应的其他条件为:预变性94℃ 5 min;94℃ 30 s,52℃ 1 min,72℃ 45 s,共30个循环;最后72℃ 10 min,4℃结束反应。琼脂糖凝胶电泳进行检测。
2 结果
2.1 孔雀粪便中大肠埃希菌分离鉴定
本研究共分离到38株细菌,分离株在伊红美蓝培养基上为黑色带金属光泽的菌落;革兰染色为阴性短杆菌,两端钝圆,长约1.5 μm~3.0 μm,多单个存在;生化鉴定特征符合大肠埃希菌的特性(表1)。分离株通过大肠埃希菌2种基因的PCR鉴定均为阳性,条带大小与预计大小一致。最终鉴定大肠埃希菌38株。
2.2 大肠埃希菌毒力基因检测
毒力基因检测结果显示(表2),traT基因全部检出;tsh基因检出率最低,为2.63%,其中66.67%的毒力基因检出率在50%以下。
2.3 大肠埃希菌毒力基因分布
从表3可以看出,38株大肠埃希菌中,携带至少1种毒力基因,最多携带8种。携带6种以上毒力基因的大肠埃希菌为34.21%。

表1 大肠埃希菌生化鉴定结果
注:⊕表示产酸产气;+表示阳性;-表示阴性。
Note:⊕Means producing acid and gas;+Means positive;-Mean negative.

表2 大肠埃希菌毒力基因检出率

表3 大肠埃希菌毒力基因分布
2.4 大肠埃希菌耐药基因的检测
采用已建立的PCR,对38株E.coli分离株进行22种耐药基因的检测(表4)。Catl检出率最高(71.05%);aac(3)-Ia、OXA和SHV基因均未检出。在耐磺胺类药物的基因中,sul3基因的检出率最高(34.21%);四环素类药物以tetA基因的检出率最高,为57.89%;氨基糖苷类以aph(3)-IIa基因的检出率最高,为50.00%;β-内酰胺类以CTX-M基因的检出率最高,为63.16%;喹诺酮类以Gyra(QRDR)基因的检出率最高,为68.42%。本研究中,分离株均携带3种以上耐药基因,最大携带量为14种,37株携带耐药基因在6种以上,占全部菌株的97.36%。
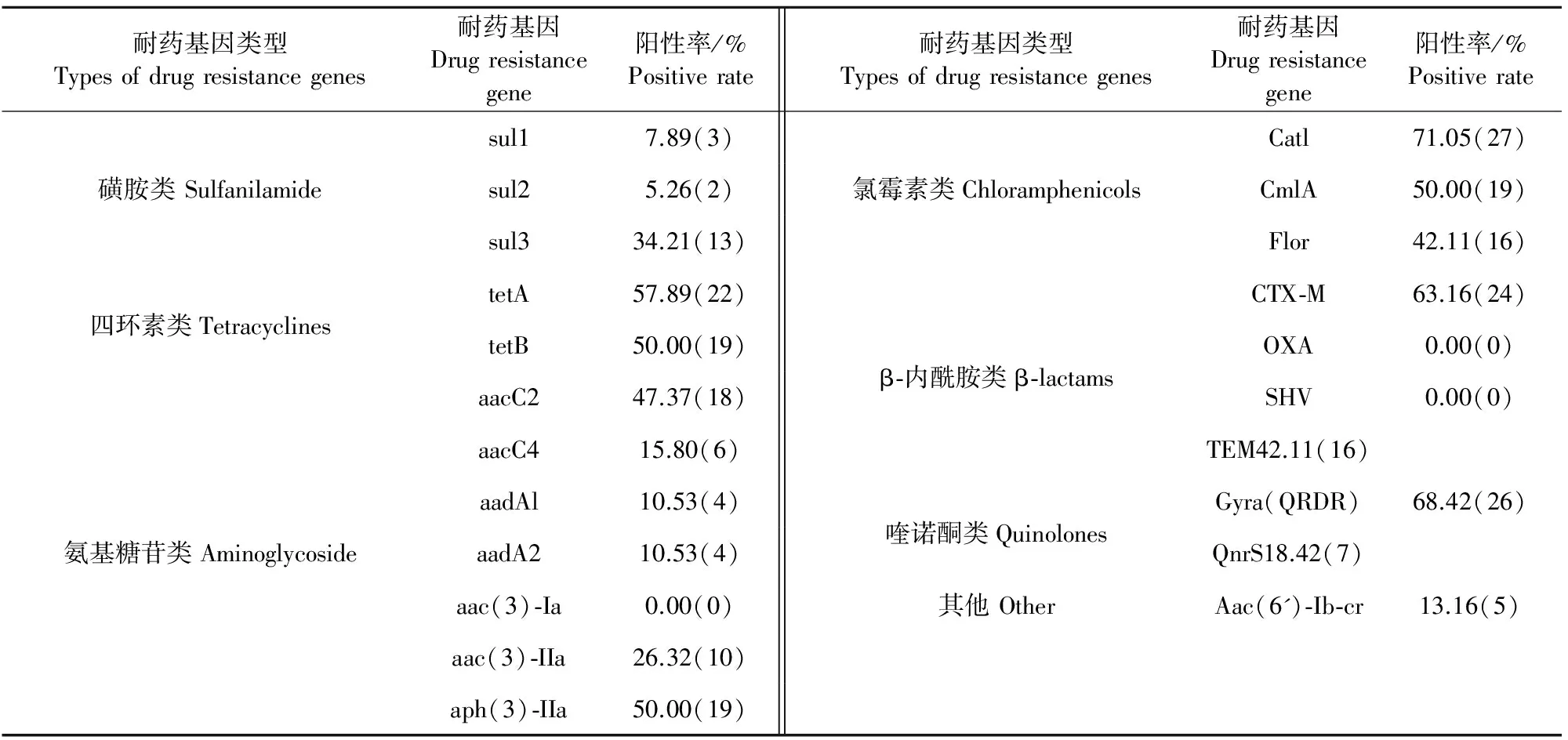
表4 大肠埃希菌耐药基因的阳性率
3 讨论
本试验从孔雀粪便中分离鉴定38株大肠埃希菌,如果饲养不当、环境卫生差等应激因素下,可诱发大肠杆菌病。大肠杆菌病病死率高,对养殖带来了严重的影响。研究发现,禽大肠埃希菌的致病力与其携带的毒力因子种类及数量密切相关,若大肠埃希菌携带毒力基因iroN、iss、tsh、cvaC、iutA、iucC,则可能是禽致病性大肠埃希菌,通常高致病性禽大肠埃希菌对上述基因携带率比较高[6-8]。为此,本研究对孔雀粪便中大肠埃希菌毒力基因进行了调查。与董向磊[4]、钟杏好等[6]研究相比,本研究中毒力相关基因iroN、iss、tsh、cvaC、iutA、iucC检出率较低,但少数菌株同时携带了较多与致病性密切相关的基因。孔雀粪便中大肠埃希菌的毒力基因携带率与大量文献中鸡源大肠埃希菌的毒力基因携带率相比普遍较低。
随着大肠埃希菌耐药谱越来越广,大量传统抗菌药物已经淘汰,研究其耐药性变得尤为重要,大肠埃希菌耐药性与其耐药基因的携带率有明显的相关性。为此,耐药基因的检测对孔雀大肠杆菌病临床用药有一定的指导意义。在陆倩倩等[1]、崔焕忠等[9]研究发现,从2011年—2013年致病性孔雀大肠埃希菌对氯霉素类和四环素类药物耐药性增强。本研究发现,分离株对磺胺类耐药基因和四环素类耐药基因的携带率比2013年张忠[5]研究结果偏高,可能与磺胺类和四环素类药物在孔雀养殖上的大量使用有关。此外,该动物园散养孔雀与人类接触比较多,在环境卫生与饲养方面应该加强管理。
大肠埃希菌毒力基因和其致病性有很大关系,本次研究毒力基因检出率较低,但少数分离菌携带了很多与致病性密切相关的基因,因此很可能由外界因素诱发大肠杆菌病。耐药基因的检测对孔雀大肠杆菌病临床用药有一定的指导意义。经过对耐药基因的调查,可以为孔雀大肠杆菌病的防治提供理论支持和实践借鉴。
[1] 陆倩倩,彭欠欠,刘 阳,等.1株孔雀源大肠杆菌的分离与药敏试验[J].养禽与禽病防治,2013(5):41-42.
[2] 宋海霞.河南省鸡腹泻重要病原菌的分离鉴定与耐药性及PCR检测方法的研究[D].河南郑州:河南农业大学,2010.
[3] 刘文强,贾玉萍,赵宏坤.16S rRNA在细菌分类鉴定研究中的应用[J].动物医学进展,2006,27(11):15-18.
[4] 董向磊.禽致病性大肠杆菌的分离鉴定和分离株毒力基因与致病性相关性研究[D].江苏扬州:扬州大学,2014.
[5] 张 忠.宁夏地区大肠杆菌临床分离株的耐药性研究[D].宁夏银川:宁夏大学,2013.
[6] 钟杏好,李进福,段沙沙,等.不同CTX-M亚群鸡大肠杆菌毒力基因的流行特征[J].中国人兽共患病学报,2016,32(2):152-155.
[7] Bonnet C,Diarrassouba F,Brousseau R,et al.Pathotype and antibiotic resistance gene distributions ofEscherichiacoliisolates from broiler chickens raised on antimicrobial-supplemented diets[J].Appl Environ Microbiol,2009,75(22):6955-6962.
[8] Tetsuo A,Kaori M,Chizuru S,et al.Phylogenetic groups and cephalosporin resistance genes ofEscherichiacoli,from diseased food-producing animals in Japan[J].Acta Vet Scand,2011,53(1):1-5.
[9] 崔焕忠,周佰祥,张 辉,等.孔雀致病性大肠杆菌的分离鉴定及药敏试验[J].中国兽医杂志,2011,47(10):33-34.
DetectionsofVirulenceGenesandDrugResistanceGenesofPeacockEscherichiacolifromKunmingZoo
WU Hai-bin1, YANG Juan1, ZHOU Jie-long1, LIU An-rong2, YANG Chao1, WU Pei-fu1
(1.CollegeofLifeScience,SouthwestForestryUniversity,Kunming,Yunnan,650224,China;2.KunmingZoo,Kunming,Yunnan,650224,China)
In order to study the epidemic characteristics of peacockEscherichiacolivirulence genes and resistance genes,38 strains ofE.coliwere isolated and identified from fecal samples of peacocks in Kunming zoo.Moreover,12 kinds of virulence genes and 22 resistance genes were detected.The results showed that the traT gene carrying rate was 100%;the tsh gene carrying rate was the lowest,up to 2.63%.In terms of resistance genes,other resistance genes were detected except OXA and SHV coding for β-lactam and aac(3)-Ia drug resistance gene.The positive rate of sulfonamide resistantce genes was 7.89%-34.21%,the positive rate of tetracycline resistance genes was 50%-57.89%,the positive rate of the aminoglycoside resistance genes was 10.53%-50%,and the positive rate of chloramphenicol resistance genes for 42.11%-71.05%,the positive rate of β-lactam resistance genes 42.11%-63.16%,the positive rate of quinolone resistance genes 13.16%-68.42%.The results provided a theoretical support and practical reference for the prevention of theE.coliinfection.
peacock;E.coli; virulence gene; drug resistance gene
2016-09-05
西南林业大学科技创新基金(C15115)
吴海滨(1988-),男,四川人,硕士研究生,主要从事动物疫源疫病研究。△同等贡献作者。*
S858.93;S852.612
:B
:1007-5038(2017)09-0122-05

