表达鸡α干扰素重组酿酒酵母菌的构建与鉴定
杜伟立,尹美辰,杨理凯,张 涛,王 令,路宏朝
(陕西理工大学生物科学与工程学院,陕西汉中 723000)
表达鸡α干扰素重组酿酒酵母菌的构建与鉴定
杜伟立,尹美辰,杨理凯,张 涛*,王 令,路宏朝
(陕西理工大学生物科学与工程学院,陕西汉中 723000)
通过构建鸡α干扰素真核表达载体,以获得能够表达鸡α干扰素的酵母工程菌株。首先根据GenBank公布的鸡α干扰素基因序列设计上、下游引物,以略阳乌鸡基因组DNA为模板,PCR扩增鸡α干扰素基因片段。然后,利用基因重组技术将鸡α-干扰素基因插入真核表达载体,通过菌落PCR和DNA测序确定目标载体,构建成功后转化至酿酒酵母AH109,再通过营养缺陷培养、质粒提取和PCR鉴定带JMB440-ChIFN-α载体的重组酵母菌株。最终通过酵母培养、总蛋白收集、SDS-PAGE电泳和Western blot等,确定鸡α干扰素基因能够与酵母菌株重组,并表达α干扰素,蛋白条带大小约为23 ku,与预期结果一致,表明成功构建了表达鸡干扰素基因的工程酵母菌株。
略阳乌鸡;鸡α-干扰素;真核表达载体;酿酒酵母
1957年Issaes A等[1]首先发现了病毒的干扰现象,即病毒感染后细胞会产生一种作用于其他细胞的物质,从而干扰病毒的复制,于是将这种干扰病毒复制的因子称为干扰素(interferon,IFN)。干扰素是一类具有高效广谱抗病毒、调节免疫活性的蛋白质因子,可以增强吞噬细胞的吞噬活性以及淋巴细胞抗病毒活性等,是机体防御系统的重要组成部分[2-4]。干扰素主要有Ⅰ型和Ⅱ型,Ⅰ型主要包括IFN-α和IFN-β,Ⅱ型的IFN-γ被称为免疫干扰素。虽然干扰素最早发现于禽类,但其研究较人类和哺乳动物相对滞后。1994年,Sekellick M J等[5]首次用原核表达载体成功表达了鸡IFN-α基因,并对其结构分析, 1995年Digby M R等[6]成功地克隆了鸡IFN-γ基因,Sick C等[7]发现鸡IFN-α抗病毒活性与其他种类的抗生素相比,有显著的抗病毒能力。
目前,原核表达系统生产鸡α干扰素的方法已经趋于成熟,但其活性受到宿主菌、表达载体、诱导表达条件及蛋白质修饰等多种不确定因素的影响[8-12]。因此,研究和开发鸡α干扰素的真核表达系统则是一种安全可靠的途径。本研究以产于秦巴山区的具有强抗病性的地方品种略阳乌鸡为研究材料,构建高效表达鸡α干扰素的酿酒酵母表达系统,以期获得安全、高效鸡IFN-α。本试验构建的可表达鸡α干扰素酿酒酵母可直接用于家禽的日常饲养管理,降低了家禽饲养管理的成本,可为家禽的安全生产提供保障。
1 材料与方法
1.1 材料
略阳乌鸡,购自原产地陕西省汉中市略阳县黑河坝;酿酒酵母、真核表达载体JMB440、大肠埃希菌Top10,本实验室保存;Ex-TaqDNA聚合酶、T4 DNA连接酶、限制性内切酶HindⅢ、XhoI和SalI等酶,氨苄青霉素、显色试剂、一抗(兔抗鸡IFN-α多抗血清)、二抗(辣根过氧化物酶标记的羊抗兔二抗),宝生物工程(大连)有限公司产品;DNA Marker DL 2 000、低分子量标准蛋白,Thermo Fisher公司产品;PVDF膜、质粒提取试剂盒、DNA纯化试剂盒,BioFlux公司产品;基因序列测序、引物合成由北京奥科鼎盛生物有限公司完成。
1.2 方法
1.2.1 引物设计 根据 GenBank所公布的鸡IFN-α基因序列(EU334503.1)设计上、下游引物:ChINFF:上游引物5′ -cccaagcttccATGGACTACAAGGATGACGACGATAAAGCCTGCAACCACCTTCGC,含有HindⅢ酶切位点,下划线为Flag标签;ChINF-R:gacgtcgac CTAAGTGCGCGTGTTGCCTG,含有SalI酶切位点。
1.2.2 真核表达载体与酿酒酵母工程菌的构建 采用SDS碱裂解法提取略阳乌鸡基因组DNA,经PCR特异扩增ChIFN-ɑ基因片段,其反应体系(50 μL):5μLTaq酶缓冲液,6 μL Mg2+,5 μL dNTP,引物各2 μL,模板1 μL,Taq酶0.3 μL,水28.7 μL;PCR 反应条件:95℃预变性5 min;95℃变性30 s;53℃ 30 s,72℃ 1 min,34个循环;72℃ 10 min,12℃结束反应。其片段纯化后用HindⅢ和SalⅠ双酶切、真核表达载体JMB440用HindⅢ和XhoⅠ双酶切并纯化,通过T4连接酶于16℃过夜将ChIFN-ɑ基因插入JMB440载体。将连接产物用热激法转化至大肠埃希菌Top10,用菌落PCR和测序鉴定重组JMB440-ChIFN-α载体。采用酵母一步转化法将鉴定成功构建的JMB440-ChIFN-α载体转化至酿酒酵母菌株AH109,经营养缺陷(缺亮氨酸SD培养基,Leu SD)筛选、提取其重组菌中质粒作PCR鉴定能够获得可表达略阳乌鸡干扰素α的重组菌株。
1.2.3 略阳乌鸡ChIFN-α真核表达Western bot鉴定 挑取成功构建的重组菌株AH109/JMB440-ChIFN-α单菌落于-Leu SD液体培养基中30℃培养。按照10 mL/L接种量分别接种到含5 mL Leu SD液体培养基30℃培养。将重组菌株收集,重悬于SDS-聚丙烯酰胺凝胶(SDS-PAGE)上样缓冲液中,充分打散后沸水浴10 min破碎细胞后冰浴,然后于4℃、10 000 r/min离心10 min[11-14]。取蛋白上清液进行120 g/L SDS-PAGE电泳,然后转至硝酸纤维膜,洗脱后用封闭液封闭,加入一抗、洗脱,加二抗,然后用ECL曝光试剂曝光。
2 结果
2.1 略阳乌鸡α干扰素基因片段PCR扩增
本试验采用SDS法从略阳乌鸡肝脏组织中提取基因组DNA(图1),并以其为模板经PCR特异扩增获得一条大约为582 bp略阳乌鸡α干扰素基因片段(图2),与预期的大小一致。
2.2 重组JMB440-IFN-α载体的鉴定
通过双酶切鸡α干扰素基因片段、酵母表达载体JMB440后用T4连接酶连接,并转化至大肠埃希菌TOP10,挑9个单克隆,经菌落PCR鉴定重组载体,获得大约582 bp条带,与预期结果一致(图3)。测序结果显示,与NCBI公布的基因序列99.5%相同,表明目的基因已成功地克隆到载体中,命名为JMB440-ChIFN-α(图4)。
2.3 重组酿酒酵母菌株与ChIFN-α基因表达鉴定
2.3.1 重组菌株的鉴定 将成功构建的JMB440-ChIFN-α重组载体转化至酿酒酵母AH109中后初步经营养缺陷型SD培养基筛选,然后挑取3个克隆摇菌提取质粒,进行PCR,结果出现约为582 bp大小的条带(图5),从而证明成功构建了表达鸡α干扰素蛋白的酿酒酵母菌株。

M.DNA 标准DL 2 000;1~4.不同个体基因组
M.DNA Marker DL 2 000;1-4.Different individual genomes
图1鸡基因组DNA检测
Fig.1 The chicken genome DNA testing

M.DNA 标准DL 2 000;1~3.ChlFN-α基因扩增产物
M.DNA Marker DL 2 000;1-3.ChlFN-α gene products
图2 ChlFN-α扩增
Fig.2 ChlFN-α amplification
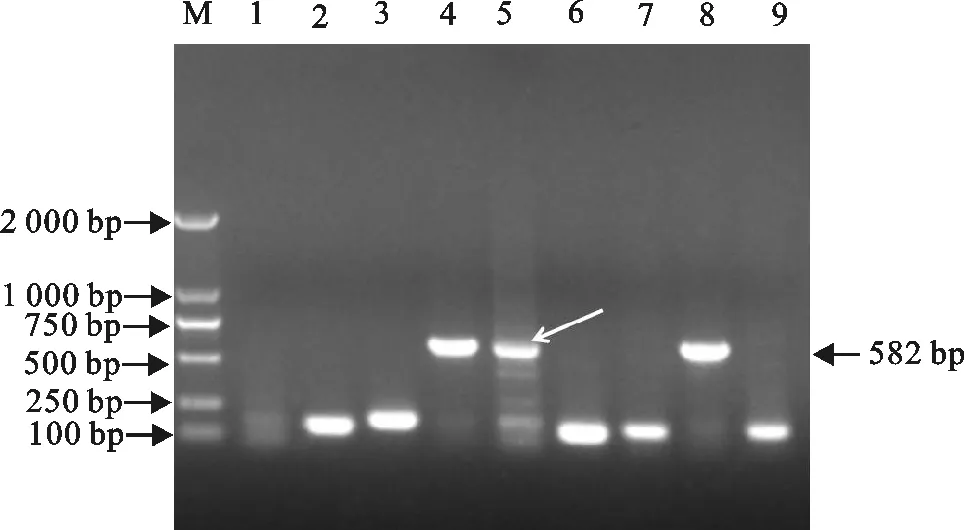
M.DNA 标准DL 2 000;1~9不同单克隆的菌落
M.DNA Marker DL 2 000;1-9.Different monoclonal colonies
图3菌落PCR
Fig.3 Colony PCR

原载体是JMB440;aagctt是HindⅢ酶切位点;gtcgac是XhoⅠ酶切GACTACAAGGATGACGACGATAAA是Flag tag sequence
The original carrier is JMB440,aagctt isHind Ⅲ enzyme sites,gtcgac isXhoⅠenzyme GACTACAAGGATGACGACGATAAA is Flag tag sequence
图4构建JMB440-ChIFN-α
Fig.4 Constructeion of JMB440-ChIFN-α

M.DNA标准DL 15 000;1~3.不同的单克隆提取的质粒
M.DNA Marker DL 15 000;1-3.Different monoclonal extracted plasmids
图5提取转染后AH109质粒PCR
Fig.5 PCR results of extraction of transfect AH109 plasmid
2.3.2 重组酿酒酵母菌株中ChIFN-α基因表达鉴定 初步鉴定成功酿酒酵母菌采用Western blot进行鉴定ChIFH-α表达含量(图6),结果表明,所构建鸡α干扰素原核表达载体,其蛋白的分子质量约为37 ku[15],酿酒酵母表达的蛋白分子质量约为23 ku。结果表明,成功构建了表达略阳乌鸡α干扰素酿酒酵母重组菌株。
3 讨论

1.原核表达载体Rossate-pET32a-ChIFN-α;2.酿酒酵母AH109空菌;3.酿酒酵母AH109-JMB440;4.酿酒酵母AH109-JMB440-ChIFN-α
1.Prokaryotic expression vector Rossate-pET32a-ChIFN-α;2.SaccharomycescerevisiaeAH109; 3.SaccharomycescerevisiaeAH109-JMB440;4.SaccharomycescerevisiaeAH109-JMB440-ChIFN-α
图6 Western blot检测
Fig.6 Western blot detection
家禽养殖过程易受病毒侵染,抗生素或其他药物的过度使用不仅增加病毒对药物的抵抗性,还能引起病毒突变为各种亚型,因此研究和开发新一代的抗病毒药物是必然的需要[13-14]。直到研究者发现干扰素能够抑制病毒自身核酸的复制而杀死病毒,这为治疗禽类病毒性疾病带来了希望。
鸡IFN-α生产通常采用繁杂的生化工艺从动物的组织中分离纯化鸡IFN-α。基于基因工程技术的发展,通过简单、低成本的原核表达系统高效表达外源基因的方法获得鸡IFN-α已经成为发展趋势,但在用原核表达载体pET-28a、pGEX-KG和pET-30a载体表达鸡α干扰素基因时均没有获得表达[15]。研究发现,切除编码鸡IFN-α基因序列的信号肽,构建的鸡IFN-α原核表达系统可获得鸡IFN-α,优化发酵条件进行后,可提高鸡IFN-α的表达量。由于原核表达系统不能对外源蛋白进行翻译后修饰、折叠和分泌等问题,存在无法弥补的缺陷。真核表达系统可以弥补原核表达系统自身的缺陷,研究者通过构建毕赤酵母真核表达系统,能够获得鸡IFN-α,但是毕赤酵母中密码子的偏好性比较强,外源基因表达较低,进而很难获得大量外源基因表达的多肽或蛋白[16-18]。本研究通过PCR扩增鸡α干扰素成熟肽基因片段,构建鸡IFN-α基因的真核表达载体JMB440-ChIFN-α,并且以酿酒酵母AH109为宿主菌,既能弥补原核表达系统不能修饰、折叠和分泌的缺陷,也能避免在毕赤酵母中表达时较高密码子偏好性的障碍,实现鸡IFN-α基因真核表达。另外,酿酒酵母容易保存,并能够广泛的使用在酿造、食品等工业,同时也是饲料的良好的添加剂,本研究构建高效表达鸡IFN-α基因的重组酿酒酵母菌株添加至饲料中直接饲喂,可降低生产成本,减少药物使用,使鸡等家禽免受病毒侵染,提高禽肉品质。
[1] Isaacs A,Lindenmann J.Virus interference.I.The interferon[J].Proceed Royal Soc London B:Biolog Sci,1957,147(927):258-267.
[2] 岳道友,索 勋,汪 明,等.鸡α-干扰素研究进展[J].中国家禽,2010,32(17):45-47.
[3] 魏雪涛,李 银,刘宇卓,等.鸡干扰素基因的分子克隆与序列测定[J].江西农业学报,2008,20(7):24-26.
[4] 侯凤香.重组鸡α干扰素结构与功能及其抗病毒活性的研究[D].江苏南京:南京农业大学,2009.
[5] Sekellick M J,Ferrandino A F,Hopkins D A.Chicken interferon gene: cloning, expression, and analysis[J].J Inter Res,1994,14(2):71-79.
[6] Digby M R,Lowenthal J W.Cloning and expression of the chicken interferon-γ gene[J].J Inter Res,1995,15(11):939-945.
[7] Sick C,Schultz U,Staeheli P.A family of genes coding for two serologically distinct chicken interferons[J].J Biol Chem,1996,271(13):7635-7639.
[8] 李秋霞,刘永录,龚 剑,等.三黄鸡α干扰素的克隆,表达及抗病毒活性初步研究[J].动物医学进展,2011,32(10):63-66.
[9] Xia C,Liu J,Wu Z G,et al.The interferon- αgenes from three chicken lines and its effects on H9N2 influenz a viruses[J].Anim Biotechnol,2004,15(1):77-88.
[10] 刘成倩,王 静,李 红,等.鸡干扰素-α基因原核表达载体的构建及高效表达[J].中国畜牧兽医,2014,41(4):47-50.
[11] 聂兆晶,程福亮,夏晓飞,等.鸡α干扰素基因的原核和真核表达载体的构建及鉴定[J].畜禽业,2015(2):56-58.
[12] 宋凌云.鸡α干扰素基因克隆、原核表达及抗病毒活性研究[D].河南郑州:河南农业大学,2006.
[13] Qu H,Yang L,Meng S,et al.The differential antiviral activities of chicken interferon α (ChIFN-α) and ChIFN-β are related to distinct interferon-stimulated gene expression[J].PLoS One,2013,8(3):e59307.
[14] Su B S,Yin H S,Chiu H H,et al.Immunoadjuvant activities of a recombinant chicken IL-12 in chickens vaccinated with Newcastle disease virus recombinant HN protein[J].Vet Microbiol,2011,151(3):220-228.
[15] 杜伟立,张 涛,王 令,等.略阳乌鸡α干扰素原核表达载体构建及诱导条件优化[J].黑龙江畜牧兽医,2017(1):51-56.
[16] 秦捷敏,宋 莉,卢凌霄,等.ChIFN-α酿酒酵母工程菌的发酵条件优化[J].山地农业生物学报,2014,11(2):51-54.
[17] 姜正军,刘树海,王茂超,等.毕赤酵母高密度培养表达鸡α-干扰素的工艺研究[J].生物技术通报,2014(6):19.
[18] 董亚青,朱文斗,王琳琳,等.鸡α-干扰素在毕赤酵母中的表达及其表达条件优化[J].江苏农业科学,2015,43(11):275-277.
ConstructionandIdentificationofSaccharomycescerevisiaeExpressingChickenInterferonAlpha
DU Wei-li,YIN Mei-chen,YANG Li-kai,ZHANG Tao,WANG Ling,LU Hong-zhao
(SchoolofBiologicalScienceandEngineering,ShaanxiUniversityofTechnology,Hanzhong,Shaanxi,723000,China)
In this study,the eukaryotic expression vector was constructed,which the main purpose was to construct yeast strains efficient expression of chicken alpha interferon (ChIFN-α).Firstly,the primers were designed,according to the sequence of chicken interferon alpha gene published in GenBank.Total DNA of Lüeyang chicken as the template,ChIFN-α encoding mature chicken alpha interferon was amplified by PCR.Then,using the gene recombination technology,ChIFN-α gene was inserted into the eukaryotic expression vector.It proved that the recombinant plasmid was constructed successfully by colony PCR and DNA sequencing.Then JMB440-ChIFN-α was transformed into yeast strain AH109,which was detected by the auxotroph culture.Plasmid extraction and PCR identification were carried out to show ChIFN-α yeast strain harboring JMB440-ChIFN-α.Finally,ChIFN-α expression in AH109 was analyzed by SDS-PAGE and Western blot,which produced pattern of relative molecular weight band about 23 ku that it was consistented with the expected result.The results showed that engineering yeast strain expressing chicken interferon were obtained.
Lveyang black-bone chicken;chicken alpha interferon;eukaryotic expression vector;Saccharomycescerevisiae
2017-04-11
陕西省农业科技创新与攻关项目(2016NY-084)
杜伟立(1990-),男,陕西周至人,硕士研究生,主要从事生物化学与分子生物学研究。*
S852.43;Q789
:A
:1007-5038(2017)09-0028-04

