63例胰腺神经内分泌肿瘤的临床特征与预后分析*
赵婷 陈炯煌 曹利平
·临床研究与应用·
63例胰腺神经内分泌肿瘤的临床特征与预后分析*
赵婷 陈炯煌 曹利平
目的:探讨胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PNETs)的发病特点、诊断、治疗及预后的影响因素。方法:回顾性分析2004年8月至2016年8月浙江大学医学院附属邵逸夫医院确诊为PNETs并接受手术治疗的患者63例。收集患者的临床资料,包括年龄、性别、肿瘤功能性、根治性切除等信息,通过单因素、多因素分析的方法求证各因素与预后之间的关系。结果:本研究患者总生存时间(overallsurvival,OS)为5~127个月,中位生存时间(median overallsurvival,mOS)为46.6个月。3年及5年生存率分别为88.8%和84.1%。在63例患者中,无功能型占65.1%(41/63),功能型占34.9%(22/63)。单因素分析结果显示淋巴结转移、肝转移、血管侵犯、TNM分期、病理分级以及是否行根治性手术与预后相关(P<0.05)。多因素分析结果并未显示其中存在影响PNETs预后的独立因素。结论:PNETs是一类低度恶性的异质性罕见肿瘤,TNM分期和世界卫生组织(WHO)病理分级能积极指导预后,且淋巴结转移、肝转移、血管侵犯情况对预后有影响。患者经积极手术,尤其是根治性手术可获得较好的预后。
胰腺神经内分泌肿瘤 临床表现 诊断 治疗 预后
神经内分泌肿瘤是一种起源于肽能神经元和神经内分泌细胞的异质性肿瘤,来源于身体多种部位,如胃肠道、肺、胰腺等[1]。胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PNETs)是胰腺肿瘤中第二常见的类型,在所有胰腺肿瘤中占1%~2%[2-3]。PNETs起源于胰腺内的肠嗜铬细胞,考虑其在胰腺中的位置,这些细胞也被称为胰岛细胞。大多数PNETs散在发生,10%~30%是遗传性神经内分泌肿瘤综合征的表现之一。约1/3的PNETs是具有功能的肿瘤,根据其高表达的激素对其进行分类,分为胰岛素瘤、胃泌素瘤、生长抑素瘤、胰高糖素瘤、生长激素瘤、血管活性肠肽瘤(vasoactive intestinalpeptide,VIP)等[2,4-5]。其临床表现多样,有的表现为神经性低血糖症,常见于清晨或运动后;有的表现为消化性溃疡相关症状;有的表现为神经症状如共济失调、老年痴呆症、抑郁症等;有的表现为水样腹泻。这也是PNETs经常被误诊的缘故。无功能性PNETs缺少典型临床表现,早期很难发现。用于其诊断的影像学检查包括计算机断层扫描(CT)、核磁共振成像(MRI)、超声内镜(endoscopic ultrasound,EUS)、生长抑素受体扫描(somatostatin receptorscintigraphy,SSRS)、数字减影血管造影(DSA)等。PNETs是一类低度恶性的异质性罕见肿瘤,其临床表现多样,确诊依赖病理。因此增加对PNETs的认识,提高诊断正确率,对其治疗水平的改善尤为重要。
本研究回顾性分析2004年8月到2016年8月浙江大学医学院附属邵逸夫医院收治的63例PNETs患者的临床及病理资料,探讨PNETs的发病特点,诊断、治疗及预后影响因素。
1 材料与方法
1.1 病例资料
本研究纳入2004年8月至2016年8月浙江大学医学院附属邵逸夫医院,经病理确诊为PNETs的患者63例。其中男性24例,女性39例,男女比例1:1.6。63例患者年龄为30~81岁,中位年龄52岁。
1.2 方法
分析每例患者的临床表现及肿瘤的大小、位置、直径、病理结果、免疫组织化学检测等,根据2000年世界卫生组织(WHO)修订的标准,PNETs的病理分型可以分为高分化神经内分泌肿瘤、高分化神经内分泌癌、低分化神经内分泌癌。而2010年WHO对其命名和分类主要依据细胞学分级和增殖指数[由Ki-67和(或)有丝分裂计数评估]决定。G1或G2级PNETs通常为惰性,侵袭性较低,G3级通常称胰腺神经内分泌癌,进一步细分为小细胞或大细胞亚型,与小细胞肺癌相似,具有高侵袭性、预后较差等特点[6-7]。采用美国癌症联合会(American JointCommit⁃tee on Cancer,AJCC)在2017年推出的PNENs TNM分期,根据原发灶的位置、大小、侵犯范围和有无转移等进行分期。新版分期与旧版相比,主要删除Tis的概念,将远处转移M进行了细分。T:T1局限于胰腺内,肿瘤直径≤2 cm;T2局限于胰腺内,肿瘤直径>2 cm;T3播散至胰周,但没有侵犯大血管;T4肿瘤侵犯大血管。N:N0无区域淋巴结转移,N1有区域淋巴结转移。M:M0无远处转移,M1有远处转移。M1a转移局限于肝脏,M1b至少一处肝外转移,如肺、卵巢等,M1c同时具有肝脏和肝外转移。
以确诊时间为随访起始时间,随访截止时间到2017年3月,采用电话联合信访方式随访。总生存期(overall survival,OS)指疾病确诊日期至死亡或随访结束日期。
1.3 统计学分析
应用SPSS20.0软件进行统计学分析。应用Kaplanmerier法进行生存分析及单因素分析,并绘制生存曲线。采用Log-rank检验比较组间差异,Cox回归进行多因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床表现及症状
63例PNETs患者中,17例为胰岛素瘤,症状包括意识障碍、晕厥、低血糖、头晕、抽搐、腹痛。3例VIP瘤的临床症状为腹泻、腹痛。1例胰高血糖素瘤主要表现为糖尿病症状。1例胃泌素瘤表现为反复发作的消化性溃疡。在41例无功能PNETs患者中,17例的首发症状是上腹部不适、疼痛,2例为梗阻性黄疸,19例患者由于体检或自行发现腹部肿块就诊,3例患者以检出肝转移灶就诊。
2.2 诊断
影像学检查在PNENs的定位和分期中具有十分重要的作用,本研究的63例病例中涉及的影像学检查主要包括B超、CT、MRI和EUS。29例超声检查的结果表现为低回声占位,多为性质待查;7例EUS检查的患者肿块表现为低回声团,定位较为准确,且诊断的准确率达100%(7/7)。44例患者接受了CT检查,准确率为79.5%(图1)。MRI的检查准确率最高,达82.9%(29/35)。最终明确PNETs诊断的唯一标准是病理检测。本研究确诊的PNETs患者中,位于胰腺钩突部的肿瘤有8例(12.7%),胰头部20例(31.7%),胰腺颈部的肿瘤有6例(9.5%),胰体尾部29例(46.0%)。依据2010年WHO病理分类标准,本研究的PNETs患者可以分为G1级42例(66.7%),G2级14例(22.2%),G3级7例(11.1%)。根据AJCC 8版TNM分期标准,可以划分为Ⅰ期41例(65.1%),Ⅱ期 9例(14.3%),Ⅲ期 1例(1.6%),Ⅳ期 12例(19.0%)。对于患者术后标本的免疫检测结果进行分析整理,在免疫组织化学结果中,较常见的嗜铬粒蛋白A(CgA)的阳性率为91.9%(57/62),突触素(Syn)的阳性率为98.4%(61/62),NSE阳性率为95.1%(58/61),CD56阳性率为90.2%(37/41)。
2.3 治疗
本研究63例患者均接受手术治疗。以切除肿瘤原发灶、转移淋巴结及转移灶为目标的根治性手术为56例(88.9%)。其中,14例接受胰腺肿瘤局部切除术,5例接受保留脾脏的胰体尾切除术,18例接受胰体尾切除术联合脾脏切除,19例接受胰十二指肠切除术联合胰胃吻合或胰管空肠Roux-en-Y吻合。在上述患者中,有些因淋巴结转移或血管及神经侵犯而根治性切除转移灶,或因肝脏转移行肝脏结节或部分肝脏的切除。7例(11.1%)因肿瘤体积较大与周围组织紧密黏连,或因广泛淋巴结及远处转移等原因,无法行根治性切除,仅切除原发灶或局部原发灶及部分转移灶。
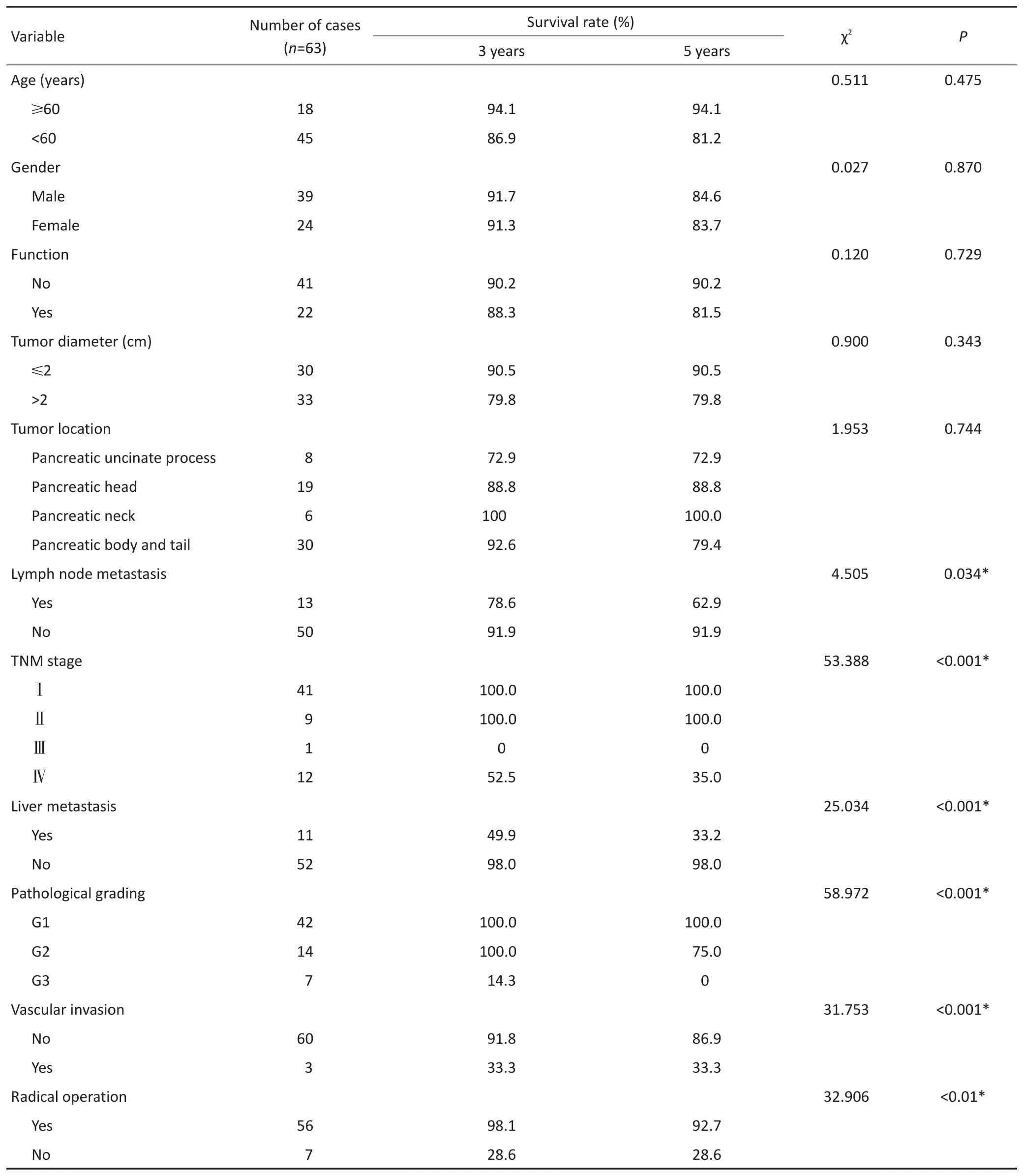
表1 63例PENTs临床病理预后单因素分析Table 1 Univariate analysisof the clinicopathologicalfeaturesof63PNETs

表2 PENTs病理分级与临床特征的关系 例Table 2 Relationship of pathologicalgrading in PNETsw ith clinicopathologicalfeatures(n)
2.4 生存期及预后
对研究患者进行随访,随访日期截止到2017年1月31日。本组患者的总生存时间(overallsurival,OS)为5~127个月,中位生存时间(median overallsurvival,mOS)为46.6个月。3年及5年生存率分别为88.8%和84.1%。生存56例,死亡7例。肿瘤各分期生存率如下:Ⅰ期41例,Ⅱ期9例,Ⅲ期1例,Ⅳ期12例。单因素分析结果显示,淋巴结转移、肝转移、血管侵犯、TNM分期、病理分级以及是否行根治性手术与预后相关(表1)。不同因素影响下的生存曲线见图2~7。根据生存曲线可以发现,无淋巴结转移、肝转移、血管侵犯的患者其预后明显优于对应组的患者。从TNM分期相关的生存曲线中,发现Ⅰ、Ⅱ期的患者预后总体上要优于Ⅲ、Ⅳ期的患者,且Ⅰ、Ⅱ期之间无明显差异,Ⅲ期患者由于仅1例,生存曲线图存在偏倚。WHO病理分级相关的生存曲线反映了G1和G2级的患者生存预后要优于G3级的患者(表2)。最后,生存分析显示接受根治性手术的患者在生存预后方面具有明显优势。多因素分析结果未显示其中存在影响PNETs预后的独立因素(表3)。

表3 63例PNETs临床病理预后多因素分析Table 3 Multivariate analysis of the clinicopathological features of 63 PNETspatients

图1 PNETs的影像学结果Figure 1 Imaging feature of PNETs
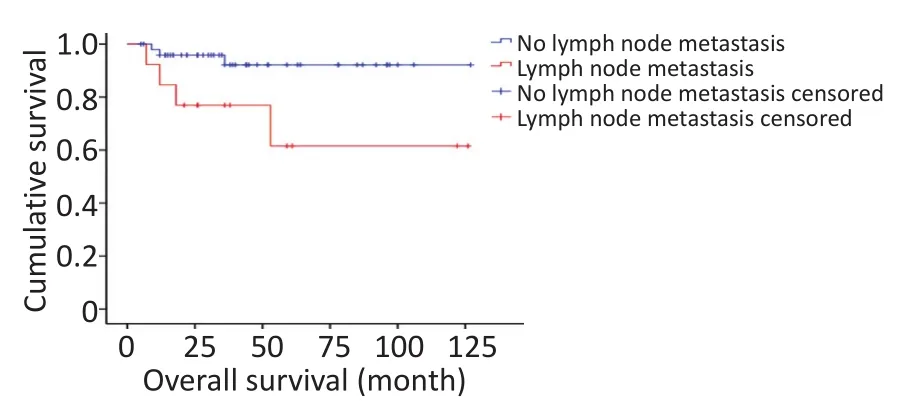
图2 淋巴结转移相关生存曲线Figure 2 Survival curve of patientsw ith and w ithout lymph nodemetastasis
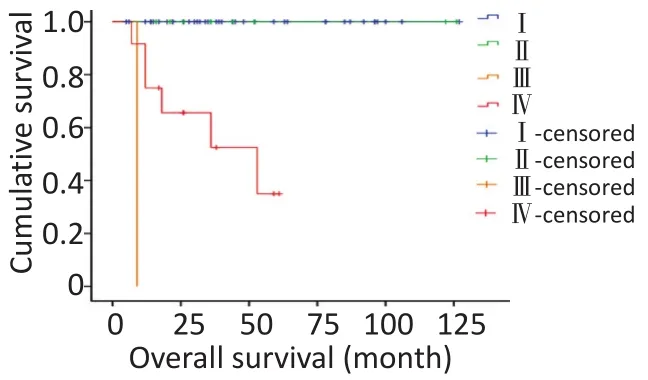
图3 TNM分期相关生存曲线Figure 3 Survivalcurve ofpatientsw ith different TNM stages
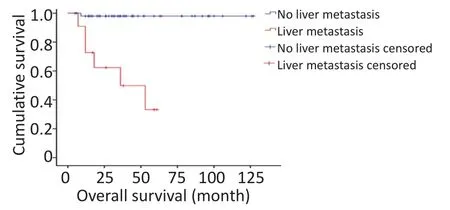
图4 肝转移相关生存曲线Figure 4 Survivalcurve ofpatientsw ith andw ithout livermetastasis
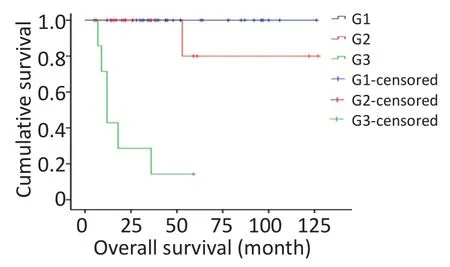
图5 WHO病理分级相关生存曲线Figure 5 Survivalcurve ofWHO pathologicalgrading
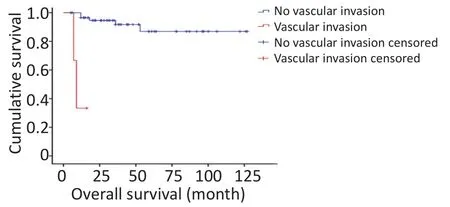
图6 血管侵犯相关生存曲线Figure 6 Survivalcurve ofpatientsw ith and w ithoutvascular invasion

图7 根治性切除相关生存曲线Figure 7 Survivalcurve ofpatientsw ith and w ithout radicaloperation
3 讨论
PNETs是一种较少见的肿瘤,发病率为1/10万,占所有胰腺肿瘤的1%~2%[8]。美国监测、流行病学与最终结果(SEER)数据显示,PNETs在美国的年发病率约为0.22/10万[6],且近年来发病率呈上升趋势。由于其较低的发病率,症状复杂,故临床上易误诊或漏诊。
有研究表明,PNETs可发生在任何年龄段,高发于40~60岁[7]。PNETs中约1/3患者表现为有功能性的肿瘤,具有相应的临床症状[8-9]。有研究提示年龄是影响PNENs患者预后的因素[6,10-11],功能性PNETs较非功能性PNETs预后好[12],但也有研究持有不同意见[13-14]。本研究结果显示,年龄和功能状态与PNENs患者的预后并无显著相关性。由于本研究纳入的病例仅代表部分PNETs患者群体,具有一定局限性,且样本量较小,不可避免地存在一些偏倚。
如上所述,由于大部分的PNETs无功能,不导致临床症状,故影像学诊断的应用能进一步明确肿瘤定位,减少误诊率。CT作为PNETs的首选影像学检查,其灵敏度为62%~83%,MRI对直径<2 cm的肿瘤敏感性高于CT[8]。PET能全面评估是否存在转移灶[6]。超声内镜有利于诊断肿瘤直径<1 cm的小病灶,敏感性达77%~95%[9]。根据63例患者的统计学结果,本研究为了在术前更好地诊断PNETs,推荐术前完善CT及MRI,在条件允许的情况下可以实施EUS并行术前穿刺活检来增加手术机会。
本课题组对PNETs患者淋巴结转移、肝脏转移、血管侵犯方面研究的结果提示,术前或术中明确患者的淋巴结、肝脏转移或血管侵犯与否,有利于评估患者的生存预后情况。在AJCC第8版TNM分期的基础上,发现其与2010年WHO的分级标准具有相关性(P<0.05)。结合两者对PNETs患者进行分类分期,能够进一步明确诊断,相对于采用单一标准而言,对预后有更准确的评估。
手术是PNETs的主要治疗手段,根治性手术切除是PNETs患者能够获得长期生存的唯一选择[12,15-16]。根治性切除要求手术切除原发肿瘤(R0切除,即显微镜下切缘无肿瘤细胞残留),并完全切除区域转移淋巴结、肝脏或其他转移性肿瘤[1,15,17-31]。本研究认为,对于PNETs患者,根治性手术是延长生存期的有效手段。而对于病变进展,肿瘤体积较大与周围组织紧密黏连,或因淋巴结广泛及远处转移等原因无法行根治术的患者,减瘤术即部分切除原发灶和(或)转移灶,降低肿瘤负荷,可控制症状,改善生存质量,延长患者生存期[32]。
综上所述,联合WHO分级标准和TNM分期标准,结合淋巴结转移、肝脏转移和血管侵犯情况,可以积极指导预后评价。PNETs患者应该尽可能采取根治性手术以获得较好的预后。
[1]Steinmuller T,Kianmanesh R,FalconiM,et al.Consensus guidelines for themanagementofpatientsw ith livermetastases from digestive(neuro)endocrine tumors:foregut,m idgut,hindgut,and unknown primary[J].Neuroendocrinology,2008,87(1):47-62.
[2]Metz DC,Jensen RT.Gastrointestinal neuroendocrine tumors:pancreatic endocrine tumors[J].Gastroenterology,2008,135(5):1469-1492.
[3]Dum lu EG,KarakoçD,Özdem ir A.Nonfunctionalpancreatic neuroendocrine tumors:advances in diagnosis,management,and controversies[J].Int Surg,2015,100(6):1089-1097.
[4]Jensen RT,BernaMJ,Bingham DB,etal.Inherited pancreaticendocrine tumor syndromes:advances in molecular pathogenesis,diagnosis,management,and controversies[J].Cancer,2008,113(7):1807-1843.
[5]Castellano D,Grande E,Valle J,etal.Expert consensus for themanagement of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors[J].Cancer Chemother Pharmacol,2015,75(6):1099-1114.
[6]Halfdanarson TR,Rubin J,FarnellMB,et al.Pancreatic endocrine neoplasms:epidem iology and prognosis of pancreatic endocrine tumors[J].EndocrRelatCancer,2008,15(2):409-427.
[7]Muniraj T,Vignesh S,Shetty S,et al.Pancreatic neuroendocrine tumors[J].DisMon,2013,59(1):5-19.
[8]Klöppel G,Perren A,Heitz PU.The gastroenteropancreatic neuroendocrine cell system and its tumors:the WHO classification[J].Ann NYAcad Sci,2004,1014(1):13-27.
[9]Jensen RT,BernaMJ,Bingham DB,etal.Inherited pancreaticendocrine tumor syndromes:advances in molecular pathogenesis,diagnosis,management,and controversies[J].Cancer,2008,113(S7):1807-1843.
[10]Modlin IM,Lye KD,Kidd M.A 5-decade analysisof13 715 carcinoid tumors[J].Cancer,2003,97(4):934-959.
[11]Panzuto F,Boninsegna L,Fazio N,etal.Metastaticand locallyadvanced pancreatic endocrine carcinomas:analysisof factorsassociated with disease progression[J].JClin Oncol,2011,29(17):2372-2377.
[12]Halfdanarson TR,Rabe KG,Rubin J,etal.Pancreatic neuroendocrine tumors(PNETs):incidence,prognosis and recent trend toward improved survival[J].Ann Oncol,2008,19(10):1727-1733.
[13]Sarm iento JM,FarnellMB,Que FG,et al.Pancreaticoduodenectomy for islet cell tumorsof the head of the pancreas:long-term survival analysis[J].World JSurg,2002,26(10):1267-1271.
[14]Phan GQ,Yeo CJ,Hruban RH,etal.Surgicalexperiencewith pancreatic and peripancreatic neuroendocrine tumors:review of 125 patients[J].JGastrointestSurg,1998,2(5):472-482.
[15]Hashim YM,TrinkausKM,Linehan DC,etal.Regionallymphadenectomy is indicated in the surgicaltreatmentof pancreatic neuroendocrine tumors(PNETs)[J].Ann Surg,2014,259(2):197-203.
[16]Wachula E,Cwikla JB,RogowskiW,etal.Assessmentof the safetyand efficiency of sunitinibmalate inmetastatic neuroendocrine tumours of the pancreas(NENG1/G2)depending on the numberand type of earlier therapeutic lines-initialreport[J].EndokrynolPol,2014,65(6):472-478.
[17]Shoup M,Brennan MF,McWhite K,et al.The value of splenic preservationwith distalpancreatectomy[J].Arch Surg,2002,137(2):164-168.
[18]Clancy TE.Surgicalmanagementofpancreaticneuroendocrine tumors[J].HematolOncolClin North Am,2016,30(1):103-118.
[19]CasadeiR,MonariF,Buscem iS,et al.Totalpancreatectomy:indications,operative technique,and results:a single centre experience and review of literature[J].UpdatesSurg,2010,62(1):41-46.
[20]Heidt DG,Burant C,Simeone DM.Totalpancreatectomy:indications,operative technique,and postoperative sequelae[J].JGastrointest Surg,2007,11(2):209-216.
[21]Imamura M.Recent standardization of treatment strategy for pancreaticneuroendocrine tumors[J].World JGastroenterol,2010,16(36):4519.
[22]Cusati D,Zhang L,Harmsen WS,et al.Metastatic nonfunctioning pancreatic neuroendocrine carcinoma to liver:surgical treatmentand outcomes[J].JAm CollSurg,2012,215(1):117-125.
[23]Kvols LK,Brendtro KL.The north american neuroendocrine tumor society(NANETS)guidelines:m ission,goals,and process[J].Pancreas,2010,39(6):705-706.
[24]Norton JA.Endocrine tumours of the gastrointestinal tract.surgical treatment of neuroendocrine metastases[J].Best Pract Res Clin Gastroenterol,2005,19(4):577-583.
[25]Que FG,Sarm iento JM,Nagorney DM.Hepatic surgery formetastatic gastrointestinalneuroendocrine tumors[J].Adv Exp Med Biol,2006,(574):43-56.
[26]FalconiM,Bettini R,Boninsegna L,et al.Surgical strategy in the treatmentof pancreatic neuroendocrine tumors[J].JOP,2006,7(1):150-156.
[27]BettiniR,MantovaniW,Boninsegna L,etal.Primary tumour resection inmetastatic nonfunctioning pancreatic endocrine carcinomas[J].Dig LiverDis,2009,41(1):49-55.
[28]De Jong MC,FarnellMB,SclabasG,et al.Liver-directed therapy for hepaticmetastases in patientsundergoing pancreaticoduodenectomy:a dual-centeranalysis[J].Ann Surg,2010,252(1):142-148.
[29]Mazzaglia PJ,Berber E,MilasM,etal.Laparoscopic radiofrequency ablation of neuroendocrine livermetastases:a 10-year experience evaluating predictorsofsurvival[J].Surgery,2007,142(1):10-19.
[30]Reddy SK,Clary BM.Neuroendocrine livermetastases[J].Surg Clin North Am,2010,90(4):853-861.
[31]Rubin J,Ajani J,SchirmerW,et al.Octreotide acetate long-acting formulation versus open-label subcutaneous octreotide acetate in malignantcarcinoid syndrome[J].JClin Oncol,1999,17(2):600-606.
[32]Glazer ES,IgarashiH,FujimoriN,etal.Long-term survivalafter surgical managementof neuroendocrine hepaticmetastases[J].HPB(Oxford),2010,12(6):427-433.
(2017-03-27收稿)
(2017-07-19修回)
(编辑:郑莉 校对:孙喜佳)
Analysis o f clinical characteristics and p rognosis o f 63 cases o f pancreatic neu roendocrine tum o r
Ting ZHAO,Jionghuang CHEN,Liping CAO
Departmentof SirRun Run Shaw Hospital,Zhejiang University SchoolofMedicine,Hangzhou 100021,China
Objective:To investigate the clinicalcharacteristics,diagnosis,treatment,and prognostic factors of pancreatic neuroendocrine neoplasms(PNENs).Methods:From August 2004 to August 2016,the clinicaldata of63 patientsw ith PNENs in the Sir Run Run Shaw Hospital,an affiliate of the Zhejiang University SchoolofMedicine,were retrospectively analyzed.The data included age,gender,function,tumor location,tumor size,pathologicalcharacteristics,lymph nodes,metastasis,and treatment.Association of these factors w ith PNEN prognosiswas proven by univariate analysis and multivariate analysis.Results:In our study,the patients'overall survival time was between 5 and 127months;themedian time was about 46.6months.Moreover,the survival rates in three years and five yearsare 88.8%and 84.1%respectively.Univariate analysisshowed that factorssuch as lymph nodemetastasis,livermetastasis,vascular invasion,TNM staging and pathologicalgrading,and radicaloperation were associated w ith prognosis(P<0.05).We did not prove any of the factors to be an independent factor associated w ith poor short-term outcome bymultivariate analysis.Conclusion:PNENs are rare low-grademalignant tumorsw ith heterogeneity,which iswhy they can be erroneously diagnosed.AJCCTNM staging in 2017 and theWHO pathologicalclassification in 2010 can actively guide the prognosisevaluation.The lymph nodemetastasis,livermetastasis,and vascular invasion affected the prognosisof PNENs.Patientsw ith radicaloperation had improved prognosis.
pancreatic neuroendocrine tumors,clinicalcharacteristics,diagnosis,treatment,prognosis
Liping CAO;E-mail:cao@zju.edu.cn

10.3969/j.issn.1000-8179.2017.16.354
This work was supported by the Major Research Project of the Science and Technology Department of Zhejiang Province(No.2015C03G2010160)and the Zhejiang ProvincialNaturalScience Foundation ofChina(No.LY17H160015)
浙江大学医学院附属邵逸夫医院普外科(杭州市310000)
*本文课题受浙江省科技厅重点研发计划项目(编号:2015C03G2010160)和浙江省自然科学基金项目(编号:LY17H160015)资助
曹利平 cao@zju.edu.cn
赵婷 专业方向为肝胆胰外科。
E-mail:15868406824@163.com

