五子衍宗方对环磷酰胺致肝损伤的保护作用及其机制研究
刘珍财,赵海霞,陈 茜,刘光耀,袁 丁,张长城
·论著·
·中医·中西医结合研究·
五子衍宗方对环磷酰胺致肝损伤的保护作用及其机制研究
刘珍财,赵海霞,陈 茜,刘光耀,袁 丁,张长城*
目的研究五子衍宗方(WP)对环磷酰胺(CTX)致肝损伤的保护作用及其机制,以期为临床治疗提供借鉴。方法2015年9月—2016年6月,将8周龄SPF级BALB/c雄性小鼠40只随机分为正常对照组、模型对照组、WP低剂量组、WP高剂量组,每组10只。应用WP提取黄酮类化合物并将其溶于1%羧甲基纤维素钠(CMC-Na),WP低剂量组和WP高剂量组提前3 d分别给予黄酮类化合物140、280 mg/kg,灌胃给药30 d,1次/d;从第3天开始,除正常对照组腹腔注射等量0.9%氯化钠溶液外,其余各组均腹腔注射CTX 50 mg/kg造模,每隔2 d注射1次,共10次。模型对照组血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)水平与正常对照组比较有统计学差异提示造模成功。最后一次注射CTX 12 h后眼球取血、脱臼处死小鼠。检测血清ALT、AST水平;取肝脏,计算肝脏系数,HE染色法观察肝组织形态学表现,检测肝组织中超氧化物歧化酶(SOD)、丙二醛(MDA)水平。结果模型对照组小鼠血清ALT、 AST水平高于正常对照组(P<0.01);WP低剂量组、WP高剂量组小鼠血清ALT、 AST水平低于模型对照组(P<0.05)。模型对照组肝脏系数高于正常对照组、WP低剂量组、WP高剂量组(P<0.01)。模型对照组小鼠肝小叶和肝索排列混乱,肝细胞肿胀明显并伴有坏死,胞质疏松。WP低剂量组、WP高剂量组肝小叶排列较整齐,肝细胞肿胀和胞质疏松程度较模型对照组明显减轻,肝细胞形态均匀,排列规整。模型对照组肝组织SOD水平低于正常对照组、WP低剂量组、WP高剂量组,MDA水平高于正常对照组、WP低剂量组、WP高剂量组(P<0.05)。结论WP对CTX所致肝损伤具有良好的保护作用,其机制可能与提高机体的抗氧化能力,清除体内自由基有关。
药物性肝损伤;环磷酰胺;药理作用分子作用机制;五子衍宗方
刘珍财,赵海霞,陈茜,等.五子衍宗方对环磷酰胺致肝损伤的保护作用及其作用机制研究[J].中国全科医学,2017,20(27):3426-3430.[www.chinagp.net]
LIU Z C,ZHAO H X,CHEN Q,et al.Protective effect and mechanism of Wuzi-Yanzong prescription against the liver injury induced by cyclophosphamid[J].Chinese General Practice,2017,20(27):3426-3430.
环磷酰胺(CTX)是目前临床上广泛应用的烷化剂类抗癌药物,也是临床上常用的免疫抑制剂,常用于治疗白血病、淋巴瘤和乳腺癌等多种恶性肿瘤与非恶性肿瘤。因CTX是细胞周期非特异性药物,在对肿瘤细胞产生杀伤作用的同时,也会对正常细胞和组织产生毒性作用。CTX的代谢产物能够和体内生物大分子如蛋白质、脂质、DNA结合,导致DNA损伤,从而引起肝损伤、骨髓抑制、生殖毒性等毒副作用。CTX的临床应用也因此受到限制,故减少CTX的毒副作用尤为重要。已有研究结果表明,CTX可致肝损伤,并且可利用CTX来建立实验性肝损伤模型[1-2]。
五子衍宗方(WP)由枸杞子、五味子、菟丝子、覆盆子、车前子组成。现代药理学研究显示,WP具有抗氧化、抗衰老、增强免疫功能等功效,如WP可明显提高小鼠睾丸的抗氧化损伤能力,改善精子质量[3-4],增强免疫低下小鼠脾脏功能,提高机体免疫功能[5]。有研究显示,WP对乙醇性肝损伤、脂肪肝等有一定的保护作用[6]。本课题组前期研究也发现,WP对CTX所致肝损伤具有保护作用[7-8],但其有效成分及其作用机制目前尚不清楚。黄酮类化合物是WP的主要活性成分之一,易溶于乙酸乙酯中。多项研究表明,天然黄酮类化合物对肝脏有保护作用[9-10]。因此,本课题组利用CTX建立肝损伤模型,进一步探讨WP对CTX所致肝损伤的保护作用及其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 2015年9月—2016年6月,选取8周龄SPF级Balb/C雄性小鼠40只,体质量22~25 g,由湖北省实验动物中心提供〔动物许可证号:SCXK(鄂)2008-0005〕,分笼饲养,环境温度(20±2)℃,相对湿度55%~65%,12 h光照,啮齿类动物饲料喂养,自由饮水,适应性饲养1个月。
1.1.2 药品与试剂 枸杞子、五味子、菟丝子、覆盆子、车前子,均购自本草堂大药房;CTX,江苏恒瑞医药股份有限公司;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 黄酮类化合物的提取 称取4副药(1副药:枸杞子40 g,五味子5 g,菟丝子40 g,覆盆子20 g,车前子10 g),总重460 g,加4 000 ml 75%乙醇浸泡过夜,第2天回流提取3次,第1次1.5 h,第2次1.5 h,第3次1.0 h;合并提取液,旋转蒸发仪(75 ℃)浓缩至1 000 ml;石油醚脱脂3次,第1次提取液与石油醚体积比1∶1,根据颜色调整比例,第2次提取液与石油醚体积比1∶1,第3次提取液与石油醚体积比2∶1。出现乳化层,超声4 min后再分液,弃石油醚层,之后与乙酸乙酯以1∶1比例萃取3次;取上层溶液,蒸馏回收乙酸乙酯得到黄酮类化合物,干燥后计算提取率为0.729%。
1.2.2 肝损伤模型 将小鼠随机分为4组:正常对照组、模型对照组、WP低剂量组和WP高剂量组,每组10只。WP低剂量组和WP高剂量组提前3 d分别给予黄酮类化合物140、280 mg/kg〔黄酮类化合物溶于1%羧甲基纤维素钠(CMC-Na)〕,灌胃给药30 d,1次/d;从第3天开始,除正常对照组腹腔注射等量0.9%氯化钠溶液外,其余各组均腹腔注射CTX 50 mg/kg造模,每隔2 d注射1次,共10次。模型对照组血清ALT、AST水平与正常对照组有统计学差异提示造模成功。
1.2.3 ALT、AST水平及小鼠肝脏系数测定 小鼠末次给药12 h后(期间禁食不禁水),称重,眼球取血后静置30 min,4 000 r/min低温离心10 min(离心半径10 cm),取上清液,按ALT、AST测定试剂盒要求测定ALT、AST水平。眼球取血后脱臼处死小鼠,取出肝脏,0.9%氯化钠溶液洗净后用滤纸擦去表面水分并称重,计算肝脏系数〔肝脏系数=肝脏质量(mg)/体质量(g)〕。
1.2.4 肝组织形态学表现 于每只小鼠肝左叶同一部位取相同大小的肝组织,10%甲醛固定,石蜡包埋,切片,HE染色,光学显微镜(×200)观察小鼠肝组织形态变化。
1.2.5 SOD、MDA水平测定 称取一定量的肝组织,加4 ℃ 0.9%氯化钠溶液制成10%的组织匀浆,以3 000 r/min低温离心3次,5 min/次,离心半径10 cm,取上清液。按SOD、MDA测定试剂盒要求测定SOD、MDA水平。

2 结果
2.1 4组小鼠血清ALT、AST水平比较 4组小鼠血清ALT、AST水平比较,差异有统计学意义(P<0.01)。模型对照组小鼠血清ALT、AST水平高于正常对照组,差异有统计学意义(P<0.01),说明肝损伤模型建立成功;WP低剂量组、WP高剂量组小鼠血清ALT、AST水平低于模型对照组,差异有统计学意义(P<0.01,见表1)。
2.2 4组小鼠肝脏系数比较 4组小鼠肝脏系数比较,差异有统计学意义(P<0.05)。模型对照组肝脏系数高于正常对照组、WP低剂量组、WP高剂量组,差异有统计学意义(P<0.01,见表2)。
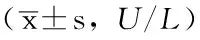
表1 4组小鼠血清ALT、AST水平比较
注:与正常对照组比较,aP<0.05;与模型对照组比较,bP<0.05;ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,WP=五子衍宗方

表2 4组小鼠肝脏系数比较
注:与模型对照组比较,aP<0.05
2.3 4组小鼠肝组织形态学表现 正常对照组小鼠肝小叶结构完整、清晰可辨,肝细胞以中央静脉为中心,呈放射状排列,且大小形态无异常;中央静脉及肝血窦未见出血、充血和水肿;肝汇管区未见纤维组织增生及炎性细胞浸润,未见明显肝细胞变性(见图1A,本文图1彩图见本刊官网www.chinagp.net电子期刊相应文章)。模型对照组小鼠肝小叶和肝索排列混乱,难以分辨;肝细胞肿胀明显、胞质很疏松、细胞结构辨识不清,有肝细胞坏死(见图1B)。WP低剂量组小鼠肝小叶有损伤,但仍有一部分肝小叶排列整齐,肝细胞有炎性细胞浸润,肝细胞肿胀、胞质疏松(见图1C)。WP高剂量组肝小叶排列较整齐,肝细胞肿胀和胞质疏松程度较模型对照组明显减轻,肝细胞形态均匀,排列规整,与正常对照组无明显差异(见图1D)。
2.4 4组小鼠肝组织SOD、MDA水平比较 4组小鼠肝组织SOD、MDA水平比较,差异有统计学意义(P<0.05)。模型对照组肝组织SOD水平低于正常对照组、WP低剂量组、WP高剂量组,MDA水平高于正常对照组、WP低剂量组、WP高剂量组,差异有统计学意义(P<0.05,见表3)。
3 讨论
CTX是一种很强的氮芥类烷化剂,具有广泛的抗肿瘤活性,在体外无烷化活性,其进入机体后先经肝脏中的微粒体功能氧化酶分解成酰胺氮芥、丙烯醛和大量的活性氧自由基,然而酰胺氮芥和活性氧自由基能够与DNA结合,引起DNA链断裂,从而抑制细胞增殖。临床研究发现,CTX在临床使用过程中出现了严重的肝损伤[11],并且可利用CTX来建立肝损伤模型[12]。CTX能够引起血清ALT、AST水平升高,肝组织中谷胱甘肽(GSH)和SOD活性降低、MDA水平升高,肝组织形态发生变化,胆汁分泌发生异常[13]。因此,研究各种可以降低或拮抗CTX毒副作用的药物,具有十分重要的意义。李育浩等[14]通过建立乙醇性肝损伤大鼠模型发现,WP通过降低血、肝过氧化脂质(LPO)水平,纠正肝内脂质代谢异常继而减少组织细胞的损伤来保护肝脏。WP及其组成成分可以减少自由基,提高机体的抗氧化能力,减少外周血白细胞线粒体DNA缺失,保护氧化应激对肝组织造成的损伤。有研究显示,枸杞中所含的甜菜碱可抑制脂肪在肝细胞内沉淀,促进肝细胞新生,同时可防止四氯化碳引起的肝功能紊乱,这可能是其可修复受损内质网,促进抗氧化酶的活化或合成,从而消除自由基,保护肝细胞[15]。菟丝子黄酮是一种天然有效的自由基清除剂,可减少脂质过氧化,对慢性肝损伤同样具有良好的保护作用[16]。文献报道,五味子制剂联合黄芪饮片治疗慢性乙型肝炎,能够增强肝脏的解毒功能,有利于肝细胞功能的恢复[17]。研究也发现,厚叶南五味子可显著降低急性肝损伤小鼠血清ALT、AST水平,有效改善小鼠肝组织的病理损伤[18]。现代药理学研究表明,五味子提取物对多种原因引起的肝损伤具有保护作用[19]。本课题组前期研究也发现WP对CTX所致肝损伤具有保护作用[7-8],但其具体机制尚不清楚,因此进一步研究WP对肝损伤的保护作用及其机制,将对临床治疗肝疾病提供新思路。

注: A为正常对照组,B为模型对照组,C为五子衍宗方(WP)低剂量组,D为WP高剂量组
图1 4组小鼠肝组织损伤(HE染色,×200)
Figure1 Injury in the liver tissue specimens of mice in the 4 groups identified by pathological examination

Table3ComparisonofSODandMDAlevelsinlivertissuespecimensofmiceinthe4groups

组别只数SOD(U/mgprot)MDA(nmol/mgprot)正常对照组1037.98±2.2213.63±2.79模型对照组1030.97±1.91a27.51±1.99aWP低剂量组1034.56±0.98b18.41±4.30bWP高剂量组1037.58±1.65b14.96±2.92bF值35.8041.90P值<0.01<0.01
注:与正常对照组比较,aP<0.05;与模型对照组比较,bP<0.05;SOD=超氧化物歧化酶,MDA=丙二醛
ALT、AST水平在肝脏疾病的诊断中具有重要意义[20]。当肝脏有实质性损害时,如肝细胞变性坏死,细胞膜通透性增加,分布在胞质中的ALT、AST释放入血,使得血清中酶含量增高。因此,血清ALT、AST水平可以反映肝脏的受损伤程度。
研究表明,WP及其各组分均具有良好的清除自由基、抗氧化作用,而氧化应激是CTX诱导肝损伤的主要原因之一[21]。SOD是细胞内天然的氧自由基清除剂,而MDA则是自由基与细胞表面不饱和酸的反应(脂质过氧化反应)产物。SOD活力的高低间接反映了机体清除自由基的能力,而MDA则反映了机体细胞受自由基攻击的严重程度。在生理状态下,机体产生的自由基与抗氧化防御系统处于动态平衡,而CTX代谢产物丙烯醛还会干扰体内的抗氧化系统,导致某些功能酶活性改变甚至丧失,使细胞内环境稳态遭到破坏,引起氧化应激性肝损伤。另外,当血清中抗氧化防御系统防御能力降低时,肝组织中MDA水平升高,SOD活性降低,引起氧化应激反应,导致细胞损伤甚至细胞死亡。而WP可提高CTX小鼠机体抗氧化能力,降低小鼠血浆、肝组织MDA水平,增强SOD活性,拮抗CTX所产生的肝毒性,保护肝脏。
本实验结果表明,模型对照组小鼠注射CTX后,肝脏系数显著升高,肝损伤严重,并伴有肝细胞坏死,血清ALT、AST水平和肝组织MDA水平显著升高,SOD活性显著降低,表明造模成功。WP灌胃后,小鼠血清ALT、AST水平明显降低,肝组织MDA水平降低,受损肝组织SOD活性明显增强,表明WP能够拮抗CTX诱导所引起的肝损伤。
综上所述,WP对CTX所致肝损伤具有良好的保护作用,其机制可能与其提高机体的抗氧化能力,清除体内自由基有关。
作者贡献:刘珍财进行研究设计与实施、资料收集整理、撰写论文并对文章负责;赵海霞、陈茜、刘光耀、袁丁进行研究实施与评估、资料收集;张长城进行质量控制及审校。
本文无利益冲突。
[1]王晓丹,杜军,刘克,等.黄伞脂溶性成分对环磷酰胺致小鼠肝损伤的保护作用[J].中成药,2013,35(9):2013-2016.DOI:10.3969/j.ssn.1001-1528.2013.09.045. WANG X D,DU J,LIU K,et al.Protective effect of liposoluble component of Pholiota adipose on liver injury induced by cyclophosphamide in mice[J].Chinese Traditional Patent Medicine,2013,35(9):2013-2016.DOI:10.3969/j.ssn.1001-1528.2013.09.045.
[2]梁园,龙腾云,陈红霞,等.玉郎伞多糖对环磷酰胺致小鼠肝损伤的保护作用[J].中国药师,2014,17(11):1800-1803.DOI:10.3969/j.issn.1008-049X.2014.11.003. LIANG Y,LONG T Y,CHEN H X,et al.Protective effect of Yulangsan polysaccharide on liver injury induced by Cyclophosphamide in mice[J].China Pharmacist,2014,17(11):1800-1803.DOI:10.3969/j.issn.1008-049X.2014.11.003.
[3]XU Y P,LIU B X,ZHANG X P,et al.A Chinese Herbal Formula,Wuzi Yanzong Pill,improves spermatogenesis by modulating the secretory function of Sertoli cells[J].Chin J Integr Med,2014,20(3):194-199.DOI:1007/s11655-014-1743-4.
[4]张长城,贾亮亮,许佳,等.五子衍宗汤对环磷酰胺致小鼠生精障碍保护作用的研究[J].中国中医基础医学杂志,2010,16(7):570-571. ZHANG C C,JIA L L,XU J,et al.Protective effect of Wuzi yanzong decoction on dyszoospermia induced by cycoxan in mice[J].Chinese Journal of Basic Medicine in Traditional Chinese Medicine,2010,16(7):570-571.
[5]王洪武,贾亮亮,徐媛青,等.五子衍宗汤对环磷酰胺致免疫低下小鼠的免疫调节作用[J].中国实验方剂学杂志,2011,17(4):144-146.DOI:10.3969/j.issn.1005-9903.2011.04.044. WANG H W,JIA L L,XU Y Q,et al.Immuno-regulation effects of Wuzi Yanzong decoction on immunosuppression mice[J].Chinese Journal of Experimental Traditional Medical Formula,2011,17(4):144-146.DOI:10.3969/j.issn.1005-9903.2011.04.044.
[6]欧琴,何坚.加味五子衍宗汤治疗脂肪肝82例[J].陕西中医,2003,24(7):587.DOI:10.3969/j.issn.1000-7369.2003.07.007. OU Q,HE J.Treatment of 82 cases of fatty liver with flavored Wuzi Yanzong decoction[J].Shaanxi Journal of Traditional Chinese Medicine,2003,24(7):587.DOI:10.3969/j.issn.1000-7369.2003.07.007.
[7]黄威峰,刘苗苗,袁丁,等.五子衍宗方对环磷酰胺致小鼠肝脏细胞DNA损伤的保护作用[J].中成药,2015,37(5):1093-1096.DOI:3969/j.ssn.1001-1528.2015.05.038. HUANG W F,LIU M M,YUAN D,et al.Protective effect of Wuzi Yanzong recipe on DNA damage induced by cyclophosphamide in liver cells of mice[J].Chinese Traditional Patent Medicine,2015,37(5):1093-1096.DOI:3969/j.ssn.1001-1528.2015.05.038.
[8]刘苗苗,袁丁,黄威峰,等.五子衍宗方对环磷酰胺致小鼠DNA损伤的影响[J].中国中医药信息杂志,2014,21(6):38-40.DOI:10.3969/j.issn.1005-5304.2014.06.014. LIU M M,YUAN D,HUANG W F,et al.Effect of Wuzi Yanzong Fang against cyclophosphamide induced DNA damage in mice[J].Chinese Journal of Information on TCM,2014,21(6):38-40.DOI:10.3969/j.issn.1005-5304.2014.06.014.
[9]黄秀曼,杜钢军,孙婷,等.过山蕨总黄酮对肝损伤的保护作用[J].中草药,2012,43(12):2458-2463. HUANG X M,DU G J,SUN T,et al.Protection of total flavonoids from Camptosorus sibiricus on hepatic injury[J].Chinese Traditional and Herbal Drugs,2012,43(12):2458-2463.
[10]王志旺,王瑞琼,郭玫,等.甘肃产藏药五脉绿绒蒿总黄酮对小鼠实验性肝损伤的保护作用[J].中国实验方剂学杂志,2013,19(2):206-209.DOI:10.13422/j.cnki.syfjx.2013.02.006. WANG Z W,WANG R Q,GUO M,et al.Study on liver protection of total flavones of meconopsis quintuplinervia from Gansu Province in mice[J].Chinese Journal of Experimental Traditional Medical Formulae,2013,19(2):206-209.DOI:10.13422/j.cnki.syfjx.2013.02.006.
[11]张晓峰.环磷酰胺口服致老年人急性肝损伤[J].药物不良反应杂志,2005,7(6):436.DOI:10.3969/j.issn.1008-5734.2005.06.014. ZHANG X F.Oral cyclophosphamide-associated acute liver impairment[J].Adverse Drug Reactions Journal,2005,7(6):436.DOI:10.3969/j.issn.1008-5734.2005.06.014.
[12]张善玉,朴娟玉,宛莹,等.不同给药次数环磷酰胺诱导小鼠肝损伤的对比研究[J].延边大学医学学报,2009,32(1):22-25.DOI:10.16068/j.1000-1824.2009.01.032. ZHANG S Y,PIAO J Y,WAN Y,et al.Comparative study of the liver injury induced with different medication times of cyclophosphamide in mice[J].Journal of Medical Science Yanbian University,2009,32(1):22-25.DOI:10.16068/j.1000-1824.2009.01.032.
[13]施畅,廖明阳.环磷酰胺与异环磷酰胺致肝毒性机制的比较[J].卫生毒理学杂志,2000,14(2):99-102.DOI:10.3969/j.issn.1002-3127.2000.02.010. SHI C,LIAO M Y.A comparative study on the mechanism(s)of the hepatotoxicity induced by Cyclophasphamide and Ifosfamide in rats[J].Journal of Health Toxicology,2000,14(2):99-102.DOI:10.3969/j.issn.1002-3127.2000.02.010.
[14]李育浩,邓响嘲,吴清和,等.五子衍宗丸对乙醇性肝损伤大鼠脂质代谢的影响[J].中国中药杂志,1994,19(5):300-302. LI Y H,DENG X C,WU Q H,et al.Effects of Wuzi Yanzong pills on lipid in rats with alcohol-induced liver injury[J].China Journal of Chinese Materia Medica,1994,19(5):300-302.
[15]刘英娟,杜金梁,贾睿,等.枸杞多糖对四氯化碳致建鲤急性肝损伤的保护作用[J].浙江农业学报,2015,27(1):37-43.DOI:10.3969/j.issn:1004-1524.2015.01.08. LIU Y J,DU J L,JIA R,et al.Protective effects of Lycium barbarum polysaccharides against carbon tertrachloride(CCl4)induced liver accurate injury in Carprinus carpoivar Jian[J].Acta Agriculturae Zhejiangensis,2015,27(1):37-43.DOI:10.3969/j.issn:1004-1524.2015.01.08.
[16]宋敏,柴连琴,左百乐.菟丝子黄酮对小鼠慢性肝损伤的影响[J].上海畜牧兽医通讯,2009(3):11.DOI:10.3969/j.issn.1000-7725.2009.03.006. SONG M,CHAI L Q,ZUO B L.Effects of flavonoids from semen cuscutae on chronic liver injury in mice[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine,2009(3):11.DOI:10.3969/j.issn.1000-7725.2009.03.006.
[17]燕菲,张巧艳,张宏,等.五味子与黄芪多糖协同保护对乙酰氨基酚致小鼠急性肝损伤[J].药学实践杂志,2009,27(5):340-344.DOI:10.3969/j.issn.1006-0111.2009.05.007. YAN F,ZHANG Q Y,ZHANG H,et al.Synergistic protective effect of Fructus Schisandrae chinensis with Astragalus polysaccharides on paracetamol-induced acute liver injury in mice[J].Journal of Pharmaceutical Practice,2009,27(5):340-344.DOI:10.3969/j.issn.1006-0111.2009.05.007.
[18]刘瑛,刘元,王丽,等.厚叶南五味子对小鼠急性肝损伤的保护作用[J].中国热带医学,2015,15(12):1424-1427.DOI:10.13604/j.cnki.46-1064/r.2015.12.03. LIU Y,LIU Y,WANG L,et al.Protective effects of Kadsura coccinea on acute liver injury of rats[J].China Tropical Medicine,2015,15(12):1424-1427.DOI:10.13604/j.cnki.46-1064/r.2015.12.03.
[19]李宜轩,陈建光,李凤,等.北五味子提取物对实验性肝纤维化大鼠肝损伤的保护作用[J].吉林大学学报(医学版),2014,40(2):285-288.DOI:10.13481/j.1671-587x.20140215. LI Y X,CHEN J G,LI F,et al.Protective effects of extract fructus Schisandrae Chinensis on hepatic injury in experimental hepatic fibrosis rats[J].Journal of Jilin University(Medicine Edition),2014,40(2):285-288.DOI:10.13481/j.1671-587x.20140215.
[20]LIU W,GAO F F,LI Q,et al.Protective effect of astragalus polysaccharides on liver injury induced by several different chemotherapeutics in mice[J].Asian Pac J Cancer Prev,2014,15(23):10413-10420.DOI:10.7314/APJCP.2014.15.23.10413.
[21]KORKMAZ A,TOPAL T,OTER S.Pathophysiological aspects of cyclophosphamide and ifosfamide induced hemorrhagic cystitis;implication of reactive oxygen and nitrogen species as well as PARP activation[J].Cell Biol Toxicol,2007,23(5):303-312.DOI:10.1007/s10565-006-0078-0.
(本文编辑:崔莎)
ProtectiveEffectandMechanismofWuzi-YanzongPrescriptionAgainsttheLiverInjuryInducedbyCyclophosphamide
LIUZhen-cai,ZHAOHai-xia,CHENQian,LIUGuang-yao,YUANDing,ZHANGChang-cheng*
MedicalCollegeofChinaThreeGorgesUniversity,Yichang443002,China
*Correspondingauthor:ZHANGChang-cheng,Professor;E-mail:greatwall@ctgu.edu.cn
ObjectiveTo study the protective effect and mechanism of Wuzi-Yanzong prescription(WP) against the liver injury induced by cyclophosphamide(CTX),so as to provide a reference for clinical treatment of the disease.MethodsFrom September 2015 to June 2016,40 8-week-old SPF grade male BALB/c mice were randomly divided into normal control group,model control group,WP low-dose group,and WP high-dose group,with 10 mice in each.Flavonoids solution was made by dissolving the flavonoids extracted from WP in 1% CMC-Na.WP low-dose and high-dose groups were respectively intragastrically administered with flavonoids solution 140 mg/kg,280 mg/kg,once a day for 30 days from the 1st day of intervention.For modeling,from the 3rd day of intervention,mice in the control group were given intraperitoneal injection of 0.9% sodium chloride solution,while those in the other groups
intraperitoneal injection of CTX 50 mg/kg,once three days for 10 times.Successful modeling was considered when the levels of serum alanine aminotransferase(ALT) and aspartate aminotransferase(AST) in the model control group were statistically different from those in the normal control group.Twelve hours after the last time of injection,all the mice were sacrificed by cervical dislocation after taking blood from the eyeball.The serum levels of ALT and AST were detected,the liver was obtained to calculate the liver index,to observe the tissue morphology changes after HE staining and to determine the levels of superoxide dismutase(SOD) and malondialdehyde(MDA) in liver tissues.ResultsThe serum ALT and AST levels in the model control mice were higher than those in the normal control group(P<0.01).The serum ALT and AST levels in the WP low-dose and high-dose groups were lower than those in the model control group(P<0.05).The liver index in the model control group was higher than that in the other 3 groups(P<0.01).In the model control group,the hepatic lobules and hepatic cords were disordered,and the hepatocytes were swollen and accompanied by necrosis and cytoplasm loose.However,in the WP low-dose and high-dose groups,liver lobules arranged neatly,liver cell swelling and cytoplasmic extent were significantly reduced compared with those in the model control group,liver cell morphology was uniform,and arranged in regular.The SOD level of liver tissue in the model control group was lower while the MDA level was higher than in the normal control group(P<0.01).WP low-dose group,WP high-dose group had higher SOD level but lower MDA level than the model control group(P<0.05).ConclusionWP has good protective effects on liver injury caused by CTX and its mechanism is probably related to the scavenging of free radical and increasing of cell anti-oxidative function.
Drug-induced liver injury;Cyclophosphamide;Molecular mechanisms of pharmacological action;Wuzi-yanzong prescription
国家自然科学基金资助项目(81573931,81373881,81503334);三峡大学人才科研启动基金(KJ2014B067)
R 575.1
A
10.3969/j.issn.1007-9572.2017.27.020
2017-04-18;
2017-07-18)
443002 湖北省宜昌市,三峡大学医学院
*通信作者:张长城,教授; E-mail:greatwall@ctgu.edu.cn

