低温胁迫下内源性ROS对磷脂酶D活性影响的研究
何文平, 杨鹏军, 张旭强, 王新霞, 仇奕之, 林美贞, 杨 宁
(西北师范大学生命科学学院, 甘肃 兰州730070)
植物生长受多种调控因子的影响,而温度是这些调控因子中一个重要因素,温度的变化直接影响植物的生长发育。活性氧(Reactive oxygen ROS)是植物有氧代谢的产物,在植物很多生理过程中均发挥作用。植物在正常条件下能产生ROS[1],此时 ROS的产生与清除处于一个动态平衡过程中。环境胁迫引发ROS的产生并过度积累[2]。早在1998年时,Rauen等[3]发现冷胁迫能引发肝癌细胞ROS的释放[3]; 1994年Prasad[4]发现在玉米幼苗中低温能够引发ROS的大量产生。之后类似的研究越来越多。积累的ROS会损伤膜脂流动性,扰乱细胞的正常代谢[5],在这个过程中因膜磷脂过氧化引起的膜损伤是ROS对植物伤害的事件之一。另外细胞和细胞器膜脂质过氧化后会直接影响细胞功能并加重氧化胁迫[6],结果是膜磷脂被过氧化并且降低了膜的流动性,在磷脂双分子层中磷脂代谢的速率加快,同时也增加了膜对底物的渗透率[7]。
PLD在植物中普遍存在,其活性直接影响膜的结构和稳定性[8]。PLD对于膜的影响相当显著,严重时能导致膜的功能和完整性丧失[9]。除此之外,PLD可根据刺激强度传递膜重建和降解的信号[10],例如在干旱胁迫早期阶段PLD转导促进气孔关闭的信号,而延长干旱胁迫后,PLD却加速膜降解[11]。
有关ROS和PLD之间的相互作用的研究已有很多,例如在拟南芥中PLD参与ROS的产生并且增加NADPH氧化酶的活性[12];在水稻细胞中,H2O2诱导PLD活性是水稻细胞抗毒素生物合成的必须过程[13];在拟南芥中,H2O2诱导PLD降低了ROS诱导的细胞凋亡等[14]。这些研究说明ROS与PLD之间存在着一定的作用关系,然而是通过怎样的机制来维持两者的相互作用目前还无明确报道。
基于此,我们以高山离子芥(chorisporabungeana)作为试验材料,以低温(4℃,0℃和-4℃)作为胁迫因子,研究低温引发的内源性ROS对线粒体膜结合态PLD活性的调控作用,以期进一步揭示ROS对PLD活性的调控机制。
1 试验材料
1.1 试管苗的培养
高山离子芥试管苗的培养根据杨宁等的方法[15]。种子去皮并用70%乙醇浸泡,再用0.1%升汞浸泡5~8 min,无菌水冲洗3次,种子直接接种于MS培养基中(不含任何激素)并置于光照培养架上(25℃,2 000 lx,12 h光照)培养。待种子萌发长至一定高度后将试管苗接种于MS培养基(MS+0.2 mg·L-16-BA+30 g·L-1蔗糖+7.8 g·L-1琼脂,pH 5.8,温度25℃,光照周期为12 h)中培养15 d,然后用于试验。
1.2 材料的处理
H2O2处理:将1,5和10 mmol·L-1H2O2分别添加于MS培养基中,然后将生长旺盛的高山离子芥接种于该培养基中并外施上述浓度的H2O2于叶上;EGTA处理:将5 mmol·L-1EGTA添加于MS培养基中;CaCl2处理:将 10 mmol·L-1CaCl2添加于MS培养基中;DPI处理:将12.5 μmol·L-1的DPI添加于MS培养基中;DPI+ CaCl2处理:将12.5 μmol·L-1DPI和10 mmol·L-1CaCl2添加于MS培养基中,然后将生长旺盛的高山离子芥接种于上述培养基中,以上处理的材料(不同浓度H2O2处理组正常培养)均置于人工培养箱中,分别在4℃,0℃和-4℃中低温培养6~72 h。试验设置0 h作为对照组。
2 试验方法
2.1 高山离子芥磷脂酶D的制备
磷脂酶D的制备根据Mao等的方法并略作改变[16]。取0.5 g高山离子芥置于预冷的研钵中研磨,以研钵10 mmol·L-1pH 7.0 的HEPES 为提取缓冲液,研制成10%的匀浆然后将匀浆转入到离心管中于高速台式离心机(Beckman,型号:Allegram64R)以1 000 g(Rotor:F1010)离心15 min去掉碎片。上清液以15 000 g(Rotor:F1010)的离心力离心60 min得到线粒体膜蛋白,所得到的这些蛋白融于100 mmol·L-1pH 6.5的DMG中,此时的溶液为线粒体膜结合态PLD酶液。
2.2 磷脂酶D活性的测定
磷脂酶D活性的测定用酶联免疫法[17],在离心管中配制200 μL的反应体系,其中100 mmol·L-1DMG(pH 6.5),10 mmol·L-1MgCl2, 0.1 mmol·L-1CaCl2, 5 mmol·L-1亚油酸,20 μL酶液以及12 mmol·L-1PC(最后加入)。反应体系于30℃水浴中反应30 min,然后在沸水浴终中中止反应15 min。冷却后加入显色液800 μL,在30℃水浴中反应60 min,待颜色稳定后加入脱蛋白液,摇匀,用0.22 μm孔径的滤膜滤去杂蛋白,最后于紫外可见分光光度计(Agilent,型号:G1115A)中500 nm处测OD值。
2.3 线粒体膜结合态Ca2+含量的测定
线粒体膜的提取方法同2.1。膜结合态Ca2+含量的测定根据赵宇瑛的方法并略作修改[18],得到的线粒体膜沉淀用悬浮液(0.125 mol·L-1蔗糖,1 mmol·L-1Tris-Mes(pH7.2),6 mmol·L-1β-巯基乙醇)悬浮,随后加入HCl使其终浓度为0.2 mol·L-1。将混合液震荡摇匀后,在15 000 g的作用下离心30 min,所得的上清液用原子吸收分光光度仪检测Ca2+含量。
2.4 H2O2含量的测定
H2O2含量的测定采用Prochazkova D的方法略作修改[19],称取0.2 g高山离子芥叶,添加2 mL0.1%预冷的三氯乙酸研磨成原浆,在12 000 g离心力下离心20 min,然后将上清液1 mL与等体积的磷酸缓冲液(10 mmol·L-1,pH 7.0)及1 mol·L-1KI混匀,于390 nm测吸光值,结果以μmol·L-1(FW)表示。
2.5 数据分析
本试验数据利用SPSS 17.0对组内随时间变化的差异性进行多重比较,采用LSD法分析,利用origin pro9.0软件作图。
3 结果分析
3.1 H2O2对高山离子芥叶中线粒体膜结合态PLD活性的的影响
为了说明H2O2对线粒体膜结合态PLD活性产生的影响,在正常培养条件下用不同浓度H2O2处理高山离子芥,结果如图1所示。3个浓度H2O2处理后,PLD活性均表现出较对照组升高,但各浓度H2O2处理下PLD活性在0~72 h过程中变化规律不一致。H2O2对PLD活性的影响在0~72 h的过程中表现出低浓度H2O2对PLD活性的诱导作用高于高浓度;并且在72 h时,3个浓度处理下PLD活性均达到最大值,分别高出对照组290.0%,163.4%和102.7%。
3.2 低温胁迫对高山离子芥叶中H2O2含量的影响
在4℃,0℃和-4℃条件下处理高山离子芥72 h后,其叶中H2O2含量如图2所示。在3个温度胁迫下H2O2含量在0~6 h过程中增加随后在0℃和-4℃处理组中H2O2含量降低直到72 h。而在4℃的处理组中H2O2含量持续增加直到72 h且在该温度下72 h时H2O2含量达到最大值,此时H2O2含量较空白对照组上升了134.4%。在0℃和-4℃条件下处理6 h时两者H2O2含量达到最大值,且分别较空白对照组上升了112.4%和184.2%。在整个胁迫过程中,3个温度处理下H2O2含量均高于对照组。

图1 H2O2对高山离子芥叶中线粒体膜结合态PLD活性的影响
Fig.1 The effect of H2O2on the activity of mitochondrial membrane bound-PLD in chorispora bungeana leaves
注:图中不同的小写字母表示同一浓度处理不同时间上差异显著(P<0.05);不同的大写字母表示同一处理时间不同浓度上差异显著(P<0.05),下同
Note: Different lowercase letters indicate significant difference at different treatment time of the same concentration, different uppercase letters indicate significant difference under different concentration at the same treatment time at the 0.05 level. The same below

图2 低温胁迫下高山离子芥叶中H2O2含量的变化
Fig.2 The change of H2O2content in leaves of chorispora bungeana under low temperature
3.3 低温胁迫对高山离子芥叶中线粒体膜结合态PLD活性的影响
在4℃,0℃和-4℃条件下处理高山离子芥72 h后叶,中线粒体膜结合态PLD活性变化如图3所示。在3个温度作用下PLD活性均表现出较空白对照组升高,在4℃胁迫下PLD活性持续增加;在0℃和-4℃胁迫下PLD活性在0~6 h过程中增加随后降低。在4℃胁迫下72 h时PLD活性达到最大值,此时相对于空白对照组上升190.6%。在0℃和-4℃处理组中6 h时PLD活性达到最大值,此时相对于空白对照组分别上升了182.5%和145.4%。

图3 低温胁迫下高山离子芥叶中线粒体膜结合态PLD活性的变化
Fig.3 The change of mitochondrial membrane bound phospholipase D in leaves of chorispora bungeana under low temperature
3.4 低温胁迫下DPI处理对高山离子芥叶中线粒体膜结合态PLD活性的影响
DPI是NADPH氧化酶的抑制剂。在4℃,0℃和-4℃胁迫下,添加12.5 μmol·L-1DPI处理高山离子芥后线粒体膜结合态PLD活性变化如图4所示。在4℃胁迫下,对照组中PLD活性持续增加,到72 h时PLD活性达到最大值,此时较空白对照组PLD活性上升了190.6%。添加DPI处理后在6~72 h过程中,PLD活性均较对照组降低。在24 h时添加DPI处理的PLD活性与其他时间点相比较对照组PLD活性下降最低,此时较对照组PLD下降17.4%。在0℃和-4℃胁迫下对照组中PLD活性在0~6 h过程中升高,在6 h时两者PLD活性均达到最大值,与空白对照组相比分别升高了196.5%和145.4%。添加DPI处理后在6~72 h过程中,PLD活性较对照组中PLD活性低。在0℃和-4℃胁迫下72 h时添加DPI处理的PLD活性与其他时间点相比较对照组PLD活性下降最低,此时相对于对照组PLD活性分别下降15.1%和21.0%。

图4 低温胁迫下DPI对高山离子芥叶中线粒体膜结合态PLD活性的影响
Fig.4 The effect of DPI on the activity of mitochondrial membrane bound PLD in leaves of chorispora bungeana under low temperature
3.5 低温胁迫下DPI处理对高山离子芥叶中线粒体膜结合态Ca2+含量的影响
在4℃,0℃和-4℃胁迫下,添加12.5 μmol·L-1DPI处理高山离子芥后线粒体膜结合态Ca2+含量变化如图5所示。在4℃胁迫下对照组中线粒体膜结合态Ca2+含量持续降低,到72 h时Ca2+含量达到最低值,此时与空白对照组相比Ca2+含量下降了77%。添加DPI处理后在6~72 h过程中,线粒体膜结合态Ca2+含量较对照组中Ca2+含量升高。在6 h时DPI处理组中Ca2+含量与其他时间点相比较对照组中Ca2+含量升高最低,此时相对于对照组中Ca2+含量升高23.07%。在0℃和-4℃条件下对照组中Ca2+含量在0~6 h过程中降低随后升高,在6 h时两者Ca2+含量均达到最低值,与空白对照组相比分别降低了49.9%和33.1%。添加DPI处理后在6~72 h过程中,Ca2+含量较对照组中Ca2+含量升高。在0℃和-4℃胁迫下72 h时DPI处理组中Ca2+含量与其他时间点相比较对照组中Ca2+含量升高最低,此时相对于对照组中Ca2+含量升高18.4%和8.7%。

图5 低温胁迫下DPI对高山离子芥叶中线粒体膜结合态Ca2+含量的影响
Fig.5 The effect of DPI on the activity of mitochondrial membrane boundCa2+content in leaves of chorispora bungeana under low temperature
3.6 低温胁迫下DPI+CaCl2处理对高山离子芥叶中线粒体膜结合态PLD活性的影响
在4℃,0℃和-4℃胁迫下添加12.5 μmol·L-1DPI+10 mmol·L-1CaCl2处理高山离子芥后, 线粒体膜结合态PLD活性变化如图6所示。在4℃条件下DPI处理组中,PLD活性在6~72 h过程中持续增加,到72 h时PLD活性达到最大值,此时与0 h 处理组相比活性上升了125.2%;添加CaCl2处理后在6~72 h过程中PLD活性均较DPI处理组增加且在6 h时PLD活性相对于DPI处理组中PLD活性上升最低,此时与DPI处理组中PLD活性相比上升14.2%。在0℃和-4℃胁迫下0~6 h过程中DPI处理组PLD活性增加;在6 h时PLD活性达到最大值分别高出空白对照组98.9%和36.9%。添加CaCl2处理后两者在6~72 h过程中PLD活性均增加且均高于DPI处理组中PLD活性。

图6 低温胁迫下DPI+CaCl2对高山离子芥叶中线粒体膜结合态PLD活性的影响
Fig.6 The effect of DPI+CaCl2on the activity of mitochondrial membrane bound-PLD in leaves of chorispora bungeana under low temperature
3.7 低温胁迫下EGTA处理对高山离子芥叶中线粒体膜结合态PLD活性的影响
在4℃,0℃和-4℃胁迫下用5 mmol·L-1EGTA处理高山离子芥后线粒体膜结合态PLD活性变化如图7所示。在4℃胁迫下对照组中 PLD活性持续增加且在72 h时活性达到最大值,此时相对于空白对照组PLD活性上升了335.7%。添加EGTA处理后PLD活性较对照组PLD活性在6~72 h过程中降低且在48 h时EGTA处理组中PLD活性与其他时间点相比下降最小,此时相对于对照组PLD活性下降了28.4%。在0℃胁迫下对照组PLD活性在0~6 h过程中增加随后降低,在6 h时活性达到了最大值,与空白对照组相比PLD活性上升了72.5%。加入EGTA处理后在6~72 h过程中,PLD活性均低于对照组且在72 h时EGTA处理组中PLD活性与其他时间点相比下降最小,此时相对于对照组PLD下降了18.2%。在-4℃胁迫下对照组中PLD活性在0~24 h过程中持续增加随后降低,在24 h时PLD活性达到最大值,此时与对照组相比上升了156.5%。加入EGTA处理后在6~72 h过程中PLD活性均低于对照组,且在6 h时EGTA处理组中PLD活性与其他时间点相比下降最小,此时相对于对照组PLD下降了19.8%。

图7 低温胁迫下EGTA对高山离子芥叶中线粒体膜结合态PLD活性的影响
Fig.7 The effect of EGTA on the mitochondrial membrane bound-PLD in leaves of chorispora bungeana under low temperature
4 讨论与结论
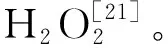
有研究发现ROS对Ca2+有调控作用,例如动物中ROS能增加神经细胞胞浆中Ca2+含量[25],氧化胁迫能诱导胞内Ca2+含量上升[26]并且对质膜Ca2+通道也发挥着重要作用[27]。H2O2能激活多种Ca2+通道并促使胞内Ca2+水平升高[28];有学者认为ROS是Ca2+信号转导的上游调节因子[29]。在本研究中,当用DPI处理高山离子芥后,其线粒体膜结合态Ca2+含量高于对照组(图5),表明ROS促进了线粒体膜结合态Ca2+的释放。PLD活性受Ca2+调控,但是调控PLD活性的Ca2+往往只需要微量级[30]。当添加DPI后,PLD活性低于对照组(图4),而该条件下线粒体膜结合态Ca2+含量却高于对照组(图5),说明ROS对线粒体膜结合态PLD活性的调控是通过钙离子介导。赵宇瑛在研究机械损伤对黄瓜的作用时得到类似的结论[18]。本研究中DPI+CaCl2处理高山离子芥后,PLD活性高于DPI处理组(图6),并且当用Ca2+螯合剂EGTA处理高山离子芥后,其PLD活性又降低(图7),这就进一步说明ROS对PLD活性的调控与Ca2+有关。但是由于胞质Ca2+的来源复杂,难确定低温胁迫下哪些途径的Ca2+参与了ROS对线粒体膜结合态PLD活性的调控。因此在后续研究Ca2+参与的信号转导事件中弄清楚Ca2+的来源更有助于研究植物细胞中Ca2+参与的信号转导机制。
以上结果表明在高山离子芥叶中低温胁迫引发的内源性ROS通过Ca2+对线粒体膜结合态PLD活性进行调控。

