影响慢乙型肝炎初治抗病毒HBeAg阴转的因素分析
丁道海,王巧合,胡 鹏
(1.重庆医科大学附属第二医院感染科 400010;2.重庆市两江新区第一人民医院消化科 4011477)
影响慢乙型肝炎初治抗病毒HBeAg阴转的因素分析
丁道海1,2,王巧合1,胡 鹏1
(1.重庆医科大学附属第二医院感染科 400010;2.重庆市两江新区第一人民医院消化科 4011477)
目的 探索影响慢性乙型肝炎(CHB)初治患者单药长期抗病毒治疗HBeAg血清学阴转的相关因素。方法 收集使用单药初治抗病毒2年以上的HBeAg阳性CHB患者的临床资料,回顾性分析其基线特征及治疗期间的生物化学、病毒学指标与HBeAg阴转的相关性。结果 92例患者纳入研究,HBeAg阴转组(n=37)与未阴转组(n=55)相比,基线总胆红素(TBIL)水平较高(P=0.018),天门冬氨酸氨基转移酶-血小板比率指数(APRI)评分较高(P=0.024),第24周的HBV DNA转阴率较高(P=0.001)。Logistic回归分析提示基线APRI评分(OR=1.398,95%CI:1.034~1.889,P=0.029)及第24周HBV DNA水平(OR=0.727,95%CI:0.532~0.991,P=0.044)是HBeAg阴转的独立影响因子。结论 对于基线APRI评分及TBIL水平较高的HBeAg阳性CHB患者,可获得高的HBeAg阴转率,建议在24周后HBV DNA未阴转考虑换用抗病毒方案。
肝炎,乙型,慢性;肝炎e抗原,乙型;抗病毒药;初治
乙型肝炎病毒(hepatitis B virus,HBV)感染及其相关疾病是一项严峻的全球医疗卫生和经济负担。乙型肝炎e抗原(hepatitis B virus e antigen,HBeAg)是HBV感染和复制的标志之一,国内外有关指南明确将HBeAg血清学转换作为HBeAg阳性慢性乙型肝炎(chionic viral hepatitis B,CHB)患者抗病毒治疗的终点之一[1-2]。HBeAg可用于评估CHB患者病情,还能够预测抗病毒疗效及临床结局[3-4]。在HBeAg阳性的CHB患者抗病毒治疗中,基线特征及早期血清学指标可预测HBeAg转换情况已被广泛证明[5-7]。大部分CHB患者经口服抗病毒治疗可取得较好的生物化学、病毒学应答及一定的HBeAg血清学转换,但在现实观察中常发现,在获得血清生物化学指标复常和HBV DNA不可检测后,仍有部分患者始终无法获得HBeAg阴转,且原因不明。
1 资料与方法
1.1 一般资料 收集2004年8月至2014年8月于本院感染科门诊及临床药理中心使用单种口服药物[替比夫定(LTD)600 mg或恩替卡韦(ETV)0.5 mg,1次/d]初次抗病毒治疗的HBeAg阳性CHB患者临床资料。纳入标准:符合《慢性乙型肝炎防治指南(2015版)》诊断标准;丙氨酸氨基转移酶(ALT)>2倍正常值上限(upper limit of normal,ULN)40 IU/L,HBV-DNA>1×105拷贝/mL;抗病毒治疗超2年(104周)。排除标准:2年内抗病毒药加量或联合用药或换药;合并其他肝炎病毒如丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)或艾滋病病毒(HIV)等感染及其他肝病如药物性肝损伤、酒精性肝病、自身免疫性肝病、肝癌等。患者单药治疗超过2年后加量、换药、联合用药即终止观察。最终纳入92例,其中男49例,女43例。年龄15~58岁,平均(30.9±8.6)岁,BMI 30.4~17.5 kg/m2,平均(22.2±2.8)kg/m2,随访时间108~520周,平均(217±86)周。阴转组37例,未阴转组55例。使用LDT的35例,使用ETV的57例,见表1。
1.2 方法 将纳入对象分为阴转组和未阴转组,回顾性分析两组患者的基本特征情况(性别、年龄、BMI、用药)和治疗过程中基线(0周)及第12、24、52、104、156、208周的生物化学指标、HBV DNA,APRI评分、病毒学突破、ALT反弹与HBeAg阴转的相关性。

表1 阴转组和未阴转组的基线特征比较
γ-GGT:谷氨酰转肽酶;ALB:清蛋白;TBIL:总胆红素;APRI评分:天门冬氨酸氨基转移酶-血小板指数评分;a:Log10
1.3 评估标准 HBeAg阴转指HBeAg由阳性转为阴性,无论HBeAb是否出现。HBV DNA转阴指经抗病毒治疗后HBV DNA<1.0×103拷贝/mL或低于检测下限。病毒学突破指在持续同种方案抗病毒治疗过程中,HBV DNA转阴后又转为阳性,或血清HBV DNA水平较最低点上升大于Log10拷贝/mL,且须经间隔1个月连续2次检测证实。ALT复常指在持续抗病毒治疗期间ALT由高于正常值上限转为低于正常值上限,ALT反弹指获得血清ALT水平复常后,ALT又升高超过正常值上限。APRI评分=天门冬氨酸氨基转移酶相对其正常上限值的倍数×100/血小板。
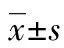
2 结 果
2.1 基线特征与HBeAg阴转的相关性 阴转组与未阴转组相比,性别构成比差异无统计学意义(P=0.902)。阴转组TBIL水平及APRI评分较未阴转组高,差异有统计学意义(P=0.018、0.024),而ALT、γ-GGT、ALB水平及年龄也相对较高,但差异无统计学意义(P=0.092、0.219、0.665、0.228)。相反,阴转组的基线BMI及HBV DNA水平则较未阴转组较低,但差异无统计学意义(P=0.200、0.747),见表1。多因素二元Logistic回归分析显示,基线APRI、24周HBV DNA评分(OR=1.398,95%CI:1.034~1.889,P=0.029)是HBeAg阴转的独立影响因子,见表2。

表2 基线及治疗过程中影响HBeAg阴转因素的单因素和多因素Logistic回归分析
a:Log10

表3 HBeAg阴转和未阴转组的抗病毒疗效比较
a:P=0.001
2.2 抗病毒疗效与HBeAg阴转的相关性 治疗24周时阴转组的HBV DNA阴转率明显高于未阴转组(54.1%vs. 21.8%),差异有统计学意义(χ2=10.72,P=0.001)。多因素二元Logistic回归分析显示,24周HBV DNA水平(OR=0.727,95%CI=0.532~0.991,P=0.044)是HBeAg阴转的独立影响因子,见表2。阴转组在其余时间点的HBV-DNA阴转率也均高于未阴转组,但差异无统计学意义(P>0.05)。两组患者的ALT复常率相似,差异无统计学意义(P>0.05)。阴转组在病毒学突破率及ALT反弹率均较未阴转组稍低,但差异均无统计学意义(P>0.05),见表3。
3 讨 论
目前多部指南建议HBeAg血清学转换可作为HBeAg阳性CHB患者的停药指针之一[1-2,8],而HBeAg的血清学转换与很多因素有关。既往大量研究报道基线ALT水平与血清学HBeAg阴转率/转换率相关,且基线ALT水平可联合24周HBV DNA水平预测后期HBeAg血清转换率[7,9]。在ALT水平高时抗病毒治疗可取得较好的HBeAg血清学转换,因ALT水平间接反映了机体免疫应答强弱,而免疫应答是清除HBeAg的关键。本研究分析结果提示基线ALT水平在阴转组与未阴转组之间差异无统计学意义,这说明对于初治单药抗病毒治疗的HBeAg阳性CHB患者,基线ALT水平对HBeAg的长期血清学阴转无显著影响。
HBV DNA是乙型肝炎病毒存在及复制的直接证据,HBV DNA C区编码HBeAg, HBV DNA阴转通常同时伴随HBeAg阴转。在CHB患者抗病毒治疗中,HBV DNA基线水平及治疗过程中的动态变化对预测抗病毒疗效及临床结局的重要意义已被广泛报道[7,10]。本研究显示在初治单药抗病毒治疗的HBeAg阳性CHB患者中,24周时HBV DNA水平是HBeAg血清学转换的影响因子,和既往研究结果一致。而基线HBV DNA在HBeAg阴转组与未阴转中则未发现统计学差异,基线HBV DNA水平对HBeAg的长期转归无显著影响,这尚需更多深入的研究验证。
目前暂无TBIL与HBeAg血清学转换之间关系的相关报道。CHB患者高胆红素者体内存在氧化损伤-抗氧化损伤失衡,TBIL水平升高时氧化损伤程度加重[11]。推测TBIL水平高的患者一方面肝细胞受机体免疫损伤,另一方面肝细胞受氧化应激损伤,肝细胞损伤后HBV DNA被抗病毒药物抑制减少,而免疫反应同时使HBeAg被清除,多种因素共同导致HBeAg阴转。本研究发现基线TBIL水平在阴转组和未阴转组之间差异有统计学意义,基线TBIL水平高的更易发生HBeAg阴转。但TBIL具体是如何影响HBeAg血清学转归的,仍不得而知。
APRI评分是肝脏纤维化程度一种简易评判指标,APRI评分越高,纤维化程度越严重。本研究提示,HBeAg阴转组APRI评分明显高于未阴转组,APRI评分是HBeAg阴转的独立影响因子。有研究报道随着炎症活动度的升高,HBeAg的血清学转换率逐步升高(χ2=8.432,P=0.015)[12]。肝脏炎症越重,表明免疫应答越强,越有利于清除HBeAg。肝脏反复炎症发作及修复,纤维化程度也越来越重。结合本研究结果,可推测HBeAg阳性CHB者APRI评分高的可能更易导致HBeAg阴转,相反,APRI评分较低的则难以发生HBeAg阴转。
在CHB患者抗病毒治疗中,若能提前预知HBeAg是否阴转或阴转概率大小,在抗HBV治疗过程中建立早期预测指标,对后期疗效判断和优化治疗极为重要。可尽早选用适合患者的治疗药物及方案,避免长期使用单一治疗方案而又临床获益欠佳,从而取得较高的成本收益。结合本研究结果,在使用单药初治抗病毒治疗的HBeAg阳性CHB患者中,若基线APRI评分及TBIL较高者要想获得高HBeAg转阴率,建议在第24周HBV-DNA未转阴时应考虑换用抗病毒治疗方案。
[1]World Health Organization.Guidelines for the prevention,care and treatment of persons with chronic hepatitis B infection[C].Geneva:World Health Organization,2015.
[2]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015更新版)[J].中华肝脏病杂志,2015,23(12):888-905.
[3]Wang CT,Zhang YF,Sun BH,et al.Models for predicting hepatitis B e antigen seroconversion in response to interferon-alpha in chronic hepatitis B patients[J].World J Gastroenterol,2015,21(18):5668-5676.
[4]Hang X,Mao W,Liu X,et al.Predictive value of HBeAg levels in telbivudine-treated chronic hepatitis Bpatients[J].Chin J Hepatol,2014,22(4):305-306.
[5]Wang CC,Tseng KC,Peng CY,et al.Viral load and alanine aminotransferase correlate with serologic response in chronic hepatitis B patients treated with entecavir[J].J Gastroenterol Hepatol,2013,28(1):46-50.
[6]Yao CC,Lee CM,Hung CH,et al.Combining age and HBsAg level predicts post-treatment durability of nucleos tide analogue-induced HBeAg seroconversion[J].J Gastroenterol Hepatol,2015,30(5):918-924.
[7]Liu F,Zou F,Wang XW,et al.A model with combined viral and metabolic factors effectively predicts HBeAg status under long term entecavir therapy:a prospective cohort study[J].Virol J,2015,12:179.
[8]European Association for the Study of the Liver.EASL clinical practice guidelines:management of chronic hepatitis B virus infection[J].J Hepatol,2012,57(1):167-185.
[9]Lv GC,Ma WJ,Ying LJ,et al.Efficacy of telbivudine in HBeAg-positive chronic hepatitis B patients with high baseline ALT levels[J].World J Gastroenterol,2010,16(32):4095-4099.
[10]Zhu XF,Lu LX,Wang Y,et al.Effect and predictive elements for 52 weeks′ telbivudine treatment on naïve HBeAg positive chronic hepatitis B[J].Hepat Mon,2011,11(12):980-985.
[11]蔡森,王凯,韩利岩,等.慢性乙型肝炎高胆红素血症患者氧化损伤的研究[J].中华实验和临床病毒学杂志,2010,24(2):131-133.
[12]颜华东,蒋帆荣,祝成亮,等.肝脏病理学特征对聚乙二醇干扰素α治疗HBeAg阳性慢性乙型肝炎患者HBeAg血清学转换的影响[J].中华肝脏病杂志,2013,21(5):340-344.
丁道海(1989-),住院医师,硕士,主要从事乙型肝炎抗病毒治疗的临床转归研究。
10.3969/j.issn.1671-8348.2017.23.036
R512.6+2
B
1671-8348(2017)23-3279-03
2017-03-22
2017-04-25)
·经验交流·

