壳聚糖对油脂物质吸附性能和再生的研究
薛秀园 , 薛月圆
(1. 重庆市合川区环境监测站, 重庆合川401520 ;2. 吕梁学院化学化工系, 山西吕梁 033000)
壳聚糖对油脂物质吸附性能和再生的研究
薛秀园1, 薛月圆2
(1. 重庆市合川区环境监测站, 重庆合川401520 ;2. 吕梁学院化学化工系, 山西吕梁 033000)
本文利用壳聚糖优异的吸附性能,以粗提花生油为吸附对象,研究壳聚糖(CS)对油脂的吸附性能.结果表明,当壳聚糖用量为0.1g时,在45℃、pH=2、油脂含量为20mL的条件下,壳聚糖对油脂的吸附量最大,最佳吸附时间为2h.
壳聚糖;介质条件;油脂吸附量
目前, 油污染严重威胁着环境, 因而油污染问题日益被人们所重视[1-3]. 现有处理油污染的方法都有缺点, 如二次污染[4]、耗时长、对环境条件要求严格或效果不理想等.
壳聚糖(chitosan,简写为CTS)又称脱乙酰甲壳素, 化学名称为聚葡萄糖胺(1-4)-2-氨基-B-D葡萄糖, 是天然多糖中唯一大量存在的碱性氨基多糖[5]. 壳聚糖因天然无毒、环境友好、可生物降解、化学性质稳定等特点[6], 其在医药、食品、化工、化妆品、水处理、金属提取及回收、生化和生物医学工程等领域的应用研究取得了重大进展[3], 特别是作为絮凝剂和鳌合吸附剂, 在环保水处理方面应用广泛[7-10].
壳聚糖分子中含有羟基、乙酰氨基和氨基, 这决定了它具有特殊的吸附作用. 壳聚糖自身的氨基使其成为聚阳离子体, 与带负电的脂肪酸产生静电作用;溶胀后的壳聚糖大分子链充分舒展, 对脂肪发生包裹, 产生包裹作用;溶解或溶胀后的壳聚糖具有黏滞性, 可黏着油脂而对其产生黏滞作用. 在不同的环境条件下, 吸附油脂的机理不同, 壳聚糖表现出不同的脂肪吸附特征.
壳聚糖可以吸附其自身质量很多倍的油脂[11]. 壳聚糖处理油污的同时又能将其吸附的油脂进行回收利用, 这是一种解决油脂污染的较好的途径. 因此, 研究影响壳聚糖吸附油脂能力的因素, 目的是通过控制环境条件来实现对油污高效快速的处理. 本实验初步研究了壳聚糖对油脂的吸附和解吸附的条件, 为壳聚糖在油污处理中的应用提供参考.
1 材料与仪器
1.1 材料
壳聚糖(山海德贝海洋化工公司, 食品级, 米黄色粉末状固体, 80目, 脱乙酰度85%), 花生仁(用于粗提花生油), 沸石, 石油醚.
1.2 仪器
索氏提取仪, 蒸馏装置.
2 实验方法
2.1 花生油的制备
称取5g烘干粉碎后的花生仁, 装入滤纸筒内密封好, 放入索氏脂肪提取器内, 调整滤纸筒的高度, 使其在抽提管的位置略低于虹吸管的上弯头处. 向洁净干燥的烧瓶内加入65mL石油醚和几粒沸石, 连接好装置, 并接通冷凝水开始水浴加热, 回流提取2~3h. 当最后一次提取器中的石油醚虹吸到烧瓶中时, 停止加热. 冷却后, 将提取装置改成蒸馏装置, 用电加热套小心加热回收石油醚. 待温度计读数明显下降时停止加热, 烧瓶中的残留物为粗油脂. 待烧瓶中的油脂冷却后, 放置待用.
2.2 油脂吸附量的测定
采用Czechowska-Biskup等[12]的实验方法, 通过改变不同的介质条件, 测定壳聚糖对含油脂物质的吸附量, 确定其最佳吸附条件.
准确称取0.1 g样品于小烧杯中, 与20mL的花生油混合均匀, 加入pH为2.0的盐酸水溶液10 mL, 25℃下恒温搅拌2h后, 冷却至室温, 静置. 待上层的油层与下层物质分开后, 小心移取上层油层, 于120 ℃烘箱中烘干2 h, 取出, 冷却后称量. 消耗部分为被吸附量, 计算每克样品吸附油脂的质量. 脂肪吸附容量按下式计算.
式中, m1为所用油的质量, m2为游离油的质量, m3为样品的质量.
2.3 不同pH条件下壳聚糖对油脂的解吸附
取0.1g壳聚糖, 在pH=2时吸附花生油达到饱和状态, 弃去上层剩余油层后, 将下层物质烘干, 称重. 分别加入不同pH的硫酸溶液和NaOH溶液, 匀速搅拌1h, 静置. 将上层的油层与下层物质分开, 将下层剩余干物质称重, 计算脱油率. 计算公式为
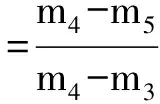
式中,m3为壳聚糖的初始质量,m4为吸油饱和的壳聚糖质量,m5为脱油后的壳聚糖质量.
3 结果与分析
3.1 pH对含油脂物质吸附性质的影响
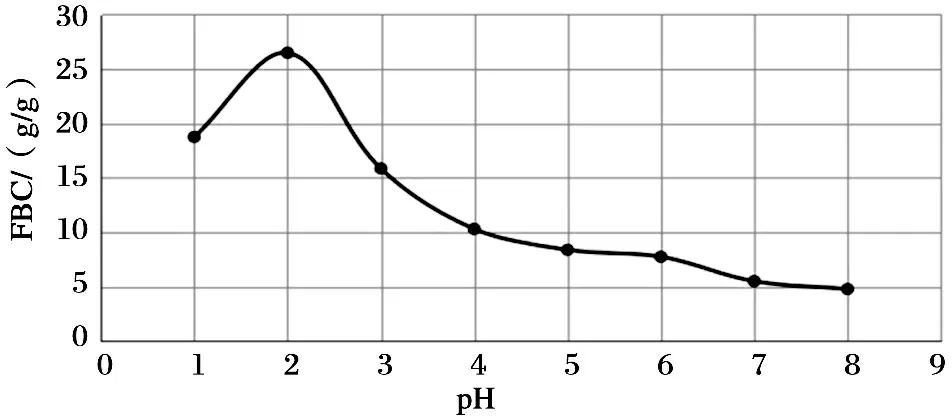
图1 壳聚糖的结构式
3.2 壳聚糖用量对含油脂物质吸附性质的影响
25℃条件下, 在20mL的花生油中分别加入0.05g、0.1g、0.15g、0.2g、0.25g的壳聚糖, 吸附结果如图2所示. 壳聚糖投入量较小时, 油脂吸附量较低, 随壳聚糖的增加, 吸附量也在增大, 且增速较快. 当壳聚糖用量为0.1g时, 其对油脂的吸附量最大. 随着壳聚糖投入量的增加, 吸附量又开始呈现下降趋势. 这是因为在油脂含量一定时, 所需要的壳聚糖的量是有限度的, 当壳聚糖用量为0.1g时, 油脂与壳聚糖的结合比例是最好的.
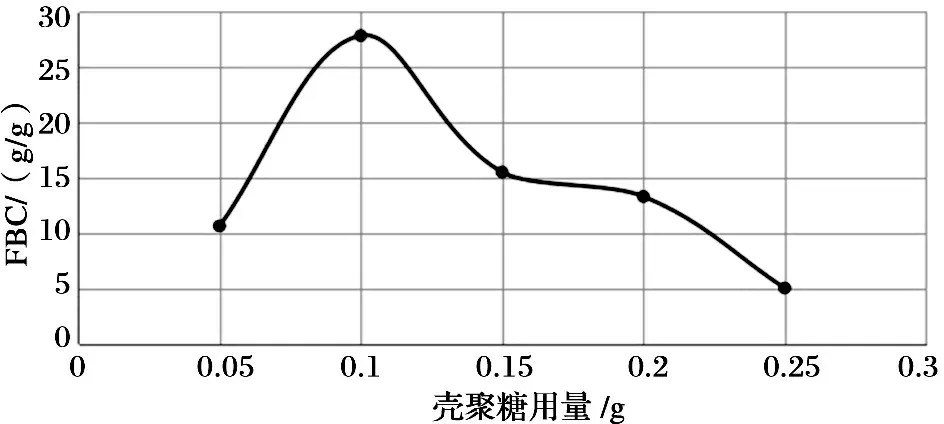
图2 壳聚糖分子内氢键
3.3 温度对含油脂物质吸附性质的影响
在温度分别为25℃、35℃、45℃、55℃、65℃的条件下, 在20mL的花生油中加入0.1g的壳聚糖, 吸附结果如图3所示. 壳聚糖的吸附量随温度的增加先增加后减少, 在45℃时吸附量达到最大值, 为28.3190g/g. 壳聚糖对油脂的吸附是一个动态过程, 温度升高会使得整个体系的热运动加快, 但是, 吸附反应一般又是放热反应, 温度升高不利于吸附. 对于壳聚糖, 45℃之前, 其吸附量随温度升高是持续增长的. 这主要是因为随着温度的增高, 油滴和壳聚糖粒子的布朗运动现象增强, 彼此之间相互碰撞的机会增加, 这样使得絮凝物相对来说较易形成, 油脂去除率上升. 当温度>45℃时, 壳聚糖对油脂的吸附量开始下降. 其原因可能是温度上升破坏了壳聚糖与油脂之间的作用力, 当温度升高到一定程度, 壳聚糖的晶体结构就会受到破坏, 由此带来壳聚糖内部结构的变化, 导致其吸附能力呈现下降的趋势. 这一点与前人的研究结果是一致的[13-14].
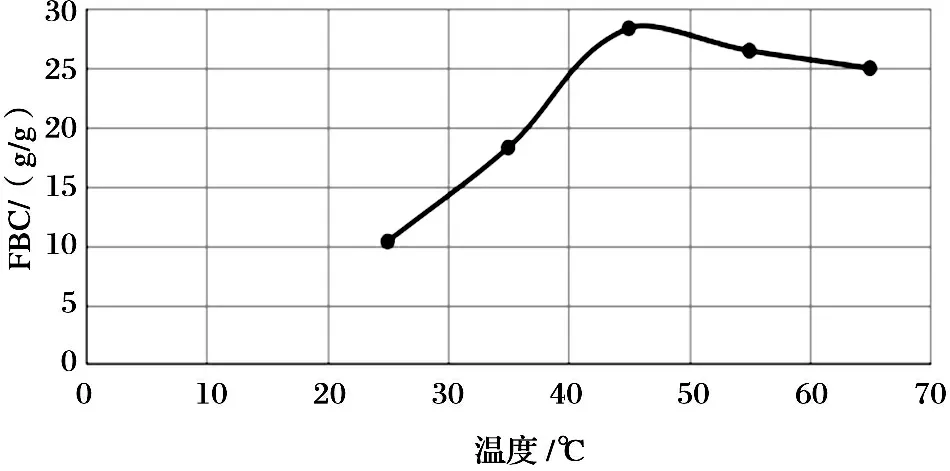
图3 壳聚糖分子间氢键
3.4 花生油用量对含油脂物质吸附性质的影响
壳聚糖0.1g, 温度25℃, 分别加入10mL、20mL、30mL、40mL、50mL的花生油, 吸附结果如图4所示. 在其他条件不变的情况下, 油脂用量为20mL时, 壳聚糖对油脂的吸附量达到最大值;油脂用量超过40mL后, 壳聚糖对油脂的吸附量呈下降趋势. 因为当油脂用量过大时, 油脂容易形成较大的液滴, 液滴之间趋向自我凝结的能力增加, 从而使得壳聚糖对油脂的吸附量下降.
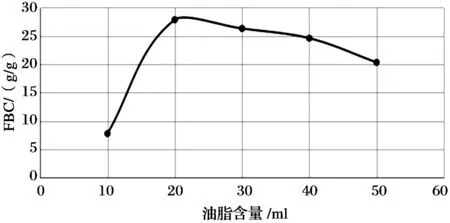
图4 花生油用量对油脂物质吸附的影响
3.5 吸附时间对含油脂物质吸附性质的影响
温度为25℃时, 在20mL的花生油中加入0.1g壳聚糖, 10mL的盐酸生理水溶液, 分别恒温搅拌0.5h、1h、1.5h、2h、2.5h后, 测定吸附量, 结果如图5所示. 在吸附的开始阶段, 因为吸附时间较短, 壳聚糖对油脂的吸附量还不能达到最大, 随着时间延长, 壳聚糖对油脂的吸附会有所增加, 而吸附2h后, 吸附量的增加趋于平缓. 这主要是由于壳聚糖是直链多糖, 相邻糖基上基团之间还可以形成氢键, 本身的相对分子质量又很大, 所以其发生溶解化的过程缓慢, 与溶剂分子之间产生溶剂化作用进而使大分子链舒展需要一定的时间, 随着壳聚糖和溶剂之间的溶剂化作用的进行, 大分子链能够有一定程度的舒展, 和脂肪的接触机会和作用面积大大增加, 尤其是适合形成离子化的基团数量快速增多, 因而对油脂的吸附能力增加很快, 使得油脂吸附量迅速提高;当吸附的时间足够长时, 壳聚糖能够充分地与溶剂进行溶剂化作用, -NH2完全离子化, 此时壳聚糖对脂肪的吸附作用很强, 对脂肪的吸附量达到很高的水平, 一旦壳聚糖上的—NH2完全离子化后, 再延长时间对脂肪吸附量的影响不大.
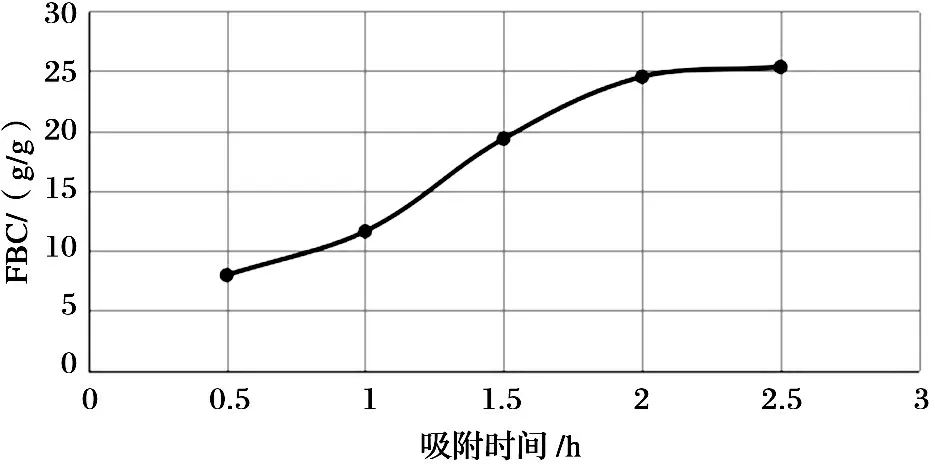
图5 吸附时间对含油脂物质吸附性质的影响
3.6 不同pH对壳聚糖脱油的影响
表1是在不同pH条件下壳聚糖的脱油率. 当壳聚糖吸附油脂达到饱和状态时, 通过改变溶液的pH值又能让油脂解吸附, 而且碱性条件解吸附能力比酸性条件要大.
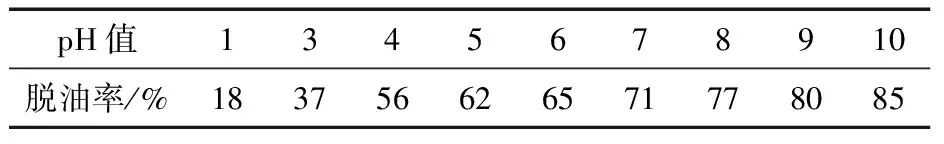
表1 不同pH对壳聚糖解吸附油脂的影响
4 结论
壳聚糖对含油脂物质的吸附能力的最佳吸附条件:当壳聚糖用量为0.1g时, 在45℃、pH=2、油脂含量为20mL的条件下, 壳聚糖对油脂的吸附量最大, 最佳吸附时间为2h.
[1] Venkateswarw Rao A,Nagaraja D.Hegde H H.Absorption and adsorption of organic liquids in elastic super hydrophobic silica aerogels[j].Journal of Colloid and Interface Science,2007,(305):124-132.
[2] 刘秀奇,张国.MgO/EPDM新型吸油材料的制备及其吸油性[J].功能材料, 2007(38):3363-3366.
[3] Abdel-Aziza A,Said Adrianeg G,Ludwick A,Heshimat A.Aglan.Usefulness of raw bagasse for oil absorption[J].Bioresource Technology,2008:1-4.
[4] 林宝凤,李术东,吕彦超等.壳聚糖复合吸附剂对油的吸附性能[J].化工环保,2009,29(5):458-462.
[5] Tharanathan R N,Kittur F S.Chitin-the undisputed biomolecule of grit potential[J].Food Science and Nutrition,2003,43(1):63-87.
[6] 李永明,于水利,唐玉霖.壳聚糖絮凝剂在水处理中的应用研究进展[J].水处理技术,2011,37(9):12-18.
[7] 董静,刘群.甲壳素/壳聚糖及其衍生物的最新应用进展[J]. 医学综述,2011, 17(6):921-922.
[8] 唐兰模,沈敦瑜,张萍等.用壳聚糖除去溶液中微量铬(Ⅵ)的研究[J].化学世界,2009,18(2):59.
[9] 李琼.壳聚糖对废水中Cu2+的吸附研究[J].水处理技术,2006,8(4):303.
[10] 陈世清. 甲壳素/壳聚糖在工业水处理中的应用 [J].工业水处理,1996,16(2):122-127.
[11] 蒋挺大. 壳聚糖[M]. 北京:化学工业出版社. 2003.
[12] Czechowska-Blskup R,Rokita B,Rosiak M.Radiation-induced and sonochemical degradation of chitosan as a way to increase its fat-binding capacity[J].Nuclear Instruments and Methods in Physics Research B,2005,236:383-390.
[13] 邓永华. 壳聚糖复合吸附剂吸附源水中有机物的研究[D]. 武汉:武汉大学. 2005.
[14] 侯玉梅,方波,关琛等.壳聚糖及其衍生物与脂肪相互作用的研究[J]. 食品与发酵工业,2006,32(9),61-63.
[责任编辑 王保玉]
The Study on Chitosan Adsorption and Regeneration of Fat
XUE Xiu-yuan1, XUE Yue-yuan2
(1. Environmental Monitor Station of Chongqing Hechuan, Chongqing 401520, China; 2. Department of Chemistry and Chemical Engineering, Lvliang University, Lvliang 033000, China)
Based on the Chitosan adsorption capacity, this research selects peanut oil as adsorption object to study the Chitosan (CS) adsorption of fat. When oil content is 20 mL, the results show that the Chitosan adsorption amount of fat (FBC) is the best under the condition of Chitosan dosage for 0.1 g, 45 ℃, hydrochloric acid solution pH=2. And the best adsorption time is 2 hours.
Chitosan; medium conditions; adsorption amount of fat
2017-02-08
薛秀园(1980—), 女, 山西吕梁人, 硕士研究生. 研究方向:环境保护.
薛月圆(1978—), 女, 山西吕梁人,硕士, 副教授. 研究方向:分析化学.
TQ647.3
A
1009-4970(2017)08-0018-04

