心肌梗死大鼠Angiopoietin2/tie2的动态表达及其与血管新生的关系
魏瑞鹏,郭凌宇,鲁燕,孙静,贾永平
心肌梗死大鼠Angiopoietin2/tie2的动态表达及其与血管新生的关系
魏瑞鹏1,郭凌宇1,鲁燕1,孙静1,贾永平1
目的 检测血管生成素2(Ang2)及其受体tie2在大鼠心肌梗死后的表达变化,探讨其与大鼠心肌梗死后血管新生的相关性。方法 健康清洁级雄性SD大鼠80只,随机分为假手术组和心肌梗死组(MI组),每组40只。通过结扎左冠状动脉前降支(LAD)建立心肌梗死模型,假手术组只穿线不结扎。分别于术后1 d、3 d、7 d、14 d及28 d五个时间点,每组随机取8只处死,留取大鼠血清、梗死区域及梗死周边区域心肌组织。酶联免疫吸附法(ELISA)检测血清中Ang2/tie2的表达,超声心动图评估大鼠心功能,免疫组织化学法观察心肌组织中Ang2及tie2的表达,CD105免疫组织化学法测定心肌梗死边缘区微血管数量并计算微血管密度(MVD)。结果 ①超声心动图结果示MI组大鼠左室舒张末期内径(LVIDd)较假手术组明显增大(P<0.01),而左室短轴缩短率(LVFS)及左心室射血分数(LVEF)明显降低(P<0.01);MI组术后14 d较术后3 d LVEF与LVFS均上升(P<0.05),LVIDd下降(P<0.05)。②ELISA检测结果示除术后1 d组外,其余各个时间点MI组血清Ang2与tie2的蛋白表达水平均高于假手术组(P<0.05)。MI组从术后1 d到术后28 d Ang2的表达依次升高,相对于术后1 d组,3 d、7 d、14 d、28 d组Ang2的表达均明显升高(P<0.01);与术后3d组相比,7 d组及14 d组Ang2的表达量虽有一定升高,但无统计学意义(P>0.05),28 d组Ang2的表达显著升高(P<0.05)。而tie2的表达在术后3 d组略上升,7 d组稍下降,相对于1 d组均无显著升高(P>0.05),在14 d及28 d时明显升高(P<0.01)。③免疫组化结果示假手术组大鼠心肌细胞可见Ang2与tie2在各个时间点均仅有少量表达;而MI组可见Ang2与tie2蛋白大量表达,阳性着色较假手术组明显加深,且随着时间的延长,Ang2的表达逐渐增多;tie2的表达在术后1 d、3 d、7 d时无明显变化,在术后14 d、28 d时明显增多。④各个时间点MI组大鼠MVD均较假手术组增加,差别均有统计学意义(P<0.05),MI组大鼠从术后1 d到术后7 d MVD逐渐增加,之后维持在同一水平。结论 Ang2/tie2在心肌梗死后表达上调,其表达水平与心肌梗死后边缘区新生血管数量呈正相关,提示Ang2/tie2可能促进心肌梗死后早期新生血管的形成。
心肌梗死;血管生成素2;血管新生
心肌梗死作为一种常见的缺血性心脏病,严重威胁着人类的健康。随着治疗方法的进步,目前,患者的死亡率已经明显降低,但仍有高达30%的患者不能得到有效治疗,迫切需要新的治疗策略,治疗性血管新生为这些患者提供了新的选择[1]。
血管生成素家族(Ang)是除血管内皮生长因子(VEGFs)外另一类在血管生成、维持组织稳态及病理性血管新生中发挥关键调节作用的因子,Ang几乎参与了血管生成的所有步骤和阶段。Ang家族中的Ang2作用于内皮细胞特异的受体tie2,触发血管新生。目前关于Angiopoietin2/ tie-2在血管新生方面的研究主要集中在抑制肿瘤血管新生方面,而在心肌梗死中的作用及机制方面的研究报道较少。
本研究通过建立心肌梗死大鼠模型,检测Angiopoietin2/tie2在心肌梗死后大鼠心肌中的表达变化,同时观察心肌梗死后梗死区周边微血管密度(MVD)的变化情况,初步明确其与血管新生的关系,为临床心肌梗死的治疗提供新的作用靶点。
1 材料与方法
1.1 实验动物及分组 健康清洁级雄性SD大鼠80只(由山西医科大学实验动物中心提供),体重(220±30)g。将80只健康清洁级雄性SD大鼠按简单完全随机分组法随机分为假手术组和心肌梗死组(MI组),每组40只。
1.2 主要试剂 Ang2、tie2的Elisa试剂盒(英国Abcam公司);多克隆兔抗大鼠Ang2、tie2、CD105抗体(北京博奥森生物技术有限公司);山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司)。
1.3 动物模型的建立 心肌梗死组(MI组):SD大鼠称体重后,以10%水合氯醛3 ml/kg腹腔内注射麻醉大鼠,动物呼吸机机械通气,频率60 次/min,吸呼比1:2,潮气量2 ml/100 g,沿胸骨左缘第3-4肋骨切开胸腔并暴露心脏,于肺动脉与左心耳之间冠状动脉走行处距肺动脉根部3 mm处以6-0无损伤缝合线结扎前降支,以结扎后大鼠心电图ST段明显抬高,结扎线以下心肌颜色变苍白、搏动减弱为标志制成心肌梗死模型。假手术组:只开胸穿线,不结扎血管。MI组和假手术组分别于术后1 d、3 d、7 d、14 d、28 d五个时间点,每组取8只处死,留取血清及心肌组织。
1.4 心功能检测 分别从假手术组和MI组随机抽取10只大鼠于术后3 d及14 d行超声心动图检查(山西医科大学中心实验室)。以10%水合氯醛对称重后的SD大鼠麻醉(0.3 ml/100 g,腹腔内注射),胸部备皮,仰卧固定。超声探头置胸前,在二维超声指导下用M型超声分别测定左室舒张末期内径(LVIDd)、左室短轴缩短率(LVFS)、左室射血分数(LVEF),连续测量3个心动周期数值,取其均值进行数据统计分析。1.5 ELISA法检测血清Ang2、tie2的表达 在各个时间点,麻醉后处死大鼠,采血,置于抗凝管后以3000 r/min离心10 min提取血清,保存于-80℃冰箱,待标本集齐后依照ELISA试剂盒说明书步骤分别测定Ang2、tie2的含量。
1.6 免疫组织化学法观察Ang2、tie2蛋白表达 ①石蜡切片脱蜡、水化;②将石蜡切片浸润于3% H2O2中15 min,灭除内源性过氧化物酶的活性,浸润于蒸馏水中3 min,PBS漂洗3次,每次3~5 min;③将切片置于EDTA缓冲液(pH 9.0)中修复,PBS洗3次,每次3~5 min;④擦干组织周围的液体,滴加一抗,于37℃孵育1 h,取出后复温0.5 h,用PBS漂洗3次,每次3~5 min;⑤吸干切片组织周围残余的PBS,滴加二抗,于37℃孵育20 min,PBS洗3次,每次3~5 min;⑥吸干切片组织周围残余的PBS,用现配的DAB显色,镜下观察至出现阳性反应终止;组织切片依次放入80%酒精(5 min)、90%酒精(5 min)、无水酒精(5 min)、无水酒精(10 min)、二甲苯1(10 min)、二甲苯Ⅱ(10 min)、二甲苯Ⅲ(10 min)。⑧滴加中性树脂,盖上盖玻片,镜下观察Ang2、tie2表达情况。
1.7 心肌梗死边缘区微血管密度测定 CD105是一种内皮细胞表达的糖蛋白,仅表达于新生的血管内皮细胞,是新生血管的标志。以Image pro-plus 6.0软件分析微血管密度,在40倍显微镜下观察全部视野,选取5个血管丰富的视野,于200倍镜下计数视野内微血管个数并取平均值,定义为微血管密度(MVD)。
1.8 统计学分析 应用SPSS 19.0统计软件进行统计分析及图表绘制。实验数据资料采用均数±标准差(x±s)的形式表示。两组均数间差异检验采用小样本t检验;多组间比较采用多个样本方差分析检验;两指标间相关性分析采用Pearson检验;检验水准以P<0.05为有统计学意义。
2 结果
2.1 术后3 d及14 d假手术组和MI组大鼠超声结果比较 假手术组大鼠室壁运动协调,而心肌梗死组大鼠左心室壁运动减弱或消失。与同一时间点假手术组相比,MI组左室舒张末期内径(LVIDd)扩大(P<0.01),左室短轴缩短率(LVFS)减小(P<0.01),且左心室射血分数(LVEF)下降(P<0.01),差异均有统计学意义。较术后3 d,MI组术后14 d 时LVEF与LVFS均上升(P<0.05),而LVIDd下降(P<0.05),差异均具有统计学意义(表1)。
2.2 各组大鼠血清Ang2、tie2蛋白表达水平 除术后1 d组外,其余各时间点MI组血清Ang2与tie2的蛋白表达水平均高于假手术组(P<0.05)。随着时间的增加,MI组Ang2的表达逐渐升高,与术后1 d组相比,术后3 d、7 d、14 d、28 d组Ang2的表达均明显升高(P<0.01);与术后3d组相比,术后7 d组及14 d组Ang2的表达量虽有一定升高,但差异无统计学意义(P>0.05),28 d组Ang2的表达显著升高(P<0.05)。tie2的表达在术后3 d略升高,7 d稍下降,但相对于术后1 d均无明显变化(P>0.05),在14 d及28 d均明显升高,差异有统计学意义(P<0.01),(表2)。
2.3 Ang2、tie2免疫组化检测结果 如图1及图2所示,假手术组大鼠心肌中Ang2与tie2表达在各个时间点均较少。而MI组可见Ang2与tie2蛋白表达较假手术组明显增加,且随着时间延长,Ang2的表达逐渐增多;tie2的表达在术后1 d、3 d、7 d时无明显变化,在术后14 d、28 d时明显增多。
2.4 CD105免疫组化染色及微血管密度分析 如图3所示,假手术组可见少量散在CD105阳性的血管内皮细胞,MI组CD105阳性的血管内皮细胞在术后1 d(1.37±0.74)、3 d(5.50±1.60)、7 d(9.75±1.67)、14 d(11.50±2.45)及28 d(10.12±2.23)均明显高于同一时间点假手术组,差异均具有统计学意义(P<0.01),且从术后1 d到术后7 d,CD105的阳性血管内皮细胞数逐渐增加,之后维持在同一水平。
2.5 Ang2/tie2与血管新生的相关性分析 如图4所示,心肌梗死后Ang2的表达水平与微血管生成密度显著正相关(r=0.729,P<0.01),tie2的表达水平也与微血管密度呈正相关(r=0.590,P<0.01),提示:Ang2与tie2可能与新生血管的形成有关。
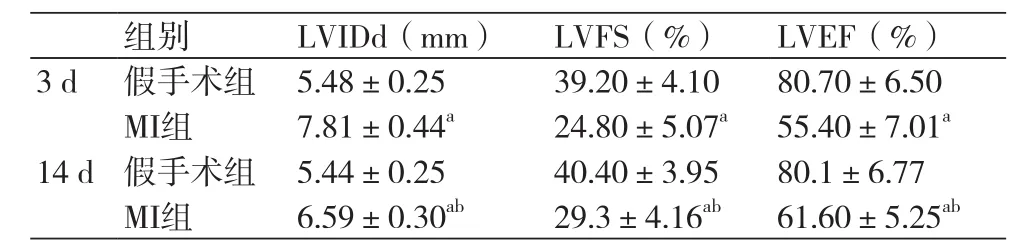
表1 术后3 d及14 d假手术组和MI组大鼠超声结果比较(x±s)
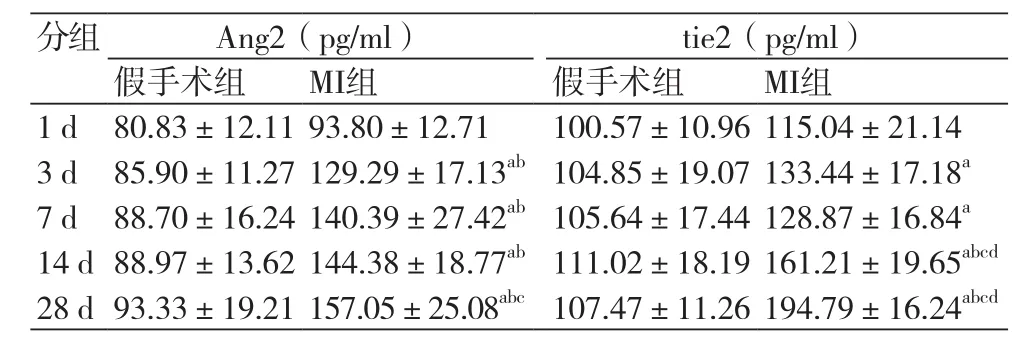
表2 各组大鼠血清Ang2、tie2的表达水平

图1 Ang2免疫组化染色(×400)
3 讨论
对心肌梗死患者早期及时行血运重建是临床上治疗心肌梗死的最重要的措施,但其对适用人群和治疗时间窗有严格限制,并且支架植入有一定的再狭窄率,因而具有一定的局限性。大量研究表明[2],尽管血运重建后冠状动脉血流恢复,但仍会观察到由心肌微循环障碍所引起的无复流现象,因此,我们需要寻求更加有效的治疗策略。治疗性血管新生是近年来治疗缺血性心脏病的新策略,其主要是通过应用促血管生长因子或干细胞移植等方法,诱发心肌缺血区小血管生长和侧支循环形成,可直接恢复心肌血供,具有非常重要的研究价值[3-5]。
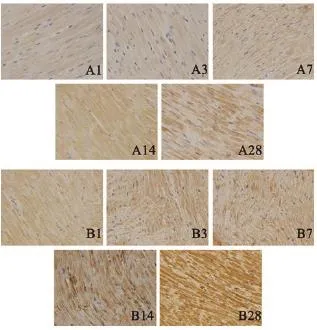
图2 tie2免疫组化染色(×400)
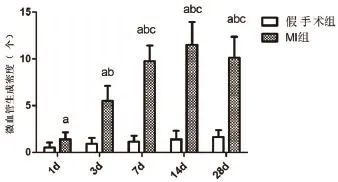
图3 假手术组、MI组在各个时间点的微血管生成密度
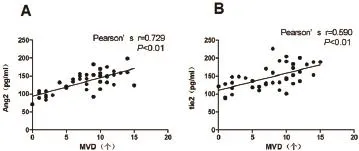
图4 Ang2与tie2表达水平与微血管密度相关性分析
研究表明,血管生成素(Ang2)在血管新生过程中起着非常重要的调节作用,Ang-2与血管内皮生长因子(VEGFs)协同作用,可促进原有血管出芽,启动血管新生,并且Ang1抑制VEGF诱导的血管渗漏,促进新生血管稳定和成熟[6,7]。近年来,关于Ang2在血管新生中的研究多集中在抗肿瘤血管新生方面,而对促进血管新生方面关注较少。已有研究发现,Ang2在肿瘤血管生成早期扮演至关重要的角色,Ang2可以通过与血管生成活化的内皮细胞中的整合素结合,诱导整合素衔接蛋白FAK的磷酸化,促进新生血管发生[8];也可以通过促使tie2表达的单核细胞或巨噬细胞(TEMs)向肿瘤组织聚集,并激活TEMs上的tie2受体,使其达增加,进一步促进血管生成[9,10]。目前,Ang2抗肿瘤血管生成的治疗策略已在多项研究得到证实[11-13],Leow等将一种抗Ang2的单克隆抗体MEDI3617应用于肿瘤组织导致肿瘤血管生成减少,抑制肿瘤生长[11],亦有研究通过敲除Ang2基因减少肿瘤的血管新生。然而,Ang2/tie2在心肌梗死后的微血管形成过程中所起的作用及其具体作用机制方面的研究较少,Lee等[14]研究发现,在急性冠脉综合征患者的血浆中Ang-2 、Tie-2表达水平显著增加,但心肌梗死后Ang-2的表达呈时相性变化,在基线和6周时较高,但在48 h和18周时较低。亦有研究发现,与健康人群相比急性心肌梗死患者中Ang-2水平增加[15,16]。因此,关于Ang2/tie2在心肌梗死中的作用及机制仍存在争议,有待进一步研究。
本研究通过结扎大鼠左冠状动脉前降支(LAD)建立心肌梗死模型,检测血清、心肌中Ang2/tie2的动态表达,观察大鼠心功能的变化及梗死后边缘区血管新生情况。结果发现,Ang2/ tie2在假手术组及MI组均有表达,且Ang2在MI组的表达随着时间的延长呈上升趋势,而tie2的表达在前7 d维持在同一水平,在术后14 d及28 d明显升高,这与Shyu等[17]的研究结果基本一致,说明心肌梗死后Ang2及其受体tie2在体内的表达调节是一个复杂的过程,其表达的这种时相性变化可能与其和Ang1、VEGF的相互作用有关。同时,本研究还发现,MI组术后14 d大鼠心功能较术后3 d有所恢复,分析其原因,可能与梗死周边区新生血管的生成有关。此外,通过分析我们发现,Ang2/tie2的表达水平与微血管密度呈正相关,尤其是在心肌梗死的早期,提示Ang2/tie2与心肌梗死后的血管新生相关,可能促进新生血管的生成。
综上所述,Ang2/tie2在心肌梗死后表达明显增加,并与新生血管的形成呈正相关,提示我们,Ang2/tie2可能促进心肌梗死后早期新生血管的形成,这为临床上心肌梗死的治疗提供了新的作用靶点。但本研究未完全排除其它血管生成因子的影响,对其具体作用机制也尚未阐明,仍需进行后续的临床和基础研究来进一步探讨解决。
[1] Ylä-Herttuala S,Bridges C,Katz MG,et al. Angiogenic gene therapy in cardiovascular diseases: dream or vision?[J]. Eur Heart J,2017:ehw547.
[2] Su Q,Nyi TS,Li L. Adenosine and verapamil for no-reflow during primary percutaneous coronary intervention in people with acute myocardial infarction[J]. Cochrane Database Syst Rev,2015,(5):CD009503.
[3] Robich MP,Chu LM,Oyamada S,et al. Myocardial therapeutic angiogenesis: a review of the state of development and future obstacles[J]. Expert Rev Cardiovasc Ther, 2011,9(11):1469-79.
[4] Mitsos S,Katsanos K,Koletsis E,et al. Therapeutic angiogenesis for myocardial ischemia revisited: basic biological concepts and focus on latest clinical trials[J]. Angiogenesis,2012,15(1):1-22.
[5] Henning RJ. Therapeutic angiogenesis: angiogenic growth factors for ischemic heart disease[J]. Future Cardiol,2016,12(5):585-99.
[6] Carmeliet P,Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature,2011,473(7347):298-307.
[7] Brudno Y,Ennett-Shepard AB,Chen RR,et al. Enhancing microvascular formation and vessel maturation through temporal control over multiple pro-angiogenic and pro-maturation factors[J]. Biomaterials,2013,34(36):9201-9.
[8] Felcht M,Luck R,Schering A,et al. Angiopoietin-2 differentially regulates angiogenesis through TIE2 and integrin signaling[J]. J Clin Invest,2012,122(6):1991-2005.
[9] Mazzieri R,Pucci F,Moi D,et al. Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells[J]. Cancer cell, 2011,19(4): 512-26.
[10] De Palma M,Naldini L. Angiopoietin-2 TIEs up macrophages in tumor angiogenesis[J]. Clin Cancer Res, 2011,17(16):5226-32.
[11] Leow CC,Coffman K,Inigo I,et al. MED13617, a human anti-Angiopoietin 2 monoclonal antibody, inhibits angiogenesis and tumor growth in human tumor xenograft models[J]. Int J Oncol,2012,40(5):1321.
[12] Zhang ZX,Zhou J,Zhang Y,et al. Knockdown of angiopoietin-2 suppresses metastasis in human pancreatic carcinoma by reduced matrix metalloproteinase-2[J]. Mol Biotechnol,2013,53(3):336-44.
[13] Eroglu Z,Stein CA,Pal SK. Targeting angiopoietin-2 signaling in cancer therapy[J]. Expert Opin Investig Drugs,2013,22(7):813-25.
[14] Lee KW,Lip GYH,Blann AD. Plasma angiopoietin-1, angiopoietin-2, angiopoietin receptor tie-2, and vascular endothelial growth factor levels in acute coronary syndromes[J]. Circulation,2004,110(16):2355-60.
[15] Iribarren C,Phelps BH,Darbinian JA,et al. Circulating angiopoietins-1 and-2, angiopoietin receptor Tie-2 and vascular endothelial growth factor-A as biomarkers of acute myocardial infarction: a prospective nested case-control study[J]. BMC Cardiovasc Disord,2011,11(1):1.
[16] Link A,Pöss J,Rbah R,et al. Circulating angiopoietins and cardiovascular mortality in cardiogenic shock[J]. Eur Heart J,2013, 34(22):1651-62.
[17] Shyu KG,Liang YJ,Chang H,et al. Enhanced expression of angiopoietin-2 and the Tie2 receptor but not angiopoietin-1 or the Tie1 receptor in a rat model of myocardial infarction[J]. J Biomed Sci, 2004,11(2):163-71.
本文编辑:李丹花,田国祥
Dynamic expression of Angiopoietin2/tie2 in rats with myocardial infarction and its relationship with angiogenesis
Wei Ruipeng*, Guo Lingyu, Lu Yan, Sun Jing, Jia Yongping.
*Department of Cardiology, The First Hospital of Shanxi Medical University, Taiyuan 030001, China.
Jia Yongping, E-mail: Jyp1022@126.com
Objective To investigate the expression of Angiopoietin2 (Ang2) and its receptor tie2 in the rat after myocardial infarction, and to explore its correlation with angiogenesis after MI in rats. Methods Eighty healthy male SD rats were randomly divided into sham-operation group (n=40) and MI group (n=40). MI model was established by occlusion of the left anterior descending artery, while the sham-operation group were braided of the left anterior descending artery without ligation. Eight rats in both groups were executed randomly at 1, 3, 7, 14, 28 days after model establishment. Meanwhile, serum and myocardial tissues were retained. Enzymelinked immuno sorbent assay (ELISA) was used to detect the serum expression of Ang2/tie2, the rat cardiac function was evaluated by echocardiography, the myocardial expression of Ang2, tie2 and CD105 were analyzed by immunohistochemical technique. Results ①Echocardiography showed the left ventricular internal diameter at end-diastol (LVIDd) in MI group was significantly higher than those in sham operation group (P<0.01), left ventricular fractional shortening (LVFS) and left ventricular ejection fraction (LVEF) were significantly lower than those in sham operation group (P<0.01); compared with the 3 d MI group, the LVEF and LVFS were increased (P<0.05), LVIDd decreased(P<0.05) in 14 d MI group. ② In addition to the 1 d MI group, the levels of serum Ang2 and tie2 in MI group were higher than those in the sham operation group (P<0.05) . The expression of Ang2 in MI group increased gradually over time; compared with the 1 d MI group, the expression of Ang2 increased significantly
Myocardial infarction; Angiopoietin2; Angiogenesis
R541.4
A
1674-4055(2017)08-0929-03
北京力生心血管健康基金会领航基金项目(LHJJ20144903)
1 030001 太原,山西省太原市山西医科大学第一医院心血管内科
贾永平,E-mail:Jyp1022@126.com
10.3969/j.issn.1674-4055.2017.08.09 in other MI groups(P<0.01). Compared with the 3 d MI group, though the expression level of Ang2 in 7 d and 14 d MI groups was increased, there was no statistical significance (P>0.05), the expression of Ang2 in 28 d MI group was significantly higher (P<0.05). However, the expression of tie2 increased slightly at 3 d after operation, decreased slightly at 7 d, and was not significantly higher than that of 1 d MI group (P>0.05), which was significantly higher in 14 d and 28 d MI group(P<0.01). ③The results of immunohistochemistry showed that Ang2 and tie2 were expressed slightly in sham operation group. The expression of Ang2 and tie2 protein in MI group was significantly higher than that in sham operation group, and the expression of Ang2 increased over time. The expression of tie2 did not change in 1 d, 3 d and 7 d MI groups, and increased significantly in 14 d and 28 d MI groups. ④The microvessel density(MVD) of MI group was significantly higher than that of sham operation group at different time points (P<0.05). The MVD increased gradually from 1d to 7 d after operation in MI group, and then maintained at the same level over time. Conclusion The expression of Ang2/tie2 was up-regulated after MI. The expression level of Ang2/tie2 was positively correlated with the number of neovascularization after MI, suggesting that Ang2/tie2 may promote the formation of neovascularization after MI.

