复合光催化膜MoS2/Ag/TiO2同步降解有机物及产氢的研究
王 熙, 董海太, 齐 中, 李晓岩, 李来胜*
(1.华南师范大学化学与环境学院, 广州 510006; 2.香港大学土木工程系,薄扶林道,香港)
复合光催化膜MoS2/Ag/TiO2同步降解有机物及产氢的研究
王 熙1, 董海太1, 齐 中1, 李晓岩2, 李来胜1*
(1.华南师范大学化学与环境学院, 广州 510006; 2.香港大学土木工程系,薄扶林道,香港)
以玻璃纤维膜为基底制备了具有三元结构的新型MoS2/Ag/TiO2光催化膜. 该复合催化膜具有多层结构,能够在模拟太阳光和紫外光下进行产氢反应. 该光催化膜可以用于新型的双室光催化反应器进行同步产氢与有机物降解. 在光催化过程中,氢气在反应器的阴极室产生,而有机物在阳极室进行降解生成二氧化碳. 当Ag负载质量百分数为1%、TiO2负载质量百分数为160%时,MoS2/Ag/TiO2复合催化膜的比产氢速率达到了最大值,在模拟太阳光下产氢速率为64mmol/(h·m2)(产二氧化碳速率为68mmol/(h·m2)),能量转化效率最高可达0.85%,是纯TiO2的2.3倍;在紫外光下产氢速率为68mmol/(h·m2),是纯TiO2的1.2倍. 在光照下TiO2和MoS2同时受光的激发产生光生电子与空穴,由于Ag功函数比TiO2的功函数低,电子从TiO2导带上转移至Ag再转移到MoS2价带上形成TiO2→Ag→MoS2的电子传递模式. 因此,MoS2/Ag/TiO2光催化膜能更有效地实现电子与空穴的分离,提高产氢效率.
MoS2/Ag/TiO2; 光催化; 产氢; 有机物降解
我国太阳能资源非常丰富,每平方米年辐照量超过5 000 MJ,三分之二的国土面积日照时数都在2 200 h以上,开发潜力巨大. 因此,用太阳能进行光分解水制氢具有重大的社会效益和经济效益,极具发展潜力. 目前利用太阳能的光催化制氢技术已得到国内外广泛关注[1]. 然而,可见光是太阳光谱中的主要部分,而常用的光催化剂如TiO2、ZnO 只能在紫外光下使用[2-3]. 目前只有少部分催化剂能够在可见光下进行光催化产氢[4].
近年来,MoS2作为一种新兴的可见光催化剂被广泛应用于复合催化剂的开发. MoS2与TiO2联用能够有效提高TiO2对可见光的响应范围[5-6]. MoS2/TiO2粉末催化剂能够有效地降解有机污染物如甲基橙[7]、四氯苯酚[8]和苯酚[9]等. 当2种或2种以上的催化剂形成具有一定微观结构的复合体系后,其光化学、光物理方面的性质都会发生很大的改变[10-13]. 因此,以MoS2为基础可以构建出具有可见光响应的催化剂用于光催化产氢和有机物降解. Z型复合光催化剂是一类非常有研究价值的复合光催化剂. Z型光催化系统通过2种光催化材料导带和价带的电位匹配,以纳米连接体实现体系的电荷平衡,使光催化降解和产氢得以连续进行[14]. 近年来,许多研究者开发了新型的以TiO2为基底的复合光催化剂,TiO2通过贵金属纳米连接体与窄带的光催化材料结合而成的全固态的三元复合Z型纳米颗粒光催化剂,该催化剂可更有效地利用2种光催化材料的性能[15-16]进行光催化反应. 该种全固态Z型光催化剂相较于传统Z型光催化体系具有如下优点:(1)不需要氧化还原电子对(如,Br2/Br-或Fe3+/Fe2+)的辅助;(2)提高导带的能级和产氢效率,同时降低禁带能级,提升催化剂的氧化性能[15-17].
本研究以环境友好的 MoS2为基础构建 MoS2/Ag/TiO2三元Z型光催化系统,以MoS2/Ag/TiO2作为光催化电极,将其应用于双室光催化反应器内进行光催化产氢及同步降解有机物.
1 研究方法
1.1 复合光催化膜的合成
1.1.1 MoS2的合成方法 以钼酸铵和硫化钠为原材料,通过如下反应制备硫化钼[18]:

2H2O+2H2S
具体操作如下:量取100 mL 1.0 mol/L HCl 溶液于烧杯中边搅拌边加热至90 ℃. 然后分别缓慢加入0.88 g (NH4)6Mo7O24·4H2O 和2.64 g Na2S·9H2O. 0.5 h后,边搅拌边加入0.7 g NH2OH·HCl并于90 ℃反应6 h. 在反应的加热过程中,深红色的前驱体逐渐变成黑色的MoS2. 最终产物在自然冷却至室温后取出,用去离子水洗去未反应的物质和反应副产物,能过高速离心收集最终产物MoS2,并在60 ℃下干燥12 h,得到的黑色固体粉末即为MoS2.
1.1.2 MoS2/Ag/TiO2膜的合成 MoS2/Ag/TiO2是将材料固定在玻璃纤维膜上,其结构如图1A所示. 先将膜剪裁成面积为7 cm2的圆形,再用Nafion溶液将催化剂固定在膜上,取50 mg MoS2粉未与100 μL 5%Nafion 溶液混合后涂抹在玻璃纤维膜上制成MoS2膜. 将MoS2膜置于图 1B的反应器中,在阳极室加入10%甲酸溶液及适量的AgNO3,使Ag相对于MoS2质量百分数由0.5%变化至2.5%. 反应器用N2吹扫1 h, 在室温下用300 W的Xe灯光照2 h, 通过光还原法将Ag负载至MoS2表面制成MoS2/Ag膜,用水和无水乙醇各洗涤3遍,于室温下干燥12 h. 最后,取适量的TiO2(Degussa, P-25)与5%Nafion 溶液混合并涂抹于MoS2/Ag膜上形成MoS2/Ag/TiO2三元复合膜,TiO2相对于MoS2质量百分数由1%变化至200%.

图1 光催化反应器和光催化膜的结构示意图
1.2 光催化反应器及产氢性能测试
该三合复合光催化膜的产氢性能在如图 1B所示的双室光催化反应器中进行, 并测试其在紫外光和模拟太阳光下的产氢性能. 催化剂膜MoS2/Ag/TiO2安放在反应器的中部并将反应器分隔成双室,负载有催化剂的一侧为阳极室并装有10%甲酸溶液作为光催化产氢的电子供体,无催化剂的一侧为阴极室装有pH1的0.2 mol/L Na2SO4的电解液. 300 W氙灯光源从阳极室一侧进行照射如图 1B所示. 每隔1 h从光催化反应器的阴极室与阳极室的气体取样口中分别采集气体样品,用气相色谱(GC-TCD)进行H2和CO2含量的定量分析. 光催化产氢性能分别在模拟太阳光(滤光片AM1.5,波长:305~1 500 nm,光功率58 mW/cm2)和紫外光(波长:190~400 nm,光功率30 mW/cm2)下进行测试,其产氢性能以比产氢速率和能量转化效率来衡量,其中比产氢速率定义为单位时间内单位质量催化剂所能转化的H2的量. 计算公式如下:

式中,RA为比产氢速率;ΔnH2为产生氢气的摩尔数;A为催化剂膜的有效面积;Δt为光催化反应时间.

式中,ΔHC为H2的热值(286 kJ/mol),I为入射光源的能量.
2 结果与讨论
2.1 材料的表征
2.1.1 MoS2颗粒的表征 该 MoS2颗粒的大小在230~400 nm之间,平均粒径为275 nm. 同时图 2的TEM照片显示该催化剂的一次颗粒在80 nm左右,同时也具有良好的结晶度. 图3是该材料的紫外可见漫反射图谱,由图可知MoS2的地吸收边为690 nm, 对应的禁带宽度为1.7 eV. 这也说明MoS2可以很好的吸收可见光,增加材料对可见光的利用.

图2 MoS2的TEM照片

图3 MoS2的紫外可见漫反射图谱
2.1.2 MoS2/Ag/TiO2膜的表征 图4为MoS2/Ag/TiO2的XRD图谱,该图谱的衍射峰与六方相MoS2的标准图谱一致(JCPDS 87-2416),该材料图谱中出现了MoS2的(002)、(100)、(103)、(110)等主要晶面的衍射峰,表明通过该方法成功制备出了MoS2[18]. 其中该晶体的(002)衍射峰尖锐而且强度较强,说明通过该方法制备的MoS2结晶程度较好. 同时该催化剂膜的XRD图中也显示出了很强的TiO2的(101)、(105)、(211)等主要晶面的衍射峰,表明该催化剂膜确实由MoS2和TiO2等2种主要材料构成. MoS2/TiO2、MoS2/Ag/TiO2显示和TiO2相类似的光致发光(PL)谱图(图5),纯TiO2的PL 强度要比MoS2/TiO2、MoS2/Ag/TiO2的要高,MoS2/Ag/TiO2的PL强度也低于MoS2/TiO2. 由此表明,相比纯TiO2和MoS2/TiO2,MoS2/Ag/TiO2的光生电子和空穴复合效率要弱,这说明MoS2/Ag/TiO2的内部存在着快速的光生载流子的迁移和分离[19].
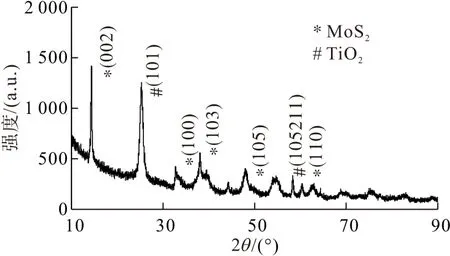
图4 MoS2/Ag/TiO2的XRD图谱

图5 TiO2、MoS2/TiO2、MoS2/Ag/TiO2的PL谱图
Figure 5 Photoluminescence spectra of TiO2,MoS2/TiO2and MoS2/Ag/TiO2
2.2 MoS2/Ag/TiO2光催化活性的影响
2.2.1 Ag负载量对MoS2/Ag/TiO2光催化活性的影响 与TiO2和MoS2/TiO2相比(图6),复合材料MoS2/Ag/TiO2光催化膜在紫外光和模拟太阳光下显示出了较高的光催化产氢活性. 当在阳极室以10%甲酸为电子供体时,MoS2/TiO2也能通过光催化产氢,而且优于TiO2. 这主要是由于MoS2的禁带宽度较小,其与TiO2复合增加可见光的吸收,同时PL图谱 (图5) 也显示与纯TiO2、MoS2/ TiO2相比,三元MoS2/Ag/TiO2光催化剂的光生电子和空穴复合降低能有效提高光催化产氢效率. 同时由结果可看出MoS2/ TiO2催化产氢过程中,氢气主要产生在阳极室(TiO2一侧),说明由于MoS2的导带能级高于TiO2的导带,在催化过程中电子可能跃迁到TiO2的导带进行催化还原反应. 但是随着Ag的加入,一方面降低光生电子与空穴的复合使复合催化剂膜的总产氢性能有了很明显的提高;另一方面加入Ag后电子跃迁的轨迹发生了变化,由MoS2→TiO2转化为Z型电子传递链TiO2→Ag→MoS2[15-16, 20],提高了阴极室的产氢量而减少了阳极室的产氢量.

图6 不同Ag负载量的MoS2/Ag/TiO2催化剂膜的产氢及产二氧化碳速率
Figure 6 Hydrogen and carbon dioxide production rates for the MoS2/Ag/TiO2catalyst films with different Ag loading ratios
2.2.2 TiO2负载量对MoS2/Ag/TiO2光催化活性的影响 与TiO2和MoS2/Ag相比(图7),复合材料MoS2/Ag/TiO2的光催化膜在紫外光和模拟太阳光下显示出了较高的光催化产氢活性. MoS2/Ag并不能通过光催化产氢,这主要是由于MoS2的禁带宽度较小,在该实验条件下无法驱动光催化产氢. 但是随着TiO2的加入,该复合催化剂膜的产氢性能有了很明显的提高,而且随着TiO2含量的增加,MoS2/Ag/TiO2复合催化膜的光催化活性逐渐增大,当TiO2的负载质量分数为160 % 的时候,比产氢速率达到了最大值,在模拟太阳光下产氢速率为64 mmol/(h·m2)(产二氧化碳速率为69 mmol/(h·m2)),能量转化较率最高可达0.85%,是纯TiO2的2.3倍;在紫外光下产氢速率为45 mmol/(h·m2),是纯TiO2的1.2倍. 产氢性能的提高主要有2个原因,一方面可能是窄带MoS2的引入增加了催化剂膜对可见光的吸收增加,这与紫外可见漫反射的谱图(图3)结果相吻合[18]. 图3为MoS2复合物的固体紫外-可见漫反射光谱图,由图可以看出二硫化钼的吸收边为690 nm, 对应的禁带宽度为1.7 eV. 说明二硫化钼可以很好地吸收可见光,增加材料对光的利用;另一方面,MoS2与TiO2通过与Ag的结合使光生电子与空穴得到有效分离,提高了对光子的利用效率,这与PL谱图(图5)观察结果相一致,相比纯TiO2,MoS2/Ag/TiO2其光生电子和空穴复合效率要弱,这说明MoS2/Ag/TiO2的内部存在着快速的光生载流子的迁移和分离[20].

图7 不同TiO2负载条件下MoS2/Ag/TiO2催化剂膜的产氢及产二氧化碳速率
Figure 7 Hydrogen and carbon dioxide production rates for the MoS2/Ag/TiO2catalyst films with different TiO2loading ratios
虽然TiO2负载在MoS2上能提高产氢活性,但当负载质量分数过多时(如200 %),其产氢活性反而降低,其活性下降的原因可能是由于TiO2负载量的增加使得 TiO2的不透明度及对光的分散性增强,从而使辐射光透过TiO2进入薄膜内部的量减少,因此过量的TiO2导致薄膜内部的MoS2不能被激发,影响催化剂膜对可见光的利用,阻碍了电子供体与光生空穴的反应,从而使催化剂活性降低[21].
此外,实验结果还显示纯TiO2和MoS2/Ag/TiO2在可见光下不能产氢;但是MoS2/Ag/TiO2催化剂膜在模拟太阳光下的产氢速度明显高于紫外光下的,这说明该MoS2/Ag/TiO2复合催化剂能够扩展催化剂对光谱的利用范围,对利用太阳能产氢有重要的意义.
2.3 MoS2/Ag/TiO2膜的催化机理探讨
2.2.1和2.2.2的结果显示复合 MoS2/Ag/TiO2膜在紫外和模拟太阳光下能够提高催化剂的产氢性能及有机物的降解率. 由于MoS2的禁带宽度较窄,其能被可见光激发,可以提高复合催化剂对太阳光的利用效率. MoS2通过Ag与TiO2的复合能够有效地减少电子与空穴的复合[22]. 当没有Ag时,MoS2/TiO2的作用机理如图8B所示,由于 MoS2的导带能级高于TiO2的导带,在催化过程中电子可能跃迁到TiO2的导带进行催化还原反应. 当Ag作为纳米连接体时,MoS2/Ag/TiO2的电子传递机理可由图8A表示:Ag作为纳米连接体可以使TiO2激发产生的电子通过Ag转移至MoS2的导带, 因此光生空穴保留在TiO2的价带上,能够有效地提高催化剂膜的氧化性能. 此外,如果TiO2的比例适当,保留在TiO2表面的空穴可以将阳极室的有机物降解,而传递至MoS2的空穴则可以在阴极室将H+还原为氢气. 产生这一现象的原因是由于在光照下TiO2和 MoS2同时受的光的激发产生光生电子与空穴,由于Ag功函数(4.62 eV)比TiO2的功函数(4.9~5.1 eV)[23]低,电子从TiO2导带上转移至Ag再转移到MoS2价带(0.23 eV)[24]上形成TiO2→Ag→MoS2的电子传递模式. 因此,MoS2/Ag/TiO2能更有效的实现电子与空穴的分离,提高催化剂的反应效率.

图8 光催化反应机理示意图
Figure 8 Proposed mechanism for the enhanced photocatalytic activity of MoS2/Ag/TiO2
3 结论
本研究采用水热法制备出了具有良好光催化产氢效果的MoS2/Ag/TiO2复合光催化剂,并对其进行了一系列表征,同时考察了其在不同实验条件下的产氢活性. 结果表明:
(1)MoS2/Ag/TiO2的XRD 图谱表明该晶体的(002)衍射峰尖锐而且强度较强,说明通过该方法制备的MoS2结晶程度较好. 同时该催化剂膜的XRD图中也显示出了很强的TiO2的(101)、(105)、(211)等主要晶面的衍射峰. TiO2、MoS2/TiO2、MoS2/Ag/TiO2的PL 光谱图表明:MoS2/TiO2、MoS2/Ag/TiO2和TiO2有相类似的光谱图,纯TiO2的PL 强度要比MoS2/TiO2、MoS2/Ag/TiO2的要高,MoS2/Ag/TiO2的PL强度也低于MoS2/TiO2. 由此表明,相比纯TiO2和MoS2/TiO2,MoS2/Ag/TiO2能有效地分离光生电子和空穴.
(2)当Ag负载质量分数为1%、TiO2负载质量分数为160%时,MoS2/Ag/TiO2复合催化膜的比产氢速率达到了最大值,在模拟太阳光下为产氢速率为64 mmol/(h·m2)(产二氧化碳速率为69 mmol/(h·m2)),能量转化较率最高可达0.85%,是纯TiO2的2.3倍;在紫外光下产氢速率为45 mmol/(h·m2),是纯TiO2的1.2倍.
(3)在光照下TiO2和 MoS2同时受到的光的激发产生光生电子与空穴,由于Ag功函数比TiO2的功函数低,电子从TiO2导带上转移到Ag再转移到MoS2价带上形成TiO2→Ag→MoS2的电子传递模式.因此,MoS2/Ag/TiO2能更有效的实现电子与空穴的分离,提高产氢的效率.
[1] MAEDA K,TERAMURA K,LU D L,et al. Photocatalyst releasing hydrogen from water-enhancing catalytic performance holds promise for hydrogen production by water splitting in sunlight[J]. Nature,2006,440:295.
[2] NADA A A,HAMED H A,BARAKAT M H,et al. Enhancement of photocatalytic hydrogen production rate using photosensitized TiO2/RuO2-MV2+[J]. International Journal Hydrogen Energy,2008,33:3264-3269.
[3] CUI W Q,FENG L R,XU C H,et al. Hydrogen production by photocatalytic decomposition of methanol gas on Pt/TiO2nano-film[J]. Catalysis Communication,2004,5:533-536.
[4] ANPO M,TAKEUCHI M. The design and development of highly reactive titanium oxide photocatalysts operating under visible light irradiation[J]. Journal of Catalysis,2003,216:505-516.
[5] COSTA D,ARROUVEL C,BREYSSE M,et al. Edge wetting effects of gamma-Al2O3and anatase-TiO2supports by MoS2and CoMoS active phases: a DFT study[J]. Journal of Catalysis,2007,246:325-343.
[6] KANDA S,AKITA T,FUJISHIMA M,et al. Facile synthesis and catalytic activity of MoS2/TiO2by a photodeposition-based technique and its oxidized derivative MoO3/TiO2with a unique photochromism[J]. Journal of Colloid and Interface Science,2011,354:607-610.
[7] HU K H,HU X G,XU Y F,et al. Synthesis of nano-MoS2/TiO2composite and its catalytic degradation effect on methyl orange[J]. Journal of Material Science,2010,45:2640-2648.
[8] HO W K,YU J C,LIN J,et al. Preparation and photocatalytic behavior of MoS2and WS2nanocluster sensitized TiO2[J]. Langmuir,2004,20:5865-5869.
[9] POURABBAS B,JAMSHIDI B. Preparation of MoS2nanoparticles by a modified hydrothermal method and the photo-catalytic activity of MoS2/TiO2hybrids in photo-oxidation of phenol[J]. Chemical Enginering Journal,2008,138:55-62.
[10]TSUJI I,KATO H,KOBAYASHI H,et al. Photocatalytic H2evolution under visible-light irradiation over band-structure-controlled (CuIn)(x)Zn2(1-x)S2solid solutions[J]. Journal of Physical Chemistry B,2005,109:7323-7329.
[11]ZHANG K,JING D W,XING C J,et al. Significantly improved photocatalytic hydrogen production activity over Cd1-xZnxS photocatalysts prepared by a novel thermal sulfuration method[J]. International Journal of Hydrogen Energy,2007,32:4685-4691.
[12]ZONG X,YAN H J,WU G P,et al. Enhancement of photocatalytic H2evolution on CdS by loading MoS2as cocatalyst under visible light irradiation[J]. Journal of the American Chemical Society,2008,130:7176-7177.
[13]ZHANG Y J,ZHANG L. Preparation of Ru-loaded CdS/Al-HMS nanocomposites and production of hydrogen by photocatalytic degradation of formic acid[J]. Applied Surface Science,2009,255:4863-4866.
[14]FUJIHARA B,OHNO T,MATSUMURA M. Splitting of water by electrochemical combination of two photocatalytic reactions on TiO2particles[J]. Journal of the Chemical Society,Faraday Transactions,1998,94:3705-3709.
[15]TADA H,MITSUI T,KIYONAGA T,et al. All-solid-state Z-scheme in CdS-Au-TiO2three-component nanojunction system[J]. Nature Materials,2006,5:782-786.
[16]ZHU H,YANG B,XU J,et al. Construction of Z-scheme type CdS-Au-TiO2hollow nanorod arrays with enhanced photocatalytic activity[J]. Applie Catalysis B: Environmental ,2009,90:463-469.
[17]SHENS,GUO L,CHEN X,et al. Effect of noble metal in CdS/M/TiO2for photocatalytic degradation of methylene blue under visible light[J]. International Journal of Green Nanotechnology,2009,1:94-104.
[18]TIAN Y M,ZHAO J Z,FU W Y,et al. A facile route to synthesis Of MoS2nanorods[J]. Materials Letter,2005,59:3452-3455.
[19]WANG X,SHIH K,LI X Y. Photocatalytic hydrogen generation from water under visible light using core/shell nano-catalysts[J]. Water Science and Technology,2010,61:2303-2308.
[20]HOU Y,WEN Z,CUI S,et al. Constructing 2D porous graphitic C3N4nanosheets/nitrogen-doped graphene/layered MoS2ternary nanojunction with enhanced photoelectrochemical activity[J]. Advanced Materials,2013,25:6291-6297.
[21]HOU Y,LAURSEN A B,ZHANG J,et al. Layered nanojunctions for hydrogen-evolution catalysis[J]. Angewandte Chemie,2013,52:3621-3625.
[22]BEST J P,DUNSTAN D E. Nanotechnology for photolytic hydrogen production: colloidal anodic oxidation[J]. International Journal of Hydrogen Energy,2009,34:7562-7578.
[23]XIONG G,SHAO R,DROUBAY T C,et al. Photoemission electron microscopy of TiO2anatase films embedded with rutile nanocrystals[J]. Advanced Functional Materials,2007,17:2133-2138.
[24]CHOI S,SHAOLIN Z,YANG W. Layer-number-dependent work function of MoS2nanoflakes[J]. Journal of the Korean Physical Society,2014,64:1550-1555.
【中文责编:成文 编辑助理:冷佳奕 英文审校:李海航】
SimultaneouslyHydrogenProductionandOrganicDegradationbyCompositeMoS2/Ag/TiO2Film
WANGXi1,DONGHaitai1,QIZhong1,LIXiaoyan2,LILaisheng1*
(1.SchoolofChemistryandEnvironment,SouthChinaNormalUniversity,Guangzhou510006,China; 2.DepartmentofCivilEngineering,theUniversityofHongKong,PokFulamRoad,HongKong)
A novel and environment-friendly photocatalyst film, MoS2/Ag/TiO2, was synthesized on a glass-fibre membrane. The composite catalyst film had a multi-layer structure and responded well to solar light. The catalyst could effectively produce hydrogen and decompose organic matters simultaneously in a two-chamber photo-reactor under either solar or UV light irradiation. The organic matter degradation was accomplished to produce CO2in the anode side chamber while hydrogen was produced in the cathode side chamber. The maximum specific hydrogen production rate was achieved at 64 mmol·h-1·m-2under simulated solar light when the mass ratios of Ag and TiO2were 1% and 160%, respectively. It is proposed that Ag functioned as a nanojunction between the TiO2and MoS2layers, which allowed the transfer of photo-excited electrons via TiO2→Ag→MoS2for organic degradation and H+reduction (hydrogen evolution) in two different chambers.
MoS2/Ag/TiO2; photocatalysis; hydrogen production; organic degradation
2016-01-07 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(51308230)
TK
A
1000-5463(2017)04-0051-06
*通讯作者:李来胜,教授,Email:lls@scnu.edu.

