海南特种野公猪不同世代膻味物质含量及相关性分析
蔡克奇,羊宣科,王鹏,吴科榜
海南特种野公猪不同世代膻味物质含量及相关性分析
蔡克奇,羊宣科,王鹏,吴科榜
(海南大学热带农林学院,海口 570228)
【目的】通过比较不同世代杂交海南特种野公猪F1、F2、F3膻味物质雄烯酮、粪臭素和吲哚含量,及血清性激素水平的差异,揭示公猪膻味物质的变化规律及性激素的变化对膻味物质含量的影响,为选育低膻味性状的公猪提供理论基础。【方法】以12月龄F1、F2、F3不同世代杂交公猪(野猪♂×屯昌猪♀)各18头为研究对象。试验猪空腹12 h,于前腔静脉采取血液样本并提取血清样品,采血后将试验猪屠宰,按照商品猪分割标准从第三和第四颈椎之间的颈部区采集脂肪和肌肉样品。利用(ELISA)试剂盒检测血清样品雄烯酮和性激素水平及脂肪和肌肉样本的雄烯酮含量,采用高效液相色谱法检测血清、脂肪和肌肉样本的粪臭素和吲哚含量。【结果】海南特种野公猪膻味物质雄烯酮、粪臭素和吲哚在血清、脂肪和肌肉组织中非均匀分布。脂肪和肌肉组织中的粪臭素和雄烯酮含量均与血清中的粪臭素和雄烯酮含量存在显著或极显著相关性(<0.05或<0.01),脂肪中粪臭素的含量与血清中粪臭素含量的相关系数最大为0.94。公猪肉品膻味物质粪臭素、雄烯酮和吲哚的沉积量在不同杂交代公猪间存在明显差异,其中雄烯酮的沉积量随着野猪血统的增加而增加,粪臭素的沉积量则随着野猪血统的增加而降低,而吲哚的沉积量不存在随野猪血统的变化规律。性激素水平在不同杂交代野猪间存在明显差异,其中雄激素睾酮水平随着野猪血统的增加而极显著增加(<0.01),而F1公猪的雌二醇水平极显著低于F2和F3公猪(<0.01)。雄烯酮含量均与血清睾酮水平呈极显著正相关(<0.01),而粪臭素含量均与血清睾酮水平呈显著或极显著负相关(<0.01),血清雄烯酮含量与睾酮水平的相关系数最大为0.95。【结论】随着海南特种野公猪血统的增加,睾酮水平和雄烯酮的沉积量显著增加,而粪臭素的沉积量显著降低。因此,海南特种野公猪睾酮水平的变化影响粪臭素和雄烯酮含量的变化。
公猪;膻味;雄烯酮;粪臭素;睾酮
0 引言
【研究意义】野猪杂交利用方法目前主要采用较原始的本交方法,既从野外抓捕野公猪圈养驯化,把发情时的家母猪放到野公猪圈舍内进行交配,家猪经过112—116 d的妊娠期,分娩产出野家杂交仔猪,简称“特种野猪”。海南特种野猪是利用海南野猪为父本(♂),海南屯昌猪为母本(♀)经过杂交获得F1代,再选用F1代的优良个体作为母本(♀)与不同血缘的海南野猪(♂)进行多次杂交获得F2代、F3代,从这些后代中选出优良个体,进行横交固定组成繁殖种群,生产含有75%以上野猪血缘的商品猪。根据Lundström等[1]报道,饲养未阉割公猪较阉割公猪具有采食量少,生长速度快,饲料转化率高,含氮化合物排放少,胴体品质良好,同时还可改善动物福利等诸多优势。野猪与屯昌猪杂交的后代在实际饲养过程中没有进行传统的阉割过程,但未阉割公猪的肉在烹调过程中散发出的“粪臭味”和“尿骚味”即公猪膻味(boar taint)影响肉的口感和风味,阻碍公猪肉品的大量开发利用。【前人研究进展】雄烯酮和粪臭素是导致公猪膻味的两种主要物质,其他物质(如吲哚)也能形成公猪膻味[2]。雄烯酮(5α-androst-16- ene-3-one)属固醇类物质,在成年公猪睾丸间质细胞中与其他雄性激素共同产生[3],两者的分泌都受下丘脑-垂体-性腺轴的调控[4]。公猪雄烯酮分泌量与性成熟相关,雄烯酮和雄性激素的分泌量随着性成熟而逐渐增加[5]。公猪唾液腺释放的雄烯酮发挥信号素的作用,剩余的部分主要在肝脏中代谢[6]。体内未代谢的部分雄烯酮沉积在脂肪和肌肉中,导致公猪肉带有尿骚味[1]。粪臭素(3-methylindole)是在大肠中由微生物发酵分解色氨酸产生,经肠道吸收进入血液循环[7]。粪臭素在肝脏中代谢分两步进行,代谢水平直接影响粪臭素在肌肉和脂肪中的沉积量,代谢产物随尿液等排出体外[8-9]。体内未代谢的粪臭素沉积到脂肪和肌肉中,导致公猪肉带有粪臭味[1]。公猪膻味性状水平受品种、年龄、性别、饲料和饲养管理等因素的影响[10]。DORAN等[8]研究报道证实膻味性状存在显著的品种差异,相同品种,不同年龄阶段,膻味性状表现不同。WAGENBERG等[11]报道称饲养管理能够影响猪群膻味性状,膻味性状含量高低与围栏面积、饲养群体、饲养器械新旧等相关。PRUNIER等[12]报道称不同饲养模式对血清睾酮、皮下脂肪雄烯酮和粪臭素含量影响不大,但季节对皮下脂肪粪臭素含量影响显著。雄烯酮主要受遗传因素影响,粪臭素主要受环境因素影响[13]。雄烯酮和粪臭素含量在公猪脂肪组织表现中度或高度相关性[14],加上公猪膻味性状具有较高的遗传力,使得选育膻味性状较低的猪种成为可能[15]。BONNEAU等[16]研究报道称检测到了血清雄性激素和促黄体生成素(LH)活性正常而雄烯酮沉积量很低的成年公猪,这对于选育雄烯酮水平较低的商品公猪具有重要意义。HABERLAND等[17]发现合适的选育策略能够降低膻味性状的水平。【本研究切入点】目前关于不同野猪血统对公猪膻味性状水平的影响研究尚未见报道。【拟解决的关键问题】以不同杂交代F1、F2、F3野屯杂交公猪为对象,研究不同野猪血统的公猪不同组织中膻味性状雄烯酮、粪臭素和吲哚水平的差异及血清性激素水平的差异,旨在揭示公猪膻味性状在不同组织中的分布特点以及不同杂交代野公猪间肉品膻味物质含量的变化规律。分析膻味性状与性激素水平间的相关性,揭示性激素水平的变化对肉品膻味物质含量变化规律的影响,为公猪肉质的开发利用和选育低膻味性状的公猪提供理论基础。
1 材料与方法
试验于2015—2016年在海南大学热带动物繁育与营养学实验室进行。
1.1 主要仪器及试剂
高效液相色谱仪:LC-20A,岛津企业管理中国有限公司;酶标仪(51119100,赛默飞世尔科技中国有限公司);可调高速匀浆机(FSH-2,江苏省金坛市宏华仪器厂);电热恒温培养箱(DNP-9082,上海精宏实验设备有限公司);台式高速冷冻离心机(5810R,Eppendorf 中国有限公司);小型高速离心机(5418,Eppendorf中国有限公司);超纯水装置(Milli-Q Biocel,密理博有限公司)。
猪雄烯酮(ADT)酶联免疫(ELISA)检测试剂盒、猪睾酮(T)酶联免疫(ELISA)检测试剂盒、猪雌二醇(E2)酶联免疫(ELISA)检测试剂盒、甲醇(色谱纯)、乙腈(色谱纯)、粪臭素(3-甲基吲哚)标准品(sigma公司)、吲哚标准品(sigma公司),试验用水为Millipore超纯水装置制备水。
1.2 试验猪与样本采集
选择12月龄F1、F2、F3的杂交野公猪(野猪♂×屯昌猪♀)各18头(各分为3组,每组6头)为试验动物,试验猪来自万宁强达特种生态养业有限公司种猪场。试验猪空腹12 h前腔静脉采血10 mL,分别加入两支不含热源和内毒素的真空采血管中,3 000×离心10 min分离血清,-20℃冰箱保存。采血后将试验猪屠宰,按照商品猪分割标准从第三和第四颈椎之间的颈部区采集脂肪和肌肉样品(约4 cm×4 cm),并储存在-20℃冰箱。
1.3 雄烯酮和性激素含量的检测
采用双抗体一步夹心法酶联免疫吸附试验(ELISA)检测各个样本雄烯酮、睾酮和雌二醇含量。
1.4 粪臭素与吲哚的检测
参照Tuomola等[18]方法略加修改,采用高效液相色谱法检测各个样本粪臭素和吲哚含量。
高效液相色谱法色谱条件:色谱柱:InertSustainSwiftTMC18、5 μm、4.6 nm×250 nm不锈钢柱;流动相:乙睛﹕水=60﹕40;柱箱温度:40℃;流速:1.0 mL·min-1;检测器条件:激发波长270 nm,发射波长350 nm;进样量:10 μL。
标准品制备:准确称量3-甲基吲哚标准品0.006 g,吲哚标准品0.004 g,用乙睛溶解并定容至500 mL棕色容量瓶中,配制成粪臭素和吲哚混合标准贮备液。分别取一定体积标准贮备液于容量瓶中,分别用乙睛-水溶液(乙睛﹕水=75﹕25)定容,稀释制备成粪臭素浓度分别为3、6、12、60、120和600 ng·mL-1,吲哚浓度分别为2、4、8、40、80和400 ng·mL-1的混合标准溶液。
脂肪样品处理:准确称取脂肪样品2 g,加入5 mL甲醇后匀浆,-20℃冷冻匀浆液30 min,1 200×离心10 min,上清液通过活化的冷却Sep-pak C18柱(Waters,Milford,MA)。弃去流出液的最初1 mL,收集2 mL洗脱液,经¢=13 mm,0.2 μm滤膜过滤,进样10 μL。
肌肉样品处理:准确称取肌肉样品2 g,加入5 mL甲醇后匀浆,-20℃冷冻匀浆液30 min,1 200×离心10 min,经¢=13 mm,0.2 μm滤膜过滤,进样10 μL。
血清样品处理:准确量取1.0 mL血清,加2 mL乙醚提取,1 200×离心10 min,醚相倾析入含1.0 mL流动相(乙睛﹕水=60﹕40)的试管中,醚相47℃蒸发除去,进样50μL。
回收率和精密度测定:在2 g脂肪样品中分别加入粪臭素60、150和300 ng·g-1,吲哚40、100和200 ng·g-1;在2 g肌肉样品中分别加入粪臭素30、60和120 ng·g-1,吲哚20、40和80 ng·g-1;在1 mL血清样本中分别加入粪臭素3、15和30 ng·mL-1,吲哚2、10和20 ng·mL-1,按血清样品处理方法,计算回收率。同一样品于1 d内连续进样3次,考察日内精密度;连续3 d每天进样1次,考察日间精密度。
1.5 数据处理与分析
利用SAS9.0统计软件对各项指标进行分析,结果用平均数±标准差表示。
2 结果
2.1 雄烯酮含量的变化
不同杂交代海南特种野公猪各组织雄烯酮浓度的测定结果见表1。血清中F3的雄烯酮浓度最高,与F1、F2相比差异极显著(<0.01),F1雄烯酮浓度含量显著低于F2(<0.05),其雄烯酮含量的大小顺序为F3>F2>F1。脂肪组织中F1的雄烯酮浓度含量最低,与F3、F2相比差异极显著(<0.01),F3雄烯酮浓度显著高于F2(<0.05),其雄烯酮含量的大小顺序为F3>F2>F1。肌肉组织中F1的雄烯酮浓度含量最低,与F3、F2相比差异极显著(<0.01),F3雄烯酮浓度显著高于F2(<0.05),其雄烯酮含量的大小顺序为F3>F2>F1。
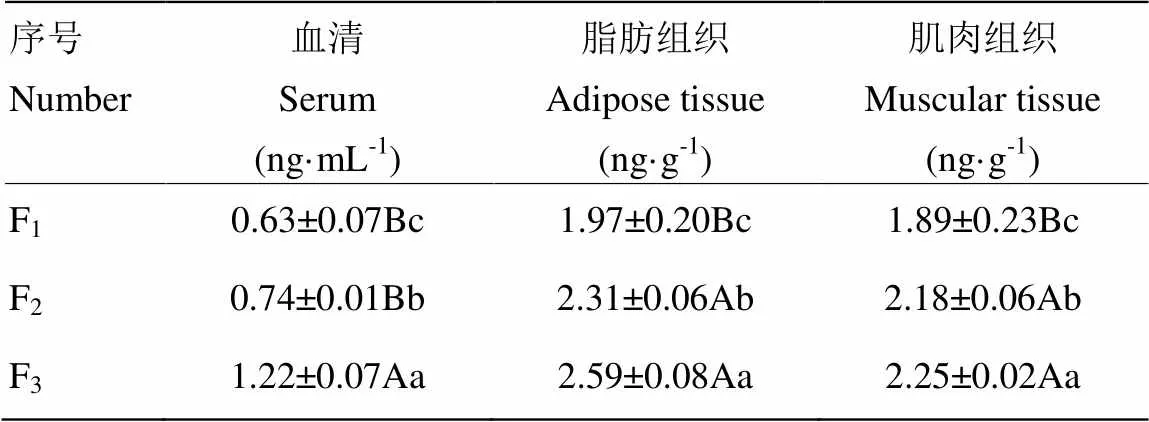
表1 各组织雄烯酮含量
同列不同大写字母表示差异极显著(<0.01),同列不同小写字母表示差异显著(<0.05)
In the same column, values with different capital letters mean significant difference (<0.01), values with different small letters mean significant difference (<0.01)
2.2 性激素水平的变化规律
不同杂交代海南特种野公猪血清性激素水平的测定结果见表2。睾酮水平在不同杂交代间存在明显的规律性,F3血清睾酮水平高于F1和F2,差异极显著(<0.01),F2血清睾酮水平显著高于F1(<0.05),其睾酮水平的高低顺序为F3>F2>F1;雌二醇含量在不同杂交代间亦存在明显的规律性,F1血清雌二醇水平相对于F2和F3低,差异极显著(<0.01),F3血清雌二醇水平高于F2,差异不显著(>0.05),其雌二醇含量的高低顺序为F3>F2>>F1。

表2 血清性激素水平
同行不同大写字母表示差异极显著(<0.01),同行不同小写字母表示差异显著(<0.05)
In the same row, values with different capital letters mean significant difference (<0.01), values with different small letters mean significant difference (<0.05)
2.3 粪臭素和吲哚含量的变化
由图1可知,在两组分进样量分别为3—600 ng·mL-1和2—400 ng·mL-1范围内,其线性回归方程分别为=30023-6336.8(2=0.9999)(图2)和=31762+ 16652(2=0.9999)(图3),经日内3次重复,相关系数均在0.9999以上,说明方法具有良好的重现性和线性关系。
由表3可知,脂肪样品中粪臭素和吲哚的平均回收率分别为97.66%和103.69%,肌肉样品中粪臭素和吲哚的平均回收率分别95.66%和104.16%,血清样品中粪臭素和吲哚的平均回收率分别为96.00%和97.28%,日内和日间精密度均小于3%,说明方法的可信度和精确度均较高。

图1 粪臭素和吲哚标准品分离色谱图

图2 吲哚标准曲线
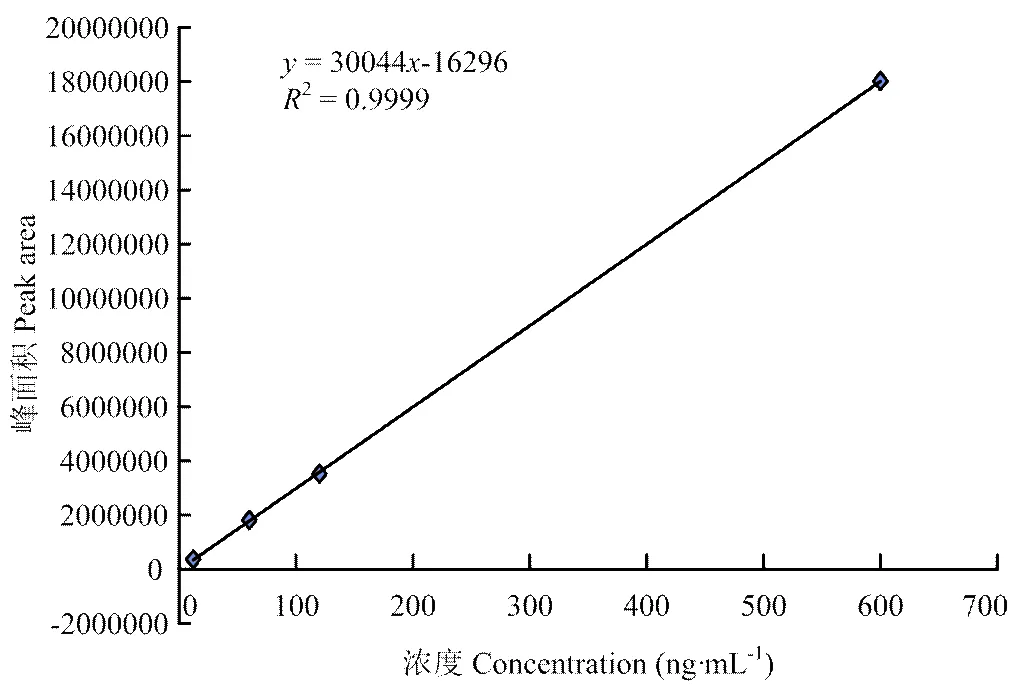
图3 粪臭素标准曲线

表3 粪臭素和吲哚的精确度和精密度(n=6)
2.3.1粪臭素含量的变化 不同杂交代海南特种野公猪各部位粪臭素含量的测定结果见表4。血清样本中F1的雄烯酮含量最高,与F1、F2和屯昌黑猪相比差异极显著(<0.01),F2粪臭素浓度含量与F3相比差异极显著(<0.01),其粪臭素含量的大小顺序为F1>F2>F3。脂肪组织中F1、F2、F3间的粪臭素含量均存在极显著(<0.01),其粪臭素含量的大小顺序为F1>F2>F3。肌肉组织中F1的粪臭素含量最高,与F3、F2相比差异极显著(<0.01),F2与F3相比差异显著(<0.05),其粪臭素含量的大小顺序为F1>F2>F3。
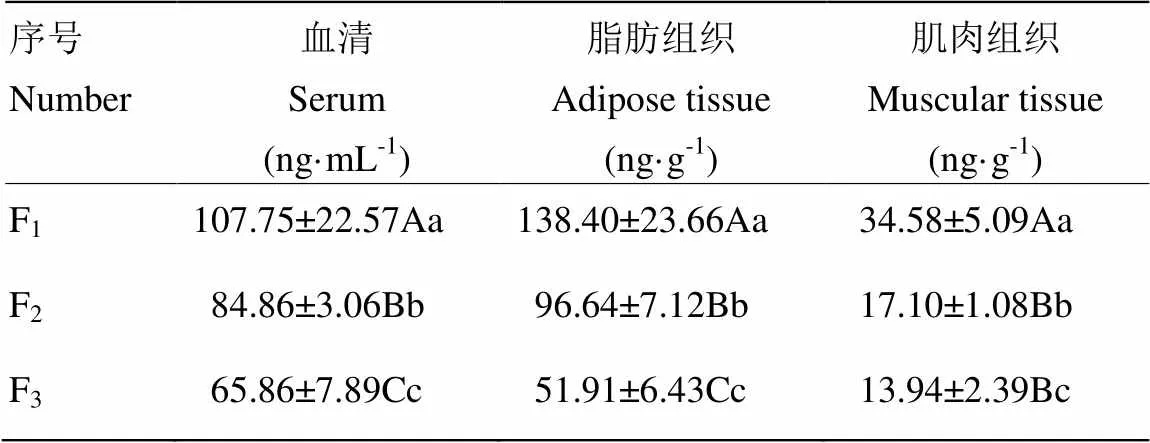
表4 各组织粪臭素含量测定结果
同列不同大写字母表示差异极显著(<0.01),同列不同小写字母表示差异显著(<0.05)
In the same column, values with different capital letters mean significant difference (<0.01), values with different small letters mean significant difference (<0.05)
2.3.2 吲哚含量的变化 不同杂交代海南特种野公猪各部位吲哚含量的测定结果见表5。血清样本中F3的吲哚含量最高,与F2相比差异极显著(<0.01),与F1相比差异显著(<0.05),F1吲哚含量与F2相比差异极显著(<0.01),其吲哚含量的大小顺序为F3>F1>F2。脂肪组织中F3的吲哚含量最高,与F1、F2相比差异极显著(<0.01),F1吲哚含量显著(<0.05)高于F2,其吲哚含量的大小顺序为F3>F1>F2。肌肉组织中F3代的吲哚含量最高,与F1、F2相比差异极显著(<0.01),F1吲哚含量显著(<0.05)高于F2,其吲哚含量的大小顺序为F3>F1>F2。

表5 各组织吲哚含量测定结果
同列不同大写字母表示差异极显著(<0.01),同列不同小写字母表示差异显著(<0.05)
In the same column, values with different capital letters mean significant difference (<0.01), values with different small letters mean significant difference (<0.01)
2.4 膻味性状间的相关性分析
海南特种野公猪各部位膻味性状间的相关性分析结果见表6。海南特种野公猪膻味性状在不同部位间存在不同程度的相关,各膻味性状亦存在不同程度的相关性。脂肪组织的雄烯酮含量与血清样本和肌肉组织的雄烯酮含量都存在极显著正相关(<0.01),脂肪组织的粪臭素含量与血清样本和肌肉组织的粪臭素含量都存在极显著正相关(<0.01),其中脂肪组织粪臭素与血清样本粪臭素的相关系数最大,达0.94;肌肉组织雄烯酮含量与血清样本雄烯酮含量存在显著正相关(<0.05),肌肉组织粪臭素与血清样本粪臭素含量存在极显著正相关(<0.01)。各部位雄烯酮含量与粪臭素含量都存在极显著负相关(<0.01),其中肌肉雄烯酮与血清粪臭素的相关系数最高,达-0.92,吲哚与雄烯酮和粪臭素存在不明显的相关性。

表6 膻味性状相关分析
*表示<0.05,**表示<0.01。下同 * indicates significant difference at 0.05, ** indicates significant difference at 0.01. The same as below
2.5 膻味性状与性激素的相关性分析
膻味性状与血清性激素的相关性分析结果见表7。血清雄烯酮含量与睾酮和雌二醇存在显著或极显著正相关,血清粪臭素含量与睾酮存在极显著负相关(<0.01),吲哚含量与睾酮和雌二醇不存在明显的相关性,其中雄烯酮与睾酮的相关系数最大为0.95。脂肪组织中雄烯酮的沉积量与睾酮水平呈极显著正相关(<0.01),与雌二醇水平呈显著负相关(<0.05);粪臭素的沉积量与血清睾酮和雌二醇水平都呈极显著负相关(<0.01);吲哚沉积量与血清雌二醇呈显著正相关(<0.05)。肌肉组织中雄烯酮的沉积量与血清睾酮水平呈极显著正相关(<0.01);粪臭素的沉积量与血清睾酮和雌二醇水平都呈显著负相关(<0.05);吲哚沉积量与血清睾酮水平呈极显著正相关(<0.01)。

表7 膻味性状与性激素的相关性分析
3 讨论
3.1 公猪膻味物质的变化规律
猪肌肉品质研究是猪肉生产的一个重要研究方向[19]。而猪肉的风味不仅取决于肉中鲜味和香味物质,同时也受肉中异味化合物的影响。在欧洲国家,与母猪肉相比,约有超过6.5%的消费者不能忍受完整公猪肉[20-21]。雄烯酮和粪臭素是引起公猪肉异味的两种主要物质,其他一些物质如吲哚,也能导致公猪膻味的形成[2]。本试验结果显示,不同杂交代海南特种野公猪膻味物质雄烯酮、粪臭素、吲哚含量在血清、脂肪和肌肉组织中分布不均匀,这与Rius等[22]和Babol等[23]研究结果一致。Bonneau等[24]研究指出,雄烯酮引起肉膻味的作用比粪臭素大,两者具有增强膻味的协同作用。雄烯酮单独作用便可造成不良气味,但粪臭素对肉味的影响更为显著,低粪臭素水平的公猪肉质风味相对较好[25]。本研究结果发现,随着野公猪血统的增加,肉品中雄烯酮含量提高,而粪臭素含量降低,粪臭素与雄烯酮存在显著的负相关,相关系数达0.84以上,导致具有高雄烯酮水平的F3野公猪粪臭素水平相对低于F2和F1。根据消费者对不同杂交代海南特种野公猪肉品口感效果的调查显示,F1肉品膻味相对F2和F3要高,说明肉品膻味的大小与雄烯酮和粪臭素的相对含量相关,粪臭素越低肉品膻味越低,可将粪臭素作为不同杂交代海南特种野公猪肉质选育中的一个生物标志物,通过级进杂交选育低粪臭素水平的野公猪,提高肉质的优良特性。粪臭素不仅影响猪肉的滋味风味,其含量的高低也会不同程度的导致寄生虫病,传染病等疾病,降低动物的生产性能;更重要的是会导致人产生恶心、呕吐、头痛、代谢机能减退等不良症状[26]。因此,通过公猪膻味物质的变化规律,为以后研究饲养过程中降低海南特种野公猪的粪臭素打下一定的基础。
3.2性激素含量变化对膻味物质的影响
睾酮(Testosterone)是主要的活性雄激素,可经芳香化酶催化转变成雌二醇或转化成其他活性形式(二氢睾酮),同时代谢产生一些生理非活性类固醇激素如公猪信号激素雄烯酮[27]。雄烯酮的分泌受到神经内分泌系统的影响,特别是睾酮水平对雄烯酮的分泌与代谢具有重要的作用[28]。青春期雄烯酮的分泌量伴随着雄性激素分泌的增加而显著增加,粪臭素也发生明显的变化[29]。本研究发现,睾酮水平随着海南特种野公猪血缘的增加而增加,雄烯酮水平也显著增加,粪臭素水平显著降低,雄烯酮水平与睾酮水平呈极显著正相关,表明睾酮水平的变化对雄烯酮和粪臭素水平的差异产生影响。Zamaratskaia等[30]研究表明,睾酮、活性雌激素、游离雌激素水平可预测脂肪中粪臭素沉积水平。本研究结果显示,海南特种野公猪肉品中粪臭素的沉积与雌二醇和睾酮水平均存在显著负相关,其脂肪粪臭素含量与睾酮水平的相关系数高达0.86,可将睾酮作为辅助雄烯酮的指标参与低粪臭素水平的公猪进行选育研究。在今后的研究中还可研究海南特种野公猪雄激素的受体基因,从分子结构上进行分析。
4 结论
海南特种野公猪膻味物质雄烯酮、粪臭素和吲哚在血清、脂肪和肌肉组织中非均匀分布。脂肪和肌肉组织中粪臭素和雄烯酮的沉积量在不同杂交代海南特种野公猪间存在明显的差异,随着海南特种野公猪血统的增加,雄烯酮的沉积量显著增加,而粪臭素的沉积量显著降低。海南特种野公猪睾酮水平的变化影响粪臭素和雄烯酮含量的变化。研究结果可为选育低粪臭素水平的杂交野公猪提供依据。
References
[1] Lundström K, Matthews K R, Haugen J E. Pig meat quality from entire males., 2009, 3(11): 1497-1507.
[2] ANDRESEN Ø. Boar taint related compounds: Androstenone/ skatole/other substances., 2006, 48(Suppl): S5.
[3] KWAN T K, ORENGO C, GOWER D B. Biosynthesis of androgens and pheromonal steroids in neonatal porcine testicular preparations., 1985, 183(2): 359-364.
[4] SINCLAIR P A, SQUIRES E J, RAESIDE J I. Early postnatal plasma concentrations of testicular hormones, pubertal development and carcass leanness as potential indicators of boar taint in market weight intact male pigs., 2001, 79(7): 1868-1876.
[5] BONNEAU M. Compounds responsible for boar taint, with special emphasis on androstenone: A review., 1982, 9(82): 687-705.
[6] MOE M, GRINDFLEK E, DORAN O. Expression of 3-hydroxysteroid dehydrogenase, cytochrome P450-c17, and sulfotransferase 2B1 proteins in liver and testis of pigs of two breeds: Relationship with adipose tissue androstenone concentration., 2007, 85(11): 2924-2931.
[7] ZAMARATSKAIA G, SQUIRES E J. Biochemical, nutritional and genetic effects on boar taint in entire male pigs., 2009, 3(11): 1508-1521.
[8] DORAN O, WHITTINGTON F, WOOD J D, MCGIVAN J D. The relationship between adipose tissue skatole levels, rates of hepatic microsomal skatole metabolism and hepatic cytochrome P450IIE1 expression in two breeds of pig., 2002, 74(3): 461-468.
[9] DIAZ G J, SQUIRES E J. Phase II in vitro metabolism of 3-methylindole metabolites in porcine liver., 2008, 33(5): 485-498.
[10] ZAMARATSKAIA G. Factors involved in the development of boar taint[D]. Campus Ultuna: Swedish University of Agricultural Sciences, 2004.
[11] WAGENBERG C P A V, SNOEK H M, FELS J B V D, PEET- SCHWERING C M C V D. Farm and management characteristics associated with boar taint., 2013, 7(11): 1841-1848.
[12] PRUNIER A, BRILLOU T A, MERLOT E, Meunier-Salaün M C, Tallet C. Influence of housing and season on pubertal development, boar taint compounds and skin lesions of male pigs., 2013, 7(12): 2035-2043.
[13] 孟晓, 贺稚非, 李洪军. 全公猪肉膻味物质研究进展. 食品工业科技, 2013(12): 392-395.
Meng X, He Z F, Li H J. The boar pork taint developments research., 2013(12): 392-395. (in Chinese)
[14] SQUIRES E J, LUNDSTR M K. Relationship between cytochrome P450IIE1 in liver and levels of skatole and its metabolites in intact male pigs., 1997, 75(9): 2506-2511.
[15] CHEN G, ZAMARATSKAIA G, MADEI A, LUNDSTRӧM K. Effect of hCG administration on the relationship between testicular steroids and indolic compounds in fat and plasma in entire male pigs., 2006, 72(2): 339-347.
[16] BONNEAU M, CARRIE-LEMOINE J, PRUNIER A, GARNIER D H, Terqui M. Age-related changes in plasma LH and testosterone concentration profiles and fat 5α-androstenone content in the young boar., 1987, 15(s3/4): 241-258.
[17] HABERLAND A M, LUTHER H, HOFER A, THOLEN E, SIMIANER H, LIND B, BAES C. Efficiency of different selection strategies against boar taint in pigs., 2013, 8(1): 1-9.
[18] TUOMOLA M, VAHVA M, KALLIO H. High-performance liquid chromatography determination of skatole and indole levels in pig serum, subcutaneous fat, and submaxillary salivary glands., 1996, 44(5): 1265-1270.
[19] 陈润生, 张伟力, 经荣斌. 猪肉品质研究三十年回眸. 猪业科学, 2007, 24(7): 90-94.
CHEN R S, ZHANG L W, JING R B. Pork quality research recent thirty years.2007, 24(7): 90-94. (in Chinese)
[20] BONNEAU M. Use of entire males for pig meat in the European union., 1998, 49(1): 257-272.
[21] MALMFORS B, LUNDSTRÖM K. Consumer reactions to boar meat-A review., 1983, 10(2): 187-196.
[22] RIUS M A, GARCIA-REGUEIRO J A. Skatole and indole concentrations in longissimus dorsi and fat samples of pigs., 2001, 59(3): 285-291.
[23] BABOL J, ZAMARATSAIA G, JUNEJA R K. The effects of age on distribution of skatole and indole levels in entire male pigs in four breeds: Yorkshire, Landrace, Hampshire and Duroc., 2004, 67(2): 351-358.
[24] BONNEAU M, DENMAT M L, VAUDELET J C, NUNES J R V, MORTENSEN A B, MORTENSEN H P. Contributions of fat androstenone and skatole to boar taint: I. Sensory attributes of fat and pork meat., 1992, 32(1): 63-80.
[25] MӧRLEIN D, THOLEN E. Fatty acid composition of subcutaneous adipose tissue from entire male pigs with extremely divergent levels of boar taint compounds-An exploratory study., 2015, 99: 1-7.
[26] 王红萍. 猪肉膻味物质粪臭素的加工降解研究[D]. 重庆: 西南大学, 2012.
WANG H P. Research on processing degradation of skatole that caused boar taint[D]. Chongqing: Southwest University, 2012. (in Chinese)
[27] SIMARD J, DUROCHER F, Mébarki F, TURGEON C, SANCHEZ R, LABRIE Y, COUET J, TRUDEL C, RHEAUME E, MOREL Y, LUU-THE V, LABRIE F. Molecular biology of the 3beta- hydroxysteroid dehydrogenase/delta5-delta4 isomerase gene family., 2005, 26(4): 525-582.
[28] CHEN G, LI S, DONG X, BAI Y, CHEN A, YANG S, FANG M, ZAMARATSKAIA G, DORAN O. Investigation of testosterone, androstenone, and estradiol metabolism in HepG2 cells and primary culture pig hepatocytes and their effects on 17βHSD7 gene expression., 2012, 7(12): e52255.
[29] BONNEAU M. Compounds responsible for boar taint, with special emphasis on androstenone: A review., 1982, 9(82): 687-705.
[30] ZAMARATSKAIA G, BABOL J, ANDERSSON H, LUNDSTROM K. Plasma skatole and androstenone levels in entire male pigs and relationship between boar taint compounds, sex steroids and thyroxine at various ages., 2004, 87(s2/3): 91-98.
(责任编辑 赵伶俐)
Change Regularity and Correlation Analysis of Hainan Special wild Boar Taint Substances
Cai KeQi, Yang XuanKe, Wang Peng, Wu KeBang
(College of Tropical Agriculture and Forestry, Hainan University, Haikou 570228)
【Objective】The aim of this study is to reveal the change regularity of boar taint substances by comparing differences in androstenone, skatole and indole in F1, F2, F3different generations and boar taint substances effects on sex hormone levels to provide a theoretical basis for breeding of low-lying boar taint pigs. 【Method】Eighteen individuals each of the different generations (boar♂×Tunchang pig♀) F1, F2, and F3were used as the research objects. Then blood was collected and sera were extracted from the precaval vein of the experimental pigs, and then the fat and muscle samples were collected from the neck after slaughtering with standard method. ELISA kit and high performance liquid chromatography were used to detect and analyze the sex hormones, skatole and indole levels of each sample. The correlation and significance analysis of data were conducted by using SAS 9.0 software. 【Result】The contents of skatole, androstenone and indole showed different correlation levels in different tissues. Skatole and androstenone contents of fat and muscle showed a significant positive relationship (<0.05 or<0.01) with serum, and the maximum correlation coefficient of skatole in fat with that in serum was 0.94. Skatole, androstenone and indole contents of pork showed significant differences among different hybrid generations. With the increase of wild boar blood, androstenone levels were significantly increased, while the skatole levels were significantly reduced, but the indole showed no regularity in change. The sex hormone levels also had significant differences among different hybrid generations, the testosterone levels were significantly increased with wild boar blood, estradiol levels of F1were significantly lower than that of F2and F3. Skatole, androstenone and indole contents of fat, muscle and serum in different hybrid generations had different correlations with sex hormone levels, and androstenone of them had significant positive (<0.01) correlation with testosterone. Skatole had a significant negative (<0.05 or<0.01) correlation with testosterone. The maximum correlation coefficient between androstenone and testosterone in serum was 0.95. 【Conclusion】 With the increase of the content of the Hainan special wild boar blood, the testosterone levels increased significantly, the androstenone sedimentary volume increased significantly, and the skatole deposition quantity significantly reduced. So the changes of testosterone levels of Hainan special wild boar affect the contents of skatole and androstenone.
wild boar; boar taint; androstenone; skatole; testosterone
2016-11-21;接受日期:2017-02-10
海南省重点科技计划项目(ZDXM20120008)
蔡克奇,Tel:13519837694;E-mail:931160431@qq.com。通信作者吴科榜,Tel:13907692135

