番茄SYTA的克隆及表达分析
潘琪,刘旭旭,彭浩然,蒲运丹,张永至,叶思涵,吴根土,青玲,孙现超
番茄的克隆及表达分析
潘琪,刘旭旭,彭浩然,蒲运丹,张永至,叶思涵,吴根土,青玲,孙现超
(西南大学植物保护学院,重庆400716)
【目的】克隆获得番茄(,),分析其基因序列生物信息学特征和预测蛋白的结构特征,明确SYTA亚细胞定位和组织表达,并分析其在绿色荧光蛋白(green fluorescence protein, GFP)标记的烟草花叶病毒(,TMV)侵染下的表达变化及其对TMV移动的影响,为明确SYTA在植物病毒侵染致病过程中的作用提供理论依据。【方法】根据番茄基因组含有的同源基因序列,利用Primer Premier 5.0软件设计克隆引物,采用RT-PCR技术克隆全长序列;应用生物信息学方法分析该基因的序列特征;使用MEGA 7.0对SYTA蛋白序列及其同源序列进行多序列比对,并构建同源物种间系统进化树;通过与GFP蛋白融合进行亚细胞定位;利用实时荧光定量PCR(qRT-PCR)检测番茄各部位的表达量以及在TMV胁迫的番茄中的表达变化;构建植物瞬时表达载体pCV-SYTA-mGFP,通过农杆菌介导在本氏烟草中瞬时表达,TMV-GFP攻毒,利用酶联免疫吸附实验(ELISA)检测在本氏烟中瞬时表达SYTA时TMV-GFP的积累和移动情况。【结果】克隆得到1 620 bp的基因开放阅读框全长,序列比对及生物信息学分析表明,其编码的氨基酸序列具有家族的典型特征,含有N端的跨膜区、胞间连接区和C端的两个C2结构域;多序列对比及系统进化树分析发现,与茄科林生烟草、绒毛状烟草等植物亲缘关系较近,与黄瓜较远;亚细胞定位显示SYTA定位于细胞质膜。在番茄的根、茎和叶中的表达量从高到低依次为根>叶>茎;TMV-GFP侵染番茄导致其表达量在接种后第1天显著上调,在第7天降至正常水平。在SYTA瞬时表达的本氏烟叶片部位接种TMV-GFP,TMV-GFP在接种第5天时已经到达新叶,而接种部位仅表达空载体对照的本氏烟新叶中未观察到TMV-GFP,且接种第5天时TMV-GFP在接种叶和新叶中的积累量均明显高于其在空载体对照处理的叶片。【结论】获得的具有家族的典型特征。SYTA定位于细胞质膜,在番茄根中表达量最高。在TMV-GFP胁迫下,番茄中表达呈现先上升后下降至正常水平。在本氏烟中瞬时表达SYTA有利于TMV-GFP侵染初期的积累和移动。
番茄;;克隆;表达分析;TMV-GFP
0 引言
【研究意义】番茄()作为茄科植物的典型代表,在农业生产中占有重要的地位。而在全国各地番茄生产中,病毒病已成为重要病害之一。尤其在秋季发病率最为严重,可达10%—30%,有时甚至可达50%以上,造成严重的产量损失,并对番茄生产安全构成威胁[1]。目前,随着设施农业的发展,蔬菜病毒病的危害愈来愈严重,不仅危害范围广、经济损失大而且难以防治[2]。Synaptotagmin是一种膜转运蛋白,广泛存在于内分泌及神经细胞上。它是囊泡融合中的Ca2+感受器,能够触发调节囊泡与质膜之间的融合过程[3],在蛋白质及膜转运过程扮演着重要的作用。前期研究发现,拟南芥SYTA不但能够调节核内体的转运循环,还可以影响植物病毒运动蛋白(movement protein,MP)介导的病毒基因组通过胞间连丝在植物细胞间的转运[4-5]。番茄基因组分析表明番茄中也存在的同源基因,明确SYTA的结构、表达及其对病毒侵染移动的影响,对进一步解析SYTA在植物病毒侵染致病过程中的作用和寻找番茄病毒病防治策略具有重要意义。【前人研究进展】Synaptotagmin最早是在大型致密核心囊泡(large dense core vesicle,LDCV)和突触囊泡的膜表面上发现的抗原,1990年被命名为Synaptotagmin[6]。在动物中己经发现了该家族16种以上的亚型,并且在植物拟南芥中发现了该家族的6种亚型,命名为SYT A-F[7]。Synaptotagmin作为植物中第一个被发现的参与细胞膜修复的蛋白质[8],能够在植物细胞中广泛表达,并且定位于细胞质膜上,基本结构为囊泡内腔的N末端为糖基化区;其后为4—62个氨基酸残基组成的单连跨膜片段(transmembrane domain,TMD);胞浆域包括连接片段和两个串联排列的C2结构域(C2A和C2B);最后是保守的C-末端[9]。其中C2结构域平均长度约为135个氨基酸残基,各自都由8个折叠和3个松散的环形结构组成[10]。C2B的第7和第8个折叠中间有一个螺旋,C2A没有[11]。目前,在动物SYTs的基因研究进展中对Syt1的了解较其余SYTs更详细。Syt1在动物神经系统和囊泡运输中起着极其重要的作用[7,12]。而在植物中,仅在拟南芥中有关于SYTs的研究报道。Yamazaki等[13]发现拟南芥SYT1(也称AtSytA)定位于细胞质膜,在依赖Ca2+调控的植物细胞抗冻过程中维持质膜的完整性和细胞活性,并在参与膜转运过程等方面发挥重要作用。并且相关研究发现,拟南芥SYTA缺失后能使细胞膜的完整性下降,从而降低细胞活性[14]。Schapire等[15]认为SYTA可能通过3种方式参与细胞膜的修复过程,即张力缓释模型、囊泡融合模型、胞吞模型;高彬[16]对拟南芥进行了生物信息学分析,并分析在盐胁迫下拟南芥的表达量,发现其受到高盐环境的诱导,而功能的缺失会造成对钙的敏感性降低,使细胞膜的不完整性进一步加剧,而过量表达可以提高植株对外源钙的敏感性,提高植株对盐胁迫的抗性;Kawamura等[17]对拟南芥进行冷处理时发现,的表达量随耐受能力提高而增加。也有研究发现拟南芥SYTA定位于核内体,可直接与甘蓝曲叶病毒(,CaLCuV)以及TMV的运动蛋白相互作用,并介导病毒在细胞间的运动[4-5]。Levy等[18]进一步证实了SYTA定位于内质网和质膜的接触点,是形成内质网和质膜接触位点所必不可少的蛋白,并且在病毒细胞间运动时,质膜组分能与SYTA发生互作而改变胞间连丝。【本研究切入点】目前关于Synaptotagmin蛋白家族的研究多是集中在哺乳动物上,植物上仅有对模式植物拟南芥SYTA进行研究。番茄作为茄科植物的典型代表,基因组分析发现其含有编码的同源基因,但其功能尚不明确。【拟解决的关键问题】以2012年完成的番茄基因组测序为基础,设计引物,克隆,获得其全长开放阅读框,分析基因序列生物信息学特征和预测蛋白的结构特征,明确SYTA亚细胞定位和组织表达,并分析其在TMV胁迫下的表达变化及其对TMV侵染移动的影响,为深入研究茄科SYTA在植物病毒侵染致病过程中的作用提供参考。
1 材料与方法
试验于2014年12月至2016年10月在西南大学植物保护学院分子植物病理实验室内进行。
1.1 试验材料
1.1.1 植物材料 本氏烟()和番茄于西南大学植物保护学院分子植物病理实验室温室内育苗盆中播种,培养至4—6叶期备用。
1.1.2 试剂与菌株 供试大肠杆菌()DH5购自北京全式金生物技术有限公司;植物总RNA提取试剂盒(LS1040)购自上海普洛麦格生物公司;限制性内切酶I和I、Ex Taq DNA聚合酶、逆转录试剂盒(RR037A)购自TaKaRa公司;SYBR染料购自德国凯杰生物公司;植物表达载体pCV-mGFP-C1[19]由浙江省农业科学院陈剑平研究员实验室馈赠;根癌土壤农杆菌株EHA105由笔者实验室保存;烟草花叶病毒荧光标记载体TMV-GFP(pSPDK661)[20]由清华大学刘玉乐教授实验室馈赠。
1.2 方法
1.2.1 总RNA的提取和反转录 将种植至4—6叶期的番茄样品,按照植物总RNA提取试剂盒使用说明书提取样品的根、茎、叶片以及总RNA。使用逆转录试剂盒对总RNA进行反转录合成cDNA,编号后置于-80℃保存备用。
1.2.2克隆 根据GenBank数据库中SYTA的同源序列,利用Primer 5.0软件设计P1引物对(表1),以番茄cDNA为模板,PCR扩增全长序列。PCR反应体系25 μL:10×Ex Taq Buffer(Mg2+)2.5 μL、MgCl22 μL、dNTP混合物2 μL、Primer(F1)1 μL、Primer(R1)1 μL、cDNA产物1 μL、Taq DNA聚合酶0.3 μL、最后加ddH2O补充至25 μL。反应程序:94℃ 1 min;94℃30 s;65℃ 30 s;72℃ 2 min;30个循环。回收PCR产物并与pGEM-T easy Vector载体连接,构建重组质粒转化DH5感受态细胞,筛选阳性克隆,送至华大生物技术有限公司测序。

表1 引物序列
1.2.3SYTA的生物信息学分析 根据获得的cDNA序列,利用NCBI站点的ORF Finder(https:// www.ncbi.nlm.nih.gov/orffinder/)推测开放阅读框,NetNGlyc1.0server分析SYTA蛋白质的糖基化位点。SingaIP 4.1(http://www.cbs.dtu.dk/services/ SignalP/)分析信号肽,TMHMM Server2.0(http://www. cbs.dtu.dk/services/TMHMM/)预测跨膜区域等[21]。利用SMART在线服务器(http://smart.embl-heidelberg. de/)分析蛋白结构域。使用在线软件ProtParam(http:// web.expasy.org/protparam/)分析蛋白质氨基酸的理化性质;使用DNAMAN分析SYTA与其他物种同源基因的一致性。在线预测SYTA三维空间结构(http://www.sbg.bio.ic.ac.uk/phyre2/html/help.cgi?id=help/faq),用MEGA 7.0软件构建进化树。
1.2.4SYTA的亚细胞定位 用I和I对质粒pGEM-SYTA和pCV-mGFP分别进行双酶切,构建植物融合表达载体pCV-SYTA-mGFP,将重组质粒转化至DH5中,筛选阳性克隆进行测序检验。采用热激法将正确的重组质粒转至农杆菌EHA105感受态细胞中[22]。选取培养至4—6叶期健壮的本氏烟,将含阳性克隆的农杆菌重悬液采用注射法浸染本氏烟叶片[23],48 h后将注射孔部位的叶片表皮组织制作成临时玻片,倒置于共聚焦荧光显微镜观察本氏烟表皮细胞内绿色荧光蛋白表达情况。
1.2.5表达分析 番茄培育至4—6叶期后,含TMV-GFP的粗提病毒粒子以摩擦接种侵染番茄叶片,侵染7 d,设置健康对照,取TMV-GFP接种后1、3和7 d的番茄叶片提取总RNA,反转录成cDNA。利用qRT-PCR分析在不同组织部位的表达及在TMV胁迫下的表达变化,以番茄为内参基因,荧光定量反应引物对分别为P2、P3(表1),按照QuantiNova SYBR® Green PCR Kit使用说明进行,每个样品设有3次重复。反应条件:95℃3 min,95℃30 s,55℃ 30 s,变性到延伸循环40次。采用2-△△CT相对定量分析法计算基因的相对表达量,并用SPSS 16.0数据处理系统软件进行差异显著性分析[24]。
1.2.6SYTA对TMV侵染的影响 将含有pCV-SYTA-mGFP的农杆菌重悬液用注射法浸润4—6叶期的本氏烟叶片,以含有pCV-mGFP的重悬液处理作为空白对照,2 d后用含TMV-GFP的重悬液注射侵染原接种叶的同一部位。TMV-GFP注射3 d后,开始在紫外灯下观察TMV-GFP的移动情况,连续观察、拍照记录并收集3、5、10 d的接种叶及新叶叶片,每个时间点设置3个生物重复。利用间接ELISA法检测病毒的含量,分别取TMV-GFP注射接种后3、5及10 d的接种叶和新叶样品0.2 g,加入2 mL CBS(0.05 mol·L-1)一起研磨,5 000 r/min离心5 min,取上清液注入酶标板,重复3次,置于4℃包被过夜后,用PBST(0.01 mol·L-1)洗涤3次,每次3 min,加入150 µL封闭液(0.01 mol·L-1PBST中加入脱脂奶粉至终浓度5%),37℃孵育0.5 h后,用PBST洗涤3次。加入TMV的一抗(1﹕1 000封闭液稀释),于37℃孵育2 h后用PBST洗涤3次。加入HRP标记的二抗(1﹕ 5 000)37℃孵育2 h后用PBST洗涤3次。添加底物缓冲液(100 mL底物缓冲液内含有5.677 g Na2HP04,0.56 g柠檬酸,40 mg OPD和40 µL 30% H2O2,临用前用去离子水配制)37℃静置15—20 min(避光反应),待显示结束添加酶终止剂(98%浓硫酸,按1﹕9倒入去离子水中配制)。底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,可根据颜色深浅进行定性或定量分析[25-27]。利用酶标仪(BIO-Tek,USA)测定OD492的值,当处理组与健康植株对照组的OD492比值>2时,待测样品判断为阳性,存在TMV侵染。
2 结果
2.1序列及其编码蛋白结构分析
引物对P1自番茄cDNA中克隆出,测序结果表明其片段大小为1 620 bp(图1),上传至GenBank获得登录号为KR005629。根据NCBI工具ORF Finder预测结果,具有1 620 bp完整开放阅读框,编码539个氨基酸。糖基化位点预测发现,存在3个潜在的N端糖基化位点,分别为N153、N371及N505。通过蛋白质跨膜区段预测发现蛋白序列中具有一个跨膜区段,为所编码氨基酸第7—29位置。SingaIP 4.1分析其无信号肽位点。蛋白质结构域预测发现,其具有N端的跨膜区、中间连接区和C端的两个C2结构域,该结构域为Synaptotagmin所特有,因此,推测属于家族。
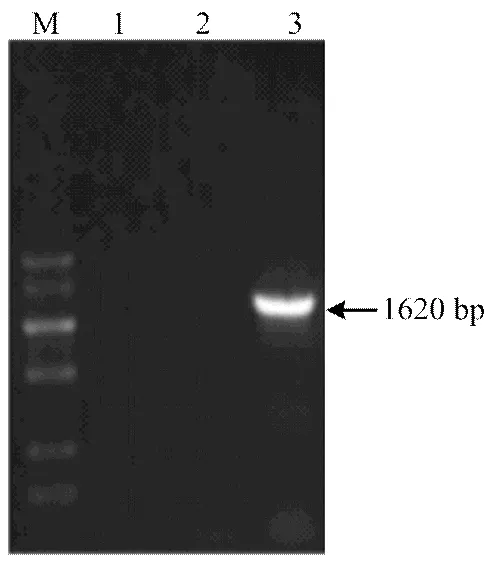
M:低分子量核酸marker BM5000+1.5K Low molecular DNA marker BM2000+1.5K;1、2:阴性对照Negative control;3:S.l SYTA
通过ProtParam预测显示,SYTA蛋白的理论分子量61.3723 kD,等电点6.85,分子式为C2788H4411N715O793S23。酸性氨基酸残基总数为73,碱性氨基酸残基总数为72,脂肪指数为92.13,亲水性平均数为-0.298,预测该蛋白为亲水性蛋白,不稳定指数为32.59,属于稳定蛋白。该蛋白中相对含量比较多的氨基酸为亮氨酸Leu(L)与赖氨酸Lys(K)(55个,占10.2%)、缬氨酸Val(V)(49个,占9.1%)、谷氨酸Glu(E)与脯氨酸Pro(P)(38个,占7.1%)及天冬氨酸Asp(D)(35个,占6.5%),而相对含量最少的氨基酸为半胱氨酸Cys(C)(6个,占1.1%)。
根据Phyre2参照synaptotagmin 2模型(PDB编号c4p42B)预测SYTA的三维空间结构图(图2)。SYTA模型有84%的覆盖率,可信度>90%(图2-A);拟南芥SYTA覆盖率78%,可靠度100%(图2-B)。从三维图中可以发现SYTA包括无规则卷曲(占16%)、螺旋(占22%)、折叠(占42%),而拟南芥SYTA(NM_127668)包括无规则卷曲(占13%)、螺旋(占22%)、折叠(占41%)。
2.2编码氨基酸序列比对及系统进化树
将的核苷酸及氨基酸序列与拟南芥、林烟草、绒毛状烟草、胡杨、黑鼠、芝麻、番茄基因组、可可和黄瓜9个物种的核苷酸及氨基酸序列进行比对,氨基酸相似性分别为73.3%、91.1%、91.1%、79.4%、20.0%、82.9%、99.8%、80.7%和71.3%(表2),总体上与茄科植物的同源性最高,在91%以上。利用MEGA 7.0软件将与上述物种序列进行聚类分析(图3),结果显示其与林烟草、绒毛状烟草等植物亲缘关系较近,与黄瓜较远,属于植物类大分支。

A图像绘制从N → C 端;模型尺寸(Å):X:73.431、Y:67.451、Z:65.895;B图像绘制从N → C端;模型尺寸(Å):X:72.027、Y:66.611、Z:66.481。绿色螺旋代表α螺旋,蓝色箭头表示β折叠和微弱的线表示卷曲Image A colored by rainbow N → C terminus; Model dimensions (Å): X: 73.431, Y: 67.451, Z: 65.895; Image B colored by rainbow N → C terminus; Model dimensions (Å): X: 72.027, Y: 66.611; Z: 66.481. Green helices represented α-helices, blue arrows indicated β-strands and faint lines indicated coil
2.3SYTA的亚细胞定位
利用农杆菌介导在本氏烟叶片细胞中表达SYTA-mGFP融合蛋白,2 d后在共聚焦荧光显微镜下观察。结果显示SYTA分布于本氏烟表皮细胞的细胞质膜,且存在不连续的聚集,与拟南芥SYT1在本氏烟表皮细胞中表达定位相似[13](图4)。

表2 不同物种SYTA核苷酸与氨基酸相似性比较

图3 基于不同物种SYTA的氨基酸构建的系统进化树
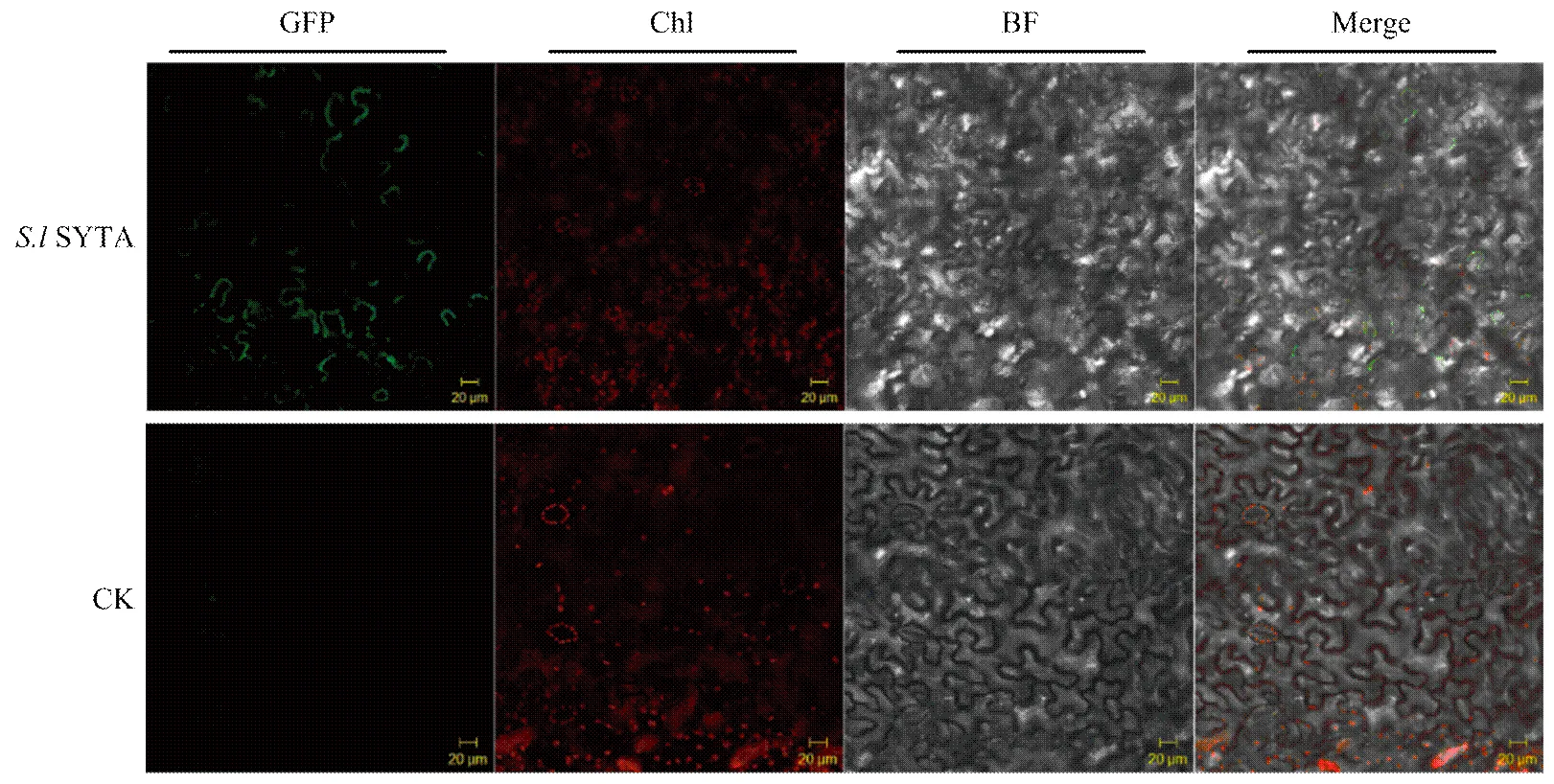
图4 S.l SYTA 在本氏烟中的亚细胞定位
2.4的表达分析
2.4.1在番茄不同部位的表达 在番茄的不同组织部位中呈现出了不同的表达模式,在番茄根中相对表达量最高,其次是叶,而在茎中的相对表达量相对较低(图5)。
2.4.2 在TMV胁迫下的表达 随着TMV胁迫时间的增加,表达量也发生变化。在接种后第1天时相对表达量呈现显著的上调,达到缓冲液处理对照的2倍;第3天时相对表达量虽然下降,但仍然高于对照,到第7天时基本恢复到了与缓冲液处理对照一致的水平(图6)。
2.4.3SYTA对TMV侵染的影响 在相同浓度的TMV-GFP处理下,SYTA瞬时表达的本氏烟及pCV-mGFP空载体对照中TMV呈现出不同的积累。在TMV侵染3 d后,SYTA瞬时表达的本氏烟及pCV-mGFP对照的接种叶上可以观察到明亮的绿色荧光,且接种叶与健康植物的OD492比值均>2,表明TMV已经在叶片中积累表达;而它们的新叶都未观察到有绿色荧光表达,并且新叶与健康植物的OD492比值均<2,表明TMV均未侵染移动至新叶。第5天时,在SYTA瞬时表达的本氏烟新叶上观察到有少量的绿色荧光,且新叶与健康植物的OD492比值>2,TMV已经侵染到了SYTA瞬时表达的本氏烟新叶上;而在表达pCV-mGFP空载体对照的本氏烟中未观察到绿色荧光,新叶与健康植物的OD492比值<2,TMV未侵染移动到新叶上,且TMV在接种叶和新叶中的积累量均明显高于其在pCV-mGFP对照处理的叶片;第10天时,表达pCV-mGFP对照的本氏烟的新叶开始观察到有少量绿色荧光,且新叶与健康植物的OD492比值>2,TMV侵染移动到对照组的新叶上。这一结果说明SYTA对TMV的侵染移动具有一定的促进作用(图7)。

图中所标不同小写字母表示差异显著(P<0.05)。下同

图6 在TMV胁迫下S.l SYTA的表达量
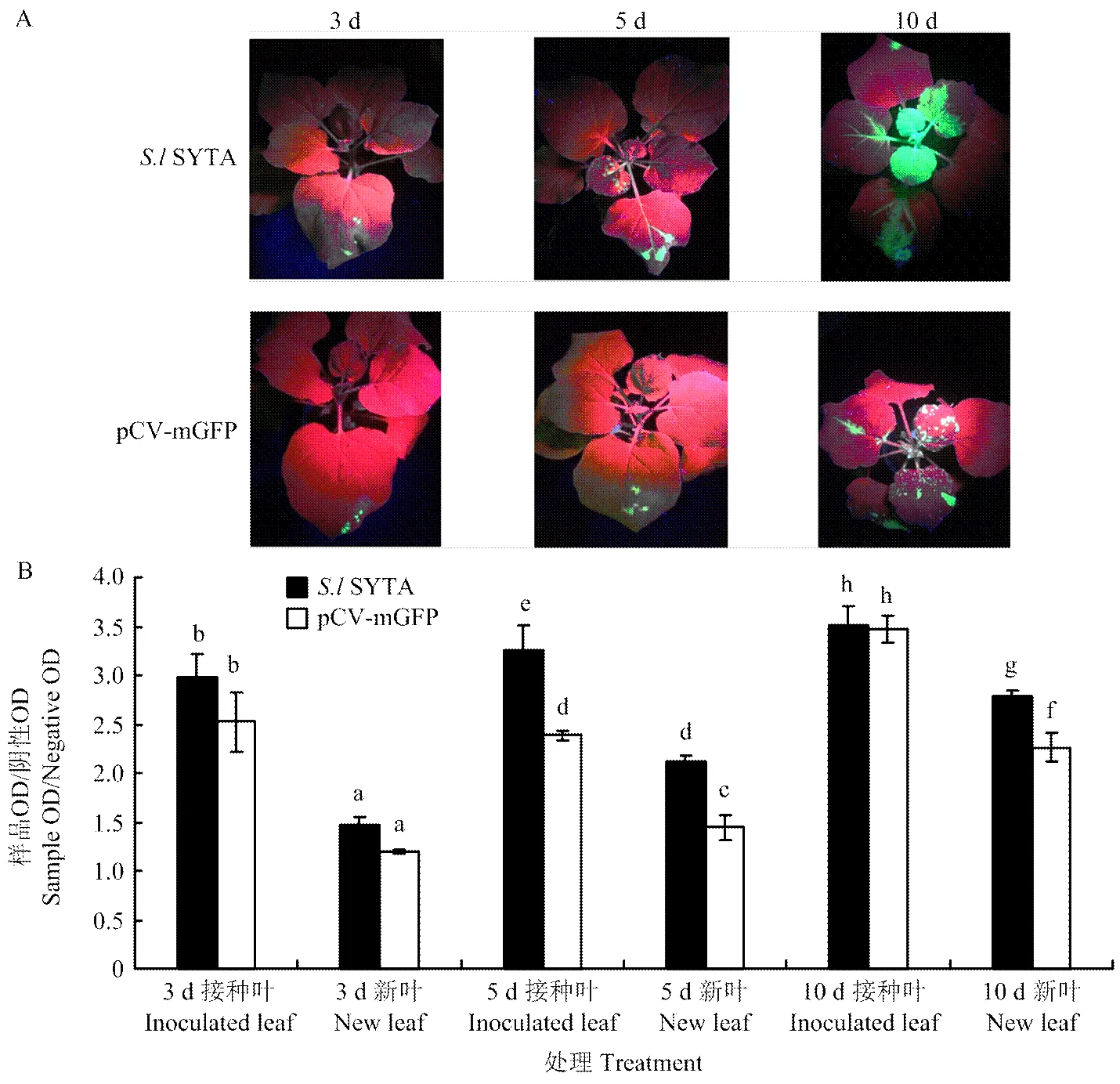
A:S.l SYTA瞬时表达的本氏烟中TMV的侵染移动情况 Symptoms of TMV-GFP infected N. benthamiana transiently expressed S.l SYTA under the UV light;B:ELISA检测不同处理本氏烟中TMV含量 Analysis of the accumulation levels of TMV in N. benthamiana under S.l SYTA treatment by enzyme-linked immunosorbent assay
3 讨论
Synaptotagmin是一个广泛存在于内分泌及神经细胞上的蛋白质家族。在Ca2+依赖性神经递质和激素释放过程中,作为囊泡融合中的Ca2+感受器,能够触发调节囊泡与质膜之间的融合过程,在蛋白质及膜转运过程中扮演着重要的作用[28-29]。在哺乳动物中关于SYT1功能了解得较多,SYT1在动物神经系统囊泡运输过程中起着极重要的作用,其余SYTs在动物神经系统或其他组织中行使运输功能[30]。植物中SYTs研究较少,仅见拟南芥中有关于SYTA功能研究的报道。本研究利用RT-PCR技术成功克隆了,通过的跨膜区、二级结构和三维结构预测分析显示,SYTA在整体结构上与拟南芥SYTA相似,含有1个跨膜区和2个核心区C2A和C2B。但三维结构显示二者在无规则卷曲(含转角)部位差异明显。在跨膜区和2个核心区C2A和C2B,二者分别有5、38和27个氨基酸差异。其与拟南芥SYTA的核苷酸和氨基酸的同源性对比分别是72.4%和73.3%,明显低于与茄科烟草之间的同源性(91%以上),也低于其与胡麻科的胡麻和杨柳科胡杨的同源性。因此,推测虽然同属于SYT家族,其功能可能与拟南芥存在一定的差异性。
关于植物SYTA的定位,Yamazaki等[13]研究发现拟南芥SYT1定位于细胞质膜,Sondra研究组最初发现拟南芥SYTA主要定位于细胞膜上衍生出的内核体上[4],后来进一步确认其定位于内质网和质膜的接触点[18]。本研究在烟草表皮细胞中表达SYTA-GFP,共聚焦观察SYTA主要定位于细胞质膜,并且沿着细胞壁不连续排列,与LEWIS等报道结果一致[4]。因为没有精细的定位marker,所以不能够进一步确定SYTA是否也是在细胞的内质网和质膜的接触点。
田文鹏[31]在关于拟南芥SYTs家族的研究中发现,拟南芥SYTA在叶中的表达量相对较高。而在番茄中,SYTA在根中的表达量最高,出现这一组织表达差异的原因尚不明确。Levy等[18]证实了SYTA是形成ER-PM接触位点所必需的,MPTVCV与SYTA互作以形成病毒运动的复制位点。那么在TMV胁迫时,它在植物中的表达量是否会发生变化?本研究对6叶期的番茄进行TMV侵染,利用qRT-PCR检测的表达量,发现在叶片中的表达呈现出先上升后下降,最后又恢复至正常。出现这一结果可能是番茄中SYTA对病毒侵染作出的积极响应,大量表达来促进病毒侵染初期的细胞间移动。
在拟南芥SYTA突变体植株中,CaLCuV系统性侵染减慢,TMV和CaLCuV的运动蛋白在细胞间的移动受到抑制[4-5]。那么SYTA是否也能影响病毒在植物中的移动?本研究在本氏烟中瞬时表达SYTA,并用TMV以农杆菌注射侵染。结果发现,与对照相比,在SYTA瞬时表达的本氏烟中,TMV的移动速度明显增快,说明SYTA与拟南芥SYTA功能类似,对TMV在植物中的移动具有一定的促进作用。出现这一结果的原因可能是在瞬时表达SYTA的烟草细胞部位,SYTA通过调节胞间连丝促进了TMV侵染叶片初期的细胞间移动,使TMV在侵染初期得到在侵染点更快的扩散。
4 结论
全长1 620 bp,编码蛋白具有类似于拟南芥SYTA蛋白质的二级结构,1个跨膜结构域(从羧基端到氨基端)、1个连接链和2个处于胞质中的C2结构域,属于SYT蛋白家族。SYTA主要定位于细胞质膜,在细胞质周缘有少许分布。SYTA在根中的表达量最大。SYTA可能通过促进TMV在侵染初期的细胞间移动促进了TMV在本氏烟中的移动速度,并且在TMV侵染初期,积极响应大量表达来促进病毒在番茄细胞间移动。
References
[1] 刘艳芝, 马井玉, 徐祥文, 王付彬, 王淑霞. 1%香菇多糖水剂防治番茄病毒病田间药效试验. 蔬菜, 2014(6): 7-8.
LIU Y Z, MA J Y, XU X W, WANG F B, WANG S X. Field control efficacy experiment of 1% lentinan agent to prevent tomato virus disease., 2014(6): 7-8. (in Chinese)
[2] 吕佩珂, 李明远, 吴钜文. 中国蔬菜病虫原色图谱. 3版. 北京: 中国农业出版社, 2002.
Lü P K, LI M Y, WU J W.. Beijing: China Agriculture Press, 2002. (in Chinese)
[3] Yoshihara M, Montana E S. The synaptotagmins: calcium sensors for vesicular trafficking., 2004, 10(6): 566-574.
[4] Lewis J D, Lazarowitz S G.synaptotagmin SYTA regulates endocytosis and virus movement protein cell-to-cell transport.,2010, 107(6): 2491-2496.
[5] Uchiyama A, Shimada-Beltran H, Levy A, Zheng J Y, Javia P A, Lazarowitz S G. Thesynaptotagmin SYTA regulates the cell-to-cell movement of diverse plant viruses.,2014, 5: Article 584.
[6] Perin M S, Fried V A, Mignery G A, Jahn R, Südhof T C. Phospholipid binding by a synaptic vesicle protein homologous to the regulatory region of protein kinase C., 1990, 345(6272): 260-263.
[7] Craxton M. Synaptotagmin gene content of the sequenced genomes., 2004, 5(1): 43.
[8] Jensen R B, Lykke-Andersen K, Frandsen G I, Nielsen H B, Haseloff J, Jespersen H M, Mundy J, Skriver K. Promiscuous and specific phospholipid binding by domains in ZAC, a membrane-associatedprotein with an ARF GAP zinc finger and a C2 domain., 2000, 44(6): 799-814.
[9] Perin M S, Brose N, Jahn R, Sudhof T C. Domain structure of synaptotagmin (p65).,1991, 266(1): 623-629.
[10] Bai J, Chapman E R. The C2 domains of synaptotagmin-partners in exocytosis., 2004, 29(3): 143-151.
[11] Rizo J, Südhof T C. C2-domains, structure and function of a universal Ca2+-binding domain.,1998, 273(26): 15879-15882.
[12] Geppert M, Goda Y, Hammer R E, Li C, Rosahl T W, Stevens C F, Südhof T C. Synaptotagmin I: a major Ca2+sensor for transmitter release at a central synapse., 1994, 79(4): 717-727.
[13] Yamazaki T, Kawamura Y, Minami A, Uemura M. Calcium-dependent freezing tolerance ininvolves membrane resealing via synaptotagmin SYT1., 2008, 20(12): 3389-3404.
[14] Bai J, Tucker W C, Chapman E R. PIP2increases the speed of response of synaptotagmin and steers its membrane-penetration activity toward the plasma membrane., 2004, 11(1): 36-44.
[15] Schapire A L, Valpuesta V, Botella M A. Plasma membrane repair in plants.,2009, 14(12): 645-652.
[16] 高彬. 拟南芥SYTA基因在盐胁迫响应中的功能研究[D].济南: 山东师范大学, 2011.
GAO B. Response of theto salt stress[D]. Ji’nan: Shandong Normal University, 2011. (in Chinese)
[17] Kawamura Y, Uemura M. Mass spectrometric approach for identifying putative, plasma membrane proteins ofleaves associated with cold acclimation l., 2003, 36(2): 141-154.
[18] Levy A, Zheng J Y, Lazarowitz S G. Synaptotagmin SYTA forms ER-plasma membrane junctions that are recruited to plasmodesmata for plant virus movement.2015, 25(15): 2018-2025.
[19] Lu Y, Yan F, Guo W, Zheng H, Lin L, Peng J, Adams M J, Chen J.11-kDa protein granules move within the cytoplasm and traffic a host protein normally found in the nucleolus.,2011, 12(7): 666-676.
[20] Liu Y, Schiff M, Marathe R, Dinesh-Kumar S P. Tobacco,and/like genes are required for-mediated resistance to., 2002, 30(4): 415-429.
[21] Krogh A, Larsson B, Heijne G V, Sonnhammer EL L. Predicting transmembrane protein topology with a hidden Markov model: application to complete genomes., 2001, 305(3): 567-580.
[22] 刘兆明, 刘宗旨, 白庆武, 方荣祥. Agroinfiltration在植物分子生物学研究中的应用.生物工程学报, 2002, 18(4): 411-414.
Liu Z M, Liu Z Z, Bai Q W, Fang R X. Agroinfiltration, a useful technique in plant molecular biology research., 2002, 18(4): 411-414. (in Chinese)
[23] Li Y, Geng Y, Song H, Zheng G, Huan L, Qiu B. Expression of a human lactoferrin N-lobe inwith-based agroinfection., 2004, 26(12): 953-957.
[24] 彭浩然, 潘琪, 魏周玲, 蒲运丹, 张永至, 吴根土, 青玲, 孙现超. 番茄抗性相关基因的克隆、表达与抗病毒功能. 中国农业科学, 2017, 50(7):1242-1251.
PENG H R, PAN Q, WEI Z L, PU Y D, ZHANG Y Z, WU G T, QING L, SUN X C. Cloning, expression and anti-virus function analysis of tomato resistance-related gene., 2017, 50(7): 1242-1251. (in Chinese)
[25] 魏周玲, 彭浩然, 潘琪, 张永至, 蒲运丹, 吴根土, 青玲, 孙现超. 核糖体失活蛋白(-MC)亚细胞定位及对TMV 的抑制作用. 中国农业科学, 2017, 50(5): 840-848.
WEI Z L, PENG H R, PAN Q, ZHANG Y Z, PU Y D, WU G T, QING L, SUN X C. Cloning, subcellular localization of the ribosome- inactivating protein-MC and its antiviral effect on TMV., 2017, 50(5): 840-848. (in Chinese)
[26] Voller A, Bartlett A, Bidwell D E, Clark M F, Adams A N. The detection of viruses by enzyme-linked immunosorbent assay (ELISA)., 1976, 33(1): 165-167.
[27] 吴丽萍. 马铃薯两种病毒的RT-PCR和ELISA检测技术的研究[D]. 兰州: 甘肃农业大学, 2006.
Wu L P. Study on technology of detecting of two main virus of potato with ELISA and RT-PCR[D]. Lanzhou: Gansu Agricultural university, 2006. (in Chinese)
[28] Brose N, Petrenko A G, Sudhof T C, Jahn R. Synaptotagmin: a calcium sensor on the synaptic vesicle surface.1992, 256(5059): 1021-1025.
[29] 薛箭飞, 陈虹, 陈乃宏. Synaptotagmin在神经递质释放过程中的作用. 生理科学进展, 2006, 37(1): 65-68.
XUE J F, CHEN H, CHEN N H. The role of Synaptotagmin in transmitter release., 2006, 37(1): 65-68. (in Chinese)
[30] Chen G H, Wang Y J, Qin S, Yang Q G, Zhou J N, Liu R Y. Age-related spatial cognitive impairment is correlated with increase of synaptotagmin 1 in dorsal hippocampus in SAMP8 mice.,2007, 28(4): 611-618.
[31] 田文鹏. 拟南芥synaptotagmin家族组织定位及非生物胁迫表达谱研究[D]. 兰州: 兰州大学, 2011.
TIAN W P. Histochemical localization and expression profiling analysis under abiotic stresses of synaptotagmin family in[D]. Lanzhou: Lanzhou University, 2011. (in Chinese)
(责任编辑 岳梅)
Cloning, Expression Analysis of
PAN Qi, LIU XuXu, PENG HaoRan, PU YunDan, ZHANG YongZhi, YE SiHan, WU GenTu, QING Ling, SUN XianChao
(College of Plant Protection, Southwest University, Chongqing 400716)
【Objective】The objective of this study is to clone(), to analyze its bioinformatic characteristics, tissue expression and subcellular localization, the effect of green fluorescence protein (GFP) labeled(TMV) on the expression level of, its effect on the infection and movement of TMV and to provide a theoretical basis for further investigation of theinfluence on the process of the infection and movement of the plant viruses. 【Method】The primer pairs ofwere designed using Primer Premier 5.0 software based on the sequence of homologousin the genome ofthe. A complete coding sequence ofwas isolated and obtained by RT-PCR method. The sequence characteristics ofwas analyzed by bioinformatics tools. Multiple sequence alignments betweenand its homologous ones from other species and a phylogenetic tree of homologous species were made by MEGA 7.0. The subcellular localization ofSYTA was analyzed through fusing with GFP protein. The real-time fluorescent quantitative PCR (qRT-PCR) was used to analyze the expression ofin different tissues and the change of its expression level in the TMV-GFP infected. TheSYTA was transiently expressed in theby agroinfiltration, and then ELISA was used to detect the accumulation and movement of TMV-GFP. 【Result】A full-lengthof 1 620 bp was cloned fromSequence alignment and bioinformatics analysis revealed that the deduced amino acids ofhad common characteristics offamily with an N-terminal transmembrane region, a linker of variable size, and two C-terminal C2 domains. Furthermore,has the closest phylogenetic relationship to that of theandin amino acids sequences, and distanced from that ofSubcellular localization results showed thatSYTA was distributed at plasma membrane. The expression level ofin different tissues ofwas root>leaf>stem. The expression ofinobviously increased on the 1st day and decreased to the normal level on the 7th day after inoculation of TMV-GFP.Following the transient expression ofSYTA in, TMV-GFP was inoculated. After 5 days, TMV-GFP had moved to the new leaf of the. But no TMV-GFP was found in the new leaf of the controlin which the empty vectors were transiently expressed. ELISA assay results showed that the accumulation of the TMV-GFP in the samples under treatment was obviously higher than that in the control group after 5 days of TMV-GFP inoculation.【Conclusion】has the typicalcharacteristics of thefamily.SYTAlocated on theplasma membrane of epidermal cell of. Theexpressed highest in root of. Under the stress of TMV-GFP, the expression ofinobviously increased firstly and then decreased to the normal level. In theSYTA transient expression of, theSYTA could promote the initial accumulation and movement of TMV-GFP.
;; gene cloning; expression and analysis; TMV-GFP
2017-02-04;接受日期:2017-03-20
国家自然科学基金(31670148)、重庆市社会事业与民生保障创新专项(cstc2015shms-ztzx80012)、中央高校基本科研业务费专项资金(XDJK2016A009,2362015xk04)
潘琪,E-mail:306077223@qq.com。通信作者孙现超,E-mail:sunxianchao@163.com

