STK1对玉米大斑病菌附着胞发育过程中糖原和脂肪积累的影响
张运峰,张淑红,武秋颖,范永山
对玉米大斑病菌附着胞发育过程中糖原和脂肪积累的影响
张运峰,张淑红,武秋颖,范永山
(唐山师范学院生命科学系,河北唐山063000)
【目的】通过研究与附着胞发育的关系,明确附着胞发育过程中对糖原和脂肪合成的调控作用,为阐明玉米大斑病菌()附着胞发育的分子机制打下基础。【方法】以玻璃平板为疏水基质表面,通过“插片分离菌丝”法使菌丝附着于载玻平板表面,然后将附着有菌丝的玻璃平板置于保湿培养皿中22℃、14 h光照和10 h黑暗交替培养,诱导野生型菌株(WT)和基因敲除突变体()的菌丝形成附着胞,每隔12 h显微观测附着胞的形态和发育过程;分别将附着有未经诱导的WT和菌丝的玻璃平板和经过48 h附着胞诱导的玻璃平板浸没在I2/KI染色液中静置染色48 h,显微观察附着胞发育过程中糖原的变化;分别将附着有未经诱导的WT和菌丝的玻璃平板和经过48 h附着胞诱导的玻璃平板置于-70℃的超低温冰箱中冷冻处理30 min,然后将玻璃平板置于Oil-red O染色液中静置染色24 h,显微观察附着胞发育过程中脂肪的代谢变化;利用real-time PCR技术检测附着胞发育过程中糖原和脂肪合成关键酶基因的表达情况。【结果】玉米大斑病菌WT菌株和菌株利用菌丝尖端在玻璃平板的疏水表面均能够产生附着胞,但菌株的附着胞发育与WT菌株显著不同,WT菌株48 h内为单胞附着胞,诱导48 h后少数附着胞形成了多细胞附着胞,而菌株在诱导24 h后即出现了扭曲附着胞的异形附着胞形态,48 h后还出现了双杈、多杈和O型等多种异常的附着胞类型;WT菌株和菌株的菌丝和附着胞进行糖原和脂肪的染色后,发现WT菌株的菌丝和附着胞都有均匀分布的糖原和脂肪,而菌株的附着胞内几乎没有糖原和脂肪的积累,与WT菌丝的结果不同,在菌株的菌丝内糖原沉积减少,脂肪主要分布于菌隔部位;附着胞诱导48 h后,WT菌株糖原合酶(glycogen synthase,GS)和二酰甘油酰基转移酶(diacylglycerol O-acyltransferase,DGAT)基因的表达量比诱导前分别增加了6.6%和40.3%,而⊿菌株GS基因的表达量则下降了9.0%,DGAT基因的表达量仅上升了24.5%。【结论】的功能缺失使玉米大斑病菌的附着胞发育形态异常,糖原积累下降,脂肪分布不均,糖原和脂肪合成的关键酶基因表达量均显著下降,表明糖原和脂肪代谢与玉米大斑病菌的附着胞发育密切相关。
玉米大斑病菌;;附着胞发育;糖原;脂肪
0 引言
【研究意义】附着胞是玉米大斑病菌()侵入寄主叶肉细胞的重要侵染机构,附着胞的发育决定了玉米大斑病菌的发病进程和危害程度[1];糖原和脂肪代谢产生的甘油是植物病原真菌附着胞产生和维持膨压的关键化学物质[2-3];是玉米大斑病菌渗透胁迫调节的关键Hog1-MAPK基因[4];开展与附着胞发育的关系及在附着胞发育过程中对糖原和脂肪代谢的调控作用研究,将有利于阐明玉米大斑病菌调控附着胞发育的分子机制。【前人研究进展】由玉米大斑病菌引起的玉米大斑病是世界各地玉米产区重要真菌病害,在流行年份常会造成50%以上的玉米减产[5]。在自然界中,玉米大斑病菌依靠分生孢子作为初侵染和再侵染的接种体,通过气流传播到达玉米叶片表面,经过下面5个阶段完成侵染过程:①分生孢子萌发产生芽管;②芽管发育成为菌丝并在顶端分化形成附着胞;③在黑色素和甘油等物质形成的膨压作用下,附着胞弯曲膨大形成钩状膨大物,产生侵染栓穿透角质层和表皮细胞壁;④在寄主细胞内形成次生菌丝,侵染邻近的表皮细胞并进入叶肉细胞;⑤感病品种在适宜条件下5—7 d 后即出现症状,并从病斑中释放新的分生孢子,重新侵染寄主[6]。因此,附着胞的正常发育是玉米大斑病菌成功侵入玉米叶片的必要条件。范永山等[7]研究发现MAPK途径对玉米大斑病菌的附着胞发育有重要的调控作用,利用MEK(MAPK kinase)特异性抑制剂U0126处理可使玉米大斑病菌的附着胞产生数目显著下降;谷守芹[8]克隆了调控玉米大斑病菌渗透胁迫的Hog1-MAPK同源基因(GenBank登录号:AY849317.2);Li等利用酵母互补试验证明具有调控盐胁迫的能力,并利用基因敲除突变体()证明不仅影响菌丝和分生孢子发育,而且对HT毒素活性和致病性也有重要调控作用[4,9]。附着胞的形成除了受到信号转导途径调控,糖原和脂肪的代谢也与附着胞的发育和功能直接相关,附着胞中的糖原和脂肪会降解成为甘油,甘油在附着胞内积累而形成的膨压是侵入钉侵入寄主的主要动力[10-12]。王梅娟等[3]研究发现,甘油是玉米大斑病菌主要的一种渗透胁迫调节物质。【本研究切入点】是玉米大斑病菌主要的渗透胁迫调节MAPK基因,但对玉米大斑病菌附着胞发育的调控作用尚未明确。【拟解决的关键问题】通过比较野生型菌株(WT)与基因敲除突变体()在附着胞发育、糖原和脂肪积累,以及糖原和脂肪合成关键酶基因表达等3个方面的差异,分析对附着胞发育过程中糖原和脂肪合成代谢的调控作用。
1 材料与方法
试验于2016年在唐山师范学院分子植物病理学实验室完成。
1.1 菌株
玉米大斑病菌基因敲除突变体()及其野生型菌株(WT)由河北农业大学真菌毒素与植物分子病理学实验室馈赠。
1.2 试剂
糖原染料(I2/KI):碘化钾60 mg,碘10 mg,蒸馏水1 mL,室温保存;脂肪染料(Oil-Red O):取0.6 mL的Oil-Red O饱和液(Oil Red O:0.5 g;80%异丙醇:100 mL。可长期保存),加入0.4 mL的无菌ddH2O,静置10 min,0.22 μm滤膜过滤除菌,现配现用。
MiniBEST Universal RNA Extraction Kit,PrimeScriptTMRT reagent Kit,One Step SYBR® PrimeScriptTMRT-PCR Kit等购于宝生物工程(大连)有限公司。
1.3 试验方法
1.3.1 玉米大斑病菌的附着胞诱导 由于玉米大斑病菌不能形成分生孢子[8],因此,本试验利用菌丝来诱导附着胞的产生。参考范永山等的方法进行改进建立了“插片分离菌丝”法,并使用分离的菌丝进行附着胞的诱导[13-14]。首先在PDA培养基上25℃黑暗培养至菌落直径约30 mm,将经过高压蒸汽灭菌的盖玻片(Size: 22 mm×22 mm)沿菌落生长方向20°—30°夹角斜插于菌落边缘处,当菌丝生长至盖玻片中部时,取出盖玻片置于保湿培养皿中22℃、14 h光照和10 h黑暗交替培养12、24、36和48 h,显微观察附着胞的形态和产生情况。
1.3.2 玉米大斑病菌菌丝和附着胞的糖原染色 将诱导附着胞48 h时的盖玻片,小心地置于糖原染色液中,静止染色1 h,显微镜观察菌丝和附着胞的糖原积累及分布情况。
1.3.3 玉米大斑病菌菌丝和附着胞的脂肪染色 将诱导附着胞48 h时的盖玻片,于-70℃冰箱中冷冻30 min后,小心地置于经0.22 µm滤膜过滤后的Oil-Red O染色液中,静止染色24 h,显微镜下强光观察菌丝和附着胞中脂肪的积累及分布情况。
1.3.4 Real-time PCR检测糖原和脂肪合成关键酶基因的表达 根据玉米大斑菌基因组数据库(JGI,http://genome.jgi.doe.gov/Settul)糖原合酶(glycogen synthase,GS)基因、二酰甘油酰基转移酶(diacylglycerol O-acyltransferase,DGAT)基因和18S rRNA基因(18S rDNA,内参基因)的cDNA序列,利用Primer Premier 5.0软件设计引物(表1),用于real-time PCR。
参照巩校东等[15]的方法进行GS和DGAT基因的表达分析:以18 S rDNA片段为内参,确定PCR反应的循环数及cDNA的模板量;15 µL扩增体系中含有2×One Step SYBR RT-PCR Buffer Ⅲ 7.5 µL,TaKaRa Ex Taq HS(5 U·µL-1)0.3 µL,PrimeScript RT Enzyme Mix Ⅱ0.3 µL,正向引物和反向引物(10 µmol·L-1)各0.5 µL,Total RNA 2 µL;real-time PCR反应程序:42℃ 5 min,95℃ 10 s,95℃ 5 s、60℃ 30 s、40个循环。采用Illumina Eco实时定量PCR系统进行扩增,以比较Ct值法分析GS和DGAT基因在附着胞诱导前及诱导后48 h时的表达变化。
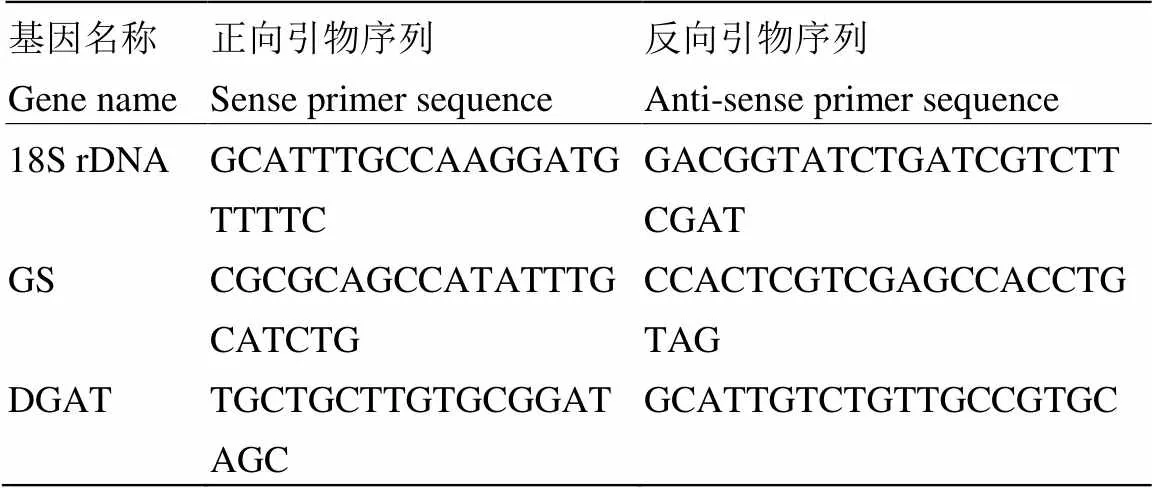
表1 Real-time PCR所扩增的基因及引物
2 结果
2.1对玉米大斑病菌附着胞发育的影响
插片分离玉米大斑病菌菌丝,在玻璃平板上诱导附着胞。结果发现,野生型菌株(WT)和基因敲除突变体菌株()均可形成附着胞。WT和菌株12 h即可观察到附着胞产生。通过观察单个视野(10×10倍)范围内平均附着胞数目,发现24 h后WT和菌株的附着胞数目均迅速增加,48 h时,调查单个视野内附着胞数目,发现两者菌丝形成附着胞的能力没有显著差异。但是,WT菌株的附着胞24—36 h以单个菌丝顶端膨大形成的单细胞附着胞为主(图1-a),48 h时则以单个菌丝形成的、由多个膨大细胞形成的多细胞附着胞为主(图1-b)。而菌株则很少出现单个菌丝形成的单细胞附着胞和多细胞附着胞,在12 h时以单个菌丝形成的双杈附着胞为主(图1-c),24 h开始出现附着胞扭曲现象(图1-d),36 h出现单个菌丝形成的多杈附着胞(图1-e),而到48 h时,会出现O型附着胞(图1-f)。在WT菌株中没有发现双杈、扭曲、多杈和O型等异常发育形态附着胞,表明缺失改变了附着胞的形态建成和发育方式。

a:单胞附着胞single-cell appressorium;b:多细胞附着胞multiple-cell appressorium;c:双杈附着胞two-branch appressorium;d:扭曲附着胞twist appressorium;e:多杈附着胞multiple-branch appressorium;f:O型附着胞O-shape appressorium
2.2对玉米大斑病菌菌丝和附着胞糖原积累的影响
利用I2/KI染色剂观测玉米大斑病菌菌丝和附着胞内糖原的沉积情况。结果发现WT菌株在菌丝和附着胞都有较深的糖原沉积,而菌株的菌丝内糖原沉积较少,在附着胞内几乎没有发现糖原的沉积(图2)。结果表明基因缺失干扰了菌丝内糖原的合成,阻断了附着胞发育过程中糖原的积累。
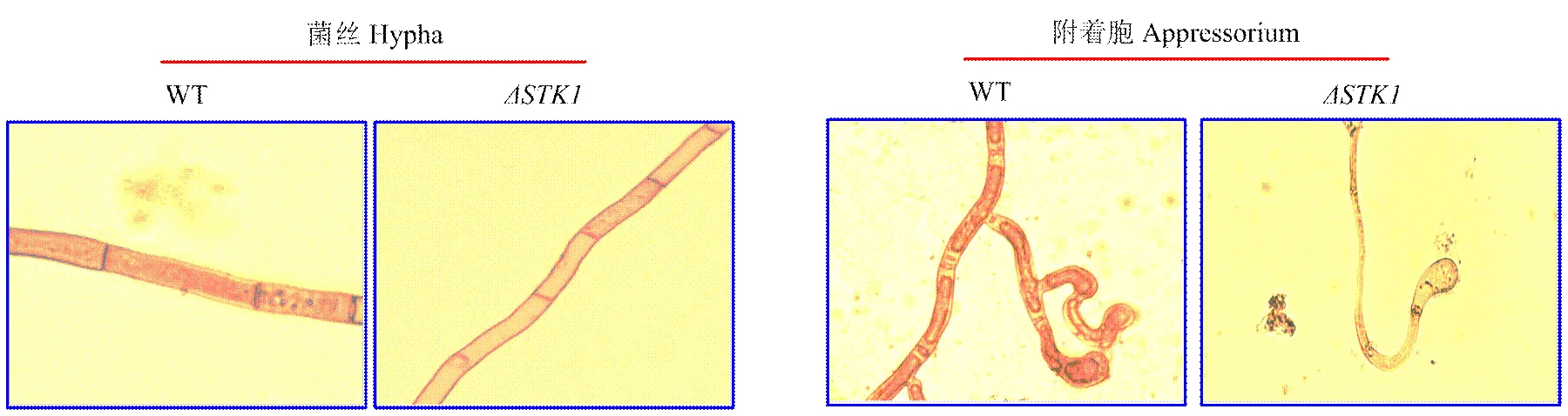
图2 STK1对玉米大斑病菌菌丝和附着胞糖原积累的影响
2.3对玉米大斑病菌菌丝和附着胞脂肪积累的影响
利用Oil-red O染色剂进行染色,发现WT菌株的菌丝和附着胞内均有较多的脂肪沉积,并且脂滴分布均匀;而菌株的没有发育成附着胞的菌丝内脂肪沉积显著减少,发育成附着胞的菌丝内的脂滴体积增大但数量减少,且分布极其不均匀,主要沉积在菌隔附近,在附着胞内没有脂肪沉积(图3)。结果表明的缺失干扰了脂肪的分布,阻断了脂肪在附着胞内的累积。
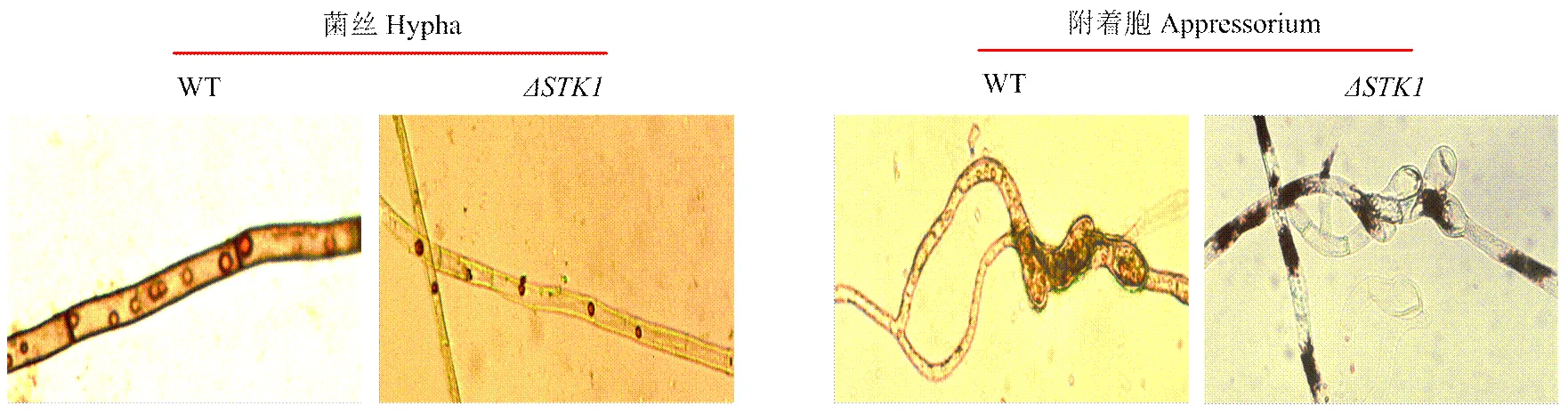
图3 STK1对玉米大斑病菌菌丝和附着胞脂肪积累的影响
2.4对玉米大斑病菌糖原和脂肪合成关键酶基因表达的影响
利用real-time PCR技术检测了WT和菌株在附着胞诱导前及诱导48 h时,GS和DGAT基因的相对表达量差异。结果发现WT菌株和菌株在附着胞诱导前GS基因表达量差异不显著;与附着胞诱导前(CK)相比,诱导48 h时,WT菌株GS基因的相对表达量显著增加,增加率为6.6%,而菌株的GS基因相对表达量显著下降,下降率为9.0%(图4)。
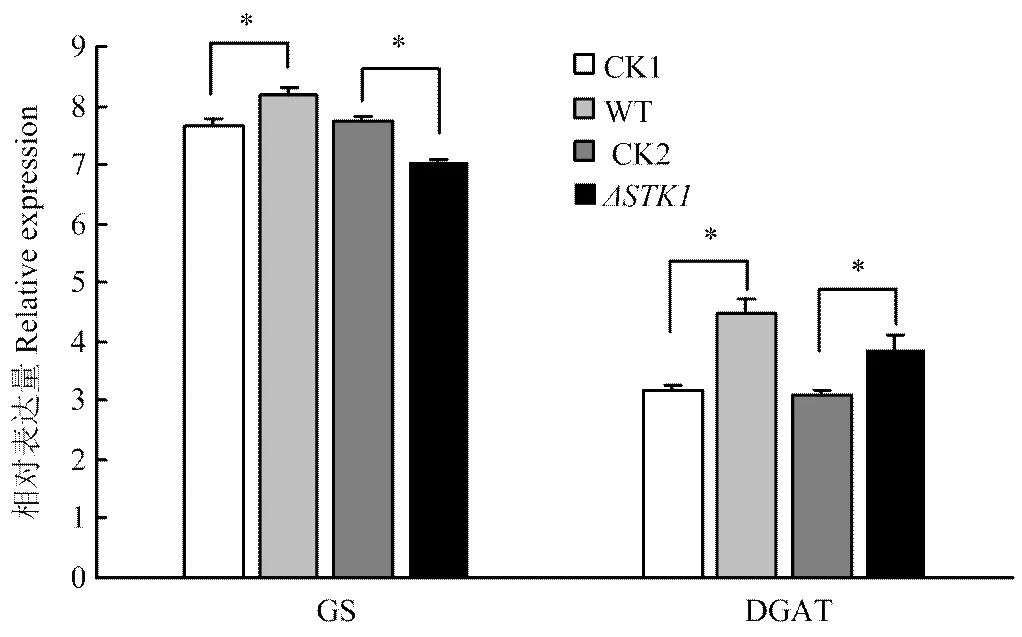
CK1:WT附着胞诱导前before appressorium induction of WT;CK2:ΔSTK1附着胞诱导前before appressorium induction ofΔSTK1;WT和ΔSTK1:WT和ΔSTK1菌株附着胞诱导48 h 48 h appressorium induction of WT and ΔSTK1
WT和菌株在附着胞诱导前DGAT基因表达量差异不显著;与附着胞诱导前(CK)相比,诱导48 h时,WT和菌株DGAT基因的相对表达量均显著增加,但增加的程度不同:WT菌株DGAT基因的相对表达量增加了40.3%,而菌株的表达量仅增加了24.5%(图4)。
3 讨论
3.1 调控植物病原真菌附着胞发育和功能的MAPK基因
附着胞是植物病原真菌感受到来自植物病原真菌内部、寄主叶片和外界环境的刺激信号后,启动一系列信号传导途径进行调控形成的。目前主要发现3条信号通路调控植物病原真菌附着胞的分化和发育:Ca2+信号通路、cAMP信号通路和MAPK信号通路[16],其中MAPK信号通路由于可直接将细胞外信号传导到细胞核内而备受关注。在植物病原真菌中至少发现了Fus3/Kss1、Slt2和Hog1等3条MAPK途径,分别与菌丝侵染、细胞壁合成和渗透胁迫调控有关[17]。研究发现,调控稻瘟病菌()附着胞发育和功能的MAPK基因主要来自于Fus3/Kss1信号通路和Slt2信号通路,而不是Hog1信号通路。例如,稻瘟病菌(Fus3-homolog)基因敲除突变体不能形成成熟的附着胞[18],(Slt2-homolog)基因敲除突变体可以形成附着胞但不能侵入寄主的表皮细胞[19],而OSM1(Hog1-homolog)基因虽然具有渗透胁迫调节功能,但与附着胞发育及膨压形成无关[20]。研究证实,植物致病真菌、的Hogl同源基因CpMK1、SRMI也不是附着胞发育和功能的必要条件[21-22]。但是,笔者课题组的前期研究发现,玉米大斑病菌的Hog1- homolog基因敲除后,不产生分生孢子,HT-毒素的活性下降,不能侵入没有伤口的玉米叶片[9],说明该基因是病菌致病性的必需基因之一。在此基础上,本研究发现基因敲除后,虽然利用菌丝也能形成附着胞,但形成的附着胞发育呈现多型化和畸形化,产生了扭曲和O形附着胞及二杈、三杈等多分支附着胞,而在野生型菌株中仅会形成单细胞附着胞和多细胞附着胞这两种正常附着胞[13,23]外,没有发现突变体菌株形成的异常附着胞。Kong 等[24]研究表明,利用菌丝尖端产生的附着胞的膨压显著低于利用分生孢子芽管产生的附着胞。这也可以用于解释基因敲除后由于不能产生分生孢子而只能利用菌丝尖端形成的附着胞,由于膨压较小而不能直接侵入玉米叶片。另外,基因敲除突变体利用菌丝形成的附着胞发育出现多型化和畸型化,也可能是该突变体失去致病毒力的原因之一。该研究结果与植物病原真菌和的Hog1-homolog基因、的研究结果是一致的,这两个基因敲除后也会失去对寄主的致病毒力,不能侵染没有损伤的健康植物组织[25-26]。
3.2 脂肪代谢和糖原代谢与附着胞功能的关系
附着胞是植物病原真菌致病过程中形成的一种半球状侵染结构,它的主要功能是积累突破寄主叶片表皮所需的机械膨压,侵入寄主细胞内部,形成次生侵染菌丝[12]。附着胞膨压的产生依赖四周沉积的黑色素及附着胞内的渗透胁迫调节物质。没有黑色素植物病原真菌就不能形成正常的附着胞,不能直接侵入寄主细胞内部[27]。本研究表明,玉米大斑病菌基因敲除突变体利用菌丝形成的附着胞有一定的黑色素沉积,因此,附着胞的功能丧失主要与附着胞内渗透胁迫调节物质的积累有关。前期研究中发现调节玉米大斑病菌渗透胁迫的物质主要是甘油、海藻糖和甘露醇[3,28]。但是,曹志艳等[2]研究表明,玉米大斑病菌附着胞细胞壁孔径(2.1—2.7 nm)远大于稻瘟病菌附着胞细胞壁孔径(<1.0 nm),不能有效阻挡甘油分子的外渗,但附着胞膨压仍可达5.4 MPa,因此推测玉米大斑病菌附着胞膨压的产生除了甘油以外,还可能有其他较大的溶质分子。Wang等研究表明,稻瘟病菌附着胞膨压的形成依赖附着胞内甘油等渗透调节物质的积累,但甘油主要来自于孢子萌发时糖原和脂类物质的降解[29-30]。因此,糖原和脂肪代谢与附着胞发育和功能密切相关。本研究表明,玉米大斑病菌基因敲除后,在附着胞内都没有明显的糖原和脂肪积累,在菌丝内糖原沉积减少,脂类物质沉积不均匀,主要分布在菌丝的隔膜部位。另外,本试验还发现,附着胞诱导48 h后,野生型菌株的糖原合酶(GS)和二酰甘油酰基转移酶(DGAT)基因表达量分别增加了6.6%和40.3%,而基因敲除突变体GS基因的表达量却下降了9.0%,DGAT基因的表达量仅上升了24.5%,表明可通过调控GS和DGAT基因表达,调节糖原和脂肪在菌丝及附着胞内的积累,从而调控玉米大斑病菌的致病性。
4 结论
S缺失导致玉米大斑病菌的附着胞出现双杈附着胞、扭曲附着胞、多杈附着胞和O型附着胞等多种异常类型;基因敲除后附着胞内几乎没有发现糖原和脂肪的积累,菌丝内糖原沉积明显减少,脂肪主要分布在菌隔部位,参与糖原和脂肪代谢的关键基因糖原合酶(GS)和二酰甘油酰基转移酶(DGAT)基因的相对表达量均显著下降。表明可通过调节在附着胞发育过程中糖原和脂肪的合成和积累调控玉米大斑病菌的致病性。
References
[1] Gu S Q, Li P, Wu M, Hao Z M, Gong X d, Zhang X y, Tian L, Zhang P, Wang Y, Cao Z Y, Fan Y S, Han J M, Dong J g.is required for the pathogenicity ofby regulating appressorium development and penetration., 2014, 169(11): 817-823.
[2] 曹志艳, 贾慧, 朱显明, 董金皋. DHN黑色素与玉米大斑病菌附着胞膨压形成的关系. 中国农业科学, 2011, 44(5): 925-932.
CAO Z Y, JIA H, ZHU X M, DONG J G. Relationship between DHN melanin and formation of appressorium turgor pressure of., 2011, 44(5): 925-932. (in Chinese)
[3] 王梅娟, 李坡, 吴敏, 范永山, 谷守芹, 董金皋. 高渗胁迫对玉米大斑病菌生长发育及表达的影响. 中国农业科学, 2012, 45(19): 3965-3970.
WANG M J, LI P, WU M, FAN Y S, GU S Q, DONG J G. Effect of hyperosmotic stress on the growth, development andexpression of., 2012, 45(19): 3965 -3970. (in Chinese)
[4] LI P, GONG X D, JIA H, FAN Y S, ZHANG Y, CAO Z Y, HAO Z M, HAN J M, GU S Q, DONG J G. MAP kinase geneis required for hyphal, conidial, and appressorial development, toxin biosynthesis, pathogenicity, and hypertonic stress response in the plant pathogenic fungus., 2016, 15(12): 2786-2794.
[5] DONG J G, FAN Y S, GUI X M, AN X L, MA J F, DONG Z P. Geographic distribution and genetic analysis of physiological races ofin northern China., 2008, 3(1): 389-398.
[6] 董金皋. 农业植物病理学. 2版. 北京: 中国农业出版社, 2007: 91-97.
Dong J G.. Beijing: China Agriculture Press, 2007: 91-97. (in Chinese)
[7] 范永山, 谷守芹, 董金皋, 董秉芳. 特异性MEK抑制剂U0126对玉米大斑病菌孢子萌发、附着胞产生和致病性的影响. 中国农业科学, 2006, 39(1): 66-73.
FAN Y S, GU S Q, DONG J G, DONG B F. Effects of the MEK-specific inhibitor U0126 on the conidial germination, appressorium production and pathogenicity of., 2006, 39(1): 66-73. (in Chinese)
[8] 谷守芹. 调控玉米大斑病菌生长发育和致病性的基因的克隆与功能分析[D]. 保定: 河北农业大学, 2007.
GU S Q. Cloning and functional analysis ofgenes regulating the growth, development and pathogenicity of[D]. Baoding: Hebei Agricultural University, 2007. (in Chinese)
[9] LI P, GU S Q, SHEN S, DONG J G, WU M, WANG M J, YANG Y, ZHANG C Z, FAN Y S, HAN J M., a MAP kinase gene from, confers preferable tolerance to sodium salt stress., 2012, 6(40): 6830-6837.
[10] 彭陈, 陈洪亮, 张玉琼, 郭士伟. 稻瘟菌附着胞形成和发育的研究进展. 微生物学通报, 2011, 38(8): 1270-1277.
PENG C, CHEN H L, ZHANG Y Q, GUO S W. A review on appressorium initiation and development in., 2011, 38(8): 1270-1277. (in Chinese)
[11] GUPTA A, CHATTOO B B. A novel geneis required for appressorium formation in., 2007, 44(11): 1157-1169.
[12] 林福呈. 稻瘟病菌附着胞形成的细胞生物学. 植物病理学报, 2001, 31(2): 97-101.
LIN F C. Cell biology of appressorium formation of., 2001, 31(2): 97-101. (in Chinese)
[13] 范永山, 曹志艳, 谷守芹, 董金皋. 不同诱导因素对玉米大斑病菌附着胞产生的影响. 中国农业科学, 2004, 37(5): 769-772.
FAN Y S, CAO Z Y, GU S Q, DONG J G. Effect of different induction factors on appressorium of., 2004, 37(5): 769-772. (in Chinese)
[14] 宋文静, 董金皋. 玉米大斑病菌孢子萌发和附着胞形成的影响因素研究. 植物病理学报, 2008, 38(5): 536-539.
SONG W J, DONG J G. Factors of influence on conidium germination and appressorium formation of., 2008, 38(5): 536-539. (in Chinese)
[15] 巩校东, 王玥, 张盼, 范永山, 谷守芹, 韩建民, 董金皋. 玉米大斑病菌MAPK基因的基因组定位、蛋白质结构预测及表达分析. 中国农业科学, 2015, 48(13): 2549-2558.
GONG X D, WANG Y, ZHANG P, FAN Y S, GU S Q, HAN J M, DONG J G. Analysis of the genomic location, protein structure prediction and expression of MAPK gene., 2015, 48(13): 2549-2558. (in Chinese)
[16] 叶幸, 孙群, 刘柱. 稻瘟菌侵染过程相关信号通路研究进展. 中国农业科技导报, 2015, 17(1): 87-94.
YE X, SUN Q, LIU Z. Progress oninfection process related to signaling pathways., 2015, 17(1): 87-94. (in Chinese)
[17] Xu J R. MAP kinases in fungal pathogens., 2000, 31(3): 137-152.
[18] JIN Q C, LI C Y, LI Y Z, Shang J J, LI D B, CHEN B S, DONG H T. Complexity of roles and regulation of the-MAPK pathway in mycelium development, conidiation and appressorium formation in., 2013, 13(5/6): 133-141.
[19] XU J R, Staiger C J, HAMER J E. Inactivation of the mitogen- activated protein kinase Mps1 from the rice blast fungus prevents penetration of host cells but allows activation of plant defense responses., 1998, 95(21): 12713-12718.
[20] DIXON K P, XU J R, SMIRNOFF N, TALBOT N J. Independent signaling pathways regulates cellular turgor during hyperosmotic stress and appressorium-mediated plant infection by., 1999, 11(10): 2045-2058.
[21] PARK S M, CHOI L S, KIM M J, CHA B J, YANG M S, KIM D H. Characterization of Hog1 homologue, CpMK1, fromand evidence for hypovirus-mediated perturbation of its phosphorylation in response to hypertonic stress., 2004, 51(5): 1267-1277.
[22] MORIWAKI A, KUBO E, ARASE S, KIHARA J. Disruption of, a mitogen-activated protein kinase gene, affects sensitive to osmotic and ultraviolet stressors in the phytopathogenic fungus., 2006, 257(2): 253-261.
[23] 吴纯仁, 刘后利. 油菜菌核病致病机理的研究Ⅳ. 病菌侵入途径和附着胞结构的观察. 华中农业大学学报, 1990, 9(1): 56-58, 108.
WU C R, LIU H L. Studies on the penetrating pathway and appressoria types of, 1990, 9(1): 56-58, 108. (in Chinese)
[24] KONG L A, LI G T, LIU Y, LIU M G, ZHANG S J, YANG J, ZHOU X Y, PENG Y L, XU J R. Differences between appressoria formed by germ tubes and appressorium-like structures developed by hyphal tips in., 2013, 56: 33-41.
[25] SEGMULLER N L, ELLENDORF U, TUDZYNSKI B, TUDZYNSKI P. BcSAKl, a stress-activated mitogen-activated protein kinase, is involved in vegetative differentiation and pathogenicity in., 2007, 6(2): 211-221.
[26] MEHRABI R, ZWIERS L H, DE WAARD M A, KEMA G. MgHogl regulates dimorphism and pathogenicity in the fungal wheat pathogen.s, 2006, 19(11): 1262-1269.
[27] CHANG H X, MILLER L A, HARTMAN G L. Melanin-independent accumulation of turgor pressure in appressoria of., 2014, 104(9): 977-984.
[28] 马兰, 薛韶娜, 唐聪, 杨晓荣, 巩校东, 韩建民, 谷守芹, 董金皋. 玉米大斑病菌渗透胁迫物质的确定//中国植物保护学会学术年会论文集. 中国植物保护学会, 2014.
MA L, XUE S N, TANG C, YANG X R, GONG X D, HAN J M, GU S Q, DONG J G. Determination of osmotic stress substances in//. China Society of Plant Protection, 2014. (in Chinese)
[29] WANG Z Y, JENKINSON J M, HOLCOMBE L J, SOANES D M, Veneault-Fourrey C, Bhambra G K, Talbot N J. The molecular biology of appressorium turgor generation by the rice blast fungus., 2005, 33(2): 384-388.
[30] WANG Z Y, SOANE D M, KERSHAW M J, TALBOT N J. Functional analysis of lipid metabolism inreveals a requirement for peroxisomal fatty acid beta-oxidation during appressorium-mediated plant infection., 2007, 20(5): 475-491.
(责任编辑 岳梅)
Effects ofon glycogen and lipid accumulation during the appressorium development of
ZHANG YunFeng, ZHANG ShuHong, WU QiuYing, FAN YongShan
(Department of Life Sciences, Tangshan Normal University, Tangshan 063000, Hebei)
【Objective】The objective of this paper is to study the relationship betweenand appressorium development, clarify the regulation ofon the glycogen and lipid accumulation, and to make a foundation for elucidation of the molecular mechanism of appressorium development of.【Method】The appressoria were induced with hypha tips of wild type (WT) isolate andknock-out mutant () on the hydrophobic surface of glass slide by the method of “hypha separation with slide insertion” and incubation in a petri-dish moist chamber at 22℃ and under alternative changes of 14 h lightness and 10 h darkness, to observe the course of appressrium development under the microscope at intervals of 12 h. The glycogen in mycelia and appressoria of WT andon the slides were stained 48 h with I2/KI before and after 48 h of appressorium induction, and the changes of glycogen metabolism during appressorium development were microscopically observed. The lipid in mycelia and appressoria of WT andon the slides were placed in a -70℃ ultra-low temperature freezer refrigeration for 30 min before stained for 24 h with Oil Red O, and the changes of lipid metabolism during appressorium development were microscopically observed. The expression of key genes in glycogen and lipid synthesis during appressorium development was detected by real-time PCR. 【Result】The appressoria from hypha tips could be induced on the hydrophobic surface of glass slide for both WT isolate and ⊿mutant. However, the appressoria ofwere differentiated into several different abnormal types, which were obviously different from WT isolate. The appressorium of WT was single cell within 48 h of appressorium induction and only a few multicellular appressoria were found after 48 h of induction. Nevertheless, the twisted appressoria were found after only 24 h of appressorium induction of, and some other abnormal appressorium forms, such as double-bifurcation, multi-bifurcation and “O” type, were found after 48 h of induction. After the glycogen and lipid staining in hypha and appressoria of WT and, it was found that the accumulation of glycogen and lipid was equally distributed in the mycelia and appressoria of WT isolate, but there was almost no accumulation of glycogen and lipid in the appressoria of. The glycogen accumulation was significantly reduced in the mycelium ofand the lipid was mainly distributed in the septum parts of hyphal cells, which were significantly different from WT. The gene expression of glycogen synthase (GS) and diacylglycerol acyltransferase (DGAT) increased by 6.6% and 40.3%, respectively, after the appressoria of WT isolate were induced after 48 hours. However, the GS gene expression decreased by 9.0% and the DGAT gene expression increased by only 24.5% in themutant.【Conclusion】The loss offunction resulted in abnormal appressorium development, decreases of glycogen accumulation, uneven distribution of lipid, and a significant reduction in the expression of key genes of glycogen and lipid synthesis, indicating the accumulation of glycogen and lipid is closely related to the appressorium development of.
;; appressorium development; glycogen; lipid
2017-01-17;接受日期:2017-03-06
国家自然科学基金(31271997)、河北省自然科学基金(C2014105067)、河北省高等学校科学技术研究计划(QN2017415)、河北省归国留学人才计划启动项目(C2015005009)、唐山师范学院科学研究基金(2014E04、2013A03、2016C05)
张运峰,E-mail:yunfengzhang1982@126.com。通信作者范永山,E-mail:fanyongshan@126.com

