不同栽培基质对蝴蝶兰组培苗生长的影响
高小坤
(福建省林业科技试验中心,福建 漳州 363600)
不同栽培基质对蝴蝶兰组培苗生长的影响
高小坤
(福建省林业科技试验中心,福建 漳州 363600)
开展了蝴蝶兰组培苗4种不同基质栽培试验,从成活率、形态、鲜质量以及叶绿素等指标对试验结果进行了综合分析。结果表明:以松树皮∶水苔=2∶1作为蝴蝶兰组培苗的基质效果较好。在林区,松树皮∶水苔=2∶1作为蝴蝶兰组培苗的栽培基质可以进行推广。
蝴蝶兰;组培苗;基质;成活率
栽培基质是影响蝴蝶兰生长及开花数量的主要因子之一[1]。台湾学者经多年试验研究,较早地将水苔作为蝴蝶兰规模化生产的栽培基质,具有成活率高、生长快、成本低、环保等优点,取得了良好的效果。随着对水苔研究的深入和生产经验的积累,水苔作为蝴蝶兰基质的一些弊端逐渐显现,如水苔具有较高的持水性且水分散失较慢,浇水后,蝴蝶兰根系在一段时间内处在低氧胁迫的环境条件下,容易烂根;基质中可溶性盐含量(EC 值)较高、保肥性较强,在生产中常造成无用阳离子的过度积累,导致对根系盐分的胁迫,这一现象在冬季气温低时尤其明显,常表现为根尖黑头[2-4]。另外,近年来,水苔由于大量采集,同时受自然生态变化的影响,产量逐渐减少,成本提高,品质亦极不稳定,且开采时部分水苔与土壤混合生长,以致水苔遭受镰刀菌感染,影响日后开花品质[5]。为此,本试验以蝴蝶兰‘台林红天使( Dtps. Tailin Red Angel)’作为供试品种,开展了不同栽培基质对蝴蝶兰‘台林红天使’组培苗生长影响的研究,旨在优化蝴蝶兰组培苗栽培基质配方。
1 材料与方法
1.1 试验地及设施概况
试验地点位于福建省林业科技试验中心五板桥基地,属南亚热带温暖湿润气候,年均气温21.1 ℃,年降水量1 589~1 880 mm,无霜期322 d,年均相对湿度80 %,年均日照时数2 052 h。试验温室大棚2012年8月建成,配备水帘风机降温系统、加温系统、内外遮阳系统、喷灌系统和移动苗床等。
1.2 苗木来源
苗木来自福建省林业科技试验花卉研究所生产的蝴蝶兰‘台林红天使’经过炼苗的组培苗。
1.3 试验方法
1.3.1 组培苗移栽 将组培苗小心从容器中逐个取出,用清水漂洗去黏附在根上的培养基后,用多菌灵800倍液浸泡消毒5 min,晾干。挑选长势基本一致的蝴蝶兰组培苗,分别用配好的四种基质栽植在1.5寸的透明软塑杯中,每杯栽植一株小苗。栽植7个月后,分别用相对应的基质转移到2.5寸的透明软塑杯中。
1.3.2 栽后管理 移栽后,昼夜温度保持在20~30 ℃,相对湿度70%~85%,光照强度5 000~12 000 lx,2个月后光强增加到20 000~30 000 lx。移栽20 d后,每隔7~10 d用花卉专用肥(N-P2O5-K2O=20-20-20)3 000~4 000倍液浇一次肥,并每月间施1次花卉专用肥( N-P2O5-K2O=30-10-10)4 000 倍液。
1.3.3 试验设计
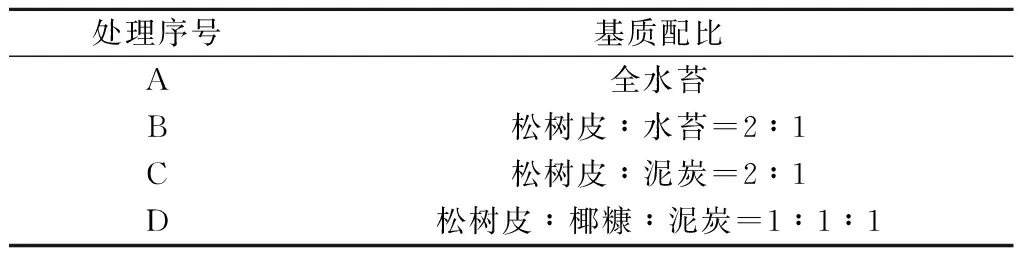
表1 不同处理基质配比(体积比)
本试验采用完全随机区组设计方法,单因素(栽培基质),4个处理(见表1),每个处理120株,3个重复。组培苗移栽时间为2014年10月25日,移栽2个月(2015年12月25日)和4个月(2015年2月25日)后分别统计组培苗成活率,2015年8月20日,测定植株的叶展、新叶片数、叶面积、地上和地下部鲜重、叶片叶绿素等指标。采用数字图像处理技术测定叶片面积,采用95%乙醇提取比色法[6]测定叶片叶绿素含量。
2 结果与分析
2.1 不同栽培基质对蝴蝶兰组培苗成活率的影响

表2 不同栽培基质对蝴蝶兰组培苗成活率(%)的影响
注:同列数据后附不同小写字母者表示差异显著,相同字母表示差异不显著,下同
由表2可知,蝴蝶兰组培苗栽培2个月后,各处理的蝴蝶兰组培苗成活率均较高,达到了90%以上,4种处理都没有达到显著差异,但处理A、处理B的成活率较高,处理D的成活率较低;栽培4个月后,4种处理的成活率都有所下降,但差异并不显著,以处理A的成活率最高,处理B次之。
2.2 不同栽培基质对蝴蝶兰组培苗形态指标的影响
由表3可知,叶展以及新叶片数,处理A与处理C、处理D达到显著差异,与处理B没有显著差异;叶面积,处理A与处理C达显著差异,与处理B、处理D没有显著差异。因此,从蝴蝶兰形态指标分析,处理A效果最佳,处理B次之。

表3 不同栽培基质对蝴蝶兰组培苗形态指标的影响
2.3 不同栽培基质对蝴蝶兰组培苗鲜质量的影响

表4 不同栽培基质对蝴蝶兰组培苗鲜质量(g)的影响
由表4可知,处理A和处理B都能明显增加植株地上部分和地下部分鲜重,都与处理C达到了显著性差异,处理D与其他3个处理没有显著差异。
2.4 不同栽培基质对蝴蝶兰组培苗叶绿素含量的影响

表5 不同栽培基质对蝴蝶兰组培苗叶绿素含量(mg/g)的影响
植物叶绿素含量在一定程度上能够反映植物的光合作用能力,由表5可知,各处理间,叶绿素a含量差异不显著,叶绿素b含量差异达到显著程度,以处理A最高,达到了0.20 mg·g-1,处理C叶绿素b含量最低。各处理间,以处理A的叶绿素总含量最高,与处理C和处理D都达到了显著性差异。
3 小结
通过不同栽培基质对蝴蝶兰组培苗生长影响的试验,蝴蝶兰组培苗移栽2个月和4个月后,成活率并无显著影响,处理A成活率最高,其次为处理B。蝴蝶兰组培苗种植10个月后,从形态指标分析,处理A叶展较长,达到28.65 cm,与处理C、处理D达到了显著差异,处理A与处理B无显著差异;处理A、处理B的新叶数较多,都超过了3片,其中处理A与处理C、处理D都达到了显著差异;叶面积处理A最大,与处理C达到了显著差异。从鲜重指标分析,处理A和处理B植株鲜重较大,均与处理C达显著差异。从叶绿素含量指标分析,叶绿素a含量4个处理均无显著差异,叶绿素b含量则有不同的影响,以处理A的含量最高。综合各个指标来看,处理A和处理B对于蝴蝶兰组培苗的生长效果最好,即用传统的全水苔或松树皮:水苔=2:1效果最佳,在林区,松树皮原材料来源较多,价格较低,松树皮∶水苔=2∶1作为蝴蝶兰组培苗栽培基质可以适当推广。
[1] 李天林,沈兵,李红霞.无土栽培中基质培选料的参考因素与发展趋势[J].石河子大学学报,1999(3):250-258
[2] 赵九洲,陈洁敏,陈松笔,等.基质与氮磷钾比例对蝴蝶兰(Phalaenopsishybridium)生长发育的影响[J].园艺学报,2000,27(5):383-384
[3] 叶振华,张雪梅,李秋霞,等.蝴蝶兰催花技术研究[J].广东园林,1996(4):7-8
[4] 王丽娟,王学利,范文静.设施蝴蝶兰栽培基质的研究现状[J]. 园艺与种苗,2011(1):41-44,101
[5] 林立航.不同栽培介质对蝴蝶兰生长及模拟储运之影响[D].台中:国立中兴大学,2006
[6] 邹琦.植物生理学试验指导[M].北京:中国农业出版社,2000
Effects of Different Cultivated Substrates on Growth ofPhalaenopsisaphroditeSeedlings
Gao Xiaokun
(Fujian Forestry Science and Technology Test Center, Zhangzhou 363600, China)
Cultivation experiments ofPhalaenopsisaphroditewere conducted by adopting four different substrates.The survival rate, morphology, fresh quality and chlorophyll were analyzed synthetically. Result shows that pine bark:Herbasphagni= 2: 1 is optimal for tissue culturePhalaenopsisaphroditeseedlings . In the forest area, pine bark:Herbasphagni= 2: 1 asPhalaenopsisaphroditetissue culture seedlings can be properly promoted.
Phalaenopsisaphrodite; tissue culture seedlings; substrates; survival rate
1005-5215(2017)08-0037-02
2017-06-30
福建省林业厅项目:兰花品种创新与高效繁育栽培体系研究;福建省林业厅科技项目(闽林科[2015]2号)
高小坤(1973-),男,福建平和人,高级工程师,主要从事观赏植物繁育及栽培研究.
S723.132.6
A
10.13601/j.issn.1005-5215.2017.07.011

