跌打丸含量测定方法的改进
钟建理,黄海燕 ,蒋彦飞
(广西壮族自治区桂林食品药品检验所,广西 桂林 541012)
·检验检测·
跌打丸含量测定方法的改进
钟建理,黄海燕 ,蒋彦飞
(广西壮族自治区桂林食品药品检验所,广西 桂林 541012)
目的 改进2015年版《中国药典(一部)》跌打丸含量测定中供试品溶液的制备方法。方法 大蜜丸样品采用硅藻土分散,以10%磷酸甲醇溶液为提取溶剂,以超声提取替代回流提取,确定最佳供试品溶液制备方法。结果 改进方法后含量测定结果明显高于原方法结果。结论 该方法供试品溶液提取更完全,试验结果更稳定,更能体现跌打丸制剂的血竭素含量。
跌打丸;含量测定;提取方法;血竭素
跌打丸是由三七、当归和血竭等24味中药组方的小蜜丸或大蜜丸,具有活血散瘀、消肿止痛的功效,用于跌打损伤、筋断骨折、淤血肿痛、闪腰岔气的治疗,收载于2015年版《中国药典(一部)》[1]。在日常检测中,发现其含量测定结果重复性差,水浴温度和提取溶剂磷酸甲醇的浓度会影响测定结果;也有文献报道,血竭素对热不稳定,且酸的浓度会影响提取效果[2-15]。本研究中对供试品的提取方法进行了改进,旨在为跌打丸质量标准的完善提供依据。现报道如下。
1 仪器与试药
Waters 2695型高效液相色谱分离单元 -Waters 2998 PAD检测器(美国Waters公司);XS205DU型电子分析天平(瑞士梅特勒公司)。血竭素高氯酸盐对照品(批号为110811-201506,纯度为98.6%)购于中国食品药品检定研究院;乙腈为色谱纯,其余试剂均为分析纯,水为高纯水。跌打丸(北京同仁堂科技发展股份有限公司制 药厂,批号分别 为 14011045,14011049,15010330,15010482,15012953)。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:资生堂 Capcell Pak MG C18柱(250 mm× 4.6 mm,5 μm);流动相:乙腈-0.05 mol/L磷酸二氢钠溶液(49∶51);检测波长:440 nm;柱温:35℃;流速:1.0 mL/min。理论板数约为6 400。上述色谱条件与《中国药典》标准一致。
2.2 供试品溶液提取方法优选
提取溶剂:取大蜜丸剪碎,加等量硅藻土,研匀,取约4 g,精密称定,置具塞锥形瓶中,分别加3%,5%,8%,10%,12%磷酸甲醇溶液25 mL,称定质量,超声处理30 min,放冷,用相应的磷酸甲醇溶液补足减失的质量,摇匀,滤过,取滤液测定。结果含量分别为0.073,0.091,0.157,0.171,0.169 mg/g,表明以10%磷酸甲醇溶液为提取溶剂提取最完全。
提取方法:取大蜜丸剪碎,加等量硅藻土,研匀,取约4 g,精密称定,置具塞锥形瓶中,加10%磷酸甲醇溶液 25 mL,称定质量,超声处理 30 min,或水浴回流30 min,放冷,用 10%磷酸甲醇溶液补足减失的质量,摇匀,滤过,取滤液测定。结果含量分别为0.168,0.143 mg/g,表明以超声提取最佳。
超声时间:取大蜜丸剪碎,加等量硅藻土,研匀,取约4 g,精密称定,置具塞锥形瓶中,10%磷酸甲醇溶液25 mL,称定质量,分别超声处理10,20,30,40 min,放冷,用10%磷酸甲醇溶液补足减失的质量,摇匀,滤过,测定。结果含量分别为0.155,0.168,0.172,0.171 mg/g,表明超声处理20 min基本提取完全。为保证提取效果,研究中选择了超声提取30 min。
2.3 溶液制备
对照品溶液:精密称取血竭素高氯酸盐对照品,加10%磷酸甲醇制成每 1 mL含血竭素高氯酸盐20 μg(相当于14.52 μg的血竭素)的溶液。
供试品溶液:取大蜜丸剪碎,加等量硅藻土,研匀,取约4 g,精密称定,置具塞锥形瓶中,10%磷酸甲醇溶液25 mL,称定质量,超声处理30 min,放冷,用10%磷酸甲醇溶液补足减失的质量,摇匀,滤过,取滤液,即得。
2.4 方法学考察
线性关系考察:称取血竭素高氯酸盐对照品10.18mg,精密称定,置50 mL容量瓶中,加10%磷酸甲醇溶液使溶解并稀释至刻度,精密量取25 mL至50 mL容量瓶中,加10%磷酸甲醇溶液至刻度,摇匀,精密量取15.0,10.0,5.0,2.0,1.0,0.5 mL,分别置25 mL容量瓶中,加10%磷酸甲醇溶液至刻度,摇匀。取上述对照品溶液进样10 μL,测定。以峰面积为纵坐标(Y)、进样质量浓度为横坐标(X)进行线性回归,得回归方程 Y=1.535 3× 104X+3.404 9×103,r=0.999 9(n=6)。结果表明,血竭素高氯酸盐质量浓度在2.007 5~200.749 6 μg/mL范围内与峰面积线性关系良好。
精密度试验:取同一对照品溶液,连续进样5次,每次10 μL。结果峰面积的 RSD为1.01%(n=5),表明仪器精密度良好。
重复性试验:取大蜜丸剪碎,依法制备供试品溶液并进样测定。结果平均含量为 0.147 9 mg/g,RSD为1.53%(n=6),表明方法重复性良好。
回收率试验:称取已知含量的样品(血竭素含量为0.148 2 mg/g)23.949 0 g,精密称定,剪碎,加等量硅藻土23.975 0 g,研匀,取约2 g,共9份,精密称定,置具塞锥形瓶中,3份分别加入 0.020 07 g/L的对照品溶液5 mL,3份分别加入0.030 11 g/L的对照品溶液5 mL,3份分别加入 0.040 15 g/L的对照品溶液5 mL,再分别精密加入10%磷酸甲醇溶液20 mL,称定质量,按供试品溶液的制备方法制得溶液,按色谱条件测定,外标法计算。结果见表1。
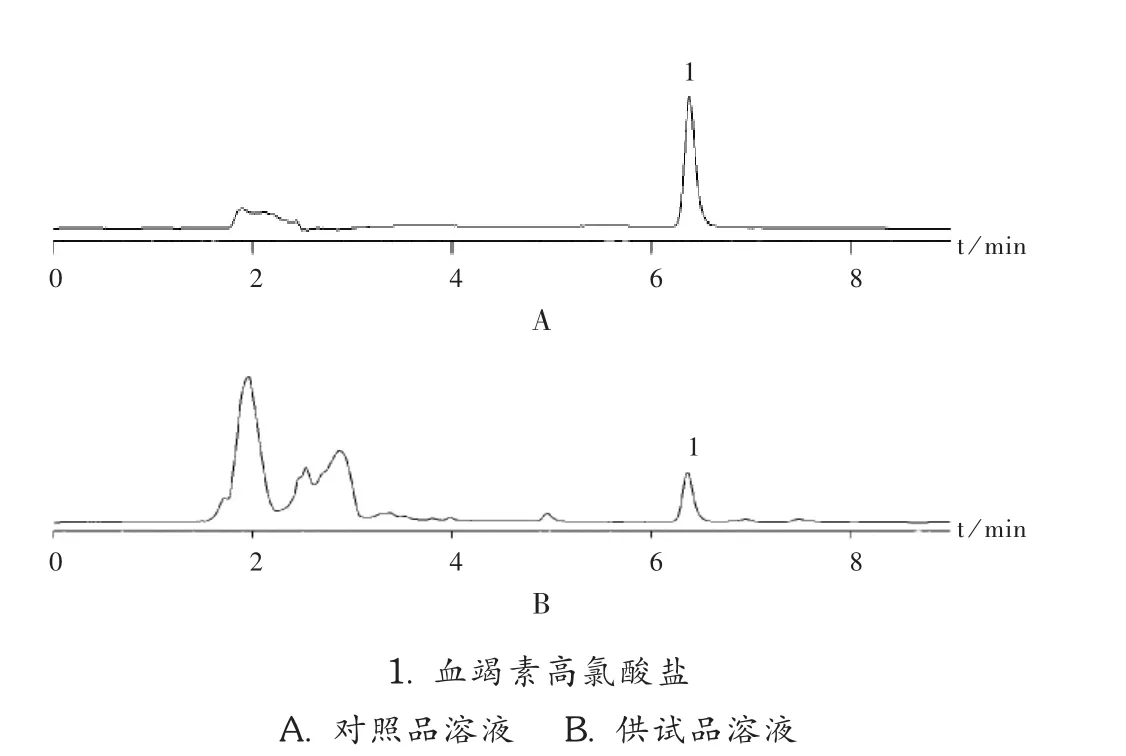
图1 高效液相色谱图

表1 血竭素高氯酸盐加样回收试验结果(n=9)
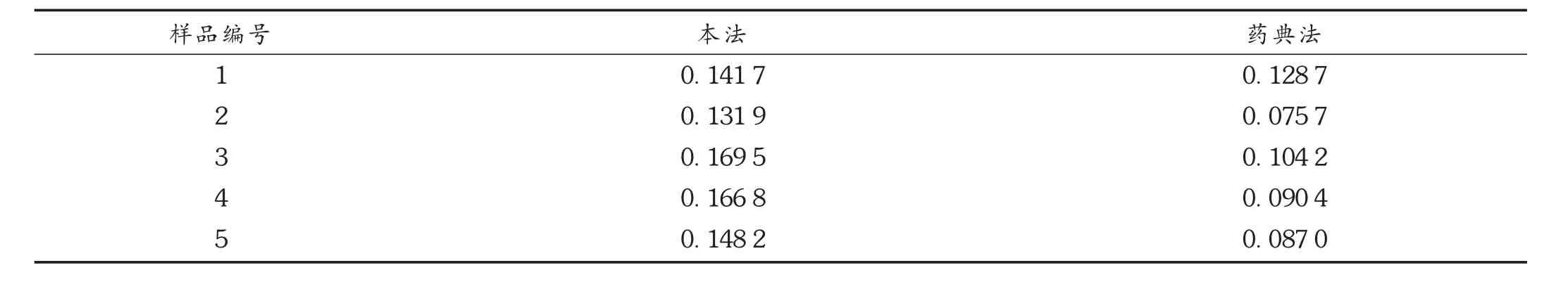
表2 5批样品血竭素含量测定结果(mg/g,n=3)
稳定性试验:取同一份供试品溶液,配制后分别在0,1,2,4,8,12 h时进样测定。结果峰面积平均值为277 892,RSD为0.60%(n=6),表明供试品溶液在配制后12 h内稳定。
2.5 样品含量测定及与药典方法的比较
取5批样品,分别按本法和2015年版《中国药典(一部)》的方法(药典法)测定样品中血竭素的含量。结果见表2。
3 讨论
从样品含量测定结果看,按本法测定的血竭素含量均高于药典规定的限度(规定每丸不得少于0.30 mg,规格为每丸3 g,约0.1 mg/g),但按照原药典标准测定的血竭素含量则小很多,且有3批含量低于药典规定的限度,这就易引起对测定结果的误判,影响检验工作。
原药典标准中供试品提取方法为大蜜丸剪碎,加3%磷酸甲醇溶液回流提取。试验中发现供试品易成团,很难溶散,造成提取不完全,故改为用硅藻土分散大蜜丸后超声提取。
在进行线性关系考察时,曾考虑以不同进样体积来得到不同的血竭素量,但当进样量为30 μL时,峰形变差,线性也变差,可能是受溶剂中有磷酸的影响。依据药典凡例,10%磷酸甲醇溶液为100 mL溶液中含10 g磷酸,故配制方法为取85%磷酸7 mL,加甲醇至100 mL。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:644.
[2]徐淑卿,沙 明,孟宪生.血竭的稳定性研究[J].中成药,2005,27(5):598-599.
[3]刘长龙,高 鹏.提取溶剂酸度对血竭及玉红生肌凝胶中血竭素含量的影响[J].辽宁中医杂志,2013,40(3):520-522.
[4]谢 艳,马克昌,谢 文.酸化对血竭中血竭素含量测定的影响[J].中草药,2000,31(4):265.
[5]胡世强,张 伟.《中国药典》2010年版血竭中血竭素含量测定提取方法的改进[J].中国药品标准,2013,14(1):36-37.
[6]蒋淑云,李 红,蒋孟良,等.七厘散凝胶剂中血竭素含量的HPLC测定[J].中国药师,2016,19(3):589-591.
[7]董宪凤.高效液相色谱法测定麝香接骨胶囊中血竭素的含量[J].海峡药学,2012,24(7):50-51.
[8]常 润,夏传涛,杨瑞瑞,等.HPLC法测定展筋活血散中血竭素的含量[J].西北药学杂志,2013,28(4):370-372.
[9]谭生建,贺业谦,梁爱君,等.HPLC法测定通络止痛散中血竭素的含量[J].解放军药学学报,2012,28(6):514-516.
[10]李小曲.HPLC法测骨伤跌打止痛胶囊中血竭素的含量[J].中国药师,2014,17(2):343-345.
[11]陆 玮,梁艺坚,潘 彬,等.HPLC法测定新舒通胶囊中血竭素与亚油酸含量[J].中国药师,2015,18(9):1601-1602.
[12]李 纯,栗建明,顾利红,等.中国药典中血竭药材含量测定方法的改进[J].今日药学,2017,27(2):73-75.
[13]何 轶,丁 宁,王瑞忠,等.冠脉宁片中化工染料检查及血竭素高氯酸盐含量测定研究[J].中国药学杂志,2015,50(2):120-124.
[14]王晓君,高鸿彬,王志君,等.用HPLC法测定清消丸中血竭素的含量[J].药学服务与研究,2016,16(5):379-381.
[15]张 伟,李 静,郭雪申,等.HPLC法测定六白白 巴布剂中血竭素的含量[J].光明中医,2015,30(4):728-730.
Improvement of Content Determination of Dieda Pill
Zhong Jianli,Huang Haiyan,Jiang Yanfei
(Guilin Institute for Food and Drug Control,Guilin,Guangxi,China 541012)
Objective To improve the preparation method for test solution in the content determination of Dieda Pill in Chinese Pharmacopoeia(Volume 1,CP 2015).Methods The samples of Dami Pill were dispersed by diatomite,with 10% phosphoric acid methanol solution as extraction solvent,the ultrasonic extraction was used to replace the reflux extraction,in order to determine the best preparation method for test solution.Results After the improvement of the method,the result of content determination was obviously higher than that of the original method.Conclusion The method can completely extract the test solution,and result of determination was more stable and can perfectly reflect the concentration of dracorhodin in Dieda Pill.
Dieda Pill;content determination;extracting method;dracorhodin
R927.2
A
1006-4931(2017)16-0023-03
2017-03-06;
2017-04-11)
10.3969/j.issn.1006-4931.2017.16.007
钟建理(1975-),男,汉族,大学本科,副主任药师,主要从事药品检验及质量标准研究,(电话)0773-2267165-808(电子信箱)1186421282@qq.com。
黄海燕(1973-),女,壮族,硕士研究生,副主任药师,主要从事药品检验及质量标准研究,(电话)0773-2267165-806(电子信箱)3467809613@qq.com。

