HPLC法同时测定不同采收期木薯叶中6种类黄酮的含量
王定美,王伟,麦力文,杨霞,李勤奋
(中国热带农业科学院环境与植物保护研究所,海南海口571101)
HPLC法同时测定不同采收期木薯叶中6种类黄酮的含量
王定美,王伟,麦力文,杨霞,李勤奋*
(中国热带农业科学院环境与植物保护研究所,海南海口571101)
建立同时测定木薯叶中6种类黄酮的高效液相色谱(high performance liquid chromatography)法,测定不同采收期下木薯叶中类黄酮含量,探讨木薯叶作为黄酮资源利用的最佳采收期。色谱柱为CNW Athena C18-WP(4.6 mm×250 mm,5 μm),流动相为乙腈-乙酸-水,梯度洗脱,流速为 1 mL/min,柱温室温,进样量5 μL,检测波长儿茶素与二氢黄酮甙为281 nm,芦丁与山奈酚为360 nm,槲皮素367 nm、穗花杉双黄酮338 nm。儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮的浓度分别为 1.5 mg/L~194.6 mg/L(R2=0.999 9)、7.8 mg/L~992.6 mg/L(R2=1.000 0)、0.7 mg/L~84 mg/L(R2=0.999 9)、0.7 mg/L~93.8 mg/L(R2=0.999 9)、0.8 mg/L~108 mg/L(R2=0.995 8)、0.5 mg/L~67.2 mg/L(R2=0.999 5)时与各自峰面积线性关系良好,回收率95.50%~100.01%,相对标准偏差(RSD)小于3%。该法适用于木薯叶中以上6种类黄酮成分的精确定量。检测结果表明,不同品种、不同采收期的木薯叶中类黄酮的组成和含量差异较大,芦丁与穗花杉双黄酮为主要类黄酮。儿茶素、芦丁、二氢黄酮甙、槲皮素含量最高采收期为种植后180 d,穗花杉双黄酮为种植后120 d,山奈酚因品种而异。
高效液相色谱;木薯叶;类黄酮;采收期
木薯叶是木薯大规模种植与加工利用产生的、还没有得到充分利用的重要副产物之一。随着木薯种植面积不断扩大,如何有效利用越来越多的木薯副产物是急需解决的问题。实践表明,食用木薯叶可提高抗病能力,减少患癌症及糖尿病、高血压等疾病的几率[1-2];木薯叶提取物可提高鱼类的糖代谢、脂肪代谢、免疫能力、促进鱼类生长[3-4]。这可能与木薯叶中含有丰富的黄酮类化合物有关。李兵等[5]研究表明,木薯叶黄酮对金黄色葡萄球菌有较高的抑菌作用。Hai-Teng Tao等[6]研究发现木薯叶黄酮提取物具有肝保健的功效。Kubo等[7]发现,巴西木薯叶含槲皮素840 mg/kg、山奈酚840 mg/kg、芦丁4 620 mg/kg,并且这3种化合物的抗氧化性效果显著。李姗姗等[8]首次从该木薯中分离得到具多种生物功能的穗花杉双黄酮。何翠薇等[9]研究确定木薯茎叶含有二氢黄酮类化合物。Tanaka Y等[10]发现,木薯在采收之后会产生大量的儿茶素等次生代谢产物。因此,开发利用木薯叶黄酮,有利于提高木薯叶资源化利用水平,实现变废为宝,延长木薯产业链。
木薯叶类黄酮成分含量的精确定量是开发利用木薯叶黄酮的必要条件。但许多类黄酮化学结构和性质相似,难以分离。高效液相色谱(High Performance Liquid Chromatography,HLPC)由于其灵敏度高、选择性强、色谱柱的选择范围宽、样品预处理简单和谱图简单等使其成为检测类黄酮化合物最常用的方法之一[11]。至今关于木薯叶类黄酮成分含量测定的文献报道,国内仅见于何翠薇[12]对芦丁的测定,对于木薯叶中多种类黄酮成分的同时测定及成分含量随采收期的动态规律更是未见报道。笔者采用高效液相色谱(HPLC)法,建立同时测定木薯叶中儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮6种类黄酮成分含量的方法,并据此监测该6种成分随生长期的动态,为确定木薯叶作为黄酮资源利用的最佳采收期,有效利用这一木薯副产物提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
以木薯品种华南9号(SC09)和华南205号(SC205)嫩茎叶为材料,于2015年6月采自中国热带农业科学院环境与植物保护研究所儋州试验基地。经60℃烘干至恒重后粉碎至粒径0.3 mm,保存待用。
1.1.2 试剂
标准品儿茶素(catechin,含量97.2%,批号:110877-201203)、芦丁(rutin,含量≥98.1%,批号:1022799)、二氢黄酮甙(hesperidin,含量95.3%,批号:110721-201316)、槲皮素(quercetin,含量≥96.5%,批号:100081-200907)、穗花杉双黄酮(amentoflavone,含量≥90.2%,批号:111902-201102):购自中国食品药品检定研究院;山奈酚(kaempferol,含量≥98.0%,编号:K107144):购自阿拉丁公司;甲醇、乙腈为色谱纯;超纯水,其它试剂均为分析纯。
1.1.3 仪器与设备
Ultimate 3000液相色谱仪:美国戴安;METTLER TOLEDO AL204电子分析天平:瑞士梅特勒-托利多;UV2600紫外可见分光光度计:日本岛津。
1.2 方法
1.2.1 样品预处理
称取1g(精确至0.0001g)木薯叶粉,置于50mL离心管中,加入40mL浓度为50%乙醇水溶液,摇动使充分混合,超声辅助提取0.5 h(功率80 W),在3 000 r/min离心5 min,取上清液于250 mL圆底烧瓶中;残渣同样超声离心,合并两次上清液于圆底烧瓶中。
45℃、120 r/min下旋转蒸发浓缩上清液至膏状,用60%乙醇清洗至50 mL离心管中,配平后8000r/min离心10 min后,用2倍~3倍体积的石油醚萃取3遍,合并乙醇层于圆底烧瓶中,45℃、120 r/min下旋转蒸发浓缩至膏状,用甲醇清洗膏状物至25 mL容量瓶中,定容贮存在-20℃下作为液相分析备用液。测定样品前取备用液,用甲醇稀释至合适倍数并过0.22 μm滤膜。
1.2.2 色谱条件
色谱柱 CNW Athena C18-WP(4.6 mm×250 mm,5 μm);流动相:A:乙腈,B:2.5%乙酸水溶液,采用梯度洗脱。流动相A的比例为:0~30 min,15%~70%;30 min~32 min,70%~100% ;32 min~34 min,100%;34 min~36 min,100%~15%;36 min~45 min,15%。流速1.0 mL/min,柱温室温,进样体积5 μL。检测波长为:儿茶素、二氢黄酮甙281 nm,芦丁、山奈酚360 nm,槲皮素367 nm,穗花杉双黄酮338 nm。
1.2.3 类黄酮标准溶液的配制
准确称取儿茶素9.7 mg、芦丁49.6 mg、二氢黄酮甙4.2 mg、槲皮素4.7 mg、山奈酚5.4 mg,穗花杉双黄酮3.4 mg于50 mL棕色容量瓶中,用甲醇超声溶解并定容至刻度,作为标准品储备液,-20℃保存备用。
1.2.4 线性关系考察
精密吸取混合标准品储备液,用甲醇按倍数2、4、8、16、32逐级稀释并定容配制5个标液。按1.2.2色谱条件,取各浓度标准品溶液分别进样5 μL,以峰面积为横坐标(X),质量浓度(Y)为纵坐标,绘制标准曲线,计算标准曲线的线性回归方程及相关系数(R2)。
1.2.5 精密度试验
精密吸取类黄酮混合标准品溶液,按1.2.2的色谱条件进样5 μL,连续进样6次,测定各自的峰面积,根据测定结果计算相对标准偏差RSD。
1.2.6 重复性试验
精密称取同一批次木薯叶干样品5份,按1.2.1的方法平行制备5份样品溶液,按1.2.2色谱条件进样5 μL,记录峰面积,并计算各类黄酮的含量及RSD值。
1.2.7 稳定性试验
精密称取同一份木薯叶干样品,按1.2.1的方法制备样品溶液,按 1.2.2 色谱条件,分别于 0、6、12、18、24 h进样5 μL,测定样品中6种类黄酮的含量,计算RSD值。
1.2.8 回收率试验
精密称取同一批次已知该6种黄酮成分含量的木薯叶干样品5份,同时分别定量加入类黄酮标准溶液,按1.2.1的方法平行制备5份样品溶液,按1.2.2的色谱条件进样5 μL,根据测定结果中6种黄酮成分的含量计算相应的平均回收率及RSD值。
2 结果
2.1 HPLC定量分析方法的建立
2.1.1 检测波长的选择
相对吸收度/%=某波长下的吸光度/扫描波长范围中的最大吸光度×100
对6种类黄酮标准样品进行最大吸收光谱扫描,得到不同类黄酮成分的最大吸收光谱图见图1。

图1 6种类黄酮成分标准样品吸收光谱图Fig.1 Absorption spectrogram of 6 flavonoids standards
如图1所示,各组分在200 nm~210 nm均有最大吸收峰,其中二氢黄酮甙、儿茶素在281 nm有最大吸收峰,穗花杉双黄酮最大吸收峰出现在270、338 nm,槲皮素 260、367 nm、芦丁 260、360 nm,山奈酚 261、360 nm。综合考虑可分4个波长进行检测:儿茶素与二氢黄酮甙为281nm、穗花杉双黄酮338nm、芦丁与山奈酚360nm、槲皮素367 nm。
2.1.2 流动相的选择
试验参考前人研究结果[13],比较研究了甲醇、乙腈与不同浓度的酸(甲酸、乙酸、磷酸)作为流动相,对类黄酮混合标准品以及木薯叶提取液中各种类黄酮色谱峰的分离效果,其中以乙腈(A)-2.5%乙酸水溶液(B)分离效果较好。根据大梯度洗脱液相扫描结果,摸索了不同的梯度洗脱,最后确定洗脱程序为:0~30 min,15%~70%A;30 min~32 min,70%~100%A;32 min~34 min,100%A;34 min~36 min,100%~15%A;36 min~45 min,15%A。试验结果表明,采用上述梯度洗脱程序条件,色谱峰之间能够达到完全分离,并且峰形尖锐,对称性好,可满足多种类黄酮的同时分离。
2.1.3 流动相流速的选择
试验比较了流动相流速在0.6、0.8、1.0、1.2 mL/min下类黄酮混合标准品以及木薯叶提取液中各种类黄酮色谱峰的分离情况见图2。
由图2可知,流速为1.0 mL/min时,分离程度最好。

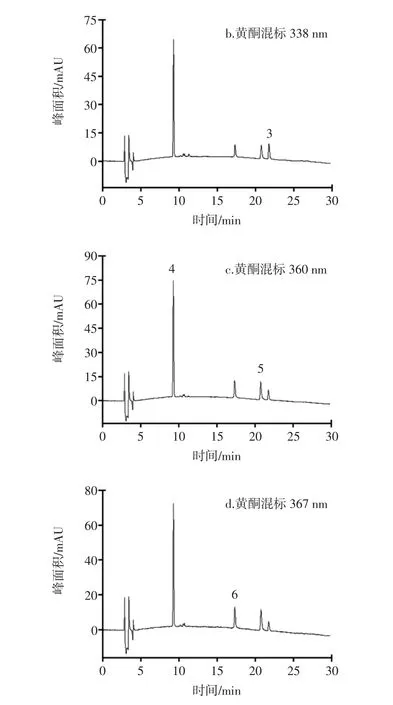
图2 6种类黄酮标准品的液相色谱图Fig.2 HPLC chromatograms of 6 flavonoids standards
2.1.4 检测进样量的选择
试验比较了在流动相流速1.0 mL/min下,在进样体积5、10、15 μL类黄酮混合标准品以及木薯叶提取液中各种类黄酮色谱峰的分离情况见图3。
由图3可知,进样体积5 μL时,峰形最好。
2.2 HPLC定量分析的方法学考察
2.2.1 线性关系考察
线性关系考察结果见表1。

图3 木薯叶样品中6种类黄酮液相色谱图Fig.3 HPLC chromatograms of 6 flavonoids in cassava leave samples

表1 类黄酮标准曲线的回归方程、相关系数、线性范围Table 1 Regression equations,correlation coefficients and linear range of the flavonoids
儿茶素、芦丁等6种黄酮成分标准品质量浓度和相应峰面积呈良好线性关系。儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮的线性范围分别为:1.5 mg/L~194.6 mg/L、7.8 mg/L~992.6 mg/L、0.7 mg/L~84 mg/L、0.7 mg/L~93.8 mg/L、0.8 mg/L~108 mg/L、0.5 mg/L~67.2 mg/L。
2.2.2 精密度试验
6种类黄酮精密度试验结果见表2。
儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮对应的RSD值分别为0.75%、0.56%、0.84%、0.55%、0.57%、0.59%,表明仪器精密度良好。
2.2.3 重复性试验
重复性试验结果见表3。
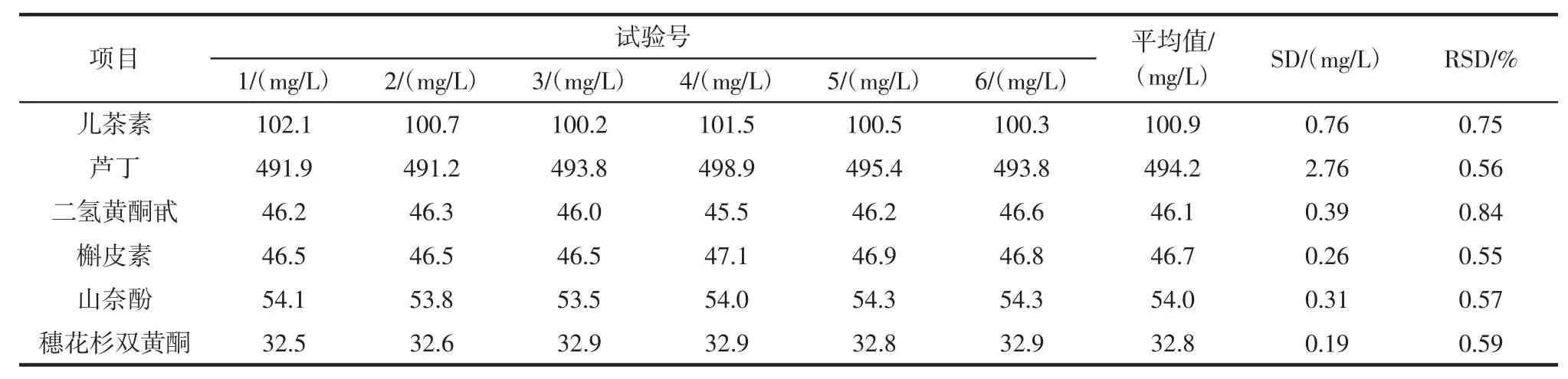
表2 6种类黄酮精密度试验结果Table 2 Accuracy tests for 6 flavonoids(n=6)

表3 6种类黄酮重复性试验结果Table 3 Repeatability tests for 6 flavonoids(n=5)
6种类黄酮含量的RSD值均小于3%,表明该测定方法重复性良好。
2.2.4 稳定性试验
稳定性试验见表4。
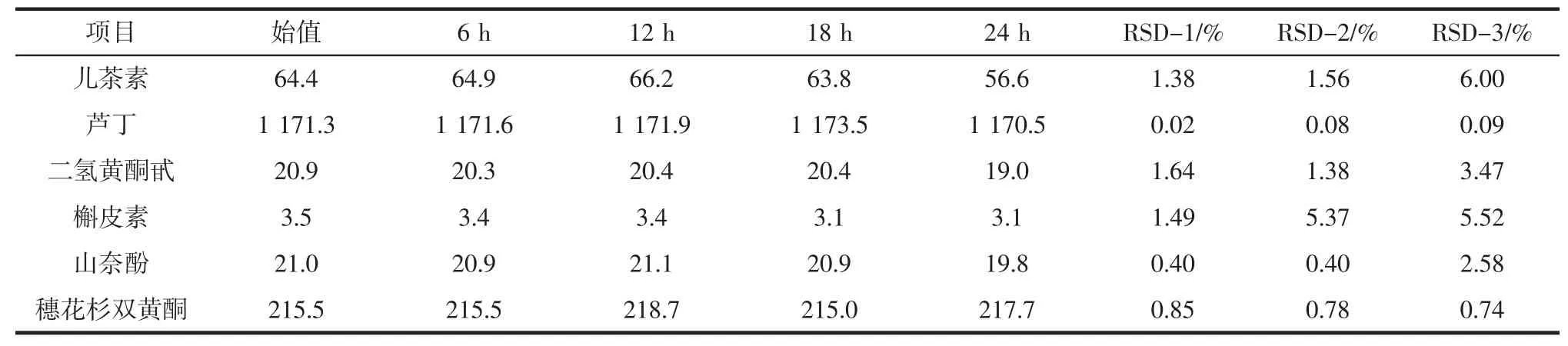
表4 6种类黄酮稳定性试验结果Table 4 Stability tests for 6 flavonoids
当样品放置18 h时,槲皮素含量的RSD值为5.37%,大于3%外,其他成分含量的RSD值均小于3%,说明该样品溶液室温放置18 h时稳定性降低,放置12 h内稳定。
2.2.5 回收率试验
回收率试验见表5。
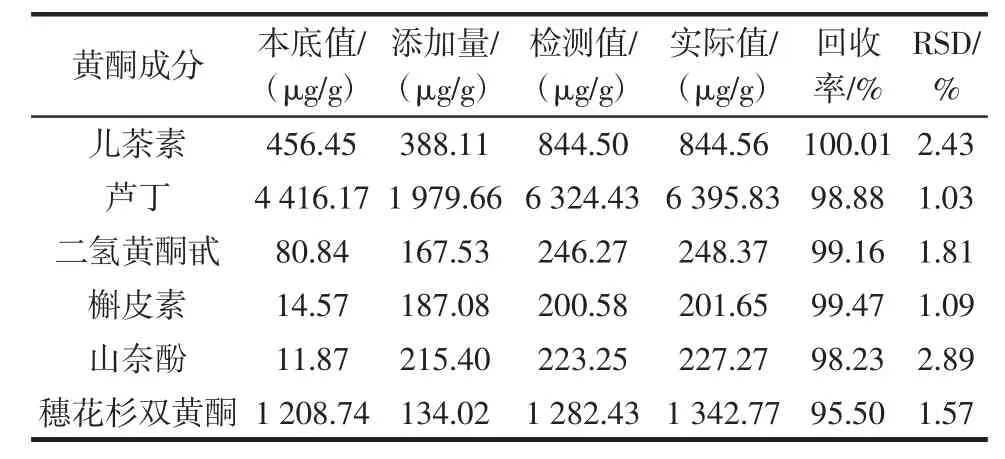
表5 6种类黄酮回收率试验结果Table 5 Recovery tests for 6 flavonoids(n=5)
6种黄酮成分含量的回收率范围95.50%~100.01%,均在允许限以内。
2.3 不同采收期下木薯叶类黄酮含量
不同采收期下木薯叶类黄酮含量见表6。
由表6可知,随采收期延长,各类黄酮成分含量变化规律不尽一致。6种类黄酮中,儿茶素、芦丁、二氢黄酮甙、槲皮素均于180 d采收期时含量达到最高,分别是 474.48、4 397.84、83.26、14.70 mg/kg(品种 SC09)和171.18、3 989.45、81.59、24.74 mg/kg(品种 SC205);山奈酚含量最高的采收期则分别在种植后210 d(SC09,32.05 mg/kg)和 180 d(SC205,56.42 mg/kg);穗花杉双黄酮含量最大时的采收期为种植后120 d,其最大含量值分别为642.09 mg/kg(SC09)和883.02 mg/kg(SC205)。SC09中山奈酚含量随叶片成熟度逐渐增大,直至达到210 d的最大值。6种类黄酮总含量随采收期发生变化,分别为 2 251 mg/kg~5 556 mg/kg(SC09)和1 153 mg/kg~4 943 mg/kg(SC205),变化范围受品种影响大,并均在种植后180 d采收期达到最大值。综上,以单一类黄酮成分含量最高为最优的最佳木薯叶采收期因木薯品种而有所差别;为达到以上6种成分总含量最大,木薯叶采收期可为种植后180 d。

表6 不同采收期下木薯叶中6种类黄酮的含量Table 6 Content of 6 flavonoids in cassava leaves from different harvest times
同一采收期下6种类黄酮成分的含量,SC09与SC205木薯叶中均以芦丁含量最高,随采收期含量范围分别为 1 590.08 mg/kg~4 397.84 mg/kg(SC09)、755.04mg/kg~3 989.45 mg/kg(SC205)。其次为穗花杉双黄酮,其含量范围分别为125.61 mg/kg~642.09 mg/kg(SC09)、243.69 mg/kg~883.02 mg/kg(SC205)。儿茶素、二氢黄酮甙、山奈酚、槲皮素含量随采收期变化规律因木薯品种而异,变化范围分别为SC09:116.60 mg/kg~474.48 mg/kg、5.47 mg/kg ~83.26 mg/kg、17.20 mg/kg ~32.05 mg/kg、0.55 mg/kg~14.70 mg/kg;SC205:12.31 mg/kg~171.18 mg/kg、0.93 mg/kg~81.59mg/kg、17.13 mg/kg~56.42 mg/kg、0.56 mg/kg~24.74mg/kg。SC09与 SC205木薯叶在种植后不超过180 d采收,槲皮素含量均为相同采收期下最小(SC09:0.55 mg/kg~14.70 mg/kg;SC205:0.56 mg/kg~24.74 mg/kg),种植 210 d 时采收,二氢黄酮甙含量最小(SC09:5.47 mg/kg;SC205:0.93 mg/kg)。由上分析,在本研究采收期(种植后90 d~210 d)下,芦丁在6种类黄酮中相对含量最高,其次为穗花杉双黄酮,两者占比合计分别为 SC09:86.0%~93.8%、SC205:90.1%~97.9%,为其他4种类黄酮成分含量总和的6倍以上,为木薯叶黄酮中的主要成分。
3 结论与讨论
3.1 结论
本试验建立的高效液相色谱分析方法可使木薯叶中6种类黄酮成分得到较好分离。经方法学验证,各成分的线性关系良好,回收率准确度较高,是一种检测木薯叶黄酮组成及含量的有效方法。
对木薯品种SC09与SC205不同采收期嫩茎叶中6种类黄酮成分检测表明,芦丁与穗花杉双黄酮为叶黄酮主要成分,其相对含量之和为其他4种类黄酮成分含量总和的6倍以上。种植后180 d采收,木薯叶中儿茶素、芦丁、橙皮苷、槲皮素的含量最高,穗花杉双黄酮含量最大的采收时间为种植后120 d,山奈酚最大含量采收期因品种而异。6种成分总含量最大的采收期为种植后180 d。
3.2 讨论
目前制备木薯叶黄酮提取液方法主要为乙醇水索氏提取或超声辅助提取。陆海腾[14]在乙醇浓度50%、提取温度70℃、液料比40∶1(mL/g),提取时间2 h条件下测定木薯叶总黄酮含量为2.836%;李冰[5]在液料比25∶1(mL/g),乙醇体积分数60%,提取时间100 min条件下测定木薯叶中总黄酮含量为2.523%;本文则采用95%乙醇对SC09与SC205嫩茎叶进行超声提取,但木薯叶类黄酮成分复杂,木薯叶类黄酮测定过程中受提取效率影响明显,影响了不同研究之间测定结果的可比性。因此,研究木薯叶黄酮提取预处理方式对成分的影响,探讨标准化处理条件,有利于完善木薯叶类黄酮测定规范。在本研究过程中,我们发现在试验采用的液相条件下还存在除6种成分之外的色谱峰(如图3(a)中峰2左边吸收峰),这些成分还有待于进一步分析与鉴定。
据报道,巴西木薯叶中槲皮素、山奈酚、芦丁含量分别为 840、840、4 620 mg/kg[7],广西桂北木薯叶中芦丁平均含量为9320mg/kg[12]。本文所测海南产木薯SC09与SC205叶片中类黄酮含量范围为:槲皮素0.55 mg/kg~1.47 mg/kg (SC09) 和 0.56 mg/kg~2.47 mg/kg(SC205);山奈酚:17.20 mg/kg~32.05 mg/kg(SC09)和17.13 mg/kg~56.42 mg/kg(SC205);芦丁:1 651 mg/kg~4 398 mg/kg(SC09)、和 821 mg/kg~3 989 mg/kg(SC205)。进一步表明了,木薯叶片类黄酮含量随采收期及品种而存在差别。
[1] 陶海腾,吕飞杰,台建祥,等.木薯叶营养保健功效的开发[J].中国农学通报,2008,24(6):78-81
[2] 冀凤杰,侯冠彧,张振文,等.木薯叶的营养价值、抗营养因子及其在生猪生产中的应用[J].热带作物学报,2015,36(7):1355-1360
[3] 郝倩,曾会明,张振文,等.木薯叶提取液制备及其对甲鱼生长的影响[J].热带作物学报,2013,34(8):1598-1602
[4] 吕飞杰,张振文,尹道娟,等.木薯叶乙醇提取物对图丽鱼和罗非鱼生长影响的研究[J].中国热带农业,2015(62):5-8
[5] 李兵,何翠薇,陈青青,等.广西木薯叶总黄酮提取工艺及抗菌性研究[J].湖北农业科学,2014,53(23):5816-5819
[6] Hai-Teng Tao,Bin Qiu,Fang-Ling D,et al.The protective effects of cassava(Manihot esculenta crantz)leaf flavonoid extracts on liver damage of carbon tetrachloride injured mice[J].African Journal of Traditional,Complementary and Alternative Medicines,2015:12(1):52-56
[7] Isao Kubo,Noriyoshi Masuoka,Ken-ichi Nihei,et al.Manicoba,aquercetin-rich Amazonian dish[J].Journal of Food Compositionand Analysis,2006,19(7):579-588
[8] 李姗姗,戴好富,赵友兴,等.海南产木薯茎化学成分研究[J].热带亚热带植物学报,2012,20(2):197-200
[9] 何翠薇,陈玉萍,覃洁萍,等.木薯茎杆及叶化学成分初步研究[J].时珍国医国药,2011,22(4):908-909
[10]TanakaY,DataES,HiroseS,et al.BioehemicalChangesinSeeondary Metabolitesin Wbundedand Deteriorated CassavaRoots[J].Agrieultural and Biologieal Chemistry,1983:47(4):693-700
[11]张元梅,周志钦,孙玉敬,等.高效液相色谱法同时测定柑橘果实中18种类黄酮的含量[J].中国农业科学,2012,45(17):3558-3565
[12]何翠薇,覃洁萍,黄俏妮.HPLC法测定木薯叶中芦丁的含量[J].中国药房,2011,22(23):2160-2161
[13]王明龙,李修禄,柴逸峰,等.黄酮类化合物高效液相色谱法分析的进展[J].西北药学杂志,1993,8(3):138-142
[14]陶海腾,陈晓明,吕飞杰,等.木薯叶黄酮类化合物提取研究[J].食品研究与开发,2010,30(12):12-15
Simultaneous Determination of 6 Flavonoids in Cassava Leaves from Different Harvest Time by HPLC
WANG Ding-mei,WANG Wei,MAI Li-wen,YANG Xia,LI Qin-fen*
(Environment and Plant Protection Institute,Chinese Academy of Tropical Agricultural Sciences,Haikou 571101,Hainan,China)
A high performance liquid chromatography (HPLC)method for the determination of six kinds of flavonoids was established and employed to the analysis of flavonoids in cassava leaves havested at different time.The chromatographic separation was performed on a CNW Athena C18-WP column kept at room temperature and acetonitrile/acetonitrile acid/water mixture were used as the mobile phase with a flow rate of 1 mL/min through gradient elution.The injection volume of the sample was 5 μL.The detection wavelengths were setat281nmforcatechinandhesperidin,338nmforamentoflavone,360nmforrutinandkaempferoland367nm for quercetin.The linear ranges of catechin,rutin,hesperidin,quercetin,kaempferol and amentoflavone were 1.5 mg/L-194.6 mg/L(R2=0.999 9),7.8 mg/L-992.6 mg/L(R2=1.000 0),0.7 mg/L-84 mg/L(R2=0.999 9),0.7 mg/L-93.8 mg/L(R2=0.999 9),0.8 mg/L-108 mg/L(R2=0.995 8),0.5 mg/L-67.2 mg/L(R2=0.999 5),respectively.This method was precise and accurate(RSD <3%)and the average recoveries ranged from 95.50%to 100.01%,suitable for the precise quantification of the six flavoinds in cassava leaves.The results indicated that rutin and amentoflavone were the major components with the total amounts over 6 times of other 4 flavoinds.The optimal harvest time to obtain the highest amouts for catechin,rutin,hesperidin,and quercetin was 180 d after planting,120 d for amentoflavone,and it depend on cassava varieties for kaempferol.
high performance liquid chromatography(HLPC);flavonoids;cassava leaves;harvest time
2016-11-30
10.3969/j.issn.1005-6521.2017.18.027
中央级公益性科研院所基本科研业务费专项(NO.2015hzs1J021、NO.2016hzs1J041);中国热带农业科学院院级重点平台-生态农业中心条件改善项目
王定美(1986—),男(汉),助理研究员,硕士,研究方向:废弃物资源化利用。
*通信作者:李勤奋(1974—),女,研究员,博士,研究方向:生态农业、产地环境风险评价。

