miR-30a-3p对食管鳞癌ECA-109细胞侵袭和增殖能力的影响及生物信息学分析
卢沐,付文博,宋亚芹,刘洋,怀施涛,吕作利,杜雅彦,魏育涛 *
(1石河子大学第一附属医院心胸外二科,新疆 石河子 832002;2新疆维吾尔自治区人民医院心内科,新疆 石河子 830001;3山东济宁市第一人民医院营养科,山东 济宁 272111;4石河子大学医学院,新疆 石河子 832002)
miR-30a-3p对食管鳞癌ECA-109细胞侵袭和增殖能力的影响及生物信息学分析
卢沐1,付文博2,宋亚芹3,刘洋4,怀施涛4,吕作利4,杜雅彦4,魏育涛 *
(1石河子大学第一附属医院心胸外二科,新疆 石河子 832002;2新疆维吾尔自治区人民医院心内科,新疆 石河子 830001;3山东济宁市第一人民医院营养科,山东 济宁 272111;4石河子大学医学院,新疆 石河子 832002)
为探讨miR-30a-3p对食管鳞癌细胞生物学行为的影响及机制,miR-30a-3p转染ECA-109细胞后,实时荧光定量PCR检测各组细胞miR-30a-3p表达水平,Transwell小室检测细胞侵袭能力,CCK-8检测细胞增殖能力,通过生物信息学预测miR-30a-3p的靶基因,分析靶基因集合的基因功能及通路富集。结果显示,miR-30a-3p抑制ECA-109细胞侵袭能力(P<0.05),但对增殖能力的影响无统计学意义(P>0.05)。利用系统的生物信息学预测得到与ESCC相关的靶基因77个,其中在食管癌中上调的差异基因42个,下调的差异基因35个。miR-30a-3p的靶基因多集中于迁移、黏附连接、外泌体及蛋白代谢等过程;靶基因显著富集于Ras信号通路。由此可知:miR-30a-3p可抑制ESCC细胞的侵袭能力,分析得出的参与侵袭迁移及其他功能的靶基因为进一步研究提供了方向。
食管癌;miR-30a-3p;侵袭;增殖;生物信息学
食管癌(Esophageal cancer,EC)主要分为食管鳞状细胞癌(EsophagealSquamousCellCarcinoma,ESCC)和食管腺癌(Esophagealadenocarcinoma,EAC)。2012年全球癌症统计数据显示,ESCC在许多国家发生率正在持续升高并成为一个严重的公共卫生问题[1]。中国ESCC发生率较高,尤其是哈萨克族人群的ESCC发生率高于国内平均水平,这可能是民族行为习惯、环境以及遗传等因素导致的[2-3],哈萨克族人群ESCC发生发展的机制对我们提高ESCC的认识具有重要意义。
微小RNA(microRNA,miRNA,miR)与细胞的分化、凋亡、增殖、转移密切相关[4],可能在促癌及抑癌方面具有重要作用[5]。近年关于miRNA和EC的数据显示,miRNA作为生物标志物在肿瘤的诊断和分型中可能表现出较高的特异性。
本课题组前期收集哈萨克族ESCC及癌旁正常组织,运用Agilent miRNA表达谱芯片技术,分析了哈萨克族ESCC患者差异表达的miRNA,经过前期生物信息学及预实验提示,miR-30a-3p可能参与ESCC细胞微环境调控。本实验以ESCC细胞系EC-109细胞为材料,miR-30a-3p为研究对象,应用生物信息学、qRT-PCR、miRNA转染及侵袭、增殖等细胞功能学实验研究miR-30a-3p对食管鳞癌细胞侵袭和增殖能力的作用。综合细胞学实验、文献支持及高通量ESCC组织芯片数据对miR-30a-3p的靶基因进行预测,增强ESCC组织特异性,以期降低预测的假阳性率;GO及KEGG分析为下一步研究提供方向。
1 材料与方法
1.1 主要试剂及细胞系
人ESCC细胞株ECA109购自中国科学院上海生命科学院细胞资源中心;RPMI1640细胞培养液及OPTI-MEM无血清培养液(美国Gibco公司);四季青胎牛血清(浙江天杭生物科技有限公司);化学修饰miRNA序列的has-miR-30a-3p模拟物agomir、抑制物antagomir及对照NC由上海吉玛制药技术有限公司设计合成;LipofectAMINETM 2000转染试剂(美国Invitrogen公司);Transwell小室及 Matrigel基质胶(美国Corning公司);CCK-8试剂盒(上海七海复泰有限公司);miRcute系列细胞miRNA提取及检测试剂盒(北京天根生化科技有限公司)。
1.2 资料来源参考数据库
miRbase、GEO、DAVID、miRWalk 2.0;采 用 软 件BRB-array tools version 4.5.0 Stable Release。
1.3 细胞培养及转染
ECA109使用含10%胎牛血清的RPMI1640培养基,在37℃、CO2浓度5%的培养箱中培养。
转染前一天,将细胞密度3.0×105~8.0×105的细胞接种至6孔板中,待细胞融合度为60%~80%时,使用LipofectAMINETM 2000转染试剂和OPTI-MEM无血清培养液按说明书进行操作。细胞转染分为3组:miR-30a-3p agomir转染增强组、miR-30a-3p antagomir转染抑制组、NC转染对照组。转染时,各组片段100 mol/L,LipofectAMINETM 2000 5 μL。转染24 h后,更换为完全培养液继续培养24 h,然后用于后续实验。
1.4 实时荧光定量PCR法检测miR-30a-3p的表达水平
按miRNA提取试剂盒操作说明书提取转染48h后的3组ESCC细胞miRNA,NanoDrop 2000分光光度仪检测浓度(D260nm/D280nm为 1.8~2.0)。按miRcute反转录试剂盒和实时荧光定量PCR试剂盒说明书对20pg~2μg总RNA进行反转录和miR-30a-3p(miR-30a-3p特异引物5'-GCTTTCAGTCGGATGTTTGCAGC-3';内参照 U6 引物,5'-TGCGGGTGCTCGCTTCGGCAGC-3')表达量的检测。CFX96扩增仪检测miR-30a-3p表达水平的PCR反应条件:95 ℃ 15 min;94 ℃ 20 s、60 ℃ 34s 40个循环;熔解曲线分析。以2-ΔΔCt计算各组中miR-30a-3p的相对表达水平。
1.5 Transwell侵袭实验检测细胞侵袭能力
在冰上将Transwell小室的上室使用0.7 mg/mL Matrigel基质胶包埋,37℃培养箱中水化40 min~60min。收集转染 48h后的 3组(Agomir组、Antagomir组、NC组)ECA109细胞,胰蛋白酶消化重悬细胞后计数,将细胞接种于包埋基质胶的Transwell小室中,上层为含有3.0×104个细胞的无血清DMEM培养液300 μL,下层为含血清的完全培养液600 μL。培养48 h后用4%多聚甲醛固定,结晶紫染色,在光学显微镜下观察穿膜细胞,使用ImageJ进行细胞计数。
1.6 CCK-8法检测细胞增殖能力
收集转染48 h后的3组(Agomir组、Antagomir组、NC组)ECA109细胞,胰蛋白酶消化重悬细胞后计数,以2×103个/孔的密度接种细胞至96孔板,培养箱中常规培养。第0、24、48 h时,在各孔中加入CCK-8试剂10 μL,培养箱中孵育3 h。酶标仪测定波长为450 nm处各孔的吸光度(OD值)。各个时间点设5个复孔,计算平均值。以时间为横轴,OD值为纵轴,绘制细胞生长曲线。
1.7 靶基因预测及生物信息学分析
在英文文献数据库(Pubmed、Web of Science、Springer Link)及中文文献数据库(中国知网、维普、万方)检索经过双荧光素酶报告基因检测系统验证的miR-30a-3p靶基因有关的文献,英文使用关键词miR-30a-3p and Luciferace,中文使用 miR-30a-3p和双荧光素酶报告基因;并用miRWalk2.0对miR-30a-3p靶基因进行预测,选择miRwalk软件包含的四个靶基因预测数据库(miRWalk、RNA22、miRanda、Targetscan)进行预测。取四个数据库的交集,并合并文献证实的miR-30a-3p靶基因作为所有可能的靶基因的集合。另一方面,使用BRB-array tools对芯片数据GSE20347进行生物信息学分析,得到差异基因。取靶基因集合与GEO数据得到的差异基因取交集,得到具有潜在调控作用并与食管癌相关的可能靶基因。靶基因使用DAVID进行GO及KEGG分析。
1.8 统计学方法
采用SPSS 17.0统计学软件进行统计分析。计量资料以±S表示。两组间比较采用t检验;多组间比较采用方差分析。BRB-array tools分析GEO数据经过软件归一化后,采用Fold-change(表达差异倍数)以及t检验统计学方法对差异基因进行筛选。以上统计学数据P<0.05为差异有统计学意义。DAVID数据库对靶基因集合进行GO和KEGG富集分析采用Fisher精确检验,检验水准α=0.05。
2 结果与分析
2.1 转染后miR-30a-3p的表达
分别在ECA-109细胞中转染miR-30a-3p agomir、antagomir和NC后,使用 qRT-PCR检测3组细胞miR-30a-3p的表达情况。与对照组NC相比,agomir转染组 miR-30a-3p明显上调(P<0.01),antagomir转染组miR-30a-3p 表达下调(P<0.01)(图 1)。
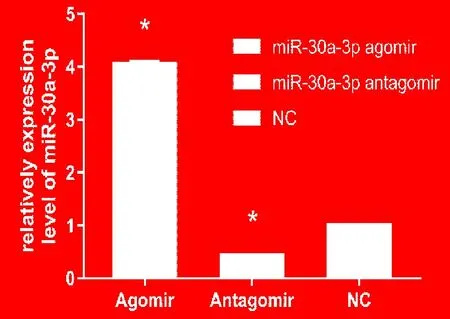
图1 qRT-PCR检测miR-30a-3p过表达或抑制后在ECA-109细胞中的表达水平Fig.1 qRT-PCR was used to detect the expression of miR-30a-3p after transfected miR-30a-3p agomir and antagomir
2.2 miR-30a-3p抑制ECA-109细胞侵袭
Transwell小室染色后,每组均在显微镜下挑选5个随机视野计数(图2)。
结果如图2所示,转染miR-30a-3p agomir的ECA-109细胞穿膜细胞数比转染对照NC组少,差异有统计学意义(P<0.01);转染 miR-30a-3p antagomir的ECA-109细胞穿膜细胞数比转染对照NC组多,差异有统计学意义(P<0.01)。说明miR-30a-3p可以抑制ECA-109细胞的侵袭能力。
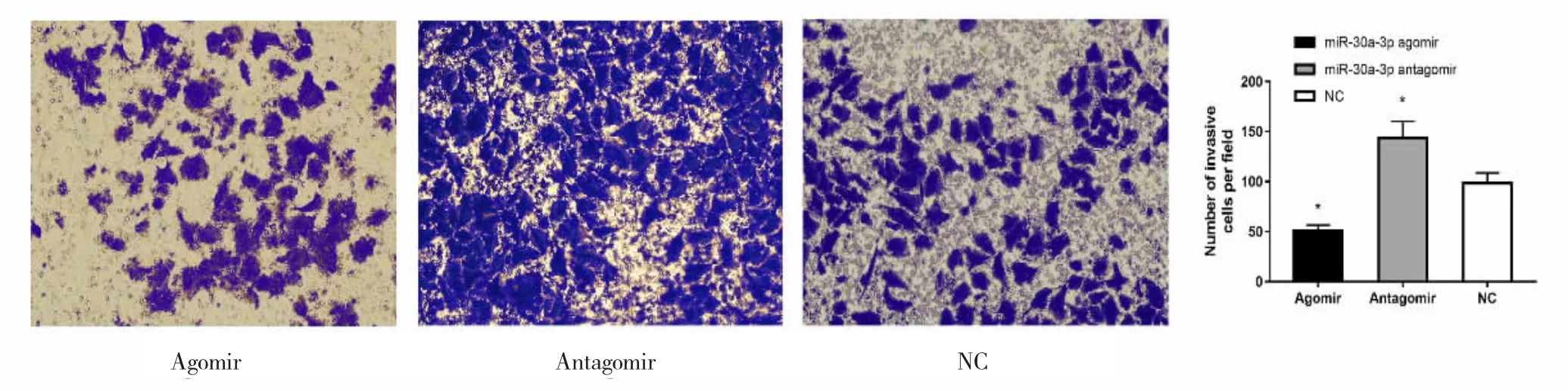
图2 Transwell侵袭实验检测miR-30a-3p过表达或抑制后对ECA-109细胞侵袭能力的影响Fig.2 Invasion of miR-30a-3p overexpression or inhibition in ECA-109 cells were detected by Transwell invasion assay(crystal violet staining,×100).
2.3 miR-30a-3p对细胞增殖的影响无统计学意义
CCK-8结果显示,转染 miR-30a-3pagomir、miR-30a-3p antagomir、NC后,3组吸光度随时间增长无明显差异(P>0.05)(图 3)。
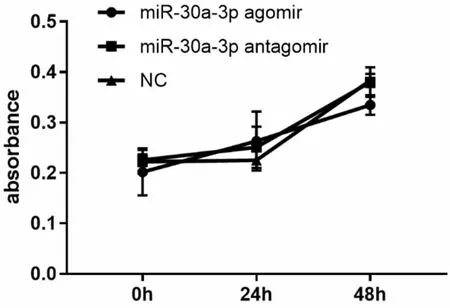
图3 CCK-8检测miR-30a-3p过表达或抑制后对ECA-109细胞增殖能力的影响(P>0.05)Fig.3 Proliferation of miR-30a-3p overexpression or inhibition in ECA-109 cells were detected by CCK-8 assay
2.4 miR-30a-3p靶基因预测
使用miRWalk 2.0软件进行miR-30a-3p靶基因预测,取软件包含的5个预测数据库(miRWalk、RNA22、miRanda、Targetscan)的交集,得到可能靶基因1041个;经文献数据库检索得到靶基因4个,两者取并集后共1044个。使用BRB-array tools分析ESCC芯片数据GSE20347得到差异基因共1163个,其中上调差异基因640个,下调差异基因521个(图4);与软件及文献靶基因集合取交集,最终可能在ESCC中作为miR-30a-3p靶基因的有77个(表1),其中上调差异基因42个,下调差异基因35个。
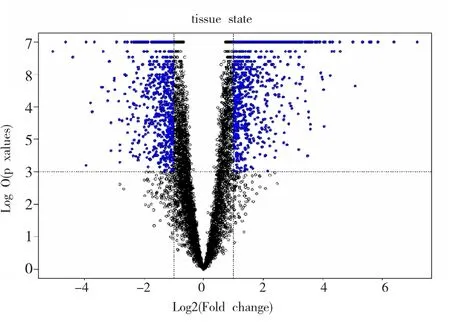
图4 BRB-array tools分析Fig.4 BRB-array tools analyzed

表1 ESCC中miR-30a-3p调控的靶基因集合Tab.1 Target genes of miR-30a-3p in ESCC
2.5 miR-30a-3p靶基因的GO及KEGG生物信息学分析
使用DAVID软件对可能在ESCC中作为miR-30a-3p靶基因的基因集合进行GO和KEGG分析。GO分析筛选条件(表2):P<0.05且基因数>2个,显示miR-30a-3p靶基因功能主要富集于细胞及分子水平蛋白代谢过程、迁移及胞外外泌体等过程;由于筛选后基因较少导致结果较少,KEGG通路分析筛选条件:P<0.10且基因数>2,显示miR-30a-3p靶基因主要富集于Ras信号通路、肿瘤及黏附连接相关等通路上。根据文献报道,选择与侵袭相关GO与KEGG相关基因的交集(表3)。
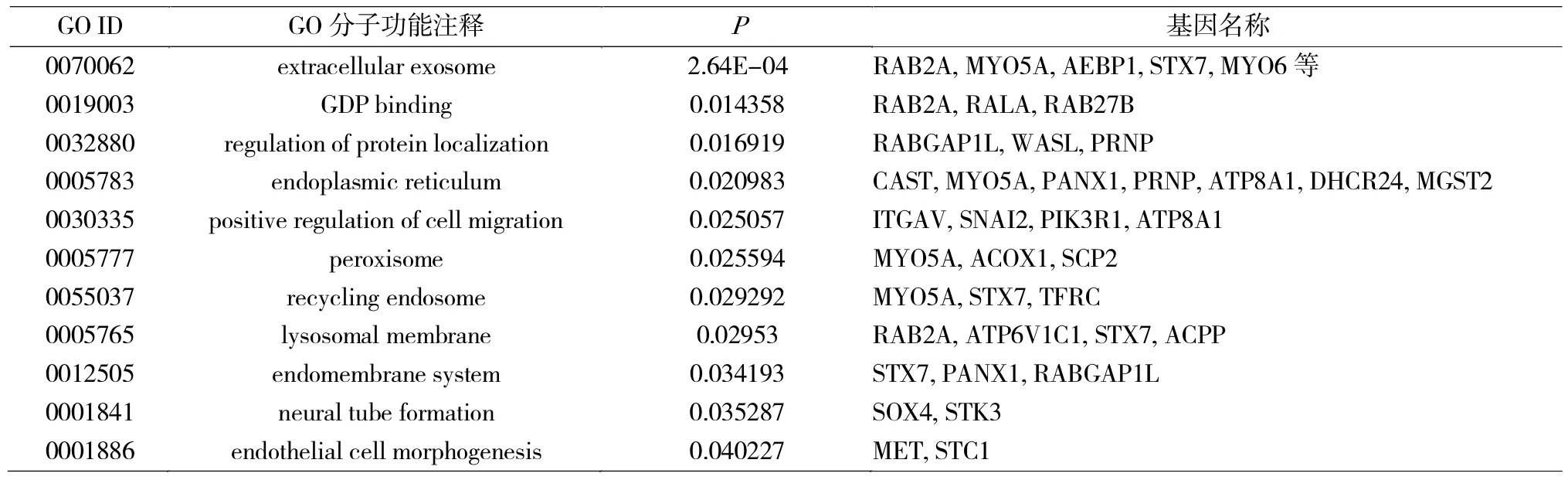
表2 miR-30a-3p靶基因的GO分子功能分类Tab.2 Molecular functional classification of miR-30a-3p target genes by GO analysis
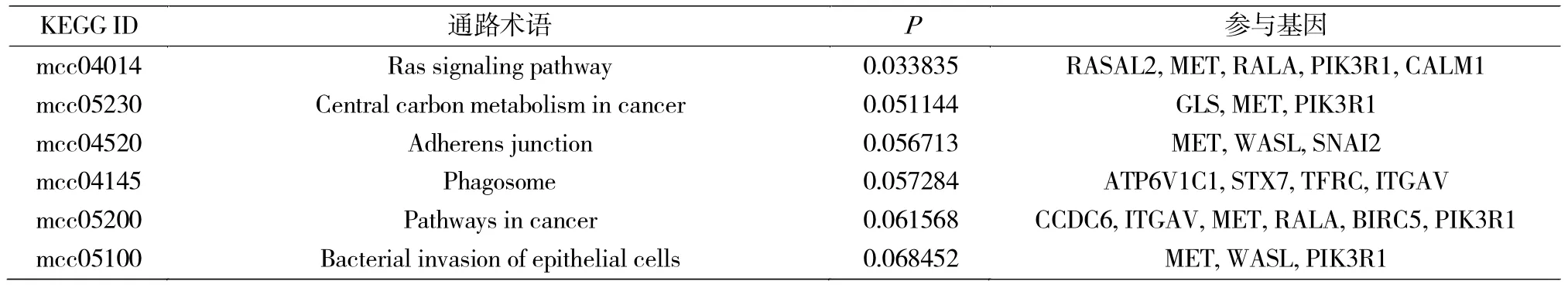
表3 miR-30a-3p靶基因KEGG信号通路富集分析结果Tab.3 KEGG pathway enrichment analysis of miR-30a-3p target genes
3 讨论
在前期的ESCC芯片结果显示,相比于癌旁正常组织,miR-30a-3p在癌组织中低表达,提示其可能是一个抑癌基因。其在ESCC中对细胞侵袭和增殖功能及分子机制的研究尚无报道。
miR-30a-3p从miR-30a前体的3’端臂加工而成[7],据miRBase的报道,其相比于miR-30a-5p表达量要少,但其同样在肿瘤中可能参与重要作用[8]。孙晓娈等[9]在人滋养肿瘤细胞系JEG-3中转染miR-30a-3p后可通过降低IGF-1的表达,从而降低JEG-3的侵袭能力。Wang等[10]发现在肝癌中miR-30a-3p下调并可抑制细胞侵袭和增殖能力。结合我们前期的ESCC组织芯片结果,miR-30a-3p可能在ESCC中具有调控侵袭和增殖的作用。
目前主流的miRNA靶基因预测软件有miRWalk 2.0、miRanda、RNA22 和 李 武 等[11], 通 过 将 候 选miRNA和靶基因的3′UTR区域配对拟合,根据二者结合成双链的自由能大小、以及靶序列在物种间是否具有高度保守性等几个条件进行预测。MiRWalk 2.0的优势在于不仅有自己的预测系统外,还整合了各大主流预测软件,可以将预测的靶基因在多个预测软件的数据库中的频次进行排序[12-13]。然而,miRNA靶基因预测软件仍处在研究当中,根据组织特异性的靶基因预测还处在开发当中,ESCC相关的测序数据还不够充足,因此需要结合既往文献和实验室证据降低预测的假阳性率,提高预测的准确性。本研究中转染miR-30a-3p后ECA-109的增殖能力改变无统计学意义,提示miR-30a-3p对ESCC增殖能力的调控可能较弱,但仍需更多细胞系实验及临床资料验证。根据实验结果,在GO及KEGG分析过程中,我们根据实验结果更加关注与细胞侵袭相关的生物学功能及通路参与的基因。
通过细胞分子生物学实验结果,提示miR-30a-3p的调控与细胞侵袭具有重要作用。在生物信息学分子功能注释分析当中可以看到有多个GO及通路指向侵袭、迁移能力,为进一步研究提供了方向,但是靶基因及其功能需要进一步的实验室分析及筛选。值得注意的是,其GO分析中显示miR-30a-3p的靶基因可能参与外泌体的构成,外泌体作为新的研究热点,后期需要将miR-30a-3p在ESCC外泌体中的表达及功能作为新的研究方向。而且根据预测,miR-30a-3p是通路相关的重要调控因子,有可能作为重要的生物标志物及治疗靶点,对其深入研究将为临床诊治提高帮助。
本研究通过综合细胞学实验、高通量ESCC组织芯片及生物信息学方法对miR-30a-3p的功能及对应的靶基因分子机制进行了分析。结果显示,miR-30a-3p可能通过调控多个靶基因参与信号通路,影响细胞的侵袭。这提示miR-30a-3p的异常表达可能是一个与ESCC转移及复发的重要生物学标志,联合靶向miR-30a-3p及其侵袭相关靶标可能是增强ESCC疗效的重要手段。我们在此次研究中只关注了侵袭与增殖能力的调控,需要注意的是,ESCC的发生发展与自噬、凋亡、代谢等许多生物功能相关,这需要后续更加完善的实验数据支持。
[1]Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Zheng S,Vuitton L,Sheyhidin I,et al.Northwestern China:a place to learn more on oesophagealcancer.Partone:behaviouraland environmentalrisk factors[J].European Journal of Gastroenterology&Hepatology,2010,22(8):917-925.
[3]Zheng S,Vuitton L,Sheyhidin I,et al.Northwestern China:a place to learn more on oesophageal cancer.Part two:gene alterations and polymorphisms[J].European Journal of Gastroenterology&Hepatology,2011,23(12):1087-1099.
[4]Bhaskaran M,Mohan M.MicroRNAs:history biogenesis and their evolving role in animal development and disease[J].Vet Pathol,2014,51(4):759-774.
[5]Yu H W H,Sze D M Y,Cho W C S.MicroRNAs involved in anti-Tumour immunity[J].Int J Mol Sci,2013,14(3):5587-5607.
[6]Mitchell P S,Pa rkin R K,Kroh E M,et al.Circulating microRNAs as stable bloodbased markers for cancer det-ection[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(30):10513-10518.
[7]Zhang C,Ma X,Du J,et al.MicroRNA 30a as a prognostic factor in Urothelial carcinoma of Bladder inhibits cellular malignancy by antagonizing Notch1[J].BJU international.2016,32(1):35-38.
[8]Moch H,Lukamowicz R M.miR-30c-2-3p and miR-30a-3p:new pieces of the jigsaw puzzle in HIF2alpha regulation[J].Cancer Discovery,2014,4(1):22-24.
[9]孙晓娈,姚元庆,尹国武,等.MiR-30a-3p靶基因的预测与验证[J].实用妇产科杂志,2014,30(9):671-674.Sun X L,Yao Y Q,Yin W G,et al.Prediction and verification of MiR-30a-3p target gene[J].Journal of Practical Obstetrics and Gynecology,2014,30(9):671-674.
[10]Wang W,Lin H,Zhou L,et al.MicroRNA-30a-3p inhibits tumor proliferation,invasiveness and metastasis and is downregulated in hepatocellular carcinoma[J].European Journal of Surgical Oncology(EJSO),2014,40(11):1586-1594.
[11]李武,贺庆芝,孙诗博,等.Has-miR-16靶基因预测及生物信息学分析[J].中华疾病控制杂志,2016,20(2):193-197.Li W,He Q Z,Sun S B,et al.Prediction of has-miR-16 target genes and its bioinformatics analysis[J].Chin J Dis Control Prev,2016,20(2):193-197
[12]Dweep H,Gretz N.miRWalk2.0:a comprehensive atlas of microRNA-target interactions[J].Nature Methods,2015,12(8):697.
[13]Downward J.Targeting RAS signalling pathways in cancer therapy[J].Nature Reviews Cancer,2003,3(1):11-22.
Roles of miR-30a-3p in invasion and proliferation of ESCC cells ECA-109 and bioinformatics analysis
Lu Mu1,Fu Wenbo2,Song Yaqin3,Liu Yang4,Huai Shitao4,Lv Zuoli4,Du Yayan4,Wei yutao1*
(1 Department of Thoracic and Cardiovascular Surgery,the First Affiliated Hospital,School of Medicine,Shihezi University,Shihezi,Xinjiang 832002,China;2 Department of Cardiology,People's Hospital of Xinjiang Uygur Autonomous Region,Urumqi,Xinjiang 830001,China;3 Department of Nutritional,Jining First People's Hospital,Jining,Shandong 272111,China;4 School of Medicine,Shihezi University,Shihezi,Xinjiang 832002,China)
To investigate the invasion and proliferation effects of miR-30a-3p in ESCC,to get target genes of miR-30a-3p in ESCC by bioinformatics approaches,and to analysis the molecular functions in effects.Transwell invasion assay and CCK-8 proliferation assay were used to detect the invasion and the proliferation after transfecting ECA-109 with miR-30a-3p.Target genes of miR-30a-3p were predicted by bioinformatics,combined with relevant literature,ESCC GEO database and prediction software.DAVID database was used to analyze the GO(Gene Ontology)annotation and KEGG(Kyoto encyclopedia of genes and genomes)signal pathway enrichment respectively.The results showed that overexpression of miR-30a-3p could inhibit the invasion (P<0.05),but had no effect on the proliferation (P>0.05).There were 77 target genes in ESCC got by bioinformatics approaches,with 42 up-regulated genes and 35 down-regulated genes.GO of these genes were significantly involved in migration,adherent junction,exosome and protein metabolism.These target genes were mainly enriched in Ras signaling pathway.It is concluded that Mir-30a-3p can inhibit the invasion of ESCC,its target genes and their ontology and pathway provide directions for further research.
esophageal carcinoma;miR-30a-3p;invasion;proliferation;bioinformatics
R735.1
A
10.13880/j.cnki.65-1174/n.2017.04.012
1007-7383(2017)04-0462-06
2017-02-24
国家自然科学基金项目(81460059),新疆兵团博士基金项目(2014BB019)
卢沐(1989-),男,硕士研究生,专业方向为心胸外科学。
*通信作者:魏育涛(1974-),男,副教授,从事心胸外科相关研究,e-mail:wytfwb@126.com。

