宫颈癌组织中HPV16L1蛋白质的表达及意义
潘贞贞,潘欢,朱君玲,郑威楠,李洪涛,何鸿昌,任显显,武丹,王红英,杨昕,潘泽民*
(1新疆地方与民族高发病教育部重点实验室/石河子大学医学院生物化学教研室,新疆 石河子 832002;2新疆生产建设兵团第四师医院检验科,新疆 伊犁 835000;3喀什地区第一人民医院病理科,新疆 喀什 844000;4新疆医科大学基础医学院微生物学教研室,新疆 乌鲁木齐 830011;5新疆医科大学自治区中医医院病理科,新疆 乌鲁木齐 830000)
宫颈癌组织中HPV16L1蛋白质的表达及意义
潘贞贞1,2,潘欢1,朱君玲3,郑威楠1,李洪涛1,何鸿昌1,任显显1,武丹1,王红英4,杨昕5,潘泽民1*
(1新疆地方与民族高发病教育部重点实验室/石河子大学医学院生物化学教研室,新疆 石河子 832002;2新疆生产建设兵团第四师医院检验科,新疆 伊犁 835000;3喀什地区第一人民医院病理科,新疆 喀什 844000;4新疆医科大学基础医学院微生物学教研室,新疆 乌鲁木齐 830011;5新疆医科大学自治区中医医院病理科,新疆 乌鲁木齐 830000)
为探讨人乳头瘤病毒(Human papilloma virus,HPV)16 L1蛋白表达与宫颈癌发生与发展的关系,为防治宫颈癌奠定基础。采用收集宫颈癌患者48例、宫颈上皮内瘤样病变(cervcal intraepithelial neoplasia,CIN)患者41例和慢性宫颈炎患者30例石蜡组织标本用于免疫组织化学实验的方法。检测HPV16 L1蛋白在宫颈癌组织、CIN组织和慢性宫颈炎组织中的蛋白质表达状况。HPV16 L1蛋白质免疫组织化学实验的结果显示,慢性宫颈炎组织中阳性率为100%,而在宫颈癌组织中阳性率仅为27.1%,差异有统计学意义(P<0.01)。慢性宫颈炎组织的阳性率明显高于宫颈癌组织。由此可知,HPV16 L1蛋白质在宫颈原位癌开始表达减少,宫颈浸润癌表达减少更明显,可能可以用于诊断CINII和CINIII或CINII和宫颈癌。
宫颈癌;HPV16 L1蛋白质;蛋白表达
子宫颈癌是全球妇女中仅次于乳腺癌的常见的恶性肿瘤[1],是威胁妇女健康、导致妇女死亡的主要恶性肿瘤之一。我国新疆维吾尔族妇女宫颈癌患病率高,死亡率高,发病年龄早,其患病率高达 459~590/10万,死亡率为15.78/10万,平均发病年龄约43岁。
HPV在宫颈癌的癌变前期及发展中扮演一个必不可少的角色。可以感染人类的HPV类型,已有超过120种被分离出来,其中约有20种已经被划分为高危HPV类型。这些高危病毒中,HPV16已被确定与宫颈癌的发生联系密切[2]。如今,高危型HPV的感染是引起宫颈上皮内瘤样病变以及宫颈癌的重要因素,临床检测HPV高危型感染作为诊断宫颈癌的一种有效的标志物[3]。
HPV在人类广泛传播,仅限于皮肤和粘膜的细胞内增殖,病毒在基底干细胞内呈隐性状态,随细胞的分裂而分裂。HPV基因组是双链闭合环状DNA,可分 3个区段:早期区(E区)、晚期区(L区)和长控制区(LCR 区)。其中 E区有 E1、E2、E4、E5、E6和E7等早期蛋白,参与病毒 DNA的复制、转录、翻译调控和细胞转化等,其中E6和E7是HPV的主要致癌蛋白,与病毒细胞转化功能及致癌性有关。L区有主要衣壳蛋白L1和次要衣壳蛋白L2,L1高度保守,特异性强;L2编码的衣壳蛋白较少,但变异多。LCR含有HPV基因组DNA的复制起点和HPV基因表达所必需的调控元件,调控病毒的转录与复制。通过研究HPV16 L1蛋白质在慢性宫颈炎组织、CIN组织和宫颈癌组织中的表达,明确该蛋白质表达的意义。认识HPV16 L1蛋白质在宫颈癌发生、发展中的作用,为预防和治疗该肿瘤奠定基础。
1 材料与方法
1.1 标本收集
研究对象为2012年6月到2014年12月在石河子大学第一附属医院和新疆库尔勒巴州医院就医的患者,收集宫颈癌患者48例,宫颈上皮内瘤样病变患者41例和慢性宫颈炎患者30例石蜡标本组织用于免疫组织化学实验,病理切片均于4℃冰箱保存。患者中位年龄45岁,最小患者年龄25岁,最大患者年龄72岁。标本组织都经过两位有经验的医师进行诊断,所有患者经书面知情同意参与本研究。
1.2 方法
HPV16 L1蛋白质在宫颈组织中的表达采用免疫组织化学实验检测。免疫组化实验中HPV16 L1抗体稀释比例为1∶400,抗原修复方式是使用pH 6.0的枸橼酸高压修复 8 min。免疫组织化学染色结果判定采用双盲法:由两位病理学专家独立双盲阅片,结果取其平均值。采用阳性细胞所占百分比和细胞染色强度两者乘积来判断阳性强度(表1)。
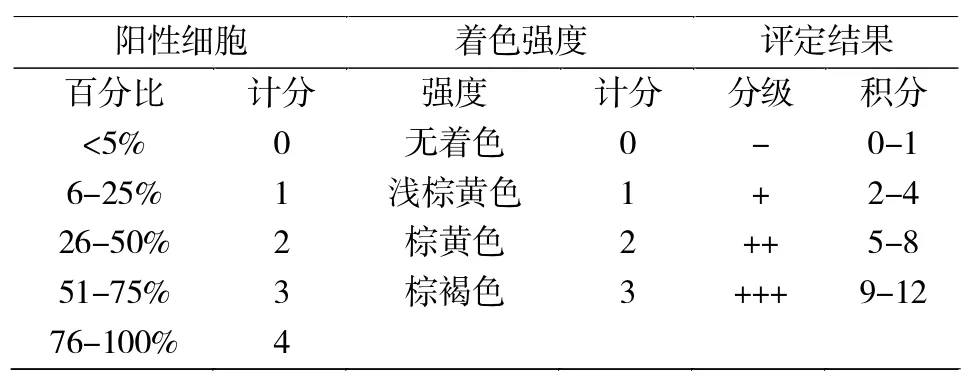
表1 免疫组化染色实验结果判断标准表Tab.1 The standard of immunohistochemical staining
1.3 统计学分析
采用SPSS17.0统计软件分析处理数据。免疫组化结果采用χ2检验和四格表的精确概率法判断蛋白表达与各病理指标的相互关系。计量资料以均数±标准差表示,组间差异比较用t检验。P<0.05为差异有统计学意义。
2 结果与分析
2.1 研究对象一般特征
对于不同年龄、民族的宫颈癌患者,HPV16 L1蛋白质表达阳性率与年龄、民族之间进行了统计学分析,其结果差异无统计学意义(P>0.05)。针对48例宫颈癌患者的病理分级与 HPV16 L1蛋白质的表达水平进行了统计学分析,结果显示宫颈癌组织中HPV16 L1蛋白质的表达水平与患者的病理分级差异无统计学意义(P>0.05)(表2)。

表2 HPV16 L1蛋白质在宫颈组织中的表达与临床信息分析Tab.2 The expression of HPV16 L1 in cervical tissue and clinical information of patients
2.2免疫组织化学实验检测HPV16 L1蛋白质在宫颈组织中的表达
免疫组织化学结果如图1所示:HPV16 L1在宫颈癌组织中的表达强度明显低于慢性宫颈炎组织,主要分布在癌细胞胞浆中,呈褐色或棕黄色颗粒状;而大部分宫颈癌组织呈浅黄色,甚至不着色。并且,随着病理分级程度的加深,HPV16 L1的表达量随着降低。免疫组化实验中HPV16 L1抗体稀释比例为1∶400,抗原修复方式是使用pH 6.0的枸橼酸高压修复 8 min。在48例宫颈癌组织中,27.1%的组织呈阳性,12例CINIII组织中阳性率为41.7%;而29例CINI、CINII组织和30例慢性宫颈炎组织中强阳性率为100.0%(表3)。实验结果表明HPV16 L1蛋白质在宫颈癌组织、CIN组织以及慢性宫颈炎组织的表达差异具有统计学意义。针对病理诊断以及 HPV16 L1蛋白质的表达情况进行了两两比较,慢性宫颈炎与 CINⅢ;慢性宫颈炎与宫颈癌;CINⅠ、Ⅱ与 CINⅢ比较;CINⅠ、Ⅱ与宫颈癌比较(P<0.05)。然而,慢性宫颈炎与 CINⅠ、Ⅱ,CINⅢ与宫颈癌比较,差异无统计学意义(P>0.05)。
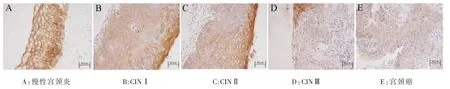
图1 HPV16 L1在慢性炎症组、宫颈上皮内瘤样病变组织和宫颈癌组织中的表达(SP×200)Fig.1 Expression of HPV16 L1 protein in chronic cervicitis,cervical intraepithelial neoplasia and cervical carcinoma(SP×200)
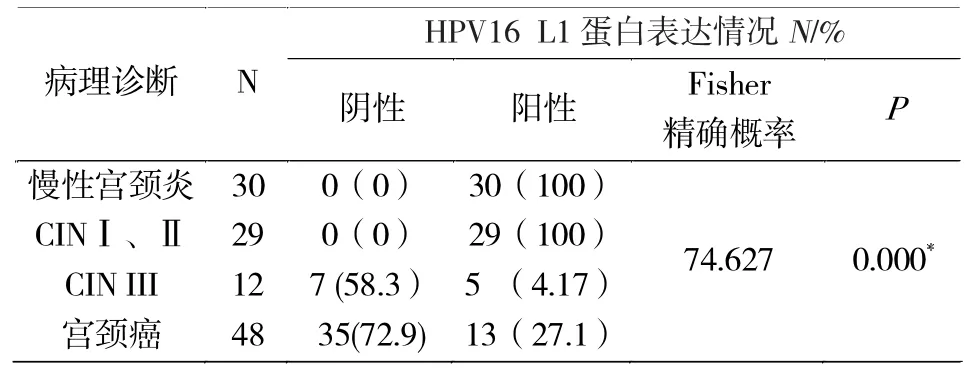
表3 HPV16 L1在慢性炎症组织、宫颈上皮内瘤样病变组织和宫颈癌组织中的表达Tab.3 Expression of HPV16 L1 protein in chronic cervicitis,cervical intraepithelial neoplasia and cervical carcinoma tissues
3 讨论
HPV感染是引起宫颈癌发生的因素之一。研究表明,宫颈癌的发病是由于多种因素、多步骤所导致的疾病。宫颈癌发生可能与生物学因素有关,例如病毒、细菌等各种微生物的感染及行为因素有关,例如初次性生活过早、多个性伴侣、吸烟等;并且与社会因素有关,例如受教育程度低、家庭经济状况差等以及家庭遗传易感性等因素有关[3]。HPV16 L1的代谢途径HPV属乳头瘤病毒家族,是特殊的 DNA病毒,可以使正常细胞不停的进行有丝分裂,并且具有高度种属特异性和特殊嗜上皮性,病毒 DNA进入宿主细胞后,以整合的形式存在于宿主细胞中。机体通过杀死被感染病毒的细胞来阻止新的病毒颗粒复制,从而抵抗病毒感染,这是机体防御病毒感染的途径之一。然而HPV可以有选择的刺激细胞增殖从而来对抗机体的防御体系。直接或间接的刺激细胞增殖,从而诱发细胞癌变[4-5]。
目前已经发现200余种不同型别的HPV,还有许多正在被检测的新型别,其中已经有100多型的基因组被分离鉴定,并且完成了全基因组测序[6],基因组被分为3个不同的类型:A、B、E 3种[6-8]。其中,A类(super group A,or Alpha papillomaviruses)HPV 只感染灵长类动物。A类HPV中有40多型是经生殖道传染,称为生殖道传染的HPV(Genitally transmitted,HPV),其主要的性传播疾病的病原体是HPV6、11、16、18。其中,HPV16、18 与宫颈癌的发生有关[9-12]。
HPV16是环状双链DNA病毒,基因组有8个基因,编码8个蛋白质,6个早期基因编码6个早期蛋白质,分别为:E1、E2、E4、E5、E6、E7 蛋白质。两个迟期基因L1和L2可编码结构蛋白质并构成病毒的外壳。当 HPV16病毒感染机体,并且形成肿瘤,在肿瘤组织内将检测不到有 HPV16 L1蛋白表达。首先,HPV16 L1蛋白表达与鳞状上皮的分化过程有关,在鳞状上皮表层细胞开始进入分化状态后,HPV16病毒的生活周期才能完成,才能出现L1蛋白的表达[13-14]。在肿瘤组织中,病毒无法启动晚期蛋白质的表达程序,是因为肿瘤组织的去分化而引起的,因而,也就检测不到HPV16 L1蛋白表达。
病毒以内吞的方式进入细胞,内吞小泡不但可以与细胞内的亚细胞器合体,而且在溶酶体弱酸性的环境中为病毒脱颗粒提供条件,甚至可以避免病毒与免疫监视细胞表面的蛋白结合,顺利进入宿主细胞。进入宿主细胞后,病毒开始脱颗粒过程,在宿主细胞内酶的作用下,病毒的基因组L1、L2壳蛋白被释放。病毒的DNA进入宿主细胞的细胞核,与宿主细胞的DNA整合,开始复制和转录,重新与L1、L2壳蛋白组装形成新的病毒。在宿主细胞内,L1蛋白衣壳的二硫键形成,处于病毒装配的晚期。HPV病毒需要与宿主细胞共同进化,从而通过特殊的机制完成病毒的释放[15]。本实验通过免疫组织化学实验检测了慢性宫颈炎、CIN、宫颈癌组织中HPV16 L1蛋白质的表达情况,经过临床病理医生的判读、计分、统计,实验结果表明,HPV16 L1蛋白在慢性宫颈炎组织中表达呈阳性,在宫颈癌组织中表达弱或几乎不表达,这一结果完全符合上文叙述中的关于病毒 L1壳蛋白分解,合成过程。有研究显示,HPV16L1蛋白的表达随着宫颈组织病变程度的加重而逐渐减少[16],Xiao等[17]通过L1衣壳蛋白的免疫染色法发现L1蛋白在CINⅠ,CIN Ⅱ,CIN III患者中的阳性表达率分别是83.53%,41.81%和3.13%,与本研究结果一致。出现这种结果的原因可能是人体的免疫系统已经识别HPV16病毒,并且正在发生免疫应答。目前的治疗性疫苗主要针对于HPV诱导下癌细胞中持续表达的早期基因产物E6和E7,HPV16L1蛋白通常在病毒感染后病变早期表达,可以当做一种有前景的预防性HPV疫苗抗原[18]。根据免疫组织化学实验结果显示,HPV16 L1蛋白在宫颈原位癌开始表达减少,宫颈浸润癌表达减少更明显,这可能被认为是诊断CINII和CINIII或CINII和宫颈癌的一项标准。
4 结论
HPV16 L1蛋白质在宫颈原位癌开始表达减少,宫颈浸润癌表达减少更明显,因此,本研究为CINII和CINIII或CINII和宫颈癌的诊断提供有价值的参考。
[1]Yang Y,Lang JH,Wang YF,et al.Assessing the effectiveness of a cervical cancer screening program in a hospitalbased study[J].Biomed Environ Sci,2015,28(1):80-84.
[2]Thones N,Muller M.Oral immunization with different assembly forms of the HPV 16 major capsid protein Ll induces neutralizing antibodies and cytotoxicT-lymphocytcs[J].Virology,2007,369(2):375-388.
[3]刘英华,陈瑛.人乳头瘤病毒感染与宫颈癌的研究进展[J].现代生物医学进展.2013,13(5):973-974.Liu Yinghua,Chen Ying.Research progress of human papillomavirus infection and cervical cancer[J].Progress in Modern Biomedicine,2013,13(5):973-974.
[4]Demers G W,Foster S A,Halbert C L,et al.Growth Arrest by Induction of p53 in DNA Damaged Keratinocytes is Bypasse by Human Papillomavirus 16 E7[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(10):4382-4386.
[5]Jones DL,KarlMunger.Analysis of the P53-mediated Gl growth arrest pathway in cells expressing the human papillomavirus type 16E7 oncoprotein[J].Journal of Virology,1997,71(4):2905.
[6]Bernard H.U.The clinical importance of the nomenclature,evolution and taxonomy of human papillomaviruses[J].Journal of Clinical Virology,2005,32(1):1-6.
[7]De Villiers EM,Fauquet C,Broker TR,et al.Classification of papillomaviruses[J].Virology.2004,324(1):17-27.
[8]Lowy DR,Kirnbauer R,Schiller JT.Genital human papillomavirus infection[J].Proceedings of the National Academy of Sciences of the United States of America,1991,43(4):2436-2440.
[9]Walboomers J,Jacobs M,Manos MM,et al.Human papillomavirus is a necessary cause of in vasive cervical cancer worldwide[J].Journal of Pathology,1999,189(1):12-19.
[10]Bosch FX,Lorincz A,Munoz N,et al.The causal relation between human papillamavirus and cervical cancer[J].Journal of Clinical Pathology,2002,55(4):244-265.
[11]Steenbergen RDM,de Wilde J,Wilting S M,et al.HPV-mediated transfor-mation of the anogenital tract[J].Journal of Clinical Virology,2005,32(1):25-33.
[12]Peto J,Gilham C,Fletcher O,et al.The cervical cancer epidemic that screening has prevented in the UK[J].Lancet.2004,364(9430):249-356.
[13]Doorbar J,Quint W,Banks L,et al.The biology and life cycle of human papilla-maviruses[J].Vaccine,2012,30(Suppl 5):55-70.
[14]Doorbar J.The papillomavirus life cycle[J].Journal of Clinical Virology,2005,32(11):7-15.
[15]杨军,王理,司履生.HPV16L1核浆运输的动力学过程[J].微生物学报.2006.46(6):917-921.Yang Jun,Wang Li,Si Lusheng.Kinetic process of HPV16L1 nuclear pulp transportation[J].Journal of Microbiology,2006,46(6):917-921.
[16]时艳梅,肖长义,叶红,等.临床宫颈组织标本HPV16 L1蛋白检测[J].基础医学与临床,2010,30(8):807-810.Shi Yanmei,Xiao Changyi,Ye Hong,et al.Clinical study of HPV16 L1 protein in clinical cervical tissue[J].Chinese Journal of Basic Medicine and Clinical Medicine,2010,30(8):807-810.
[17]Xiao W,Bian M,Ma L,et al.Immunochemical analysis of human papillomavirus L1 capsid protein in liquid-based cytology samples from cervical lesions.[J].Acta Cytologica,2010,54(5):661-667.
[18]Li L L,Wang H R,Zhou Z Y,et al.One-prime multiboost strategy immunization with recombinant DNA,adenovirus,and MVA vector vaccines expressing HPV16 L1 induces potent,sustained,and specific immune response in mice[J].Antiviral Research,2016,128:20-27.
The expression and significance of HPV16L1 protein in cervical cancer tissues
Pan Zhenzhen1,2,Pan Huan1,Zhu Junling3,Zheng Weinan1,Li Hongtao1,He Hongchang1,Ren Xianxian1,Wu Dan1,Wang Hongying4,Yang Xin5,Pan Zemin1*
(1 Laboratory for Xinjiang Endemic and Ethnic Diseases/Department of Biochemistry and Molecular Biology,School of Medicine,Shihezi University,Shihezi,Xinjiang 832002,China;2 Department of Clinical Laboratory,Xinjiang production and Construction Corps of the Fourth Division Hospital,Yining,Xinjiang 835000,China;3 Department of Pathology,the First People Hospital of Kashgar,Kashgar,Xinjiang 844000,China;4 Department of Microbiology,College of Basic Medicine,Xinjiang Medical University,Urumqi,Xinjiang 830011,China;5 Department of Pathology,Chinese Medicine Hospital of Autonomous Region,Xinjiang Medical University,Urumqi,Xinjiang 830000,China)
To elucidate the relationship between the expression of human papilloma virus (HPV)16 L1 protein and the development and progression of cervical cancer,and to lay a foundation for the prevention and treatment of cervical cancer.48 patients with cervical cancer,41 patients with cervical intraepithelial neoplasia(CIN)and 30 patients with chronic cervicitis paraffin embedded specimens were used for immunohistochemistry.Detected the expression of HPV16 L1 protein in cervical cancer tissues,CIN tissues and chronic cervicitis tissues.The results of HPV16 L1 protein with immunohistochemistry showed that the positive rate of chronic cervicitis was 100%,while the positive rate in cervical carcinoma was only about 27.1%,and the difference was statistically significant(P<0.01).The results indicated that the positive rate of chronic cervicitis was significantly higher than that of cervical cancer.It can be seen that the expression of HPV16 L1 protein in cervical carcinoma in situ is decreased and the expression of HPV16 L1 protein is decreased more significantly in cervical carcinoma,which may be used to diagnose CINII and CINIII or CINII and cervical cancer.
cervical cancer;HPV16 L1 protein;protein expression
R793.9
A
10.13880/j.cnki.65-1174/n.2017.04.011
1007-7383(2017)04-0458-04
2017-03-24
国家自然科学基金项目(U1503125,30860302,30660193),新疆兵团国际科技合作项目(2013BC003),石河子大学重大科技攻关计划项目(gxjs2013-zdgg05),高层次人才科研启动资金专项(RCZX201534)
潘贞贞(1981-),女,主管检验医师,专业方向为人体重要功能蛋白的克隆与基因工程。
*通信作者:潘泽民(1966-),男,教授,博士生导师,从事肿瘤分子生物学研究,e-mail:panteacher89@sina.com。

