HPV16阳性和阴性患者宫颈癌组织中miR-27a-3p和HOXB8蛋白的表达差异及其机制研究
李会影,王慧智,张子旸(牡丹江医学院附属红旗医院妇产科,黑龙江牡丹江 157011)
·精准医疗·
HPV16阳性和阴性患者宫颈癌组织中miR-27a-3p和HOXB8蛋白的表达差异及其机制研究
李会影*,王慧智,张子旸#(牡丹江医学院附属红旗医院妇产科,黑龙江牡丹江 157011)
目的:探讨miR-27a-3p和同源盒B8(HOXB8)蛋白在人乳头瘤病毒16型阳性[HPV16(+)]和阴性[HPV16(-)]患者宫颈癌组织中表达的差异及其机制。方法:选取2012年1月-2016年1月于我院就诊的宫颈癌患者120例,根据其是否感染HPV16分为HPV16(+)组(60例)和HPV16(-)组(60例)。采用实时荧光定量聚合酶链反应法检测两组患者宫颈癌组织中miR-27a-3p和HOXB8 mRNA的表达水平,采用蛋白印迹法检测HOXB8蛋白的表达水平,采用巢式降落式甲基化特异性聚合酶链反应法检测miR-27a-3p启动子区DNA甲基化水平,采用染色质免疫共沉淀-定量聚合酶链反应法检测miR-27a-3p启动子区组蛋白甲基化水平;培养人宫颈癌细胞系SiHa细胞株,考察转染miR-27a-3p模拟物(mimic)和抑制物(inhibitor)后miR-27a-3p和HOXB8 mRNA的表达水平。结果:HPV16(+)组患者宫颈癌组织中miR-27a-3p的表达水平显著低于HPV16(-)组患者,HOXB8 mRNA和蛋白表达水平、miR-27a-3p启动子区DNA甲基化水平和组蛋白甲基化水平均显著高于HPV16(-)组患者,差异均有统计学意义(P<0.05或P<0.01)。在SiHa细胞转染miR-27a-3p mimic后,miR-27a-3p的表达水平显著升高,而HOXB8 mRNA的表达水平显著降低;转染miR-27a-3p inhibitor后,miR-27a-3p的表达水平显著降低,而HOXB8 mRNA的表达水平则显著升高,差异均有统计学意义(P<0.01)。结论:HPV16可能通过启动子区DNA甲基化和组蛋白甲基化下调miR-27a-3p的表达,从而影响宫颈癌的发生与发展,HOXB8蛋白可能是其作用靶点。
人乳头瘤病毒16型;宫颈癌;miR-27a-3p;同源盒B8蛋白;DNA甲基化;组蛋白甲基化
宫颈癌是女性生殖系统恶性肿瘤,在世界范围内的发病率和病死率均较高,严重威胁女性生命健康[1-2]。人乳头瘤病毒16型(Human papilloma virus type 16,HPV16)是最普遍、最致命的HPV类型之一,也是诱发宫颈癌的主要原因[3]。同源盒B8(Homeobox B8,HOXB8)是HOX蛋白家族成员,其表达水平在HPV16阳性[HPV16(+)]宫颈癌组织中显著升高,但具体机制尚未阐明[4]。微RNA(MicroRNAs,miRNAs)是一类内源性小分子非编码RNA,可在转录后调控基因的表达[5]。研究表明,多种miRNAs通过调控靶基因的表达参与宫颈癌的发生与发展,其中miR-27a-3p可调控HOXB8基因的表达[6-8]。现有研究多集中于miRNAs的调控作用,而忽视了miRNAs表达变化的机制。DNA甲基化和组蛋白甲基化是表观遗传学调控的重要方式[9-10],其是否参与miRNAs的表达调控仍不清楚。因此,本研究以HPV16(+)和HPV16阴性[HPV16(-)]宫颈癌患者为研究对象,探讨miR-27a-3p的表达变化及其机制,并考察其对HOXB8蛋白是否具有调控作用。
1 资料与方法
1.1 材料
1.1.1 仪器 QuantStudio Q3型实时荧光定量聚合酶链反应(PCR)仪(美国Applied Biosystems公司);Mastercycler Nexus Eco型普通PCR仪、547R型台式高速冷冻离心机(德国Eppendorf公司);Powerpac HV Power Supply型电泳仪(美国BioRad公司);FCM型凝胶成像系统(美国Protein Simple公司);DLHR-D1603型电动匀浆器(华邻科技有限公司);HR900-ⅡA2型生物安全柜(海尔生物医疗)。
1.1.2 试剂 胎牛血清(FBS)、opti-MEM无血清培养基、青链霉素和高糖培养基(DMEM)(美国Gibco公司,批号分别为12483-012、51985042、15240-062、12491-015);磷酸盐缓冲液(PBS)(美国Hyclone公司,批号:SH30256.01B);聚山梨酯20(美国BioRad公司,批号:170-6531);DNA提取试剂盒、总RNA提取试剂盒、荧光定量PCR试剂盒(含SYBR Green、ddH2O)(美国Qiagen公司,批号分别为69506、74104、204054);逆转录试剂盒及发光液(美国ThermoFisher公司,批号分别为K1691、32106);DNA甲基化修饰试剂盒(北京天漠科技开发有限公司,批号:D5030);miRNA提取试剂盒、miRNA逆转录试剂盒、miRNA荧光定量PCR试剂盒、miR-27a-3p及U6引物(天根生化科技有限公司,批号分别为DP501、KR201-02、FP401-02、CD201-0025、CD201-0145);蛋白质提取及定量试剂盒、蛋白上样缓冲液(江苏凯基生物技术股份有限公司,批号分别为KGP250、KGPBCA、KGP101);anti-HOXB8、anti-H3K9me2(美国Abcam公司,批号分别为ab125727、ab120);anti-β-actin及辣根过氧化物酶(HRP)标记二抗(北京中杉金桥生物技术有限公司,批号分别为TA-09、SC-2048);人工合成miR-27a-3p模拟物(mimic)、抑制物(inhibitor)及阴性对照(上海吉玛制药技术有限公司);Lipo2000(美国Invitrogen公司,批号:11668027);染色质免疫共沉淀试剂盒[含蛋白A/G琼脂糖(Protein G Agarose),美国Millipore公司,批号:17-371];普通引物由华大基因提供,HOXB8、甘油醛-3-磷酸脱氢酶(GAPDH)引物及甲基化特异性引物由上海生工生物工程股份有限公司合成;人宫颈癌细胞系Si-Ha细胞株购自美国模式培养物集存库。
1.2 研究对象
纳入标准:(1)于我院首次就诊或接受治疗的宫颈癌患者,经组织活检及术后病理学检查确诊为宫颈癌;(2)既往无其他恶性肿瘤病史;(3)不合并其他恶性肿瘤;(4)术前未接受放疗、化疗或其他治疗。排除标准:(1)年龄≤18岁者;(2)妊娠期妇女;(3)严重的肝肾功能障碍者;(4)合并不能有效控制的高血压、糖尿病及心脏疾病等。本研究方案经医院医学伦理委员会审核通过,患者均知情同意并签署知情同意书。
本研究共纳入2012年1月—2016年1月于我院妇产科就诊的宫颈癌患者120例,根据其是否感染HPV16分为HPV16(+)组和HPV16(-)组。其中,HPV16(+)组患者60例,年龄28~63岁,平均年龄(47.2±9.5)岁;HPV16(-)组患者60例,年龄25~59岁,平均年龄(45.7±8.3)岁。所有患者均留取手术切除的癌组织标本,于-80℃冻存,备用。
1.3 研究方法
1.3.1 实时荧光定量PCR法检测miR-27a-3p和HOXB8 mRNA的表达水平 按照试剂盒说明书提取宫颈癌组织中的总miRNA和总mRNA,并将其逆转录为互补脱氧核糖核酸(cDNA)。其中,总miRNA的逆转录分为加多聚腺苷酸(PolyA)尾和逆转录两部分。以cDNA为模板,进行实时荧光定量PCR分析,反应体系包括cDNA 2 μL,上、下游引物各0.8 μL,SYBR Green 12.5 μL,ddH2O 8.9 μL,共25 μL。反应条件:95℃预变性5 min,1个循环;95℃变性10 s,58℃退火30 s,72℃延伸30 s,40个循环;产物经熔解曲线分析。HOXB8基因上游引物:5′-GTCCCTGCGCCCCAATTATTA-3′,下游引物:5′-GCCCGTGGTAGAACTCCTG-3′。HOXB8 mRNA相对表达水平以GAPDH的表达水平为参照,根据目的基因的相对表达量=2-ΔΔCt计算结果,ΔΔCt=[CtHOXB8-CtGAPDH],计算HOXB8 mRNA的相对表达变化。miR-27a-3p相对表达水平以U6的表达水平为参照,根据目的基因的相对表达量=2-ΔΔCt计算结果,ΔΔCt=[CtmiR-27a-3p-CtU6],计算miR-27a-3p的相对表达变化。式中,Ct(Cycle threshold)表示每个反应管内的荧光信号到达设定的阈值时所经历的循环数。
1.3.2 蛋白质印迹(Western blotting)法检测HOXB8蛋白的表达水平 将宫颈癌组织剪碎,冰上匀浆,以离心半径6 cm、转速5 000 r/min离心5 min,弃去上清,收集沉淀。按照蛋白提取试剂盒说明书提取宫颈癌组织的总蛋白,并进行蛋白定量。按体积比1∶4加入蛋白上样缓冲液混匀,于100℃下反应5 min,使蛋白变性。取变性后的蛋白样品5 μL,进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,切取大小约为32 kDa(HOXB8)和43 kDa(β-actin)的片段,分别进行半干转膜操作。转膜结束后,采用5%脱脂奶粉对聚偏二氟乙烯膜(PVDF)封闭2 h。分别与anti-HOXB8和anti-β-actin混合后,于4℃下孵育过夜。用磷酸缓冲盐溶液-聚山梨酯(PBST,由PBS和聚山梨酯20配制)洗膜后,与HRP标记的二抗于室温下孵育2 h,PBST洗膜后加发光液,于凝胶成像分析仪上成像并分析条带灰度值。以β-actin的表达量为参照,计算HOXB8蛋白的相对表达水平。HOXB8蛋白的相对表达水平=HOXB8灰度值/βactin灰度值。
1.3.3 巢式降落式甲基化特异性PCR(nMS-PCR)法检测miR-27a-3p启动子区DNA甲基化水平 按照试剂盒说明书提取宫颈癌组织的基因组DNA,并采用亚硫酸氢盐法对基因组DNA进行甲基化修饰。在Ensembl Genome Browser(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)中查找miR-27a-3p启动子区序列并线上设计1对外引物和2对内引物(即甲基化引物和非甲基化引物)。外引物上游:5′-GGTTTTGTGTAGGGGAAATTTTATAG-3′,外引物下游:5′-CAACCCTATCCCCTTAAAATCTAAA-3′;甲基化引物上游:5′-TTGGGGTGAGATTATTTTTTTATTC-3′,甲基化引物下游:5′-CTAAAACCTAACTATACCCTCCGTT-3′;非甲基化引物上游:5′-GGGGTGAGATTATTTTTTTATTTGT-3′,非甲基化引物下游:5′-CTAAAACCTAACTATACCC-TCCATT-3′。外引物扩增的反应条件:95℃预变性5 min;95℃变性30 s,61℃退火30 s,72℃延伸30 s,20个循环,每个循环降0.5℃至52℃,72℃再延伸7 min。以外引物的PCR产物为模板,继续进行内引物的扩增,其扩增反应条件同外引物。取PCR产物5 μL于2%琼脂糖凝胶上进行电泳分析,并于凝胶成像分析系统成像,计算甲基化条带及非甲基化条带的光密度(OD),miR-27a-3p启动子区DNA甲基化水平=甲基化条带的OD值/(甲基化条带的OD值+非甲基化条带的OD值)。
1.3.4 染色质免疫共沉淀-定量PCR(CHIP-qPCR)法检测miR-27a-3p启动子区组蛋白甲基化水平 将宫颈癌组织冰上匀浆后,以终体积分数为1%的甲醛室温固定10 min。采用终浓度为0.125 mol/L甘氨酸作用5 min以终止交联。以离心半径6 cm、转速5 000 r/min离心5 min后,弃去上清,PBS冲洗2遍。SDS裂解液重悬并裂解组织沉淀,冰上进行超声破碎操作,使DNA破碎为100~1 000 bp大小的片段。以离心半径6 cm、转速12 000 r/min离心15 min后取上清液100 μL,加入anti-H3K9me2抗体,于4℃下孵育过夜,形成anti-H3K9me2-H3K9me2复合物;经蛋白A/G琼脂糖结合沉淀后,形成Protein G Agarose-anti-H3K9me2-H3K9me2复合物,于65℃水浴中解除交联,并采用DNA提取试剂盒、按说明书操作纯化DNA,以纯化后的DNA为模板,对miR-27a-3p启动子区进行实时荧光定量PCR扩增反应。扩增反应体系及反应条件同“1.3.1”项,退火温度为59℃。
1.3.5 细胞培养及转染 用含10%FBS及1%抗生素的DMEM培养基,于37℃、5%CO2的培养箱中静置培养SiHa细胞株。按每孔1×106个细胞铺板:①取100 μL opti-MEM与适量Lipo2000混匀静置5 min;②另取100 μL opti-MEM与适量miR-27a-3p mimic、inhibitor或阴性对照混匀静置5 min;③将上述①②混匀后静置20 min,加至细胞培养液中,于48 h后收集细胞,提取RNA进行后续试验,步骤同“1.3.1”项。
1.4 统计学方法
应用SPSS 17.0软件对数据进行统计分析。计量资料以±s表示,两组间比较采用Students’t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者宫颈癌组织中miR-27a-3p表达水平比较
HPV16(+)组患者宫颈癌组织中miR-27a-3p的表达水平显著低于HPV16(-)组,差异有统计学意义(P<0.01),详见图1。
2.2 两组患者宫颈癌组织中HOXB8 mRNA和蛋白表达水平比较

图1 两组患者宫颈癌组织中miR-27a-3p表达水平比较Fig 1 Comparison of the expression of miR-27a-3p in cervical cancer tissue between 2 groups
HPV16(+)组患者宫颈癌组织中HOXB8 mRNA和蛋白的表达水平均显著高于HPV16(-)组患者,差异均有统计学意义(P<0.05),详见图2。
2.3 两组患者宫颈癌组织中miR-27a-3p启动子区DNA甲基化水平比较
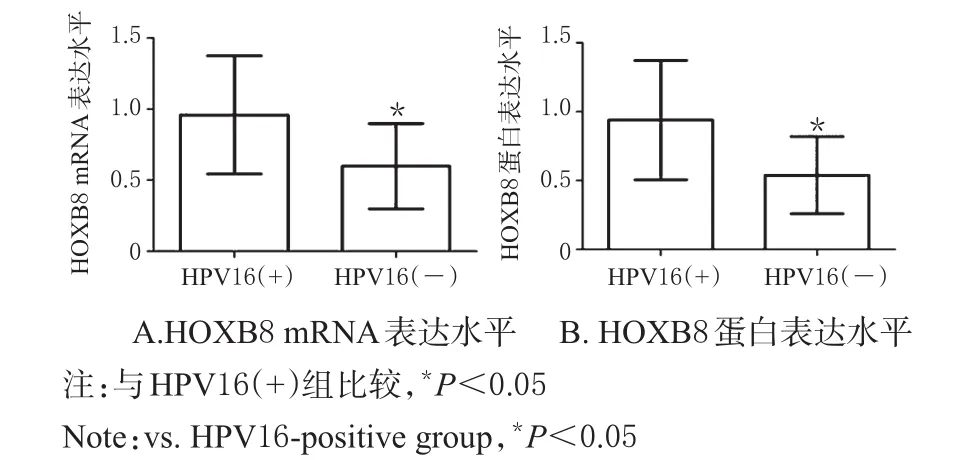
图2 两组患者宫颈癌组织中HOXB8 mRNA和蛋白表达水平比较Fig 2 Comparison of the expression of HOXB8 mRNA and protein in cervical cancer tissues between 2 groups
在线(http://www.urogene.org/methprimer/)查看miR-27a-3p启动子区CpG位点和CpG岛分布情况,结果显示,miR-27a-3p启动子区富含CpG岛,详见图3。
HPV16(+)组患者宫颈癌组织中miR-27a-3p启动子区DNA甲基化水平显著高于HPV16(-)组患者,差异有统计学意义(P<0.01),详见图4、图5。

图3 miR-27a-3p启动子区CpG位点和CpG岛分布情况Fig 3 Distribution of CpG islands and CpG sites in miR-27a-3p promoter region
2.4 两组患者宫颈癌组织中miR-27a-3p启动子区组蛋白甲基化水平比较

图4 nMS-PCR产物电泳图Fig 4 Electrophoretogram of nMS-PCR product
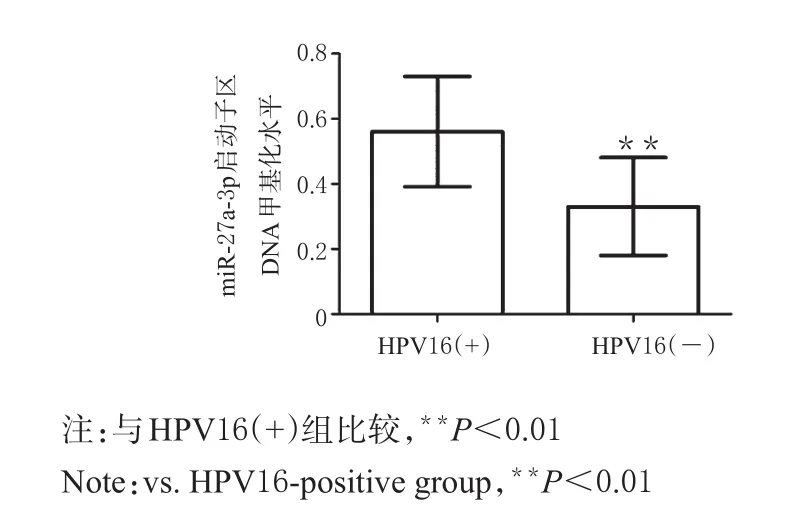
图5 两组患者宫颈癌组织中miR-27a-3p启动子区DNA甲基化水平比较Fig 5 Comparison of DNA methylation levels of miR-27a-3p promoter region in cervical cancer tissues between 2 groups
HPV16(+)组患者宫颈癌组织中miR-27a-3p启动子区组蛋白甲基化水平显著高于HPV16(-)组患者,差异有统计学意义(P<0.05),详见图6。
2.5 miR-27a-3p对HOXB8表达的影响
在人宫颈癌细胞系SiHa细胞株中分别转染miR-27a-3p mimic和inhibitor后,检测miR-27a-3p和HOXB8 mRNA表达的变化。结果显示,在SiHa细胞转染miR-27a-3p mimic后,miR-27a-3p的表达水平显著升高,而HOXB8 mRNA的表达水平显著降低,差异均有统计学意义(P<0.01);转染miR-27a-3p inhibitor后,miR-27a-3p的表达水平显著降低,而HOXB8 mRNA的表达水平则显著升高,差异均有统计学意义(P<0.01),详见图7。
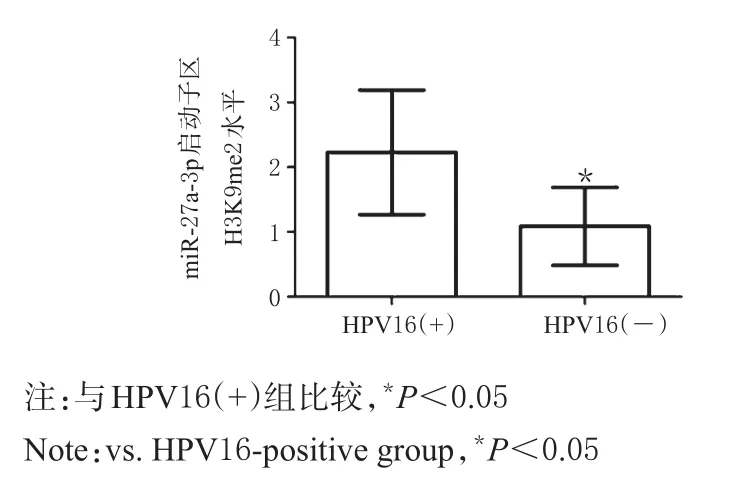
图6 两组患者宫颈癌组织中miR-27a-3p启动子区组蛋白甲基化水平比较Fig 6 Comparison of histone methylation levels of miR-27a-3p promoter region in cervical cancer tissues between 2 groups
3 讨论
宫颈癌是女性生殖系统恶性肿瘤,HPV感染是引起宫颈癌的主要原因之一。HPV是一种双链DNA病毒,低危险性HPV可引起良性的生殖器疣,而高危险性HPV与宫颈癌的发生与发展密切相关。其中,HPV16是HPV最常见的类型,是导致宫颈癌的重要因素[3,11-12]。本研究以HPV16(+)和HPV16(-)宫颈癌患者为研究对象,初步探讨HPV16的致病机制。
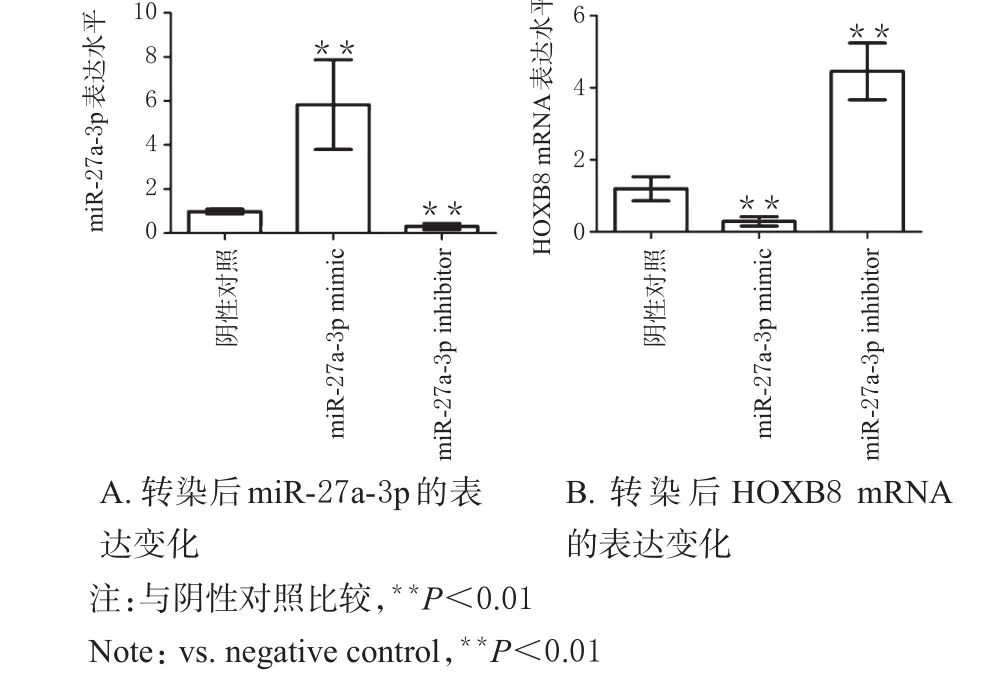
图7 miR-27a-3p对HOXB8表达的影响Fig 7 Effect of miR-27a-3p on the expression of HOXB8
3.1 HOXB8与miRNAs
HOXB8是同源盒家族成员,能够编码具有HOX DNA结合结构域的核蛋白。研究表明,HOXB8与结直肠癌、胃癌和宫颈癌的发生、发展密切相关[4,13-14]。本研究结果显示,在HPV16(+)宫颈癌患者组织中HOXB8的表达水平显著升高,与文献[4]报道一致,但其具体机制尚不清楚。miRNAs是一类大小约为18~22个核苷酸的内源性小分子非编码RNA,可通过结合靶mRNA 3′-非翻译(UTR)区使其降解或翻译一致,从而实现在转录后调控基因表达的目的。Yang H等[15]研究发现,miR-497可靶向转酮酶调控宫颈癌对铂化疗的敏感性;Zhou N等[16]研究发现,miR-138可通过调控人端粒逆转录酶(hTERT)的表达水平抑制宫颈癌细胞的增殖、迁移和侵袭;Lai XJ等[17]研究表明,miR-421可通过下调Bcl-xL从而介导c-33a宫颈癌细胞的凋亡,这提示多种miRNAs可通过调控靶基因的表达参与宫颈癌的发生与发展。本研究结果显示,在人宫颈癌细胞系SiHa细胞株中,转染miR-27a-3p mimic(即过表达miR-27a-3p)后,HOXB8 mRNA的表达水平显著降低;而转染miR-27a-3p inhibitor(即抑制miR-27a-3p的表达)后,HOXB8 mRNA的表达水平显著升高,提示miR-27a-3p可能直接或间接靶向调控HOXB8的表达,但具体机制尚有待进一步研究。
3.2 miRNAs与表观遗传学修饰
以往研究多集中于miRNAs对其靶基因的调控作用,而忽视了miRNAs表达变化的机制。表观遗传学修饰是指在基因核苷酸序列不发生改变的情况下,基因表达发生可逆、可遗传的改变。表观遗传的现象很多,已知的有DNA甲基化(DNA methylation)、组蛋白甲基化(Histone methylation)、基因组印记(Genomic imprinting)、母体效应(Maternal effects)、基因沉默(Gene silencing)、核仁显性、休眠转座子启动和RNA编辑(RNAediting)等[18]。其中,DNA甲基化和组蛋白甲基化是表观遗传学调控的重要方式,文献报道DNA甲基化和H3K9me2均为基因沉默的标志,且二者可能具有协同调控基因表达的作用[9,19]。赵丽等[20]研究表明,miR-124启动子区DNA甲基化在动脉粥样硬化的发生与发展过程中发挥了重要的作用。然而,DNA甲基化和组蛋白甲基化是否参与HPV16(+)宫颈癌组织miR-27a-3p的表达调控仍不清楚。本研究结果显示,HPV16(+)组患者宫颈癌组织中miR-27a-3p启动子区DNA和组蛋白甲基化水平均显著高于HPV16(-)组患者,提示DNA甲基化和组蛋白甲基化参与了HPV16(+)宫颈癌组织中miR-27a-3p的表达调控。DNA甲基化和组蛋白甲基化的发生需要相应酶的催化,如DNA甲基转移酶1(DNMT1)、组蛋白甲基化酶G9a等,但其在HPV16(+)宫颈癌中是否发生改变尚需进一步研究。
综上所述,HPV16可能通过启动子区DNA甲基化和组蛋白甲基化下调miR-27a-3p的表达,从而影响宫颈癌的发生与发展;HOXB8蛋白可能是其作用靶点,HOXB8基因可能是miR-27a-3p的靶基因。本研究为HPV16(+)宫颈癌患者的临床治疗提供了理论基础和治疗靶点。但miR-27a-3p启动子区发生DNA甲基化和组蛋白甲基化的机制仍不明确,还需后续深入研究。
[1] Yamagami W,Nagase S,Takahashi F,et al.Clinical statistics of gynecologic cancers in Japan[J].J Gynecol Oncol,2017,28(2):e32.
[2] Hasahya OT,Berggren V,Sematimba D,et al.Beliefs,perceptions and health-seeking behaviours in relation to cervical cancer:a qualitative study among women in Uganda following completion of an HPV vaccination campaign[J].Glob Health Action,2016,doi:10.3402/gha. v9.29336.
[3] Torres Lobatón A,Rojo Herrera G,Torres Rojo A,et al. Cervical cancer:current view of its epidemiology and risk factors[J].Ginecol Obstet Mex,2004,72:466-474.
[4] Liu C,Lin J,Li L,et al.HPV16 early gene E5 specifically reduces miRNA-196a in cervical cancer cells[J].Sci Rep,2015,doi:10.1038/srep07653.
[5] Barwari T,Joshi A,Mayr M.MicroRNAs in cardiovascular disease[J].J Am Coll Cardiol,2016,68(23):2577-2584.
[6] Xu D,Liu S,Zhang L,et al.MiR-211 inhibits invasion and epithelial-to-mesenchymal transition(EMT)of cervical cancer cells via targeting MUC4[J].Biochem Biophys Res Commun,2017,485(2):556-562.
[7] Fan JY,Fan YJ,Wang XL,et al.MiR-429 is involved in regulation of NF-κB activity by targeting IKKβ and suppresses oncogenic activity in cervical cancer cells[J]. FEBS Lett,2017,591(1):118-128.
[8] Shi C,Zhang Z.MicroRNA-362 is downregulated in cervical cancer and inhibits cell proliferation,migration and invasion by directly targeting SIX1[J].Oncol Rep,2017,37(1):501-509.
[9] Estève PO,Chin HG,Smallwood A,et al.Direct interaction between DNMT1 and G9a coordinates DNA and histone methylation during replication[J].Genes Dev,2006,20(22):3089-3103.
[10] Hashimoto H,Vertino PM,Cheng X.Molecular coupling of DNA methylation and histone methylation[J].Epigenomics,2010,2(5):657-669.
[11] Schiffman M,Castle PE,Jeronimo J,et al.Human papillomavirus and cervical cancer[J].Lancet,2007,370(9590):890-907.
[12] Zhao JW,Fang F,Guo Y,et al.HPV16 integration probably contributes to cervical oncogenesis through interrupting tumor suppressor genes and inducing chromosome instability[J].J Exp Clin Cancer Res,2016,35(1):180.
[13] Shen S,Pan J,Lu X,et al.Role of miR-196 and its target gene HOXB8 in the development and proliferation of human colorectal cancer and the impact of neoadjuvant chemotherapy with FOLFOX4 on their expression[J].Oncol Lett,2016,12(5):4041-4047.
[14] Ding WJ,Zhou M,Chen MM,et al.HOXB8 promotes tumor metastasis and the epithelial-mesenchymal transition via ZEB2 targets in gastric cancer[J].J Cancer Res Clin Oncol,2017,143(3):385-397.
[15] Yang H,Wu XL,Wu KH,et al.MicroRNA-497 regu-lates cisplatin chemosensitivity of cervical cancer by targeting transketolase[J].Am J Cancer Res,2016,6(11):2690-2699.
[16] Zhou N,Fei D,Zong S,et al.MicroRNA-138 inhibits proliferation,migration and invasion through targeting hTERT in cervical cancer[J].Oncol Lett,2016,12(5):3633-3639.
[17]Lai XJ,Cheng XY,Hu LD.MicroRNA 421 induces apoptosis of c-33a cervical cancer cells via down-regulation of Bcl-xL[J].GenetMolRes,2016,doi:10.4238/gmr15048853.
[18] Russo V,Bernabò N,Di Giacinto O,et al.H3K9 trimethylation precedes DNA methylation during sheep oogenesis:HDAC1,SUV39H1,G9a,HP1,and Dnmts are involved in these epigenetic events[J].J Histochem Cytochem,2013,61(1):75-89.
[19] Leung DC,Dong KB,Maksakova IA,et al.Lysine methyltransferase G9a is required for de novo DNA methylation and the establishment,but not the maintenance,of proviral silencing[J].Proc Natl Acad Sci U S A,2011,108(14):5718-5723.
[20]赵丽,焦运,杨安宁,等.MiR-124及其启动子区DNA甲基化在同型半胱氨酸致动脉粥样硬化中的作用[J].生理学报,2015,67(2):207-213.
(编辑:张元媛)
Expression Difference and Its Mechanism Study of miR-27a-3p and HOXB8 Protein in Cervical Cancer Tissues of HPV16-positive and HPV16-negative Patients
LI Huiying,WANG Huizhi,ZHANG Ziyang(Dept.of Obstetrics and Gynecology,Hongqi Hospital Affiliated to Mudanjiang Medical College,Heilongjiang Mudanjiang 157011,China)
OBJECTIVE:To investigate the expression difference and its mechanism of miR-27a-3p and HOXB8 protein in cervical cancer tissues of HPV16-positive and HPV16-negative patients.METHODS:A total of 120 patients with cervical cancer in our hospital during Jan.2012-Jan.2016 were divided into HPV16-positive group(60 cases)and HPV16-negative group(60 cases)according to HPV16 infection situation.The expression of miR-27a-3p mRNA and HOXB8 mRNA in cervical cancer tissue were detected by RT-qPCR.The expression of HOXB8 protein was detected by Western blotting assay.DNA methylation level of miR-27a-3p promoter region was detected by nested-down methylation specific PCR(nMS-PCR).Histone methylation level of miR-27a-3p promoter region was detected by chromatin immunoprecipitation PCR(CHIP-PCR).The expression of miR-27a-3p mRNA and HOXB8 mRNA were detected after transfecting miR-27a-3p mimic and inhibitor into Human cervical cancer cell line SiHa,respectively.RESULTS:The expression of miR-27a-3p in HPV16-positive group was significantly lower than HPV16-negative group,while HOXB8 mRNA and protein expression,DNA and histone methylation levels of miR-27a-3p promoter region were significantly higher than HPV16-negative group,with statistical significance(P<0.05 or P<0.01).After transfecting miR-27a-3p mimic into SiHa cells,the expression of miR-27a-3p was increased significantly,while that of HOXB8 mRNA was decreased significantly;after miR-27a-3p inhibitor transfection,the expression of miR-27a-3p was decreased significantly,while that of HOXB8 mRNA was increased significantly,with statistical significance(P<0.01).CONCLUSIONS:HPV16 may down-regulate the expression of miR-27a-3p through DNA methylation and histone methylation of promoter region,so as to influence the generation and development of cervical cancer.HOXB8 may be the target protein of miR-27a-3p.
Human papilloma virus type 16;Cervical cancer;miR-27a-3p;Homeobox B8 protein;DNA methylation;Histone methylation
R711.74
A
1001-0408(2017)23-3169-06
2016-12-22
2017-06-15)
*副主任医师,硕士。研究方向:妇产科学。电话:0453-6602036。E-mail:huiying26@163.com
#通信作者:副主任医师。研究方向:妇产科学。电话:0453-6602036。E-mail:1403355759@qq.com
DOI10.6039/j.issn.1001-0408.2017.23.01

