HSV Us3蛋白激酶对巨噬细胞生物学活性和凋亡的影响研究
吴建奇, 柴若楠, 木村吉延, 刘北星
(1.中国医科大学附属第一医院 神经外科,辽宁 沈阳 110001;2.沈阳军区总医院 变态反应科,辽宁 沈阳 110016;3.福井医科大学 微生物学教研室,福井 日本 910-1193;4.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
HSV Us3蛋白激酶对巨噬细胞生物学活性和凋亡的影响研究
吴建奇1, 柴若楠2, 木村吉延3, 刘北星4*
(1.中国医科大学附属第一医院 神经外科,辽宁 沈阳 110001;2.沈阳军区总医院 变态反应科,辽宁 沈阳 110016;3.福井医科大学 微生物学教研室,福井 日本 910-1193;4.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
为探讨单纯疱疹病毒Us3基因及其编码产物对LPS活化的巨噬细胞生物学活性和凋亡的影响,小鼠巨噬细胞系RAW246.7细胞瞬时转染pcDNA3.1(+)-Us3重组质粒并体外培养。利用免疫荧光技术检测转染率,ELISA方法检测培养上清中TNF-α分泌水平,Annexin-V染色评价转染细胞凋亡情况。结果发现,pcDNA3.1(+)-Us3重组质粒可成功转染至RAW246.7细胞,转染率为10.3%。与空质粒转染组相比,pcDNA3.1(+)-Us3转染细胞培养上清中TNF-α分泌水平明显升高,但凋亡细胞数量略有下降,证实Us3基因及其编码蛋白在调控巨噬细胞细胞因子分泌活性及其活化细胞凋亡方面发挥一定作用。
Us3蛋白激酶基因;RAW246.7细胞;TNF-α;凋亡
单纯疱疹病毒(herpes simplex virus,HSV)属疱疹病毒科,有两个血清型,可分别引起眼角膜炎、致死性脑炎及生殖器疱疹等严重危害人类健康的疾病[1]。HSV为约80个基因的DNA病毒,其基因的一半以上为与病毒复制无直接关系的附加基因[2]。Us3即为HSV的附加基因,其产物Us3蛋白激酶具有多功能性,其中Us3介导的病毒抗宿主细胞凋亡功能受到密切关注。 研究发现在培养细胞系及小鼠感染模型中,Us3蛋白激酶通过影响细胞凋亡途径相关因子的活性介导HSV抗宿主细胞凋亡,进而在HSV病毒的增殖及扩散方面发挥重要作用[3-6]。巨噬细胞作为连接固有免疫应答和适应性免疫应答的桥梁细胞,HSV病毒、特别是Us3蛋白激酶对巨噬细胞生物学活性及凋亡的影响作用值得研究。本研究利用含HSV Us3基因的DNA质粒-pcDNA3.1(+)-Us3转染巨噬细胞系RAW246.7细胞株,探讨Us3基因对LPS活化巨噬细胞TNF-α分泌活性及活化巨噬细胞凋亡的影响,为阐明Us3蛋白激酶在抗宿主细胞凋亡中的作用提供参考。
1 材料与方法
1.1 材料
1.1.1 重组DNA质粒 pcDNA3.1(+)-Us3(HSV-2)质粒, 由爱滋医科大学森勇博士惠赠。
1.1.2 细胞株 小鼠巨噬细胞系RAW246.7细胞,为本实验室保存细胞株。用含10% FCS 的RPMI 1640培养液常规传代培养。
1.2 方法
1.2.1 重组质粒体外培养及表达 转染前1天,在放有载玻片的35 mm培养皿中加入RAW246.7细胞,37 ℃、5%CO2孵箱培养细胞至单层。将含4 μg质粒DNA和10 μL脂质体2000转染液加入其中,培养4 h后弃转染液,加入含10% FCS的RPMI 1640继续培养至48 h。取出载玻片,丙酮固定后,用抗Us3蛋白激酶单克隆抗体染色,4 ℃过夜, 加FITC标记的二抗,荧光显微镜下观察质粒DNA转染和表达情况。同设空质粒和细胞对照。质粒转染率用荧光显微镜40倍视野下荧光染色细胞数与同一视野普通光源下细胞总数比值的百分率来表示:
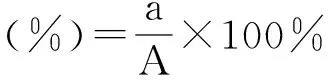
a:荧光染色细胞数;A:相同视野普通光源下的细胞数。
1.2.2 细胞因子检测 将RAW246.7细胞接种于6孔板培养至单层。转染DNA质粒 4 h后,加入含10 μg/mL LPS的10% FCS RPMI 1640继续培养至48 h,收集细胞培养上清,ELISA试剂盒检测细胞因子TNF-α含量。
1.2.3 细胞凋亡实验 将细胞培养于含LPS的10% FCS RPMI 1640培养液中72 h后制备细胞悬液,按照凋亡试剂盒说明书用Annexin V-FITC和Propidium iodide (购自BD Pharmingen)染色细胞。
1.2.4 统计学分析 应用Mann-Whitney U检验分析重组质粒(pcDNA3.1-Us3)与对照空质粒组(pcDNA3.1)的显著性差异。P<0.05判定为具有统计学意义。
2 结果与分析
2.1 活化RAW246.7细胞的最适LPS刺激浓度
用含不同浓度LPS的RPMI 1640培养液培养RAW246.7细胞, 37 ℃、5% CO2培养48 h后,收集培养上清, 检测TNF-α水平。结果显示,在LPS终浓度为10 μg/mL的培养条件下,RAW246.7细胞培养上清中TNF-α含量最高,提示10 μg/mL是本实验体系中活化RAW246.7细胞的最适LPS浓度(图1)。
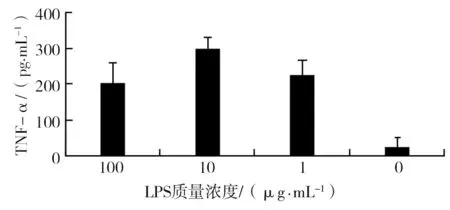
图1 不同LPS刺激浓度下RAW246.7细胞培养上清中TNF-α分泌水平Fig.1 Levels of TNF-αin the supernatant of cultured RAW246.7cells by stimulation with different concentrations of LPS
2.2 DNA质粒转染RAW246.7细胞
将质粒pcDNA3.1(+)-Us3及空质粒pcDNA3.1(+)转染至RAW246.7细胞,免疫荧光染色后观察细胞转染情况。结果发现pcDNA3.1(+)-Us3质粒可成功转入目的细胞,并在细胞中表达Us3基因编码蛋白,即Us3蛋白激酶。转染48 h后,在荧光显微镜下可观察到发出绿色荧光的细胞(图2), 而空质粒转染组及LPS刺激组未发现荧光阳性细胞。pcDNA3.1(+)-Us3质粒对RAW246.7细胞转染率为10.3%。
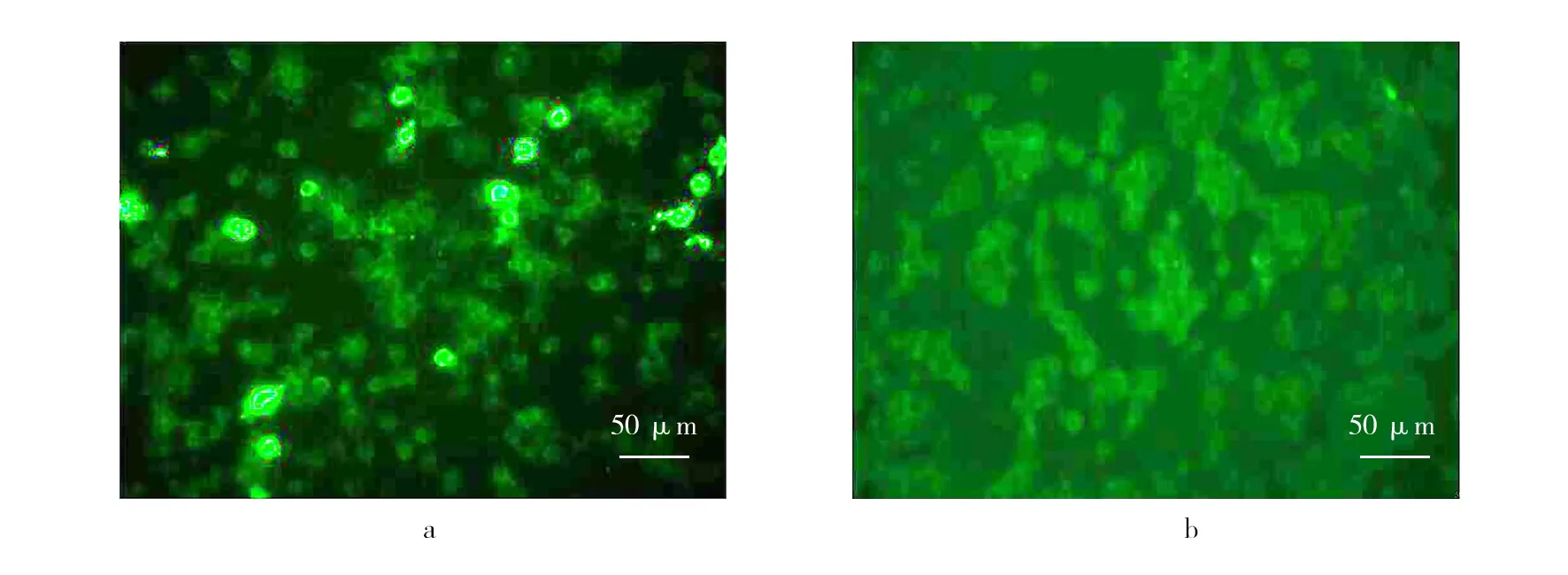
图2 pcDNA3.1(+)-Us3重组质粒 (a) 和空质粒pcDNA3.1(+) (b) 转染RAW246.7细胞后48 h的免疫荧光照片Fig.2 Fluorescence staining of RAW246.7 cells that were transfected with recombinant plasmids of pcDNA3.1(+)-Us3 (a) and blank plasmid of pcDNA3.1(+) (b) for 48 h
2.3 Us3对LPS活化的RAW246.7细胞TNF-α分泌活性的影响
将转染pcDNA3.1(+)-Us3质粒及空质粒的RAW246.7细胞培养于含10 μg/mL LPS的10% FCS RPMI 1640中,检测培养上清中TNF-α水平。结果发现,与空质粒组及LPS单纯刺激组相比,pcDNA3.1(+)-Us3质粒转染组RAW246.7细胞培养上清中TNF-α分泌水平有所升高,提示Us3对巨噬细胞TNF-α分泌活性具有一定的促进作用(图3)。
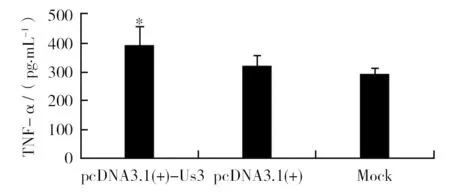
图3 转染DNA质粒的LPS活化RAW246.7细胞培养上清中TNF-α分泌水平Fig.3 Cytokine production from LPS-stimulated RAW246.7 cells transfected with plasmid DNA*与空质粒pcDNA3.1(+)相比,P<0.01* Significant difference (P<0.01, by Mann-Whitney U-test), compared with corresponding pcDNA3.1(+) and Mock group
2.4 Us3对LPS活化的RAW246.7细胞凋亡活性的影响
利用凋亡检测试剂盒检测巨噬细胞系RAW246.7细胞凋亡情况,结果发现转染pcDNA3.1(+)-Us3基因的RAW246.7细胞死亡率低于空质粒转染组和LPS刺激组,提示Us3基因对LPS活化诱导的RAW246.7细胞凋亡起到一定的抑制作用(表1)。
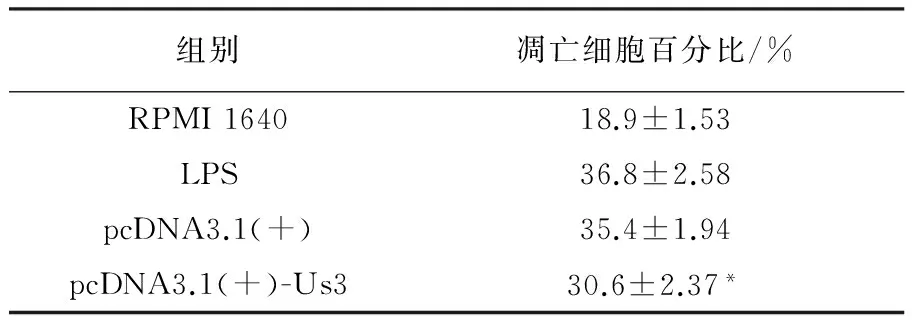
表1 Us3蛋白激酶对LPS活化的RAW246.7细胞凋亡的影响
注:*与空质粒pcDNA3.1(+)组相比,P<0.05
3 讨 论
本研究利用含HSV Us3目的基因的DNA质粒,采用体外细胞培养体系,探讨Us3基因及其编码蛋白对巨噬细胞生物学活性和凋亡的影响,结果发现重组质粒pcDNA3.1(+)-Us3可成功转入目的细胞,并在细胞中表达Us3基因编码的蛋白,即Us3蛋白激酶,并一定程度上提升LPS活化巨噬细胞的细胞因子TNF-α的分泌水平。推测pcDNA3.1(+)-Us3转染的RAW246.7细胞培养上清中高水平TNF-α可能源于以下两个方面:其一,Us3基因的转染改变了RAW246.7细胞生物学活性,使其对LPS的刺激能更好地反应活化,由此产生更多的细胞因子;其二,Us3基因通过种种相关机制抑制RAW246.7细胞的凋亡,活化RAW246.7细胞存活时间延长,由此可分泌更多的细胞因子,从而导致培养上清中TNF-α水平的上升。与转染空质粒的细胞相比,转染了重组质粒的RAW246.7细胞死亡率明显下降,提示Us3基因一定程度上抑制LPS活化RAW246.7细胞的凋亡。
迄今为止,单纯疱疹病毒Us3蛋白激酶调控细胞凋亡的作用机理尚不十分清楚。有研究表明,Us3基因可通过抑制山梨醇诱导的JNK磷酸化抑制山梨醇诱导的细胞凋亡,当Us3表达上调时,JNK上游激酶MKK4/SEK1磷酸化明显减弱,提示Us3蛋白激酶抑制其磷酸化,从而在外部途径上游阻断细胞凋亡[3]。Us3是HSV的一个多功能基因,其编码的蛋白分子是丝氨酸/苏氨酸蛋白激酶,该酶具有自磷酸化活性,且酶活性区域倾向于结合富含碱性氨基酸残基的底物[7]。多种HSV蛋白均被报道为Us3蛋白激酶的底物[8]。Bcl-2家族成员Bad可被Us3蛋白激酶磷酸化,Us3还可阻断Bax和Bid过表达介导的细胞凋亡[4-5],表明Us3基因也可通过影响细胞凋亡内部途径相关因子的活性调控细胞凋亡。尽管本研究未检pcDNA3.1(+)-Us3转染RAW246.7细胞内各种凋亡相关蛋白激酶活性或磷酸化方面的变化,但推测Us3基因及其编码产物可能依然是通过细胞内、外两条凋亡途径,影响RAW246.7细胞的凋亡活性。
HSV之所以能在宿主细胞内长期潜伏并反复激发,与其抗凋亡功能密切相关。Us3是介导HSV抗宿主细胞凋亡的重要基因。通过对其深入研究,对阐明HSV感染过程以及增殖扩散机制等具有积极意义。
[1] Hamza MA, Higgins DM, Ruyechan WT. Herpes simplex virus type-1 latency inhibits dendritic growth in sympathetic neurons[J]. Neurobiol Dis, 2006,24(2):367-373.
[2] Nishiyama Y. Herpes simplex virus gene products: the accessories reflect her lifestyle well[J]. Rev Med Virol, 2004,14(1):33-46.
[3] Mori I. Herpes simplex virus US3 protein kinase regulates host responses and determines neurovirulence[J]. Microbiol Immunol, 2012,56(6):351-355.
[4] Cartier A, Broberg E, Komai T, et al. The herpes simplex virus-1 Us3 protein kinase blocks CD8T cell lysis by preventing the cleavage of Bid by granzyme B[J]. Cell Death Differ, 2003,10(12):1320-1328.
[5] Ogg PD, McDonell PJ, Ryckman BJ, et al. The HSV-1 Us3 protein kinase is sufficient to block apoptosis induced by overexpression of a variety of Bcl-2 family members[J]. Virology, 2004,319(2):212-224.
[6] Mori I, Goshima F, Watanabe D, et al. Herpes simplex virus US3 protein kinase regulates virus-induced apoptosis in olfactory and vomeronasal chemosensory neurons in vivo[J]. Microbes Infect, 2006,8(7):1806-1812.
[7] Matsuzaki A, Yamauchi Y, Kato A, et al. US3 protein kinase of herpes simplex virus type 2 is required for the stability of the UL46-encoded tegument protein and its association with virus particles[J]. J Gen Virol, 2005,86(Pt 7):1979-1985.
[8] Benetti L, Munger J, Roizman B. The herpes simplex virus 1 US3 protein kinase blocks caspase-dependent double cleavage and activation of the proapoptotic protein BAD[J]. J Virol, 2003,77(11):6567-6573.
Effects of HSV Us3 Protein Kinase on Bio-Activity and Apoptosis of Megaphage
WU Jian-qi1, CHAI Ruo-nan2, KIMURA Yoshi-nobu3, LIU Bei-xing4
(1.Dept.ofNeurosurgery,the1stAffil.Hosp.ofChinaMed.Uni.,Shenyang110001; 2.ThePLACtr.ofRespir. &Allerg.Dis.Diagnos.Manag’t,theGen.Hosp.ofShenyangMil.Comm.,Shenyang110016; 3.Teach. &Res.Div.ofMicrobiol.,FukuiMed.Uni.,Japan910-1193; 4.Teach&Res.Div.ofImmun.,Schl.ofBasicMed.Sci.,ChinaMed.Uni.,Shenyang110122)
In order to investigate the effect of Us3 gene of protein kinase of herpes simplex virus (HSV) on regulating cytokine production and apoptosis of RAW246.7 cells after LPS activation, RAW246.7 cells were transfected with recombinant plasmid of pcDNA3.1(+)-Us3 and culturedinvitro. Immunofluorescence staining was used for identification of transfection rate. The level of TNF-α in the cultured supernatant was detected by ELISA. And evaluated apoptosis of transfected cells with Annexin-V staining. The results showed that recombinant plasmid pcDNA3.1(+)-Us3 could successfully transfected into RAW246.7 with transfection rate at 10.3%. As compared with empty plasmid transfected group, the secretion level of TNF-α in supernatant transfected cells by pcDNA3.1(+)-Us3 was apparently ascent, but the amount of apoptosis cells were slightly descent, thus proved that Us3 gene and it coded protein play a certain role in regulating and controlling cytokine secretive activity by macrophage as well as in activating cell apoptosis.
Us3 protein kinase gene; RAW246.7 cells; TNF-α; apoptosis
沈阳市科技计划支持项目(F10-205-1-34)
吴建奇 男,硕士研究生。主要研究方向为肿瘤与免疫。E-mail:2569660477@qq.com
* 通讯作者。女,教授,博士生导师。研究方向为抗感染免疫。E-mail:bxliu@mail.cmu.edu.cn
2016-07-18;
2016-08-26
Q939.93
A
1005-7021(2017)03-0048-04
10.3969/j.issn.1005-7021.2017.03.009
- 微生物学杂志的其它文章
- Identification and characterization of Acidithiobacillusferrooxidans with high activity and resistance isolated from ancient mine area
- Effect of environmental stresses and high hydrostatic pressure on the Antibiotic susceptibility of pathogenic Vibrioparahaemolyticus
- 脂环酸芽胞杆菌对果汁危害的研究
- 芽胞杆菌产生的脂肽类抗生素的结构和应用
- 抗生素与抗菌药物协同作用防控生物膜的研究进展
- 乳酸菌的抗氧化作用机制

