芽胞杆菌产生的脂肽类抗生素的结构和应用
金伟伟, 贾振华, 宋水山*
(1.河北工业大学 化工学院,天津 300130;2.河北省科学院生物研究所河北省主要农作物病害微生物控制工程技术研究中心,河北 石家庄 050081)
芽胞杆菌产生的脂肽类抗生素的结构和应用
金伟伟1, 2, 贾振华2, 宋水山2*
(1.河北工业大学 化工学院,天津 300130;2.河北省科学院生物研究所河北省主要农作物病害微生物控制工程技术研究中心,河北 石家庄 050081)
脂肽类抗生素不仅对细菌、真菌有抗菌作用,而且对支原体、寄生虫和病毒等也具有显著的抑制作用。其主要包括表面活性素(Surfactins)、伊枯草菌素(Iturins)和芬芥素(Fengycins),其中Iturins和Fengycins有抗真菌活性,Surfactins有抗支原体、抗病毒等活性。综述了芽胞杆菌产生的脂肽类抗生素的结构、功能和应用,为其在农业和医药的研究与应用提供参考。
芽胞杆菌;脂肽类抗生素;结构和应用
脂肽类抗生素由芽胞杆菌非核糖体途径合成[1],具有无毒性、无耐药性和生物可降解性等特点[2],是芽胞杆菌发挥生防效果的重要物质。由于芽胞杆菌产生的脂肽类抗生素具有抗菌、抗肿瘤、抗病毒等多种生物活性而被广泛研究[3]。例如,2003年由美国食品药品管理局第一个批准的环状脂肽抗生素达托霉素可以用于治疗由一些革兰阳性菌引起的并发性皮肤及皮肤结构感染等疾病[4];另一个脂肽类抗生素多粘菌素通过静电作用结合到革兰阴性菌的脂多糖上,通过连接脂肪酸的N端抑制细胞膜的合成而起到杀菌作用。经过多年研究,通过化学合成或基因重组的方法获得的一些脂肽类抗生素类似物,其具有一定的免疫反应或抗肿瘤作用[5]。目前脂肽类抗生素主要来源于芽胞杆菌,在生物防治、食品和生物医药等方面应用广泛。本文主要综述了由芽胞杆菌产生的脂肽类抗生素的结构、功能和应用,为其在医药和农业的研究与应用提供参考。
1 脂肽类抗生素的类型和结构
生物合成的脂肽类抗生素是芽胞杆菌通过非核糖体途径合成的,由亲水的肽链和亲油的脂肪酸链组成。脂肪酸链由14~17个碳原子组成,碳原子的数量会影响抗生素的抗菌活性,脂肽类的抗菌活性随着脂类长度的增加而增加[6]。脂肽类抗生素主要有三大家族:表面活性素(Surfactins)、伊枯草菌素(Iturins)和芬芥素(Fengycin)。
1.1 Surfactins
Surfactins(约1.3 kDa)由环7肽Glu-Leu-Leu-Val-Asp-Leu-Leu(LLDLLDL)与β-羟基脂肪酸组成[7](图1)。相同的氨基酸序列在芽胞杆菌AMS-H2O-1[8]中被发现。根据氨基酸的顺序和肽链的长度,分为SurfactinsA、B、C,A在7位点是L-Leu,B是L-Val,C是L-Ile[9],其具有较强的乳化作用。通常情况下,Surfactins的亚型以氨基酸变体带有不同长度的脂肪酸链的混合物共存于细胞中[10],表面活性素分子的氨基酸和β-羟基脂肪酸的模式不仅仅依赖于细菌的种类还依赖于培养条件[7]。

图1 Surfactins的结构Fig.1 The structure of Surfactins
1.2 Iturins
Iturins(约1 kDa)由7个氨基酸和1个β-氨基脂肪酸组成(图2),疏水部分是β-氨基脂肪酸,由14~17个碳原子组成;亲水部分是肽链,是7个氨基酸通过脂肪酸的氨基与C-末端氨基酸的羧基形成的酰胺键成环[11],表明该化合物是两亲化合物。Iturins主要分为ItuA、ItuB、ItuC和ItuD,具有较强的溶血特性[12],因其生物和物理化学性质,使其在农业、食品和医药行业得到广泛应用[13]。
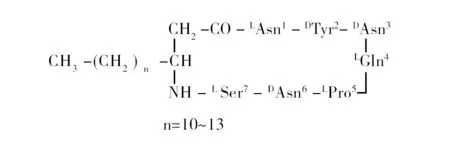
图2 Iturins的结构Fig.2 The structure of Iturins
1.3 Fengycin
Fengycin(约1.5 kDa)由10个氨基酸与β-羟基脂肪酸组成(图3),是Surfactin和Iturin之后脂肽类抗生素的第3个家族,也称制磷脂菌素(Plipastatin)。Fengycin的结构为10个氨基酸的肽链连接到一个脂肪酸链上,其家族成员在肽部分的第6位置和β羟基脂肪酸的C14~C18位置上表现出异质性,可以产生不同的同系物和同分异构体[14],分为Fengycin A 和 Fengycin B。Fengycin A在第6个位置上的氨基酸是Ala,而Fengycin B是Val,其对丝状真菌具有较强的抗菌活性[15]。
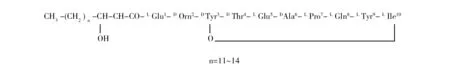
图3 Fengycin的结构Fig.3 The structure of Fengycin
2 脂肽类抗生素的应用
由于脂肽类抗生素具有抗菌、抗支原体和抗病毒等活性[16],使其应用于医药[17]、农业[18]、食品[19]、化妆品[20]等领域,已成为发展新型环保绿色工业的“助力剂”,具有巨大的生态、社会和环境效益[21]。
2.1 脂肽类抗生素在生物医药方面的应用
脂肽类抗生素因其潜在的医药应用可以作为抗病毒药物[22]、抗肿瘤药物[23]、免疫调节剂和一些抑制剂[24]。脂肽类抗生素与T细胞的结合也形成了有效的辅助剂,用于人的单核细胞与小鼠B细胞的体外反应,导致抗体分泌杂交瘤细胞产量的增加。由于脂肽类抗生素作用于病原菌的细胞壁及细胞膜,因此病原菌不容易产生抗药性[25],是很有发展前景的抗菌药物。
2.1.1 脂肽类抗生素的抗支原体活性 支原体是最小的能独立生活的生物体和真核细胞的寄生虫,是影响哺乳动物组织培养的主要污染物之一。支原体是人类和动物病害的主要病原菌,如急性呼吸道炎症(包括肺炎)、尿道感染、获得性免疫缺陷综合征[26]。在细胞治疗中使用脂肽类抗生素可以有效地消除和抑制支原体感染。Surfactin在商业上用于细胞培养物的固化和支原体污染生物技术产品的清洁[27]。脂肽类抗生素有显著的抗支原体特性,由于其物理化学性质与支原体的磷脂双分子层膜活性相互作用导致渗透性改变并破坏脂膜结构,促使细胞内物质外流,使细胞死亡[28]。
2.1.2 脂肽类抗生素的杀灭幼虫活性 蚊子是以血液为食的害虫,是传播人类疾病的媒介,例如疟疾、黄热病、登革热、脑炎和淋巴丝虫病。在芽胞杆菌培养物的上清液中发现Surfactin能有效杀灭蚊子幼虫和蛹的物质,并且在疟疾的控制中具有潜在的应用价值[29]。与化学农药相关的环境问题、人类健康问题引起越来越多的重视。昆虫种群对农药抗性的出现和化学农药价格的上涨已不可避免地使人们去寻找新型的生态友好型的化学农药替代品。目前,一些生物控制剂已在世界许多地区进行了测试,以评估其潜在的控制蚊虫的能力。美国已经注册了两种用来防治蚊子的芽胞杆菌,分别为苏云金芽胞杆菌变种和球形芽胞杆菌[30]。
2.1.3 脂肽类抗生素的抗寄生虫活性 微孢子虫被认为是有高度特异性的真菌。脂肽类抗生素是一种能够减少寄生虫发展的物质,无论是通过直接暴露孢子还是插入在蜜蜂的肠腔中[31]。其用于NAD+的竞争性抑制剂和乙酰化肽的非竞争性抑制剂,也被认为是体外恶性疟原虫红细胞生长的抑制剂[32]。微孢子虫的孢子接触脂肽类抗生素后,寄生虫感染的病原体显著降低[33]。此外,当脂肽类抗生素被导入蜜蜂消化道时也将导致寄生物的减少[33]。
2.1.4 脂肽类抗生素的抗病毒活性 脂肽类抗生素具有抑制病毒的作用,例如对疱疹性口炎病毒(VSV)、猪细小病毒(PPV)、疱疹病毒(HSV)等多种病毒。环状表面活性素脂肪酸链长度影响杀灭病毒的能力[34],而且其对包膜病毒具有更好的杀灭效果。这表明,脂肽类抗生素的抗病毒作用主要是由于物理化学特性和表面活性剂的膜活性与病毒脂质膜作用。对于病毒灭活的一个重要特征是脂肽类物质酰基链的碳原子个数,杀灭病毒的能力随着碳原子数的增加而增加[7]。在病毒失活过程中,脂肽类抗生素渗透到脂质双分子层从而诱导包括病毒蛋白在内的膜的完全裂解,包含病毒的吸附和靶细胞的渗透。膜的缺失会导致病毒的传染性的降低。黄现青等[22]研究发现Surfactin可直接作用于新城疫病毒的LaSota株和伪狂犬病病毒。
2.1.5 脂肽类抗生素的抗生物膜和抗黏性的活性 细菌利用表面的黏性和生物膜的机制生存。生物膜是用于保护细菌在极端条件下生存, 脂肽类抗生素是良好的微生物黏膜和生物膜形成的抑制剂。例如,枯草芽胞杆菌的Surfactin可以减少乙酰基导尿管生物膜量[35]。环状芽胞杆菌分离的脂肽生物表面活性剂对多种细菌的黏性都有抗性。Surfactin具有抑制金黄色葡萄球菌和大肠埃希菌分别为97%和90%的聚苯乙烯的生物膜形成的特性[36]。Surfactin有阴离子特性,抗黏性作用可能是由于细菌和表面活性素分子之间的静电排斥作用吸附在聚苯乙烯的表面上。因此,脂肽类抗生素似乎已被证明是潜在的抗黏性剂化合物,用于保护表面免受微生物污染[37]。
2.2 脂肽类抗生素的抗菌活性
真菌和细菌是植物病害的主要病原菌,植物病害会导致粮食作物产量急剧下降。脂肽类抗生素可以防止多种病原菌引起的植物病害(表1)。Iturin和Fengycin对病原真菌具有良好的防治效果,Surfactins具有抑制细菌的作用。Surfactins是有效的表面活性化合物,显示出了抗细菌活性但没有抗真菌标志(有一些例外)。另一方面,Iturin家族的脂肽是有效的抗真菌剂。因此,它可以用作植物保护的生物农药。最近,一种从蜡样芽胞杆菌中分离的新的脂肽“Kannurin”[38]已被发现具有良好的抗真菌活性,抗真菌性几乎依赖于其渗透靶生物体的细胞膜的能力。环状芽胞杆菌的Surfactins被发现有抵抗耐多药细菌的活性,如普通变形细菌、绿脓杆菌、大肠埃希菌和金黄色葡萄球菌。本实验室分离的枯草芽胞杆菌J-5已经证明可以产生具有抑制番茄灰霉病的脂肽类抗生素(待发表)。

表1 脂肽类抗生素抑制植物病原体的生长
2.3 脂肽类抗生素在食品行业的应用
脂肽类抗生素可以作为乳化剂,烘烤时用脂肽类抗生素做表面活性剂可以维持食品的质地、稳定性,帮助脂肪乳化,防止脂肪球的聚集。高晓平等[47]研究发现Surfactin可有效抑制乳中大肠埃希菌O157的生长,延长乳保质期。脂肽类抗生素还可作为防腐剂,阻止食品快速腐烂变质,具有环状结构的抗菌肽防腐剂可以抑制对蛋白酶的敏感性,这些化合物有效控制了食品由于微生物导致的变质[48]。Meena等[49]研究发现Surfactin可有效控制食品中有害微生物的滋生,具有一定食品防腐保鲜功能。章栋梁[50]研究发现Surfactin可以减缓肉制品储藏过程中pH的上升,具有保鲜作用。另外,食品添加剂的经济效益以2%~3%的年速度在增长,其中以乳化剂和胶体的增长最为迅速。在不久的将来,脂肽类抗生素可能成为新型的食品添加剂并将产生显著的经济效益。
2.4 脂肽类抗生素在化妆品行业的应用
Surfactin具有很好的表面性能使其在化妆品行业应用广泛,其可以改善化妆品的水洗性能,增加皮肤的光滑性,在化妆品行业中具有极大的吸引力。
3 展 望
脂肽类抗生素是一种用于抑制各种植物病原菌的新型、有效、多功能物质,其优良的抗菌活性有望成为化学农药的理想替代品。脂肽类抗生素是无毒、生物所能降解、高稳定性、环保、无污染的生物分子,这些特性使其能有效地应用于植物病害管理、化妆品、食物保藏、表面活性剂、抗寄生虫药剂、抗病毒药物、抗肿瘤剂等方面。Iturin和Fengycin将作为新型的生态农药用于防治农业生产中的植物病原菌。此外,Iturin和Fengycin引起植物系统抗性的能力和其在细菌细胞扩散的能力可以开拓一个新的应用领域,即作为植物药剂的使用。目前环脂肽单一组分纯化困难、产量低,限制了环脂肽在抗肿瘤、抗病毒等其他方面的应用研究。这些脂肽类抗生素大规模的生产和应用面临挑战,在工业生产中需要寻找适当的方法。
[1] Roongsawang N, Washio K, Morikawa M. Diversity of nonribosomal peptide synthetases involved in the biosynthesisof lipopeptide biosurfactants[J]. Molecular Sciences, 2011, 12(1): 141-172.
[2] Brandenburg L O, Merres J, Albrecht L J, et al. Antimicrobial peptides: multifunctional drugs for different application[J]. Polymers, 2012, 4(1): 539-560.
[3] Kasote D M, Katyare S S, Hegde M V. Lipopeptides as the antifungal and antibacterial agents: applications in food safety and therapeutics[J]. BioMed Research International, 2015, 2015(3): 1-9.
[4] Nakhate P H, Yadav V K, Pathak A N. A Review on Dap-tomycin; the first US-FDA approved. Lipopeptide antibiotics[J]. Scientific and Innovative Research, 2013, 2(5): 970-980.
[5] Song Y C, Liu H H, Chen I H, et al. A purified recombinant lipopeptide as adjuvant for cancer immunotherapy[J]. BioMed Research International, 2014, 2014(1): 1-10.
[6] Mandal S M, Sharma S, Pinnaka A K, et al. Isolation and characterization of diverse antimicrobial lipopeptides produced by Citrobacter and Enterobacter[J]. BMC Microbiology, 2013, 13(1): 21-30.
[7] 吕应年, 杨世忠, 牟伯中. 脂肽类生物表面活性剂的研究进展[J]. 生物技术通报, 2004, 6(3): 11-16.
[8] Korenblum E, DeAraujo L V, Guimaraes C R, et al. Purification and characterization of a surfactin-like molecule produced byBacillussp. H2O-1 and its antagonistic effect against sulfate reducing bacteria[J]. Microbiology, 2012, 12(1): 1-13.
[9] 侯红漫, 勒艳, 金美芳. 环脂肽类生物表面活性剂结构、功能及生物合成[J]. 微生物学通报, 2006, 33(5): 122-128.
[10]Tang J S, Gao H, Hong K, et al. Complete assignments of1H and13CNMR spectral data of nine surfactin isomers[J]. Magnetic Resonance in Chemistry, 2007, 45(9): 792-796.
[11]付雯, 高永祥, 张晓勇. 伊枯草菌素研究进展[J]. 安徽农学通报, 2014, 20(24): 23-26.
[12]熊汉琴, 蔡燕飞, 郭真真,等. 芽胞杆菌脂肽类抗生素的研究进展[J]. 湖北农业科学,2015, 54(12): 2817-2821.
[13]Peng W J, Zhong J, Yang J, et al. The artificial neural network approach based on uniform design to optimize the fed-batch fermentation condition: application to the production of iturin A[J]. MicrobCell Fact, 2014, 13(54): 1-10.
[14]Pathak K V, Keharia H, Gupta K, et al. Lipopeptides from the banyan endophyte,BacillussubtilisK1: mass spectrometric characterization of a library of fengycins[J]. Mass Spectrometry, 2012, 23(10): 1716-1728.
[15]Deleu M, Paquot M, Nylander T. Effect of fengycin, a lipopeptide produced byBacillussubtilis, on model biomem-branes[J]. Biophysical, 2008, 94(7): 2667-2679.
[16]Sachdev D P. Cameotra. Biosurfactants in agricul-ture[J]. Applied Microbiology and Biotechnology, 2013, 97(3): 1005-1016.
[17]Hajare S N, Subramanian M, Gautam S, et al. Induction of apoptosis in human cancer cells by aBacilluslipopeptide bacillomycin D[J]. Biochimie, 2013, 95(9): 1722-1731.
[18]Hsieh F C, Lin T C, Meng M, et al. Comparing methods for identifyingBacillusstrains capable of producing the antifungal lipopeptide iturin A[J]. Current Microbiology, 2008, 56(1): 1-5.
[19]付红菊, 刘玮. 食品乳化剂复配在食品生产中的应用[J]. 黑龙江科技信息, 2012,(3): 264-269.
[20]Kanlayavattanakul M, Lourith N. Lipopeptides in cosmetics, International[J]. Cosmetic Science, 2010, 32(1): 1-8.
[21]李俊峰, 刘丽. 脂肽类生物表面活性剂的研究进展[J]. 化学与生物工程, 2015, 32(1): 12-15.
[22]黄现青, 崔保安, 魏战勇, 等. 生物表面活性素体外抗病毒活性[J]. 中国兽医医学, 2009, 29(2): 143-149.
[23]曹小红, 焦润芝, 王春玲, 等.BacillusnattoTK-1产脂肽的结构鉴定及其诱导MCF-7细胞凋亡的研究[J]. 中国生物工程杂志, 2009, 29(2): 54-58.
[24]Rodrigues L R, Teixeira J A. Biosurfactants: Biomedical and Therapeutic Applications of Biosurfactants[J]. Experimental Medicine and Biology, 2010, 672: 75-87.
[25]陈萍, 冯芬, 杨恬然, 等. 脂肽类抗生素及其作用机制[J]. 微生物学杂志, 2015, 35(5): 89-93.
[26]Blanchard A, Montagnier L. AIDS-associated mycoplasmas[J]. Annual Review of Microbiology, 1994, 48(1): 687-712.
[27]Boettcher C, Kell H, Holzwarth J F, et al. Flexible loops of thread-like micelles are formed upon interaction of L-α-dimyristoyl-phosphatidylcholine with the biosurfactant surfactin asrevealed by cryo-electron tomography[J]. Biophysica Chemistry, 2010, 149(1): 22-27.
[28]Geetha I, Manonmani A M, Paily K P. Identification and characterization of a mosquito pupicidal metabolite of aBacillussubtilissubsp. subtilis strain[J]. Applied Microbiology and Biotechnology, 2010, 86(6): 1737-1744.
[29]Patel H, Huynh Q, Barlehner D, et al. Additive and synergistic membrane permeabilization by antimicrobial (Lipo) peptides and detergents[J]. Biophysical, 2014, 106(10): 2115-2125.
[30]Knight R L, Walton W E, O’Meara G F, et al. Strategies for effective mosquito control in constructed treatment wetlands[J]. Ecological Engineering, 2003, 21(4): 211-232.
[31]Porrini M P, Audisio M C, Sabaté D C, et al. Effect of bacterial metabolites on microsporidianNosemaceranae and on its host Apis mellifera[J]. Parasitology Research, 2010, 107(2): 381-388.
[32]Chakrabarty S P, Saikumari Y K, Bopanna M P, et al. Biochemical characterization of Plasmodium falciparum Sir2, a NAD+-dependent deacetylase[J]. Molecular and Biochemical Parasitology, 2008, 158(2): 139-151.
[33]Porrini M P, Audisio M C, Sabaté D C, et al. Effect of bacterial metabolites on microsporidianNosemaceranae and on its host Apis mellifera[J]. Parasitology Research, 2010, 107(2):381-388.
[34]Singla R K, Dubey H D, Dubey A K. Therapeutic spectrum of bacterial metabolites[J]. Pharmaceutical Sciences, 2014, 2(2): 52-64.
[35]Mireles J R, Toguchi A, Harshey R M. Salmonella enterica serovar typhimurium swarming mutants with altered biofilm-forming abilities: Surfactin inhibits biofilm formation[J]. Bacteriology, 2001, 183(20): 5848-5854.
[36]Rivardo F, Turner R J, Allegrone G, et al. Anti-adhesion activity of two biosurfactants produced byBacillusspp. prevents biofilm formation of human bacterial pathogens[J]. AppliedMicrobiology Biotechnology, 2009, 83(3): 541-553.
[37]Zeraik A E, Nitschke M. Biosurfactants as agents to reduce adhesion of pathogenic bacteria to polystyrene surfaces: effect of temperature and hydrophobicity[J]. Current Microbiology, 2010, 61(6): 554-559.
[38]Ajesh K, Sudarslal S, Arunan C, et al. Kannurin,a novel lipopeptide fromBacilluscereusstrain AK1: isolation, structural evaluation and antifungal activities[J]. Applied Microbiology, 2013,115(6): 1287-1296.
[39]Deravel J, Lemière S, Coutte F, et al. Mycosubtilin and surfactin are efficient, low ecotoxicity molecules for the biocontrol of lettuce downy mildew[J]. Applied Microbiogy and Biotechnology, 2014, 98(14): 6255-6264.
[40]Waewthongrak W, Pisuchpen S, Leelasuphakul W. Effect ofBacillussubtilisand chitosan applications on green mold(PeniciliumdigitatumSacc.)decay in citrus fruit[J]. Postharvest Biology and Technology, 2015, 99: 44-49.
[41]王洪梅, 吴云成, 沈标. 青枯病生防菌N5的特性及其生物学效应[J]. 土壤, 2013, 45(6): 1082-1090.
[42]张荣胜, 王晓宇, 罗楚平, 等. 解淀粉芽胞杆菌Lx-11产脂肽类物质鉴定及表面活性素对水稻细菌性条斑病的防治作用[J]. 中国农业科学, 2013, 46(10): 2014-2021.
[43]Romero D, DeVicente A, Rakotoalyetal R H. The iturin and fengycin families of lipopeptides are key factors in antagonismofBacillussubtilistoward Podosphaera fusca[J]. Molecular Plant-Microbe Interactions, 2007, 20(4): 430-440.
[44]Preecha C, Sadowsky M J, Prathuangwong S. Lipopeptide surfactin produced byBacillusamyloliquefaciensKPS46 is required for biocontrol efficacy againstXanthomonasaxonopodispv. Glycines[J]. Natural Science, 2010, 44(1): 84-99.
[45]Alvarez F, Castro M, Principe A, et al. The plant-associatedBacillusamyloliquefaciensstrains MEP218 and ARP23 capableof producing the cyclic lipopeptides iturin or surfactin andfengycin are effective in biocontrol of sclerotinia stem rotdisease[J]. Applied Microbiology, 2012, 112(1): 159-174.
[46]Kim H J, Choi H S, Yang S Y, et al. Both extracellular chitinase and a new cyclic lipopeptide, chromobactomycin,contribute to the biocontrol activity ofChromobacteriumsp.C61[J]. Molecular Plant Pathology, 2014, 15(2): 122-132.
[47]高晓平, 胡惠, 黄现青. Surfactin抑制乳中大肠杆菌O157活性研究[J]. 食品科学, 2009, 30(11): 91-94.
[48]Mandal S M, Barbosa A E, Franco O L. Lipopep-tides in microbial infection control: scope and reality for industry[J]. Biotechnology Advances, 2013, 31(2): 338-345.
[49]Meena K, Kanwar S S. Lipopeptides as the antifungal and antibacterial agents: applications in food safety and therapeutics[J]. Biomed Research Internation, 2015, 2015(3): 1-9.
[50]章栋梁. Surfactin工业分离纯化工艺及其对肉品的防腐保鲜效果[D]. 南京: 南京农业大学, 2013.
Structure and the Application of Lipopeptides Antibiotics fromBacillus
JIN Wei-wei1, 2, JIA Zhen-hua2, SONG Shui-shan2
(1.Coll.ofChem. &Engin.,HebeiUni.ofTechnol.,Tianjin300130;2.Biol.Inst.HebeiAcad.ofSci.,HebeiEngin. &Technol.CtrofMicrobiol.Ctrl.onMainCropDis.,Shijiazhuang050081)
The lipopeptides antibiotics not only have been explored for their antagonistic activities towards a wide range of phytopathogens including bacteria, fungi, but also have antimycoplasma, antiparasitic, antiviral activities. All the three families ofBacilluslipopeptides, namely, Surfactins, Iturins and Fengycins. Among them Iturin and Fengycin have antifungal activities, Surfactins has antimycoplasma, antiviral activity. In this paper the structure, function and application of lipopeptides antibiotics were reviewed, to provide a reference for further research and application in agriculture and medicine.
Bacillus; lipopeptides; structure and application
河北省自然科学基金项目(C2015302005)
金伟伟 女,硕士研究生。研究方向为微生物学。E-mail:673086417@qq.com
* 通讯作者。男,研究员,博士。研究方向为细胞信号转导。E-mail:shuishans@hotmail.com
2016-05-17;
2016-07-15
Q939.93
A
1005-7021(2017)03-0122-06
10.3969/j.issn.1005-7021.2017.03.020
- 微生物学杂志的其它文章
- Identification and characterization of Acidithiobacillusferrooxidans with high activity and resistance isolated from ancient mine area
- Effect of environmental stresses and high hydrostatic pressure on the Antibiotic susceptibility of pathogenic Vibrioparahaemolyticus
- 脂环酸芽胞杆菌对果汁危害的研究
- 抗生素与抗菌药物协同作用防控生物膜的研究进展
- 乳酸菌的抗氧化作用机制
- 通风房间常见微生物颗粒蒸发特性的仿真研究

