乳酸菌的抗氧化作用机制
段希宇, 叶 陵, 刘成国, 王蓉蓉, 周 辉
(湖南农业大学 食品科技学院,湖南 长沙 410128)
乳酸菌的抗氧化作用机制
段希宇, 叶 陵, 刘成国, 王蓉蓉, 周 辉*
(湖南农业大学 食品科技学院,湖南 长沙 410128)
乳酸菌可以作为发酵剂、保鲜剂用于发酵食品的生产和保藏。由于无法进行呼吸产能,乳酸菌在生长过程中会面临氧化胁迫。研究表明,乳酸菌具有一定的抗氧化能力,能清除体内的活性氧分子,并使其保持相对稳定。综述了乳酸菌的抗氧化作用机制,主要从抗氧化酶、维持细胞还原状态、金属离子螯合等方面进行了介绍,以期为深入了解乳酸菌的抗氧化机制以及改善乳酸菌的环境生存能力提供一定的理论参考。
乳酸菌;抗氧化作用;抗氧化酶
乳酸菌(Lactic acid bacteria,LAB)是指一类不产生芽胞、不能进行呼吸作用、能利用碳水化合物发酵产生大量乳酸的革兰阳性细菌[1]。乳酸菌无处不在,广泛分布于人体、动物、植物和整个自然界。乳酸菌用途广泛,可以作为发酵剂、保鲜剂用于发酵食品的生产和保藏,也能作为保健食品和药品,改善和提高人体的健康水平,还可作为微生物学和微生态学领域研究的模式生物。作为一类不能利用氧气进行呼吸产能的细菌,乳酸菌在长期的进化过程中,不得不面对来自氧的胁迫。环境中的氧进入细胞后,接收菌体提供的电子而依次被还原为超氧阴离子、过氧化氢和羟自由基等有毒的代谢产物,习惯上将超氧阴离子、过氧化氢及羟自由基合称为活性氧簇(reactive oxygen species, ROS),ROS具有较强的氧化活性,可以氧化蛋白质、细胞膜、DNA等生物大分子,造成蛋白的变性、酶蛋白的失活及细胞膜的通透性改变,从而抑制菌体的生长代谢。本文对乳酸菌的抗氧化机制进行综述,从抗氧化酶、胞内氧化还原状态、金属离子螯合等抗氧化作用机制进行介绍。
1 抗氧化酶
在面临来自自然界中氧气的胁迫时,微生物逐渐进化出能将氧及其代谢产物进行还原和降解的蛋白酶,在乳酸菌中这些抗氧化酶主要有NADH氧化酶/NADH过氧化物酶、超氧化物歧化酶、过氧化氢酶等。
1.1 NADH氧化酶(NADH oxidase)/NADH过氧化物酶(NADH peroxidase)
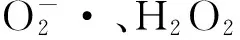

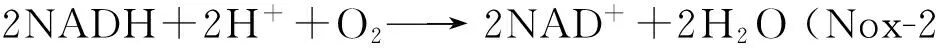
除NADH氧化酶外,还在乳杆菌和粪球菌中发现一类NADH过氧化物酶[5-7],这类酶催化反应如下:
NADH过氧化物酶可直接将过氧化氢还原为水,但这种酶在氧化胁迫时降解过氧化氢的效率较低,只是作为一种协同的氧化防御机制。
1.2 超氧化物歧化酶(Superoxide dismutase, SOD)
超氧化物歧化酶是广泛存在于生物体的一种十分重要的金属酶,按其结合金属离子种类的不同可以分为Cu/Zn-SOD、Mn-SOD和Fe-SOD三种,这类酶在抗氧化功能中起着非常重要的作用,广泛分布于一些好氧菌中,如大肠埃希菌中的Fe-SOD,在一些乳酸菌属中也有超氧化物歧化酶的分布,这类酶主要是Mn-SOD,如链球菌和乳杆菌[8-9]。这类酶催化反应如下:
与很多菌体的SOD不同,嗜热链球菌无论是在厌氧还是通氧的培养状态下,都有SOD的表达,而且这种表达不受百草枯(能产生超氧自由基)的诱导,在它的生长进入平台期以后,SOD的表达量会增加三至四倍[10]。将sod基因进行外源表达后,可明显提高乳杆菌的抗氧化能力,还可以使其发挥抗炎症的生理作用[11-12]。
研究还发现SOD与酸胁迫之间存在一定的关系,将Mn-SOD基因敲除后,增加了嗜热链球菌对酸应激的敏感性,推测氧化应激反应与酸应激反应间存在一种共同的应答机制,酸应激也存在产生ROS的过程[13]。
1.3 过氧化氢酶(Catalase, CAT)
过氧化氢酶可简单地分为两种:一种以血红素为辅基的过氧化氢酶或被称为真正的过氧化氢酶;另外一种以锰离子为辅基的过氧化氢酶,称为假过氧化氢酶(Mn-Kat),或锰离子型过氧化氢酶[14],其催化反应如下:
由于乳酸菌胞内普遍缺乏合成血红素的机制,所以只能通过添加外源血红素来表达过氧化氢酶的活性,但也发现了需要锰离子为辅基的过氧化氢酶[15]。目前鉴定过的过氧化氢酶主要存在于植物乳杆菌和清酒乳杆菌中,而且进行了基因工程的构建,通过外源表达,可以提高宿主菌对过氧化氢耐受的能力,延缓发酵肉制品的脂质过氧化等[16-19]。而将SOD与CAT进行共表达时,这两种抗氧化酶可在活性氧清除途径中发挥互补作用,显著提高长双歧杆菌和副干酪乳杆菌的耐氧能力[20-21]。
1.4 过氧化物氧化还原酶
目前在细菌中研究较多的过氧化物氧化还原酶主要是烷基过氧化物酶(Alkyl-hydroperoxidase, AhpC)、巯基过氧化物酶(Thiol peroxidase, Tpx)、有机过氧化物抗性蛋白(Organic hydroperoxide resistance protein, Ohr)。
1.4.1 烷基过氧化物酶 AhpC首先在沙门氏菌的氧化胁迫应激反应中发现,随后相继在许多细菌中发现。它可以还原包括过氧化氢、有机过氧化物等许多更高结构的过氧化物,所以在细菌抗氧化反应中具有重要作用。AhpC通常以二聚体形式参与氧化还原反应,AhpC结构中具有两个保守的半胱氨酸残基,其中能被过氧化的半胱氨酸残基首先与过氧化物(ROOH)反应生成相应的乙醇,或将过氧化氢还原为水,而自身生成半胱氨酸次磺酸,接着半胱氨酸次磺酸与另一个保守半胱氨酸残基形成二硫键,而二硫键的还原再生需要AhpC的还原酶AhpF参与[22]。AhpF是AhpC专一性的还原酶,广泛分布在细菌中[23],一般与AhpC位于同一个操纵子结构中,并受到过氧化物转录因子OxyR、PerR等的调控。目前研究还发现,在低温下AhpC还可以增强乳酸菌的抗氧化能力,对乳酸菌的快速增长起着重要作用[24]。
1.4.2 巯基过氧化物酶 Tpx最早从大肠埃希菌中分离得到,具有一种巯基依赖型的过氧化物酶活性,Tpx是大肠埃希菌在厌氧条件下生存的主要抗氧化剂[25]。与AhpC类似,Tpx以二聚体形式头尾相连,通过每个亚基中保守的半胱氨酸残基来感受环境中过氧化物,与之反应生成乙醇或水,自身氧化为次磺酸后被还原为巯基,完成一次氧化还原循环。有研究发现Tpx可能在单线态氧介导的细胞损伤中起重要的保护作用,同时Tpx也对细菌细胞胞内的氧化还原的平衡有重要贡献[26]。目前对于Tpx的表达调控机制还不是十分清楚。
1.4.3 有机过氧化物抗性蛋白 Ohr 是一种分子量在15 kDa、基于半胱氨酸硫醇依赖的过氧化物酶,包含两个高度保守的氧化还原反应性半胱氨酸残基,这些残基在过氧化代谢中起重要作用。Ohr具有独特的三维结构,且需要单硫醇来支持其生理活性。在反应时,一个半胱氨酸残基被氧化成次磺酸中间体,然后立即与第二个半胱氨酸残基形成分子内二硫键[27]。Ohr在有机过氧化物应激反应中发挥重要作用[28-29]。
2 锰离子
在植物乳杆菌中,胞内普遍缺乏超氧化物歧化酶,但是具有较高浓度的锰离子,胞内的锰离子浓度可达到35 mmol/L。研究发现这些高浓度的锰离子具有类似于超氧化物歧化酶的作用,可以清除胞内的超氧阴离子,这种清除作用需要有胞内磷酸基团及乳酸的参与。SOD基因敲除的嗜热链球菌在进行通气培养时,如果培养基中添加了MnCl2,则可以明显改善菌体在通氧下的生长情况。但是一些其他的乳酸菌,如保加利亚乳杆菌,在富含锰离子的培养基中生长时,依然没有表现出较强的抗氧化能力,进一步推测这种依靠胞内锰离子的抗氧化机制可能与菌体膜上的锰离子转运蛋白有关[30]。
3 维持胞内氧化还原状态
在细菌受到氧化胁迫后,细菌胞内原有的一些小分子蛋白具有抗氧化的作用。这些小分子蛋白或肽是一种组成型表达,组成了细菌防御氧化胁迫反应的第一道防线。在革兰阴性菌及少数阳性菌中有一类重要的小分子肽谷胱甘肽(L-glutamyl-L-cysteinylglycine, GSH),在维持细菌胞内氧化还原状态中发挥重要作用。由于谷胱甘肽结构中半胱氨酸残基中的巯基具有接收电子的作用,所以经常以氧化还原酶的辅基形式参与氧化胁迫应激反应和受损蛋白等生物大分子的修复。乳酸菌中有些种可以合成或从生长介质中导入谷胱甘肽,如发酵乳杆菌ME-3中包含谷胱甘肽过氧化物酶和谷胱甘肽还原酶,可以从环境中运输及合成谷胱甘肽来参与抗氧化反应[31]。而乳酸乳球菌不具有谷胱甘肽生物合成的途径,但是通过在培养基中添加外源的谷胱甘肽,平台期生长的乳酸乳球菌可以有效地转运和利用谷胱甘肽,来增加对过氧化氢氧和酸的抗性[32-33]。
在氧化胁迫反应中,对生物大分子最显著的影响就是蛋白质中半胱氨酸残基中的巯基被氧化,有些乳酸菌如干酪乳杆菌胞内由于不能合成谷胱甘肽,但是它们可以通过硫氧还蛋白途径或谷氧还蛋白途径,利用半胱氨酸残基中的巯基来还原蛋白质中的二硫键 (如蛋氨酸亚砜还原酶和过氧化物氧还酶中的二硫键),保持细胞内还原环境,而自身被氧化的硫氧还蛋白和谷氧还蛋白需要NADPH和NADH提供电子来恢复还原状态[34-35]。
4 适应性机制
适应性是一种广泛存在于细菌中的生理反应能力。当生长中的环境发生改变时,细菌会激活一种适应性机制去抵抗更为恶劣的生存环境。乳球菌在用亚致死水平的H2O2处理后,能增强菌体对致死水平的H2O2的抵抗力,延长菌体的生存期[36]。而且乳酸菌经过一定的环境胁迫处理,比如用UV辐射、饥饿、高温及低pH,可以增强菌体对其他一些胁迫应激反应的防御能力,这主要由于一定的胁迫处理后能诱导菌体产生共同防御机制来抵抗不同的胁迫反应[37]。
5 其他机制
除上述机制外,在变性链球菌中,还存在一种DNA结合蛋白dpr,这种蛋白属于DNA结合蛋白大家族,但是还能与Fe2+结合,阻止Fe2+参与Fenton反应,从而预防了羟自由基的产生,减轻了自由基对细胞的损害[38]。此外,在植物乳杆菌中,还存在丙酮酸氧化酶等酶蛋白[39],这些酶虽然没有广泛分布,但还是具有一定的抗氧化作用,在一定程度上减轻了氧化胁迫对细胞的影响。抵抗氧化应激的另一种方法是对氧的有效吸收和利用,乳酸乳球菌在血红素存在下进行通气培养,其细胞色素氧化酶可以直接参与电子传递链进行呼吸作用,可在一定范围内克服氧化应激损伤[40]。此外,还存在一类DNA修复蛋白Rec A。乳酸菌在氧化胁迫应激下,当自由基如羟自由基攻击菌体DNA并造成DNA损伤时,需要Rec A这类修复蛋白对受损伤的DNA进行修复,以使其发挥正常的遗传信息载体作用[41]。
6 展 望
近年来对于乳酸菌抗氧化机制的研究已经取得了一定的研究结果,但对于乳酸菌氧化应激反应中基因表达调控机制的研究还比较缺乏。此外,一些乳酸菌可能同时存在多种抗氧化机制,并且这些抗氧化机制与其他环境胁迫应激反应存在一定的交叉和互补,比如在酸胁迫条件下,细胞内也会产生大量的氧自由基,从而诱发细胞的抗氧化反应。因此在研究乳酸菌对环境胁迫应激的响应机制时,有必要同时对乳酸菌的抗氧化水平进行评价。
氧化胁迫是影响乳酸菌生长、发酵性能及产品特性的重要因素,因此阐明乳酸菌的抗氧化机制将有助于筛选抗氧化菌株,为解决乳品工业中发酵剂菌株面临的耐氧问题提供思路。而作为益生菌,具有较强的抗氧化性,可以提高菌株在产品生产以及肠道中的存活率,有利于发挥益生作用。在深入了解乳酸菌抗氧化机制的基础上,可以利用抗氧化功能基因为靶标进行抗氧化乳酸菌的高通量筛选,而这无疑将大幅提高抗氧化乳酸菌的筛选效率。
[1] 郭兴华, 凌代文. 乳酸细菌现代研究实验技术[M]. 北京: 科学出版社, 2013.
[2] Higuchi M, Yamamoto Y, Poole L B, et al. Functions of two types of NADH oxidases in energy metabolism and oxidative stress ofStreptococcusmutans[J]. Journal of Bacteriology, 1999, 181(19): 5940-5947.
[3] Baker J L, Derr A M, Karuppaiah K,et al.StreptococcusmutansNADH oxidase lies at the interse ction of overlapping regulons controlled by oxygen and NAD+levels[J]. Journal of Bacteriology, 2014, 196(12):2166-2177.
[4] Sasaki Y, Horiuchi H, Kawashima H, et al. NADH oxidase ofStreptococcusthermophilus1131 is required for the effective yogurt fermentation withLactobacillusdelbrueckiisubsp. bulgaricus 2038[J]. Biosci Microbiota Food Health,2014,33(1):31-40.
[5] Sakamoto M, Komagata K. Aerobic growth of and activities of NADH oxidase and NADH peroxidase in lactic acid bacteria[J]. Journal of Fermentation and Bioengineering, 1996, 82:210-216.
[6]Jansch A, Freiding S, Behr J, et al. Contribution of the NADH-oxidase (Nox) to the aerobic life ofLactobacillussanfranciscensisDSM20451T[J]. Food Microbiology, 2011, 28(1):29-37.
[7] Kang T S, Korber D R, Tanaka T. Influence of oxygen on NADH recycling and oxidative stress resistance systems inLactobacilluspanisPM1[J]. AMB Express, 2013, DOI: 10.1186/2191-0855-3-10.
[8] Amanatidou A, Bennikm H J, Gorris L G M, et al. Supreoxide dismutase plays an important role in the survival ofLactobacillussakeupon exposure to elevated oxygen[J]. Archives of Microbiology, 2001, 176: 79-88.
[9] Fujishima K, Kawada-Matsuo M, Oogai Y, et al. Dpr and sod inStreptococcusmutansare involved in coexistence withS.sanguinis, and PerR is associated with resistance to H2O2[J]. Applied and Environmental Microbiology, 2013,79(5):1436-1443.
[10]Chang S K, Hassan H M. Characterization of superoxide dismutase inStreptococcusthermophilu[J]. Applied and Environmental Microbiology, 1997, 63:3732-3735.
[11]Lin J, Zou Y, Cao K, et al. The impact of heterologous catalase expression and superoxide dismutase overexpression on enhancing the oxidative resistance inLactobacilluscasei[J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43(5):703-711.
[12]Carroll I M, Andrus J M, Bruno-Barcena J M, et al. Anti-inflammatory properties ofLactobacillusgasseriexpressing manganese superoxide dismutase using the interleukin 10-deficient mouse model of colitis[J]. AJP Gastrointestial and Liver Physiology, 2007, 293:G729-G738.
[13]Bruno-Barcena J M, Azcarate-Peril M A, Hassan H M. Role of antioxidant enzymes in bacterial resistance to organic acids [J]. Applied and Environmental Microbiology, 2010, 76(9):2747-2753.
[14]Cosgrove K, Coutts G, Jonsson I M, et al. Catalase(KatA) and alkyl hydroperoxide reductase(AhpC) have compensatory roles in peroxide stress resistance and are required for survival, persistence, and nasal colonization inStrephylococcusaureus[J]. Journal of Bacteriology, 2007,189(3): 1025-1035.
[15]Watanabe M,Vander V S, Nakajima H,et al. Effect of respiration and manganese on oxidative stress resistance ofLactobacillusplantarumWCFS1[J]. Microbiology, 2012 ,158(Pt 1):293-300.
[16]Abriouel H, Herrmann A, Starke J, et al. Cloning and heter ologous expression of hematin-dependent catalase produced byLactobacillusplantarumCNRZ 1228[J]. Applied and Environmental Microbiology, 2004, 70:603-606.
[17]Rochat T, Miyoshi A, Gratadoux J U, et al. High-level resistance to oxidative stress inLactococcuslactisconferred byBacillussubtiliscatalase KatE[J]. Microbiology, 2005, 151:3011-3018.
[18]Noonpakdee W, Sitthimonchai S, Panyim S, et al. Expression of the catalase genekatA in starter cultureLactobacillusplantarumTISTR850 tolerates oxidative stress and reduces lipid oxidation in fermented meat product[J]. International Journal of Food Microbiology, 2004, 95:127-135.
[19]An H, Zhai Z, Huang Y, et al.High-level expression of heme-dependent catalase genekatA fromLactobacillussakeiprotectsLactobacillusrhamnosusfrom oxidative stress[J]. Molecular Biotechnology, 2010, 45(2):155-160.
[20]An H, Zhai Z, Yin S, et al. Coexpression of the superoxide dismutase and the catalase provides remarkable oxidative stress resistance inLactobacillusrhamnosus[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8):3851-3856.
[21]Zuo F, Yur, Feng X J, et al. Combination of heterogeneous catalase and superoxide dismutase protectsBifidobacteriumlongumstrain NCC2705 from oxidative stress[J]. Applied Microbiology and Biotechnology, 2014,98(17):7523-7534.
[22]Ellis HR,Plle LB. Roles for the two cysteine residues of AhpC in catalysis of peroxide reduction by alkyl hydroperoxide reductase fromSalmonellatyphimurium[J]. Biochemistry, 1997, 36:13349-13356.
[23]Jonsson TJ, Ellis HR, Poole LB. Cysteine reactivity and thiol-disulfide interchange pathways in AhpF and AhpC of the bacterial alkyl hydroperoxide reductase system[J].Biochemistry, 2007, 46(19):5709-5721.
[24]Goto S, Iki T, Watanabe I, et al. Alkyl hydroperoxide reductase enhances the growth ofLeuconostocmesenteroideslactic acid bacteria at low temperatures[J]. AMB Express, 2015, DOI: 10.1186/s13568-015-0098-3.
[25]Cha MK, Kim WC, Lim CJ, et al.Escherichiacoliperiplasmic thiol peroxidase acts as lipid hydroperoxide peroxidase and the principal antioxidative function during anaerobic growth[J]. Journal of Biological Chemistry, 2004, 279(10):8769-8778.
[26]Horst SA, Jaeger T, Denkel LA, et al. Thiol peroxidase protectsSalmonellaentericafrom hydrogen peroxide stressinvitroand facilitates intracellular growth[J]. Journal of Bacteriology, 2010,192(11):2929-2932.
[27]Cussiol JR, Alegria TGP, Szweda LI, et al. Ohr (Organic Hydroperoxide Resistance Protein) possesses a previously undescribed activity, lipoyl-dependent peroxidase[J]. Journal of Biological Chemistry, 2010, 285(29):21943-21950.
[28]De Silva Neto JF, Negretto CC, Netto LE. Analysis of the organic hydroperoxide response ofChromobacteriumviolaceumreveals that OhrR is a Cys-based redox sensor regulated by thioredoxin[J]. PLoS one, 2012, 7(10):e47090.
[29]Si M, Xiao X, Zhang Y, et al. Ohr ProtectsCorynebacteriumglutamicumagainst Organic Hydroperoxide Induced Oxidative Stress[J]. PLoS One, 2015,10(6):e0131634.
[30]Rochat T, Gratadoux J, Gruss A, et al. Production of a heterologous nonheme catalase byLactobacilluscasei: an efficient tool for removal of H2O2and protection ofLactobacillusbulgaricusfrom oxidative stress in milk[J]. Applied and Environmental Microbiology, 2006, 72(8): 5143-5149.
[31]Kullisaar T, Songisepp E, Aunapuu M, et al. Complete glutathione system in probioticLactobacillusfermentumME-3[J]. Applied Biochemistry and Microbiology, 2010, 46(5):481-486.
[32]Li Y, Hugenholtz J, Abee T, et al. Glutathione protectsLactococcuslactisagainst oxidative stress[J]. Applied and Environmental Microbiology, 2003, 69:5739-5745.
[33]Zhang J, Fu RY, Hugenholtz J, et al. Glutathione protectsLactococcuslactisagainst acid stress[J]. Applied and Environmental Microbiology, 2007, 73: 5268-5275.
[34]Serata M, Iino T, Yasuda E, et al. Roles of thioredoxin and thioredoxin reductase in the resistance to oxidative stress inLactobacilluscasei[J]. Microbiology, 2012, 158:953-962.
[35]Lu J, Holmgren A. The thioredoxin antioxidant system[J]. Free Radical Biology and Medicine, 2014,66:75-87.
[36]Woojin SK, Park JH, Tandianus JE, et al. A distinct physiological state ofLactococcuslactiscells that confers survival against a direct and prolonged exposure to severs stresses[J]. FEMS Microbiol, 2002, 212:203-208.
[37]Duwat P, Cesselin B, Sourice S, et al.Lactococcuslactis, a bacterial model for stress responses and survival[J]. International Journal of Food Microbiology, 2000, 55: 83-86.
[38]Haikarainen T, Papageorgiou AC. Dps-like proteins: structural and functional insights into a versatile protein family[J]. Cellular and Molecular Life Sciences, 2010, 67(3):341-351.
[39]Goffin P, Musariello L, Lorquet F, et al. Involvement of pyruvate oxidase activity and acetate production in the survival ofLactobacillusplantarumduring the stationary phase of aerobic growth[J]. Applied and Environmental Microbiology, 2006, 72(12): 7933-7940.
[40]Miyoshi A, Rochat T, Gratadoux JJ, et al. Oxidative stress inLactococcuslactis[J].Genet Mol Res, 2003,2(4):348-359.
[41]Duwat P, Ehrlich SD, Gruss A. The recA gene ofLactococcuslactis: characterization and involvement in oxidative and thermal stresses[J]. Molecular Microbiology, 1995, 17:1121-1131.
The Antioxidative Mechanism of Lactic Acid Bacteria
DUAN Xi-yu, YE Ling, LIU Cheng-guo, WANG Rong-rong, ZHOU Hui
(Coll.ofFoodSci. &Technol.,HunanAgric.Uni.,Changsha410128)
Lactic acid bacteria (LAB) could be used as leavening agents and preservative in the production and preservation of fermented food. Due to the inability of breathing and energy producing capacity during the growth, LAB will face with oxidative coercion. Studies have shown that, LAB possess a certain antioxidant capacity, it can scavenging active oxygen molecule (AOM) within the cell, and keep it in relatively stable. This review provided the antioxidative mechanisms of LAB, mainly from the introduction of antioxidant enzymes, the maintenance of cellular redox status, and the chelation of metal ions and other aspects, so as to get the insight of the antioxidative mechanisms of LAB and provide certain theoretical references of the improvement of the environmental viability of LAB.
lactic acid bacteria (LAB); antioxidation; antioxidant enzymes
国家自然科学基金项目(31571811)
段希宇 女,硕士研究生。研究方向为食品生物技术。E-mail:598224594@qq.com
* 通讯作者。男,副教授,博士,硕士生导师。主要从事食品生物技术研究。Tel:0731-84617007,E-mail:paradise917@163.com
2016-06-13;
2016-08-14
Q939.11+7
A
1005-7021(2017)03-0111-05
10.3969/j.issn.1005-7021.2017.03.018
- 微生物学杂志的其它文章
- Identification and characterization of Acidithiobacillusferrooxidans with high activity and resistance isolated from ancient mine area
- Effect of environmental stresses and high hydrostatic pressure on the Antibiotic susceptibility of pathogenic Vibrioparahaemolyticus
- 脂环酸芽胞杆菌对果汁危害的研究
- 芽胞杆菌产生的脂肽类抗生素的结构和应用
- 抗生素与抗菌药物协同作用防控生物膜的研究进展
- 通风房间常见微生物颗粒蒸发特性的仿真研究

