过表达KLF4抑制非小细胞肺癌增殖及上皮间质转化的作用机制*
刘华松,徐兰兰,张军,郭家龙,林称意,原野,曾敏,程栋梁
[1.湖北省十堰市太和医院(湖北医药学院附属医院)胸心大血管外科,湖北 十堰 442099;2.湖北医药学院护理学院,湖北 十堰 442000]
过表达KLF4抑制非小细胞肺癌增殖及上皮间质转化的作用机制*
刘华松1,徐兰兰2,张军1,郭家龙1,林称意1,原野1,曾敏1,程栋梁1
[1.湖北省十堰市太和医院(湖北医药学院附属医院)胸心大血管外科,湖北 十堰 442099;2.湖北医药学院护理学院,湖北 十堰 442000]
目的 探究KLF4调控非小细胞肺癌(NSCLC)增殖及上皮间质转化(EMT)发生的作用机制,为NSCLC的临床研究提供理论依据。方法 收集临床病理资料进行统计学分析,免疫组织化学检测KLF4在癌旁及癌组织中的表达,细胞水平检测KLF4在癌细胞和正常细胞中的表达差异,过表达KLF4检测对肺癌细胞的增殖、侵袭、迁移及EMT相关标志物的影响。结果 KLF4在癌组织中的表达低于癌旁组织中的表达,并且与患者的临床分期及远处转移密切相关,细胞水平检测也得到了相同的结果,上调KLF4的表达抑制了细胞的增殖、侵袭及迁移,同时抑制EMT相关的间充质标志物的表达,促进上皮标志物的表达。结论 过表达KLF4能够抑制NSCLC增殖及EMT的发生。
KLF4;非小细胞肺癌;增殖;上皮间质转化
肺癌是最常见的恶性肿瘤之一,其发病率及癌症致死率在所有肿瘤中均居第一位[1]。肺癌按病理类型主要包括小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),NSCLC占到80%以上。NSCLC患者中只有不到50%的能够接受以手术为主的治疗方案,绝大多数NSCLC患者确诊时多已发展到中晚期,致使NSCLC患者的5年生存率只有15%左右,严重影响患者的治疗及预后[2]。因此,寻找NSCLC早期诊断的特异性标志物显得尤为重要。
Krüppel样因子(krüppel-like factors,KLFs)家族是广泛存在于人类组织中的锌指型转录因子,主要参与到细胞的增殖、分化、周期、胚胎形成等多个生理活动过程中[3]。目前,KLF家族中研究最多的是KLF4基因,人类KLF4基因位于染色体9q31,其编码的KLF4蛋白是能够特异识别并结合DNA序列(5'-TGGGTGGGGC-3')的转录因子。作为重要的核转录因子,KLF4蛋白即能通过调控下游靶基因表达发挥生物学功能,同时也能够结合到自身启动子上激活自身表达,因此,KLF4是一个双向调节的转录因子[4]。针对KLF4与肿瘤的相关性研究发现,KLF4在不同的肿瘤中发挥着不同的作用。通过免疫组织化学和实时荧光定量聚合酶链反应(qRT-PCR)检测等实验验证,发现其在白血病[5]、皮肤癌[6]、结肠癌、胃癌、食管癌、膀胱癌、肝癌及宫颈癌[7]等多个肿瘤组织中均低表达,然而在口腔上皮细胞鳞癌,乳腺癌[8]以及前列腺癌[9]中却高表达。相关的临床研究证实KLF4的表达异常与肿瘤患者的预后密切相关,成为判断疾病预后的重要指标。CHALEB[10]等在研究中指出,杂合子缺失及启动子甲基化导致的蛋白活性降低可能是KLF4在多个肿瘤组织中表达下调的重要机制。尽管KLF4与肿瘤发生发展的机制研究已取得了一定进展,但是有关KLF4与NSCLC关系的研究却很少[11]。最新的研究表明,KLF4在NSCLC细胞系中均低表达,并且发现Numb-KLF4信号通路在调控NSCLC的侵袭转移中发挥着重要的作用,然而,有关KLF4参与调控NSCLC的上皮间质转化(EMT)的机制仍不清,因此,本研究主要探究KLF4调控非小细胞肺癌EMT的作用机制。
1 资料与方法
1.1 病例资料
随机选取十堰市太和医院胸心外科2012年9月-2015年9月收治的NSCLC病例100例。其中,男性63例,女性37例;年龄45~78岁,平均62岁;其中鳞癌56例,腺癌32例,其他12例。术后病理检测均已证实,术前均未接受化疗和放疗,临床病理资料完整,同时选取相对应的癌旁组织作为对照,本研究所收病例标本已获本院伦理委员会的批准。
1.2 主要试剂
KLF4兔抗人多克隆抗体(免疫组织化学1∶200 Western blot 1∶500武汉三鹰生物技术有限公司),E-cadherin兔抗人多克隆抗体(1∶500武汉三鹰生物技术有限公司),N-cadherin兔抗人多克隆抗体(1∶1 000 abcam),α-catenin兔抗人多克隆抗体(1∶1 000 CST),vimentin兔抗人多克隆抗体(1∶500 abcam),GADPH兔抗人多克隆抗体(1∶1 500北京博奥森生物技术有限公司),山羊抗兔二抗(1∶5000-10000,武汉博士德生物工程有限公司),SP系列检测试剂盒(中杉金桥生物技术有限公司)。
1.3 细胞培养与转染
人NSCLC(A549,NCl-H460,NCl-H1299,95D)以及人胚胎肺成纤维细胞(WI-38)来源于中国典型培养物保藏中心,用含10%胎牛血清(excellbio南美)RPMI-1640培养基(Hyclone USA)培养NCl-H1299,其他细胞用10%胎牛血清DMEM高糖培养基培养,细胞均培养于37℃、含5%二氧化碳CO2的培养箱,pMXs-hKLF4过表达质粒购于addgene(货号17219),按照lipofectamine 2000转染手册的步骤进行转染
1.4 免疫组织化学法
所有组织均经过了甲醛固定和石蜡包埋处理后,制备成厚度约为5μm的切片,采用SP免疫组织化学2步法进行后续处理,制成的切片经二甲苯脱蜡以及不同浓度的酒精脱水处理,后续进行微波抗原修复,再滴加3%双氧水H2O2孵育10 min,PBS冲洗,10%山羊血清室温封闭30 min,接着进行湿盒孵育KLF4抗体(1∶200)4℃过夜,第2天PBS冲洗,切片进行生物素标记的山羊抗兔二抗室温孵育30 min,PBS冲洗,最后DAB显色,显微镜下观察,自来水冲洗,苏木素复染,酒精脱水,树胶封片。每张切片随机选择400倍下不重复视野5个,按阳性细胞百分比评分:≥30%表达阳性。
1.5 细胞计数
接种相同细胞到24孔板,设置阴性对照组和实验组,实验组转染KLF4过表达质粒,24、48、72及96 h后分别在显微镜下统计各个时间点的细胞数,绘制生长曲线图。
1.6 Western blot实验
收集转染过表达质粒48 h后的细胞,利用含PMSF的RIPA裂解液提取总蛋白,BCA蛋白定量,将变性蛋白进行垂直凝胶电泳2 h之后,接着湿法转膜,再5%脱脂奶粉对PVDF膜进行室温封闭处理1 h,封闭完的膜进行一抗4℃孵育过夜,TBST清洗3次,进行二抗室温孵育1 h,TBST再次清洗3次,化学发光成像系统暗室曝光蛋白拍照。
1.7 迁移与侵袭
利用包埋基质胶或不包埋基质胶的Transwell小室检测细胞迁移与侵袭能力,消化转染48 h后的细胞,用不含血清的培养基重悬,取200μl(2×104个细胞)的单细胞悬液种植在Transwell小室的上室,下室加入600μl含10%的胎牛血清的培养基,37℃培养箱孵育24 h后,棉签擦拭掉Transwell上室膜细胞,接着4%甲醛室温固定10 min,0.05%结晶紫染色10 min,最后,显微镜200倍下每个小室随机观察5个视野计数并拍照。
1.8 统计学方法
采用SPSS 20.0统计软件进行数据分析,KLF4与临床病理特征关系的分析采用χ2检验,随机成对计量资料采取t检验,P<0.05为差异有统计学意义。
2 结果
2.1 KLF4在非小细胞肺癌组织中的表达
KLF4主要表达在细胞核,少部分表达在细胞浆,阳性染色呈棕黄色颗粒,阴性则为无色。KLF4在肺癌组织中的阳性表达率为23.35%,而在对应的癌旁组织的阳性表达率高达86.14%(t=3.485,P= 0.034)。见图1。
2.2 KLF4蛋白表达与NSCLC临床病理特征的关系
免疫组织化学法检测100例NSCLC组织中KLF4的阳性表达率为64%,KLF4在非小细胞肺癌中的表达与患者所处的临床分期、是否远处转移密切相关,而与患者的性别、年龄、病理类型、肿瘤大小等无关。临床分期等级越高,KLF4的表达越少(P<0.05);远处转移患者KLF4的阳性表达(23.07%)低于非远处转移者(52.45%),两者差异有统计学意义(P<0.05)。见表1。
2.3 KLF4蛋白在NSCLC细胞系中的表达
Western blot检测结果显示,KLF4在非小细胞肺癌细胞系中的表达均低于WI-38中的表达,Image J软件灰度分析蛋白表达情况,差异具有统计学意义(t=2.189,P=0.037,n=3)。见图2。
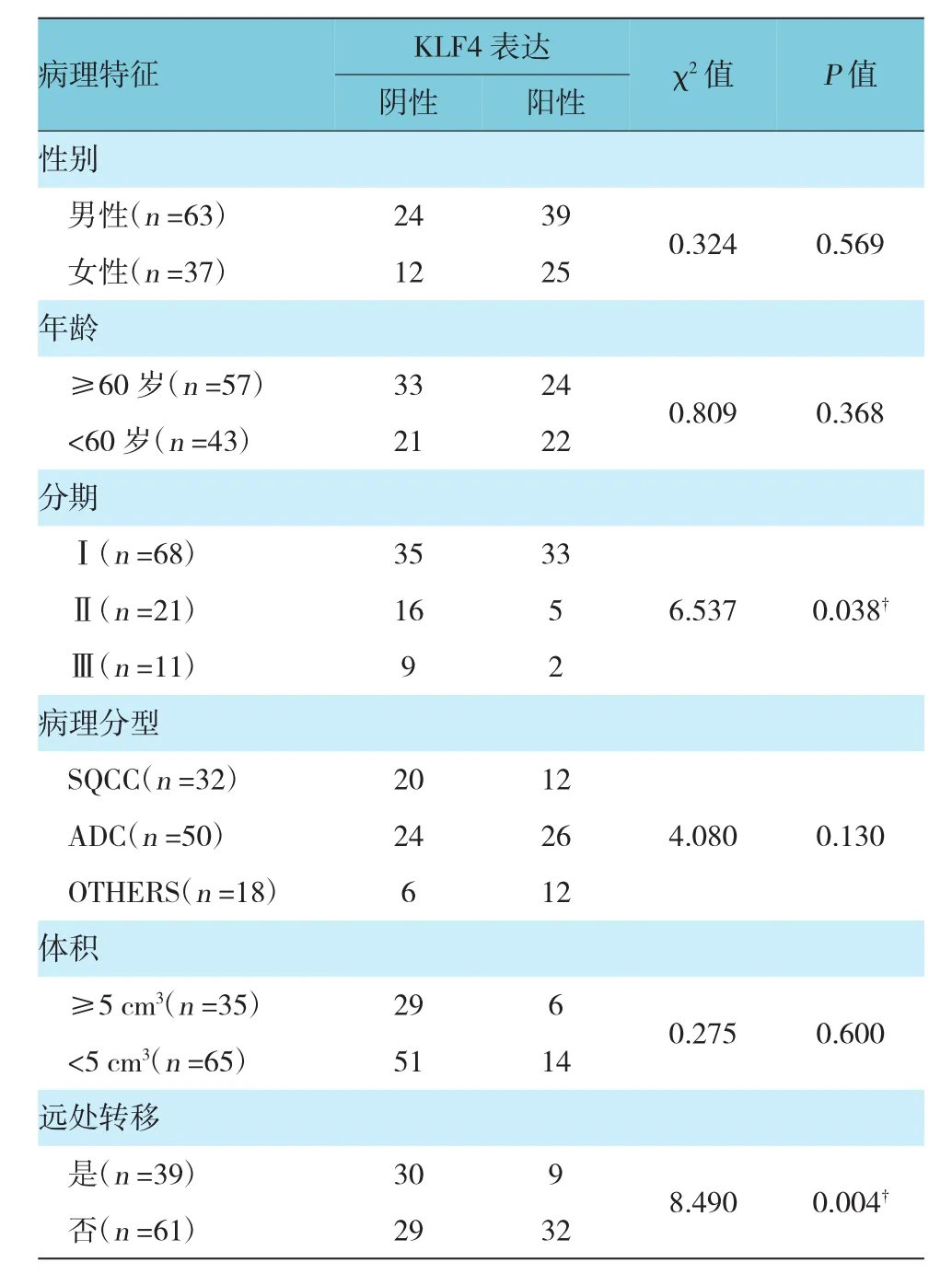
表1 KLF4蛋白的表达与临床病理的相关性 例
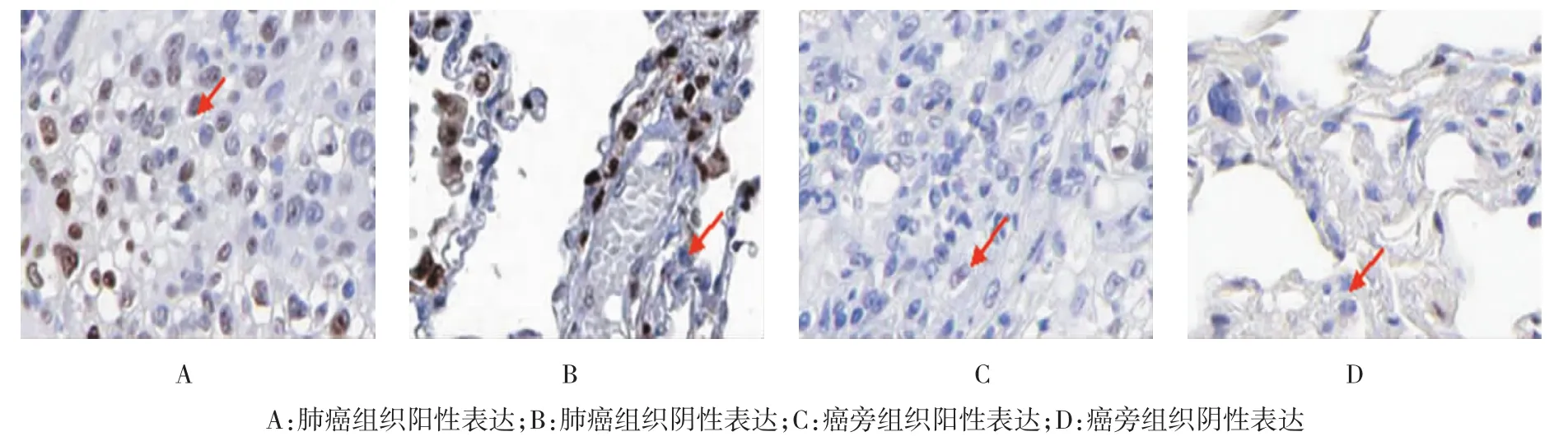
图1 KLF4蛋白在肺癌及癌旁组织中的表达 (SP×400)
2.4 过表达KLF4抑制NSCLC细胞的增殖
转染KLF4的过表达质粒后,A549(t=4.763,P= 0.004)和H1299(t=1.368,P=0.006)的细胞增殖能力受到抑制。见图3。
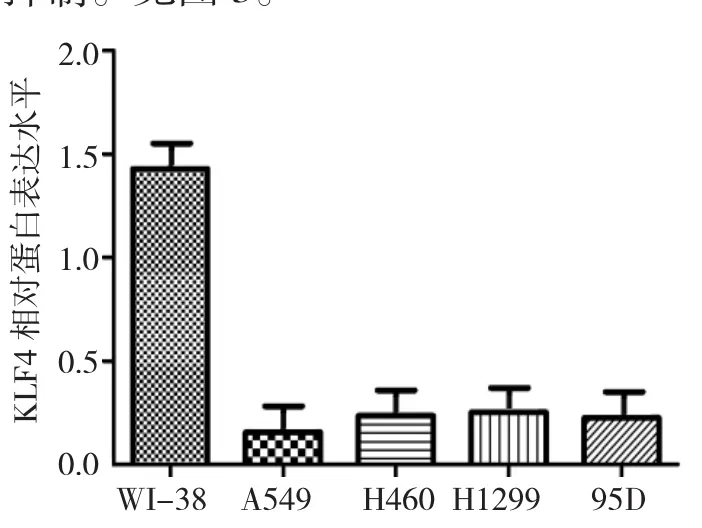
图2 KLF4蛋白在正常肺细胞以及NSCLC细胞系中的表达水平
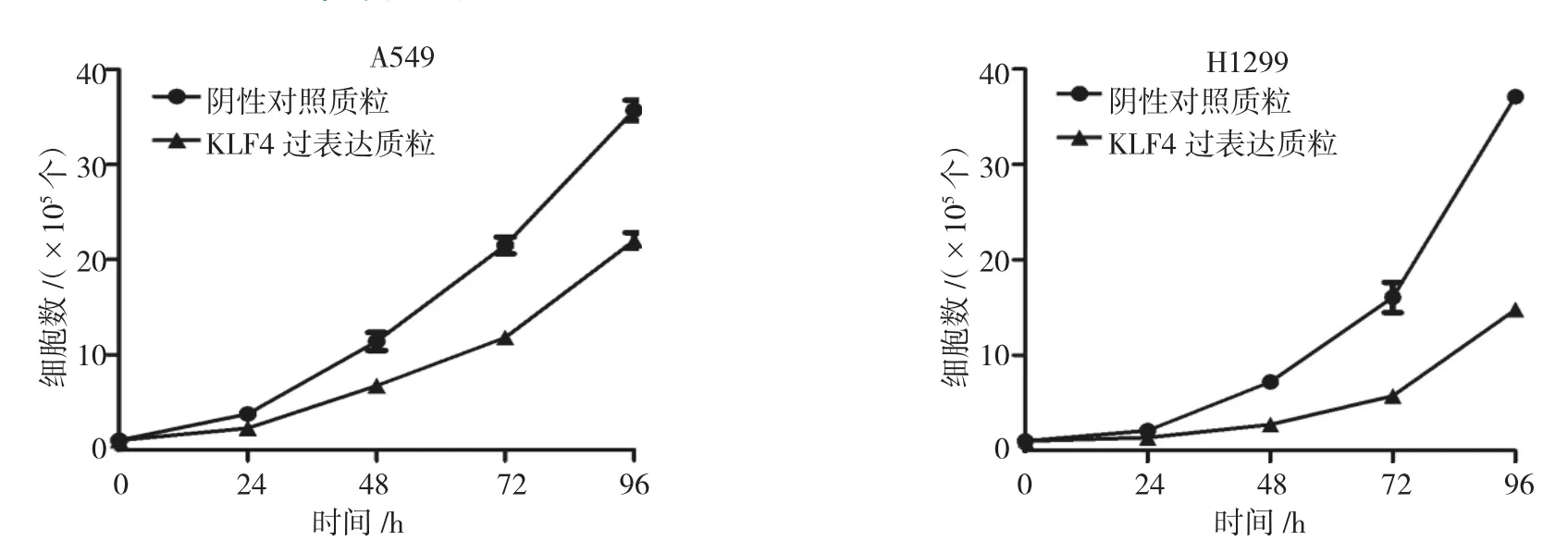
图3 过表达KLF4抑制NSCLC细胞的增殖能力
2.5 过表达KLF4蛋白对EMT相关标志物的影响
A549细胞和H1299细胞分别转染pMXs-hKLF4过表达质粒后,提取蛋白进行Western blot检测,发现过表达KLF4后2种细胞的上皮标志物E-caherin、α-catenin表达均升高,而间皮标志物N-caherin、vimentin的表达下调(见图4),说明过表达KLF4能够抑制NSCLC细胞EMT的发生。
2.6 过表达KLF4蛋白对NSCLC细胞迁移和侵袭的影响
瞬转KLF4过表达质粒的细胞进行Transwell实验,发现过表达KLF4的A549细胞(t=5.763,P= 0.024;t=2.489,P=0.015,n=3)和H1299细胞(t= 1.463,P=0.033;t=3.398,P=0.107,n=3)迁移及侵袭能力均受到明显抑制。见图5。
3 讨论
KLF4是重要的核转录因子,在参与调控癌细胞的增殖、分化、周期等方面发挥着重要的作用。目前的研究已经证实,KLF4在组织中的表达失调与多种肿瘤的发生发展密切相关,鉴于KLF4作为双向调控因子,在肿瘤中既发挥抑癌作用,也发挥促癌作用,因此对于KLF4在肿瘤的具体作用机制仍存在诸多疑问。关于KLF4在NSCLC中的作用机制的研究,虽已有少量文献报道,但是KLF4调控NSCLC及EMT的发生的研究却很少,EMT是肿瘤恶性转变的一个重要的标志,EMT的发生与肿瘤的增殖、侵袭及转移密切相关。NEHA等[12]在其研究中指出KLF4是EMT的关键调节因子;此外,有关肾纤维化的研究报道了KLF4能够通过抑制EMT来延缓肾纤维化的发生[13],同时Dnmt1甲基化KLF4的启动子促进EMT的发生;ZHOU等[14]在其乳腺癌的研究也做了类似的研究;有文献报道KLF4抑制SPARC的表达来抑制肺癌细胞的侵袭转移;最新的研究表明,KLF4能够抑制K-Ras诱导的小鼠肺癌的形成,组蛋白乙酰化可能抑制KLF4的表达[15]。
本研究发现,KLF4在肺癌组织中的表达低于癌旁组织,并且KLF4的表达与患者的临床分期、远处转移密切相关;在NSCLC细胞系中的表达也低于正常的肺细胞,过表达KLF4抑制NSCLC细胞的侵袭与迁移,同时,KLF4的过表达抑制了EMT的发生,因此,推测KLF4在调控NSCLC增殖及EMT的发生过程中发挥着重要的作用,可能成为NSCLC临床早期诊断的特异性标志物。KLF4在非小细胞肺癌中的研究较少,其机制有待深入研究。该论文收集了100例NSCLC进行统计学分析,同时通过免疫组织化学分析过表达KLF4,发现KLF4与细胞的增殖、侵袭及迁移有关,并得出过表达KLF4能够抑制NSCLC增殖及EMT的发生这一结论。该结论有较好的实验证据支持,具有一定的理论和临床指导意义。
[1]DIRECTOR A J D S,MANAGER R S,EPIDEMIOLOGIST J X, et al.Cancer statistics,2010[J].Ca A Cancer Journal for Clinicians,2010,60(5):277-300.
[2]HARUBUMI K,YUKITO I,MORIO O,et al.A randomized trial of adjuvant chemotherapy with uracil-tegafur for adenocarcinoma of the lung[J].New England Journal of Medicine,2004,350(17): 1713-1721.
[3]SHIELDS J M,CHRISTY R J,YANG V W.Identification and characterization of a gene encoding a gut-enriched Krüppel-like factor expressed during growth arrest[J].Journal of Biological Chemistry,1996,271(33):20009-20017.
[4]QIBING Z,YUAN H,QIMIN Z,et al.Role for Kruppel-like factor 4 in determining the outcome of p53 response to DNA damage[J].Cancer Research,2009,69(21):8284-8292.
[5]HUANG Y,CHEN J,LU C,et al.HDAC1 and Klf4 interplay critically regulates human myeloid leukemia cell proliferation[J]. Cell Death&Disease,2014,5(5):e1491.
[6]JUAN L,HAI Z,FANG Y,et al.Deficiency of the Kruppel-like factor KLF4 correlates with increased cell proliferation and enhanced skin tumorigenesis[J].Carcinogenesis,2012,33(6):1239-1246.
[7]YANG W T,LIU S Y,ZHENG P S.Expression of KLF4 in cervical carcinoma and its significance[J].Journal of Xi-an Jiaotong University,2010,6(31):22.
[8]YU F,LI J,CHEN H,et al.Kruppel-like factor 4(KLF4)is required for maintenance of breast cancer stem cells and for cell migration and invasion[J].Oncogene,2011,30(18):2161-2172.
[9]MAGNEN C L,BUBENDORF L,RUIZ C,et al.Klf4 transcription factor is expressed in the cytoplasm of prostate cancer cells[J]. European Journal of Cancer,2013,49(4):955-963.
[10]GHALEB A,MCCONNELL B B,YANG V W.Intestine-specific deletion of the krüppel-like factor 4 (klf4)gene protects mice from dextran sulfate sodium (dss)induced colitis[J].Gastroenterology,2011,140(5):S84-85.
[11]HU W,HOFSTETTER W L,LI H,et al.Putative Tumor-Suppressive Function of Krüppel-Like Factor 4 in Primary Lung Carcinoma[J].Clinical Cancer Research An Official Journal of the American Association for Cancer Research,2009,15(18): 5688-5695.
[12]NEHA T,NATHALIE M S,PHIL A,et al.Klf4 is a transcriptional regulator of genes critical for EMT,including Jnk1 (Mapk8)[M].Tin ore resources of Asia and Australia..United Nations,1964:e57329.
[13]XIAO X,TANG W,YUAN Q,et al.Epigenetic repression of Kr ppel-like factor 4 through Dnmt1 contributes to EMT in renalfibrosis[J].InternationalJournalofMolecularMedicine, 2015,35(6):1596-1602.
[14]ZHOU Y,HOFSTETTER W L,YONG H,et al.KLF4 inhibition of lung cancer cell invasion by suppression of SPARC expression[J].Cancer Biology&Therapy,2010,9(7):507-513.
[15]YU T,CHEN X,ZHANG W,et al.KLF4 regulates adult lung tumor-initiating cells and represses K-Ras-mediated lung cancer[J].Cell Death&Differentiation,2015,23(2):207-215.
(张西倩 编辑)
Mechanisms of KLF4 over-expression in inhibiting proliferation and EMT of NSCLC*
Hua-song Liu1,Lan-lan Xu2,Jun Zhang1,Jia-long Guo1,Chen-yi Lin1,
Ye Yuan1,Min Zeng1,Dong-liang Cheng1
(1.Department of Thoraco-cardio-macrovascular Surgery,Shiyan Taihe Hospital(the Affiliated Hospital of Hubei University of Medicine),Shiyan,Hubei 442099,China;2.Shool of Nursing, Hubei University of Medicine,Shiyan,Hubei 442000)
Objective To explore the effect of KLF4 on proliferation and epithelial mesenchymal transition(EMT) innon-small cell lung cancer(NSCLC).Methods KLF4 expression in 100 samples of surgical resected NSCLC and matched normal tumor-adjacent tissues were measured by immunohistochemical staining.KLF4 expression in WI-38 and NSCLC cell lines was detected by Western blot.The regulatory effect of KLF4 on proliferation,invasion, migration and EMT markers were confirmed by cell counting,Transwell and Western blot,respectively.Results KLF4 expression was impaired in the NSCLC tissues.Loss of KLF4 expression was correlated with poor clinicopathological features including tumor stage and distant metastasis,upregulated KLF4 attenuated proliferation, invasion and migration.Meanwhile,the expressions of N-cadherin and vimentin were markedly decreased,but E-caherin and α-catenin expressions were increased after NSCLC cells were transfected with pMXs-hKLF4. Conclusions Our work provides a novel molecular insight into KLF4-directed tumor suppression through regulation of EMT.
KLF4;NSCLC;proliferation;EMT
R734.2
A
2016-12-06
湖北省教育厅项目(No:B2016497)
10.3969/j.issn.1005-8982.2017.19.008
1005-8982(2017)19-0040-05

