IgA肾病大鼠肾组织中T细胞免疫球蛋白与黏蛋白域基因1的表达和意义*
王缨,胡贵荣,李弼民
(南昌大学第一附属医院 肾内科,江西 南昌 330006)
IgA肾病大鼠肾组织中T细胞免疫球蛋白与黏蛋白域基因1的表达和意义*
王缨,胡贵荣,李弼民
(南昌大学第一附属医院 肾内科,江西 南昌 330006)
目的 观察IgA肾病(IgAN)大鼠肾组织中T细胞免疫球蛋白与黏蛋白域基因1(TIM-1)的表达,探讨TIM-1在IgAN大鼠发病中的作用。方法 20只雄性SD大鼠随机分成IgAN模型组和对照组,每组10只。在复制模型完成后处死大鼠,取肾脏,肾组织切片行PAS染色,免疫荧光观察大鼠肾脏病理变化,并行免疫组织化学法检测肾组织中TIM-1的表达,实时荧光定量聚合酶链反应(qRT-PCR)检测TIM-1 mRNA的表达。结果 IgAN组TIM-1主要分布在肾小球和肾小管,表达量较对照组增加(P<0.05)。IgAN组肾组织中TIM-1 mRNA表达量均较对照组升高。TIM-1 mRNA相对表达量和肾脏病理Katafuchi评分呈正相关,且差异具有统计学意义(P<0.05)。结论 TIM-1可能参与了IgAN的发生发展。
肾小球肾炎;IgA;T细胞免疫球蛋白与黏蛋白域基因-1
IgA肾病(IgA Nephropathy,IgAN)是目前最常见的原发性肾小球疾病之一,目前国际上尚无广泛被认同的IgAN发病机制,其中机体免疫功能障碍,多种细胞因子和炎症介质分泌异常被认为是IgAN发病的重要因素。T细胞亚群分化异常在多种自身免疫疾病发病中渐被阐明证实,Th1/Th2失衡与IgAN相关性也已开始受到重视。T细胞免疫球蛋白与黏蛋白域(T-cell immunoglobulin domain and mucin domain,TIM)基因家族共同编码具有多种生物活性的I型跨膜糖蛋白,广泛表达并参与多种T细胞介导的各类免疫反应。其中,T细胞免疫球蛋白与黏蛋白域基因1(TIM-1)与其天然配体T细胞免疫球蛋白与黏蛋白域基因4(TIM-4)特异性结合共刺激T细胞增殖,调节Th1/Th2细胞的平衡[1]。综上所述,Th1/Th2失衡参与IgAN发病,而TIM-1信号通路可调控多种T细胞亚群免疫功能,调节T细胞平衡,那么在肾脏组织中TIM-1的表达如何?本研究通过复制IgAN大鼠模型,观察IgAN大鼠肾组织中TIM-1的表达,初步探讨TIM-1在IgAN中的作用与机制。
1 材料与方法
1.1 动物
20只SPF级SD大鼠,均为雄性,体重180~200 g。购自湖南斯莱克景达实验动物有限公司。按标准饲养条件。
1.2 动物模型的复制及分组
20只大鼠按随机数字表法分为正常对照组(n= 10)和模型组(n=10)。模型组:牛血清白蛋白(美国Sigma公司)按400 mg/kg隔日灌胃,至复制模型结束共9周;在第6周和第8周末通过尾静脉注射脂多糖(美国Sigma公司),0.05 mg/(只·次);每个周末通过皮下注射四氯化碳CCl4(美国Sigma公司),每只每次蓖麻油0.5 ml+CCl40.1 ml,共9周;在相同时间给予正常对照组等体积蒸馏水灌胃,同体积生理盐水皮下注射及同等量的生理盐水尾静脉注射。
1.3 取材及标本处理
实验第9周复制模型完成后,采用3%戊巴比妥麻醉大鼠迅速游离肾脏,放入10%中性甲醛固定后用石蜡进行包埋,留待行光镜检查及免疫组织化学检查,另一部分放入-80℃保存备用。
1.4 免疫组织化学法检测肾组织TIM-1的表达
采用SP法检测TIM-1(英国Abcam公司),阳性组织呈棕色,半定量结果分析采用 Image pro-plus 6.0图像采集软件,每张切片随机采集20个视野(10×物镜),用Image pro-plus 6.0图像分析软件对每个视野进行分析,其阳性染色面积/视野总面积即为免疫组织化学阳性目标的强度。
1.5 实时荧光定量聚合酶链反应(qRT-PCR)检测大鼠肾脏组织中TIM-1 mRNA表达
提取细胞总RNA,参照cDNA试剂盒(AE301-02,北京全式金生物技术有限公司)说明书合成cDNA。采用大连宝生物有限公司PCR反应试剂盒进行PCR扩增。反应条件为95℃5 s,60℃ 30 s,95℃ 15 s,60℃ 1 min,60℃ 15 s(退火温度及循环周期依据引物和PCR产物而定)。所有引物序列均由Invitrogen公司合成。引物序列见表1。
1.6 统计学方法
应用SPSS 17.0统计软件对实验结果进行数据分析,计量资料以均数±标准差(±s)表示,IgAN模型组和正常对照组比较采用t检验,对IgAN模型组的TIM-1表达与临床、病理资料进行Pearson相关性分析,P<0.05时差异为差异有统计学意义。

表1qRT-PCR引物序列
2 结果
2.1 肾脏病理结果
光镜组织学见正常对照组肾小球系膜细胞无明显细胞增多,基质无明显增生,毛细血管襻开放,肾小管未见明显异常,肾间质未见明显增生,无炎症细胞浸润;模型组在肾小球内可见明显的系膜细胞增多,系膜基质中到重度增生,毛细血管管腔狭窄,肾间质内可见明显的炎症细胞浸润,并可见肿胀变性的肾小管上皮细胞。免疫荧光:正常对照组未见IgA沉积,模型组可见团块状或颗粒状绿色IgA荧光。见图1。
2.2 两组大鼠临床指标比较
IgAN模型组大鼠24 h尿蛋白定量高于正常对照组,差异有统计学意义(P<0.05),IgAN模型组大鼠血清白蛋白较正常对照组则下降,差异有统计学意义(P<0.05),两组血肌酐相比较差异无统计学意义(P>0.05)。见表2。
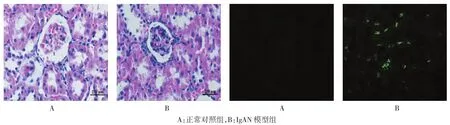
图1 两组大鼠肾脏病理学改变
表2 两组大鼠24 h尿蛋白定量、血清白蛋白及肾功能的比较 (±s)
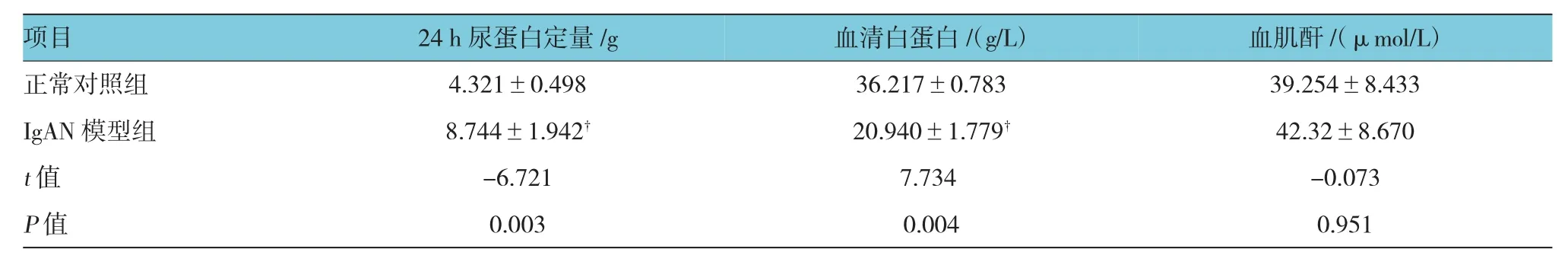
表2 两组大鼠24 h尿蛋白定量、血清白蛋白及肾功能的比较 (±s)
注:†与正常对照组同时期相比,P<0.05
项目血肌酐/(μmol/L)正常对照组 39.254±8.433 IgAN模型组 42.32±8.670血清白蛋白/(g/L)4.321±0.498 36.217±0.783 8.744±1.942† 20.940±1.779†t值24 h尿蛋白定量/g-6.721 7.734 P值 0.003 0.004 0.951 -0.073
2.3 两组大鼠肾脏病理损伤Katafuchi评分
每张HE染色切片取任意5个高倍镜(×40)视野,每个视野取任意2个小球和2个小管,IgAN模型组和正常对照组的Katafuchi评分分别为(6.303± 1.949)和(1.301±0.823),差异有统计学意义(t= 9.682,P=0.000),IgAN模型组高于正常对照组。
2.4 两组大鼠肾脏TIM-1的表达
正常对照组仅在肾小管上皮细胞中可见少量TIM-1阳性表达,而IgAN模型组阳性表达较正常对照组增多,广泛分布在肾小球细胞核和肾小管上皮细胞核,见图2;IgAN模型组和正常对照组的TIM-1定量积分分别为(7.519±1.580)和(1.036±0.824),差异有统计学意义(t=-11.551,P=0.000),IgAN模型组高于正常对照组。
2.5 两组大鼠肾脏TIM-1 mRNA的表达
qRT-PCR检测结果显示,IgAN模型组和正常对照组的 TIM-1 mRNA的相对表达量分别为(2.033±0.784)和(0.830±0.209),差异有统计学意义(t=4.532,P=0.001),IgAN模型组高于正常对照组。
2.6 TIM-1表达与各个临床及病理指标间的相关性分析
采用双变量Pearson相关性分析法,可见IgAN模型组大鼠肾脏 TIM-1 mRNA相对表达量与TIM-1半定量积分呈正相关(r=0.481)(见图3),分别分析IgAN模型组大鼠肾脏TIM-1 mRNA相对表达和24 h尿白蛋白定量、血清白蛋白变化、肾脏病理损伤Katafuchi评分及TIM-1半定量积分的相关性。结果见表3、图3。在IgAN模型组中,TIM-1 mRNA相对表达量与24 h尿白蛋白的变化呈正相关,与血清白蛋白变化呈负相关,但差异无统计学意义(P>0.05);TIM-1 mRNA相对表达量和肾脏病理Katafuchi评分呈正相关(r=0.846),且差异有统计学意义(P<0.05)。
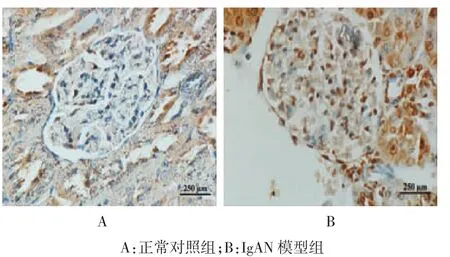
图2 两组大鼠肾脏TIM-1的表达
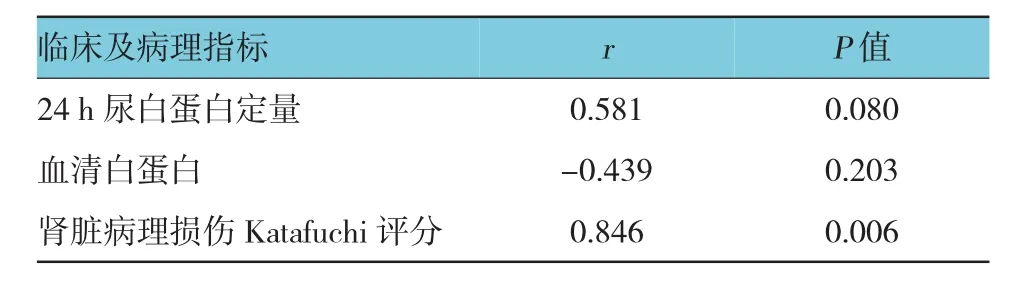
表3 TIM-1 mRNA与24 h尿白蛋白、血清白蛋白及肾脏病理损伤Katafuchi评分相关性分析
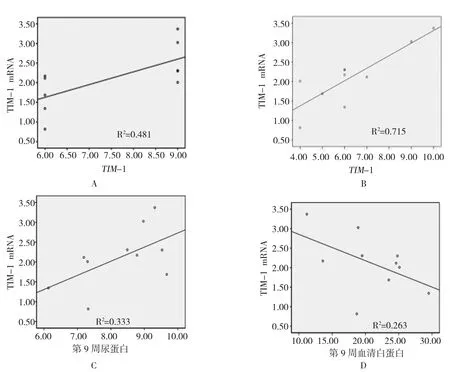
图3 TIM-1 mRNA与24 h尿白蛋白、血清白蛋白及肾脏病理损伤Katafuchi评分相关性
3 讨论
目前国际上尚无广泛被认同的IgAN发病机制,其中机体免疫功能障碍,多种细胞因子和炎症介质分泌异常被认为是IgAN发病重要因素。T细胞亚群分化异常在多种自身免疫疾病发病中渐被阐明证实,Th1/Th2失衡与IgAN相关性也已开始受到重视。早在上世纪90年代年ANDRE等[2]已经检测到大部分IgAN患者肾小球系膜区均有IgAl分子高表达,而过量IgA1需要由成熟B细胞在Th2细胞或病毒抗原的刺激下才能生成。人们还发现自发性产生IgAN的ddY小鼠幼鼠为Thl优势,但成年小鼠却呈现Th2优势、血清IgA水平升高,NOGAKI等[3]由此提出Thl/Th2失衡与IgA的分泌水平相关,Th2优势时分泌过量IL-4、IL-6等细胞因子,IL-4和IL-6不仅正反馈Th2过度分化,还同时刺激B细胞活化、增殖,并增加抗体分泌,可能在促进IgAN的发病中占据重要地位。肖俊等[4]发现IgAN较正常人外周血中IFN-γ表达减少,而IL-4比例升高,Th1/Th2比值下降并与血IgA水平构成正比,证实了IgAN患者外周血中Th1/Th2失衡向Th2偏倚。近年来,参与自身免疫性疾病的发病的Treg/Th17细胞平衡在IgAN患者向Treg有所偏倚也渐受重视,LIN等[5]证实了其肾脏组织Foxp3表达上调、而致炎因子IL-17A的表达减少,尽管在血清中IL-17A表达有所升高。
21世纪初MCINTIRE等[6]在分析人类染色体5q23-35基因与哮喘的易感性时,在染色体5q33.2上识别出一个基因的主要序列编码完全背离了控制气道高反应性的TAPR调节器,且与人类甲肝病毒(HAV)受体同源,首次将其命名为TIM-1。TIM家族在小鼠有8个基因(TIM-1至TIM-8),其中TIM-5至TIM-8为有待证实序列的预测基因,在人类发现有 3个:TIM-1(Havcrl)、TIM-3(Havcr2)、TIM-4[7]。小鼠和人类 TIM基因编码区分别位于染色体11b1.1和5q33.2上,这两处染色体区在人类基因图谱中被证实为与过敏性和自身免疫性疾病易感性相关,中国地区的儿童哮喘等的发病有可能也同TIM-1、TIM-3、TIM-4的基因多态性存在一定联系[8]。T细胞免疫球蛋白和黏蛋白基因家族编码的跨膜糖蛋白具有多种生物活性,各自表达于T淋巴细胞、APC等不同细胞表面,主要参与调节T辅助细胞介导的各种免疫反应,其中,TIM-1与其天然配体TIM-4特异性结合,共刺激T细胞增殖,可调节多种效应性T细胞的表达,影响Th1/Th2细胞的平衡[9],而Th1/Th2失衡,Th0分化向Th2偏倚,在调节Th2反映中起重要作用。研究证实在Henoch-Schonlein purpura患者外周血单核细胞中Th2占优势且TIM-1mRNA的表达上调,并与血清IgA1和IL-4分子水平呈正相关[9]。在有关哮喘小鼠模型中发现TIM-1介导免疫反应,当给予抗TIM-1抗体后可减少气道黏液高分泌,且IL-4表达下调,说明TIM-1通过调节Th2细胞,参与了气道高反应[10]。
1998年,ICHIMURA等[11]又将其命名为肾损伤分子1(kidney injury molecule-1,KIM-1),因在缺血再灌注大鼠模型中确定该分子的高度表达与肾小管损伤程度相关。KIM-1是人们发现的首个非骨髓源性清道夫受体,由肾小管上皮细胞表达,并参与肾小管中凋亡细胞的吞噬清除和诱导淋巴细胞浸润。KIM-1在近膜端释放出细胞外区并溶于尿液,由于在健康肾脏中几乎不表达,尿液KIM-1联合中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、IL-8、半胱氨酸酶抑制剂Cysc等的检测等可以作为急性肾缺血性损伤、慢性肾脏病等各类肾损伤的诊断及预后标志。NOZAKI等[12]发现TIM-1增强新月体性肾小球肾炎T细胞免疫应答,并促进细胞介导的肾脏损害。在顺铂诱导的急性肾损伤模型中的研究发现,运用TIM-1抗体后肾脏NF-κB的表达及促炎因子、趋化因子的表达下降,而且肾脏的免疫炎症反应也受到抑制[13]。人们在IgAN发病中对TIM-1的研究还比较少,本研究中观察到IgAN大鼠肾脏TIM-1 mRNA的表达上调,与肾脏病理组织学损伤程度呈正相关,差异有统计学意义;同时观察到IgAN大鼠肾脏TIM-1 mRNA的表达上调与24 h尿白蛋白定量呈正相关,与血清白蛋白呈负相关,但可能因为样本量过小或检验方法的局限性,相关性分析结果差异无统计学意义,推测TIM-1可能一定程度参与大鼠IgAN的发病及进展。
Th1/Th2和Treg/Th17失衡均参与IgAN发病,而TIM-1信号通路可调控多种T细胞亚群免疫功能,调节T细胞平衡,究竟TIM-1在IgAN的免疫发病机制中如何发挥作用,是否通过调控Th1/Th2、 Treg/Th17参与IgAN发病?这将是下一步的研究方向。
[1]DEGAUQUE N,MARIAT C,KENNY J,et al.Regulation of T-cell immunity by T-cell immunoglobulin and mucin domain proteins[J].Transplantation,2007,84(Suppl 1):S12-16.
[2]ANDRE P M,LE POGAMP P,CHEVET D,et al.Impairment of jacalin binding to serum IgA in IgA nephropathy[J].J Clin Lab Anal,1990,4(2):115-119.
[3]NOGAKI F,MUSO E,KOBAYASHI I,et al.Interleukin 12 induces crescentic glomerular lesions in a high IgA strain of ddY mice,independently of changes in IgA deposition [J].Nephrol Dial Transplant,2000,15(8):1146-1154.
[4]肖俊,曹春瑜,周静,等.IgAN患者外周血Th1、Th2、Th3细胞水平的变化及意义[J].实用临床医学,2012,13(12):28-31.
[5]LIN F J,JIANG G R,SHAN J P,et al.Imbalance of regulatory T cells to Th17 cells in IgA nephropathy[J].Scand J Clin Lab Invest,2012,72(3):221-229.
[6]MCINTIRE J J,UMETSU S E,AKBARI O,et al.Identification of Tapr(an airway hyperreactivity regulatory locus)and the linked Tim gene family[J].Nat Immunol,2001,2(12):1109-1116.
[7]KUCHROO V K,UMETSU D T,DEKRUYFF R H,et al.The TIM gene family:emerging roles in immunity and disease[J].Nat Rev Immunol,2003,3(6):454-462.
[8]WU Q W,CAI P C,WANG L,et al.Family-based association study of Tim-1 and Tim-3 gene polymorphisms with childhood asthma in Chinese trios[J].Int Arch Allergy Immunol,2009,150 (3):252-260.
[9]YUAN L P,LING L,BO H.T cellimmunoglobulinand mucin-domain containing molecule 1 in peripheral blood mononuclear cells in Henoch Schonlein purpura[J].Indian Pediatr,2012,49(3):225-227.
[10]强丽霞,金寿得,唐昊,等.TIM-1对哮喘小鼠气道MUC5AC及Th2细胞因子表达的影响 [J].第二军医大学学报,2012,33(6): 581-584.
[11]ICHIMURA T,BONVENTRE J V,BAILLY V,et al.Kidney injury molecule-1(KIM-1),a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain,is up-regulated in renal cells after injury[J].J Biol Chem,1998,273(7): 4135-4142.
[12]NOZAKI Y,NIKOLIC-PATERSON D J,SNELGROVE S L,et al.Endogenous Tim-1(Kim-1)promotes T-cell responses and cell-mediated injury in experimental crescentic glomerulonephritis[J].Kidney Int,2012,81(9):844-855.
[13]NOZAKI Y,NIKOLIC-PATERSON D J,YAGITA H,et al. Tim-1 promotes cisplatin nephrotoxicity[J].Am J Physiol Renal Physiol,2011,301(5):1098-1104.
(张西倩 编辑)
E xpression of TIM-1 in renal tissue of IgAN rats and significance*
Ying Wang,Gui-rong Hu,Bi-min Li
(Department of Nephrology,the Frist Affliated Hospital of Nanchang University, Nanchang,Jiangxi 330006,China)
Objective To investigate the expression of T-cell immunoglobulin domain and mucin domain-1(TIM-1)in rats with IgA nephropathy(IgAN),and to explore the role of TIM-1 in the pathogenesis of IgAN.Methods Twenty male SD rats were randomized into two groups,i.e.IgAN model group(10 rats)and control group(10 rats). The rats were sacrificed after the completion of building the model and the kidneys were obtained.The pathological changes of the rat kidneys were observed after PAS and immunofluorescence staining.Immunohistochemical staining was used to detect the expression of TIM-1 protein and RT-PCR was used to measure the expression of TIM-1 mRNA in the renal tissue.Results TIM-1 expression in the IgAN group mainly distributed in glomeruli and renal tubules,the expression levels of TIM-1 mRNA and protein significantly increased in the IgAN group compared with those in the control group(P<0.05).A positive correlation was found between the expression quantity of TIM-1 mRNA and Katafuchi score(r=0.846,P<0.05).Conclusions TIM-1 may be involved in the occurrence and development of IgAN.
IgAN;T-cell immunoglobulin domain and mucin domain-1(TIM-1);rat
R-332
A
2016-12-20
江西省自然科学基金(No:20142BAB205006);江西省教育厅科学技术研究项目(No:14005)
李弼民,E-mail:lbmjx@163.com ·12·
10.3969/j.issn.1005-8982.2017.19.003
1005-8982(2017)19-0012-05

