利拉鲁肽1对非酒精性脂肪肝大鼠及细胞因子的影响*
侯洪涛,冯佳,裘艳梅,胡义亭,王玉珍
(1.河北省人民医院 消化科,河北 石家庄 050051;2.解放军白求恩国际和平医院 消化内科,河北 石家庄 050082;3.河北医科大学第二医院 儿科,河北 石家庄 050000)
利拉鲁肽1对非酒精性脂肪肝大鼠及
细胞因子的影响*
侯洪涛1,冯佳2,裘艳梅3,胡义亭1,王玉珍1
(1.河北省人民医院 消化科,河北 石家庄 050051;2.解放军白求恩国际和平医院 消化内科,河北 石家庄 050082;3.河北医科大学第二医院 儿科,河北 石家庄 050000)
目的 探讨利拉鲁肽(Lira)对非酒精性脂肪肝(NAFLD)大鼠及细胞因子的影响。方法 将雄性SD大鼠32只随机分为3组:正常对照组(NC)10只、高脂组(HF)12只、HF+Lira组10只。HF组、HF+Lira组给予高脂饲料喂养16周,HF+Lira组高脂喂养12周后,给予Lira 600μg/(kg·d)4周。在16周末处死大鼠。光学显微镜下观察肝脏病理变化;全自动生化仪检测血清三酰甘油(TG),酶联免疫法测定空腹胰岛素(FINS),并计算胰岛素抵抗指数(HOMA-IR);GPO-PAP法测定肝脏TG含量;酶联免疫吸附法检测血清IL-18、IL-10水平。多组间数据比较采用单因素方差分析,组间比较采用SNK-q检验。结果 与NC组相比,HF组的肝指数、肝脏TG、血清IL-18、TG、空腹血糖(FBG)、FINS及HOMA-IR均升高(P<0.05);HF+Lira组与HF组相比,差异有统计学意义(P<0.05),大鼠肝指数、肝脏TG、血清IL-18、TG、FBG、FINS及HOMA-IR均下降。HF组血清IL-10下降(P<0.05),HF+Lira组较HF组血清IL-10升高(P<0.05)。相关分析显示,血清IL-18水平与肝脂肪变、肝小叶炎症及HOMA-IR呈正相关(P<0.05);IL-10水平与肝脂肪变、肝小叶炎症及HOMA-IR呈负相关(P<0.05)。结论 Lira可能通过调节NAFLD大鼠的炎症因子平衡,减轻胰岛素抵抗和炎症反应,减少肝脏脂质沉积,从而对NAFLD起到治疗作用。
非酒精性脂肪肝;胰岛素抵抗;利拉鲁肽;白细胞介素18;白细胞介素10
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除外酒精和其他明确的肝损害因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征。近年来,随着我国经济水平不断发展,NAFLD的发病率在我国不断升高,并且有低龄化趋势。尽管发现NAFLD与高脂血症、肥胖、糖尿病密切相关,但其发病机制至今尚不明确。细胞因子通过调节胰岛素敏感性和炎症反应促进肝脏脂质沉积,从而影响NALFD的发展。脂肪组织可分泌多种细胞因子,IL-18是一种炎症趋化因子,在炎症反应中起着中心作用。IL-18与NAFLD的发生、发展关系密切。IL-10是体内重要的抗炎因子。IL-18与IL-10在一定程度上可反映机体的炎症状况。利拉鲁肽(Liraglutide,Lira)是胰高血糖素样肽l(glucagon-like peptide-1,GLP-1)类似物,研究表明GLP-1能改善胰岛素抵抗及肝脂质沉积,已越来越多地被应用于NAFLD的治疗研究中[1]。本研究通过高脂饮食复制 NAFLD大鼠模型,观察Lira对NAFLD大鼠及细胞因子的影响,为NAFLD的防治提供理论依据。
1 材料与方法
1.1 材料
清洁级雄性SD大鼠32只,体重140~150 g,购自河北医科大学实验动物中心。Lira购自丹麦诺和诺德公司。胰岛素酶联免疫试剂盒购自南京建成生物有限公司。三酰甘油(Triglycerides,TG)试剂(GPO-PAP法)购自美国罗氏公司。IL-18、IL-10酶联免疫试剂盒均购自武汉博士德公司。
1.2 方法
1.2.1 动物模型的复制及分组 32只大鼠适应性喂养1周后,随机分为两组:10只为正常对照(normal control,NC)组,给予普通饲料,余下22只,给予高脂饲料(普通饲料88%、猪油10%、胆固醇2%)。饲养12周后,随机处死高脂喂养大鼠2只,进行肝组织切片HE染色确认模型是否复制成功。高脂喂养大鼠再随机分为两组:高脂(HF)组10只、HF+Lira组10只,HF+Lira组给予高脂喂养的同时腹腔内注射药物Lira 600μg/(kg·d),1次/d;HF组高脂饲料喂养的同时给予等体积生理盐水腹腔内注射。在16周末禁食12 h,以2%戊巴比妥钠腹腔麻醉并处死所有大鼠,采血分离血清。
1.2.2 肝组织病理学观察 摘取肝脏,称肝质量,计算肝指数(肝指数=肝脏湿重/体重×100%)。观察肝脏大体情况,每只大鼠取相同部位肝组织,置于4%多聚甲醛固定液中,常规脱水,石蜡包埋,切片,苏木精-伊红染色后光镜下观察肝脏脂肪变程度、炎症程度[2]。肝细胞脂肪变评分:0分(<5%);1分(5%~33%);2分(34%~66%);3分(>66%)。小叶内炎症(10个高倍镜视野计数坏死灶):0分(无);1分(<2个);2分(2~4个);3分(>4个)。所有切片由有经验的病理科医师进行评分。
1.2.3 血清及肝脏指标检测及方法 血生化学指标的测定:全自动生化仪检测TG,快速血糖仪测定空腹血糖(fasting blood glucose,FBG);肝脏TG含量测定:每只大鼠取相同部位肝组织50 mg,应用氯仿/甲醇制备肝组织匀浆并提取脂质,采用GPOPAP法测定;血清胰岛素测定:酶联免疫法测定空腹血清胰岛素(fasting insulin,FINS),由公式(FBG× FINS/22.5)计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR);血清IL-18、IL-10水平:酶联免疫吸附法(ELISA)检测血清IL-18、IL-10水平。
1.3 统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,进行单因素方差分析,两组之间比较用SNK-q检验,血清IL-18、IL-10水平与肝脂肪变、肝小叶炎症及HOMA-IR相关性用直线相关分析,P<0.05为有差异统计学意义。
2 结果
2.1 大鼠一般状态、肝脏形态学改变及肝指数
3组大鼠全部存活。NC组大鼠皮毛光泽,灵活好动;HF组大鼠不喜活动,皮毛光泽度差。肉眼观察,NC组大鼠肝脏色泽红润,边缘锐利整齐,HF组大鼠肝脏体积增大,边缘圆钝,色泽变黄,切面有油腻感,HF+Lira组大鼠肝脏体积较HF组减小,呈浅黄色,油腻感减轻。HF组大鼠肝指数增高,与NC组相比,差异有统计学意义(P<0.05);HF+Lira组肝指数与HF组比较,差异有统计学意义(P<0.05),HF+ Lira组高于HF组。见表1。
2.2 肝组织病理学检查
光镜下观察NC组大鼠肝小叶结构清晰,肝细胞索呈放射状排列,胞质均匀,无脂滴浸润,汇管区及小叶内无炎症细胞浸润;HF组大鼠肝细胞体积增大,肝细胞排列紊乱,细胞内有较多脂滴,并且有气球样变,部分肝细胞变性,有炎症细胞浸润;HF+Lira组肝细胞脂肪变明显改善,肝细胞内有少量脂肪滴,炎症细胞浸润改善。见表1和图1。
2.3 血清IL-18、IL-10、TG及肝脏TG
与NC组相比,差异有统计学意义(P<0.05),HF组血清IL-18、IL-10、TG及肝脏TG升高。与HF组相比,差异有统计学意义(P<0.05),HF+Lira组血清IL-18、IL-10、TG及肝脏TG下降。HF+Lira组血清IL-18、IL-10、TG及肝脏TG与NC组比较,差异有统计学意义(P<0.05),HF+Lira组高于HF组。见表2。
表1 各组大鼠肝脏脂肪变及炎症评分 (±s)
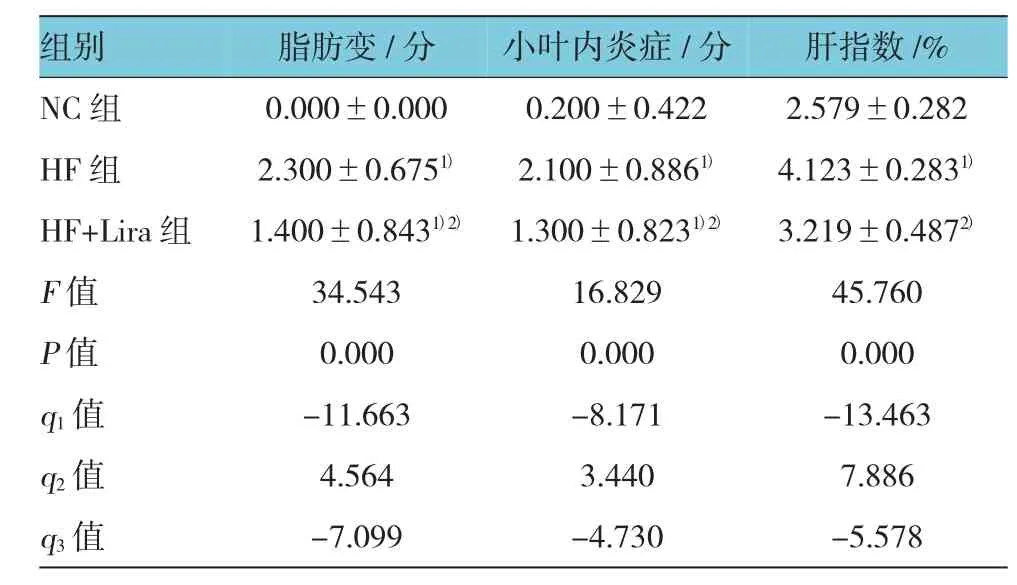
表1 各组大鼠肝脏脂肪变及炎症评分 (±s)
注:1)与NC组比较,P<0.05;2)与HF组比较,P<0.05;q1:NC组与HF组比较,q2:HF组与HF+Lira组比较,q3:NC组与HF+Lira组比较
组别N C组H F组H F + L i r a组F值P值q 1值q 2值q 3值脂肪变/分0 . 0 0 0 ± 0 . 0 0 0 2 . 3 0 0 ± 0 . 6 7 51)1 . 4 0 0 ± 0 . 8 4 31)2)3 4 . 5 4 3 0 . 0 0 0 -1 1 . 6 6 3 4 . 5 6 4 -7 . 0 9 9小叶内炎症/分肝指数/ % 0 . 2 0 0 ± 0 . 4 2 2 2 . 5 7 9 ± 0 . 2 8 2 2 . 1 0 0 ± 0 . 8 8 61) 4 . 1 2 3 ± 0 . 2 8 31)1 . 3 0 0 ± 0 . 8 2 31)2) 3 . 2 1 9 ± 0 . 4 8 72)1 6 . 8 2 9 4 5 . 7 6 0 0 . 0 0 0 0 . 0 0 0 -8 . 1 7 1 -1 3 . 4 6 3 3 . 4 4 0 7 . 8 8 6 -4 . 7 3 0 -5 . 5 7 8
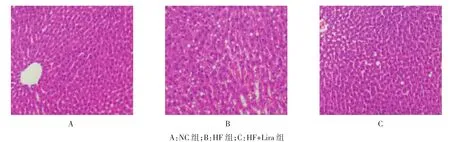
图1 各组大鼠肝组织病理学检查结果 (HE×100)
表2 各组大鼠血清IL-18、IL-10、TC及肝脏TG比较 (n=10,±s)
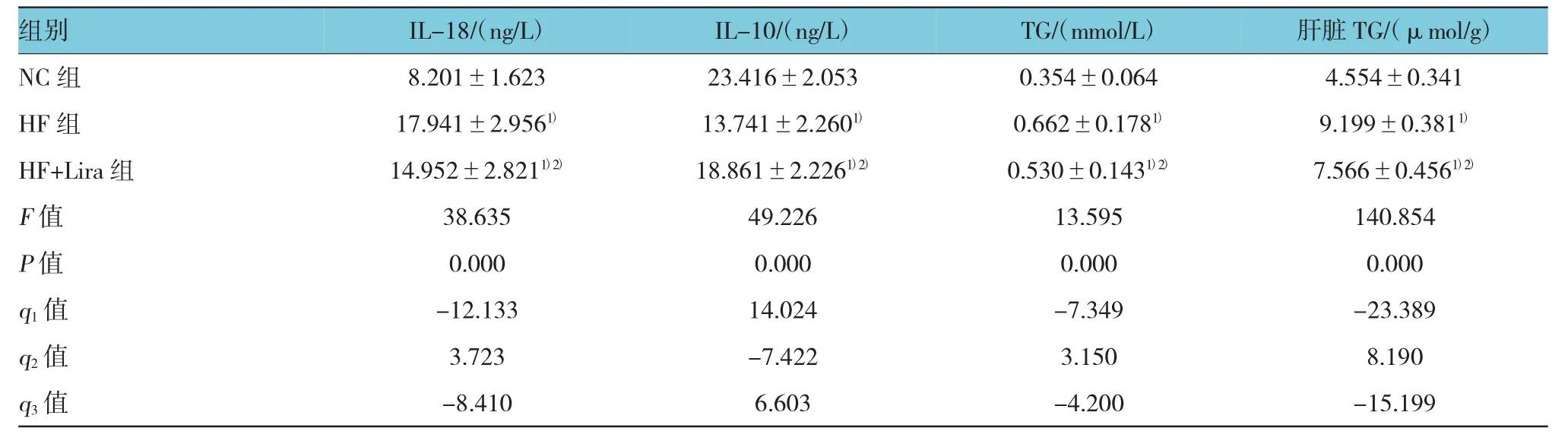
表2 各组大鼠血清IL-18、IL-10、TC及肝脏TG比较 (n=10,±s)
注:1)与NC组比较,P<0.05;2)与HF组比较,P<0.05;q1:NC组与HF组比较,q2:HF组与HF+Lira组比较,q3:NC组与HF+Lira组比较
组别I L -1 8 /(n g / L)I L -1 0 /(n g / L)T G /(m m o l / L)肝脏T G /(μ m o l / g)N C组 8 . 2 0 1 ± 1 . 6 2 3 2 3 . 4 1 6 ± 2 . 0 5 3 0 . 3 5 4 ± 0 . 0 6 4 4 . 5 5 4 ± 0 . 3 4 1 H F组 1 7 . 9 4 1 ± 2 . 9 5 61) 1 3 . 7 4 1 ± 2 . 2 6 01) 0 . 6 6 2 ± 0 . 1 7 81) 9 . 1 9 9 ± 0 . 3 8 11)H F + L i r a组 1 4 . 9 5 2 ± 2 . 8 2 11)2) 1 8 . 8 6 1 ± 2 . 2 2 61)2) 0 . 5 3 0 ± 0 . 1 4 31)2) 7 . 5 6 6 ± 0 . 4 5 61)2)F值 3 8 . 6 3 5 4 9 . 2 2 6 1 3 . 5 9 5 1 4 0 . 8 5 4 P值 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 q1值 -1 2 . 1 3 3 1 4 . 0 2 4 -7 . 3 4 9 -2 3 . 3 8 9 q2值 3 . 7 2 3 -7 . 4 2 2 3 . 1 5 0 8 . 1 9 0 q3值 -8 . 4 1 0 6 . 6 0 3 -4 . 2 0 0 -1 5 . 1 9 9
2.4大鼠FBG、FINS及HOMA-IR
HF组与NC组比较,差异具有统计学意义(P<0.05),HF组FBG、FINS及HOMA-IR水平升高;HF组+Lira与HF组比较,差异有统计学意义(P<0.05),HF+Lira组FBG、FINS及HOMA-IR水平降低。见表3。
2.5 IL-18、IL-10与肝脂肪变、肝小叶炎症及HOMA-IR的直线相关分析
血清IL-18水平与肝脂肪变、肝小叶炎症及HOMA-IR呈正相关(P<0.05);IL-10水平与肝脂肪变、肝小叶炎症及HOMA-IR呈负相关(P<0.05)。见表4。
表3 大鼠FBG、FINS及HOMA-IR比较 (n=10,±s)
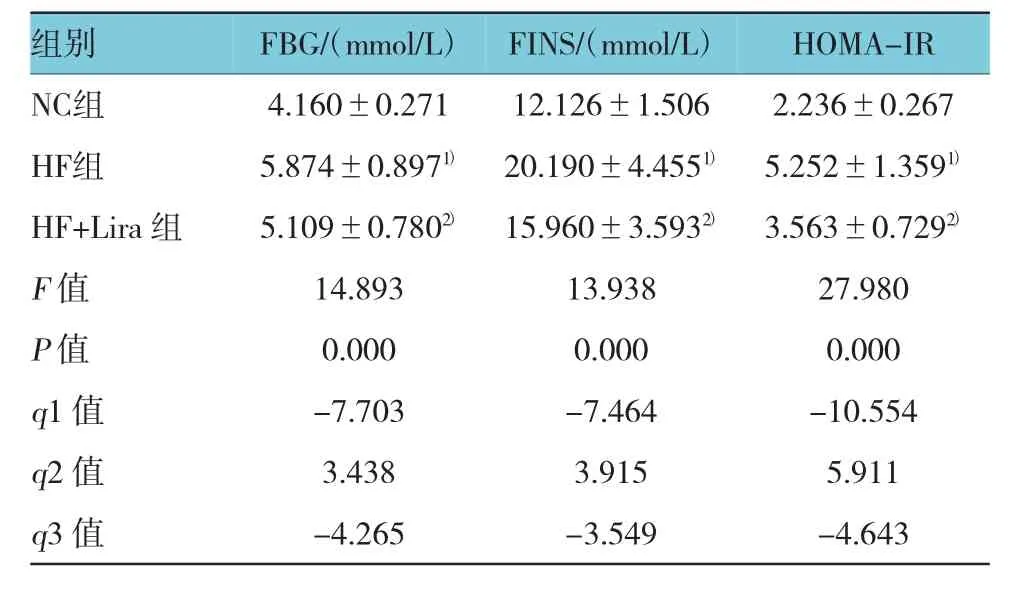
表3 大鼠FBG、FINS及HOMA-IR比较 (n=10,±s)
注:1)与NC组比较,P<0.05;2)与HF组比较,P<0.05;q1:NC组与HF组比较,q2:HF组与HF+Lira组比较,q3:NC组与HF+Lira组比较
组别F B G /(m m o l / L)F I N S /(m m o l / L)H O M A -I R N C组 4 . 1 6 0 ± 0 . 2 7 1 H F组 5 . 8 7 4 ± 0 . 8 9 71)H F + L i r a组 5 . 1 0 9 ± 0 . 7 8 02)1 2 . 1 2 6 ± 1 . 5 0 6 2 . 2 3 6 ± 0 . 2 6 7 2 0 . 1 9 0 ± 4 . 4 5 51) 5 . 2 5 2 ± 1 . 3 5 91)1 5 . 9 6 0 ± 3 . 5 9 32) 3 . 5 6 3 ± 0 . 7 2 92)F值 1 4 . 8 9 3 P值 0 . 0 0 0 q 1值 -7 . 7 0 3 q 2值 3 . 4 3 8 q 3值 -4 . 2 6 5 1 3 . 9 3 8 2 7 . 9 8 0 0 . 0 0 0 0 . 0 0 0 -7 . 4 6 4 -1 0 . 5 5 4 3 . 9 1 5 5 . 9 1 1 -3 . 5 4 9 -4 . 6 4 3
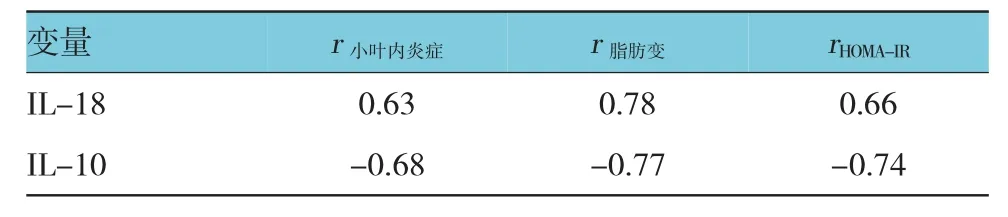
表4 IL-18、IL-10与肝脂肪变、肝小叶炎症及HOMA-IR的相关因素分析
3 讨论
NAFLD目前在我国已成为除病毒性肝炎外的第二大肝病,被认为是隐源性肝硬化的主要原因之一,其主要危害在于其增加了肝脏相关死亡率和心血管疾病风险。NAFLD的病理学特征是肝细胞大泡性脂肪变,NAFLD包括单纯性肝脂肪变,非酒精性脂肪性肝炎,肝纤维化以及肝硬化,甚至肝细胞癌。NAFLD的发病机制与胰岛素抵抗(IR)和代谢综合征(MS)密切相关。目前多数学者支持“二次打击”学说,第一次打击是指脂肪在肝脏的沉积,这一过程主要和IR有关。第二次打击是指以线粒体反应氧体系为核心的氧应激和脂质过氧化对肝脏造成的进一步损害。“二次打击”学说认为其发病可能主要有以下几种因素:IR、氧化应激、脂质过氧化。IR是NAFLD的始动因素,IR不仅参与首次打击,也参与第二次打击[3]。
细胞因子介导的炎症反应是NAFLD的重要发病机制之一,细胞因子通过干扰胰岛素的敏感性、促进炎症反应,参与NAFLD的发生发展。IL-18是一种促炎因子,1995年由OKAMURA等[4]在小鼠肝脏的Kupffer细胞中提纯得到,对γ-干扰素(IFN-γ)具有强烈的诱生作用。近年来的研究发现[5],IL-18也是一种脂肪细胞因子,脂肪组织是其重要来源之一。人类IL-18是由193个氨基酸组成的单链蛋白,它是一种缺乏信号肽、没有生物活性的前体多肽,经IL-1β转化酶剪切后成为有活性的IL-18。IL-18可由Kupffer细胞、Th1细胞、巨噬细胞和自然杀伤细胞(NK)等多种细胞产生,具有多种生物学活性。IL-18通过和IL-18受体结合,通过一系列途径使核因子κB激活,诱导靶基因表达,产生生物学效应。IL-18可以通过IRAK/TRAF-6途径诱导Th1细胞、NK细胞产生IFN-γ,并且能够增强NK细胞的细胞毒作用以及杀伤活性[6],它还可以促进TNF-α、IL-6等细胞因子的分泌增多,加剧了代谢紊乱和炎症反应,促进了NAFLD的发展。IL-18在IR中起重要作用,FISCHER等[7]的研究发现,人血清IL-18水平与IR密切相关,调节IL-18可改善IR。王伟占[8]等通过高脂喂养OLETF大鼠建立IR模型后发现其血清IL-18水平明显上升,且与HOMA-IR呈正相关。IL-18还可以通过参与肝脏的炎症反应,引起氧化应激、脂质过氧化,使肝细胞发生炎症、坏死甚至纤维化。周冬生等[9]的研究发现,NAFLD大鼠血清中IL-18水平升高,并且与肝脏炎症和脂肪变性呈正相关。大鼠注射IL-18和IL-12后,通过损伤肝脏线粒体功能介导了肝脏的炎症反应,导致了肝脏的脂肪变[10]。本研究通过高脂饮食复制NAFLD大鼠模型,HF组大鼠血清IL-18水平明显升高,与肝脏炎症及脂肪变程度呈正相关,与既往研究结果一致。HF组大鼠肝指数、肝脏TG、血清TG、FBG、FINS及HOMA-IR较对照组明显升高,IL-18水平与肝脂肪变、肝小叶炎症及HOMA-IR呈正相关,支持IL-18参与NAFLD的发病过程。
促炎因子的增多与抗炎因子的不足影响了NAFLD的进展[11]。IL-10是由Th2细胞产生的免疫调节因子,是体内重要的抗炎因子。IL-10通过抑制单核-巨噬细胞激活下调炎症反应,它还能抑制IL-1、IL-6、IL-18及TNF-α等炎症介质,减少炎症因子对肝脏的损伤。CINTRA等[12]通过高脂饮食诱导瑞士小鼠成为糖尿病和NAFLD模型,发现IL-10能够抑制炎症细胞因子的表达及胰岛素信号的转导,对肝脏是一种保护性因子。本研究显示,NAFLD大鼠IL-10水平降低,这表明细胞因子IL-10参与了NAFLD的发展。
本研究结果显示,应用Lira干预NAFLD大鼠后,血清IL-18水平降低,IL-10水平升高,大鼠肝指数、肝脏TG、血清TG、FBG、FINS及HOMA-IR较HF组明显降低,肝脏脂肪变及炎症改善。
综上所述,IL-18、IL-10参与了NAFLD的发生、发展,Lira可以调节NAFLD大鼠的炎症因子平衡,减轻胰岛素抵抗和炎症反应,减少肝脏脂质沉积,从而对NAFLD起到治疗作用。
[1]VAN-WAGNER L B,RINELLA M E.The role of insulin-sensitizing agents in the treatment of nonalcoholic steatohepatitis[J]. Therap Adv Gastroenterol,2011,4(4):249-263.
[2]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3): 163-166.
[3]LORIA P,LONARDO A,CARULLI N.Relative contribution of iron burden,HFE mutations,and insulin resistance to fibrosis in nonalcoholic fatty liver[J].Hepatology,2004,39(6):1749.
[4]OKAMURA H,TSUTSI H,KOMATSU T,et al.Cloning of a new cytokine that induces IFN-gamma production by T cells[J]. Nature,1995,378(6552):88-91.
[5]SKURK T,KOLB H,MULLER-SCHOLZE S,etal.The proatherogenic cytokine interleukin-18 is secreted by human adipocytes[J].Eur J Endocrinol,2005,152(6):863-868.
[6]HUANG Y,LEI Y,ZHANG H,et al.Role of interleukin-18 in human natural killer cell is associated with interleukin-2[J].Mol Immunol,2010,47(16):2604-2610.
[7]FISCHER C P,PERSTRUP L B,BERNTSEN A,et al.Elevated plasma interleukin-18 is a marker of insulin-resistance in type 2 diabetic and non-diabetic humans[J].Clin Immunol,2005,117 (2):152-160.
[8]王伟占,孙立亭,赵志强,等.胰岛素抵抗OLETF大鼠血清IL-18水平变化及替米沙坦的干预研究[J].天津医科大学学报,2015(2): 101-104.
[9]周冬生,梁志清,秦青,等.槲皮素对大鼠非酒精性脂肪性肝病的疗效及其机制[J].中华肝脏病杂志,2013,21(2):134-137.
[10]KANEDA M,KASHIWAMURA S,UEDA H,et al.Inflammatory liver steatosis caused by IL-12 and IL-18[J].J Interferon Cytokine Res,2003,23(3):155-162.
[11]ZHAN Y T,AN W.Roles of liver innate immune cells in nonalcoholic fatty liver disease[J].World J Gastroenterol,2010, 16(37):4652-4660.
[12]CINTRA D E,PAULI J R,ARAUJO E P,et al.Interleukin-10 is a protective factor against diet-induced insulin resistance in liver[J].J Hepatol,2008,48(4):628-637.
(张西倩 编辑)
Effect of Liraglutide on cytokines and rats with nonalcoholic fatty liver disease*
Hong-tao Hou1,Jia Feng2,Yan-mei Qiu3,Yi-ting Hu1,Yu-zhen Wang1
(1.Department of Gastroenterology,Hebei General Hospital,Shijiazhuang,Hebei 050051,China; 2.Department of Gastroenterology,Bethune International Peace Hospital of PLA,Shijiazhuang,
Hebei 050082,China;3.Department of Pediatrics,the Second Hospital of Hebei Medical University,Shijiazhuang,Hebei 050000,China)
nonalcoholic fatty liver;insulin resistance;Liraglutide;IL-18;IL-10
R575.5
A
2016-12-17
河北省卫生计生委基金资助项目(No:ZL20150117)
10.3969/j.issn.1005-8982.2017.19.002
1005-8982(2017)19-0007-05
Abstrct:Objective To investigate the effect of Liraglutide on cytokines and biochemical indexes in rats with nonalcoholic fatty liver disease.Methods Thirty-two male SD rats were randomly divided into normal control group (NC,10 rats),high fat group(HF,12 rats),HF+Lira group(10 rats).The HF group and the HF+Lira group were given high-fat diet for 16 weeks.After 12 weeks of high-fat feeding in the HF+Lira group,Liraglutide was administered 600 μg/(kg·d)by intraperitoneal injection for 4 weeks.At the end of the 16th week,the rats were sacrificed.The pathological changes of the liver were observed under optical microscope.The serum level of total triglyceride(TG)was detected by automatic biochemical analyzer.The serum levels of interleukin-18(IL-18),IL-10 and fasting insulin(FINS)were determined by ELISA,and insulin resistance index(HOMA-IR)was assessed by homeostasis mode assessment.TG content of the liver was measured by GPO-PAP method.TheFtest and SNK-qtest were used for statistical analyses.Results Compared with the NC group,the liver function indexes,the serum levels of IL-18 and TG,FBG,FINS and HOMA-IR in the HF group were obviously increased(P<0.05).Compared with the HF group,the liver function indexes,the serum levels of IL-18 and TG,FBG,FINS and HOMA-IR in the HF+Lira group were all obviously lowered(P<0.05).The serum level of IL-10 in the HF group was significantly lower than that in the NC group (P<0.05);the level of IL-10 in the HF+Lira group was significantly higher than that in the HF group(P<0.05).HOMA-IR,liver steatosis and hepatic lobular inflammation were positively correlated with the serum level of IL-18(P<0.05),but negatively correlated with the serum level of IL-10(P<0.05).Conclusions Liraglutide can regulate the balance of inflammatory cytokines in rats with nonalcoholic fatty liver disease,alleviate insulin resistance and inflammation,reduce lipid deposition in liver,thus has therapeutic effect on nonalcoholic fatty liver disease.

