腌腊肉制品中乳酸菌的筛选鉴定及其在腊肠中的应用
潘晓倩,成晓瑜,张顺亮,赵 冰,乔晓玲,陈文华,李家鹏,曲 超,王守伟*
腌腊肉制品中乳酸菌的筛选鉴定及其在腊肠中的应用
潘晓倩,成晓瑜,张顺亮,赵 冰,乔晓玲,陈文华,李家鹏,曲 超,王守伟*
(中国肉类食品综合研究中心,北京 100068)
为筛选适合传统腌腊肉制品的优良乳酸菌菌株,从多种农家自制传统腌腊肉制品中分离纯化出9株优势乳酸菌。通过发酵特性筛选,得到一株性状优良菌株10M-7,并制备该菌株的干粉发酵剂,以未接种发酵剂腊肠为对照,分析此发酵剂对腊肠感官品质和微生物变化的影响。结果表明,10M-7菌株具有良好的产酸特性和抑菌性能。根据形态学、生理生化特征和16S rRNA序列分析,鉴定其为植物乳杆菌,采用冷冻干燥法制备纯种发酵剂,并制作人工发酵腊肠。发酵剂组pH值在初期便迅速下降,且始终低于对照组;发酵剂组乳酸菌迅速生长繁殖,且葡萄球菌和大肠杆菌数量与对照组相比明显降低。感官评价表明,当添加量为104CFU/g原料肉时,能够很好地保持和改善产品风味,使产品整体感觉更好。
发酵剂;腌腊肉制品;乳酸菌;鉴定;应用
传统腌腊肉制品具有高盐和低水分活度的特点,便于贮藏,风味独特,营养价值高,是中国肉制品几千年制作经验与智慧的结晶。它属于自然条件下,经内源酶及特定有益微生物的作用,发生一系列生化变化而制成的一类发酵肉制品[1-2]。现阶段,我国传统腌腊肉制品生产仍然存在一些不可忽视的问题,如传统农家方式生产的腌腊肉制品周期长,其中微生物来源复杂,难以保障产品质量稳定,易受杂菌污染,而工业化生产腌腊肉制品为了提高生产效率,多采用快速烘干成熟法,丧失了腌腊肉制品的独特风味[3-4]。筛选优良发酵剂菌种并制备适用于腌腊肉制品发酵剂,实现对腌腊肉制品发酵过程的人工控制及工业化生产,不仅提高了产品食用安全性和风味质量,而且克服了自然发酵过程时间过长,难以控制的缺点。
早在20世纪30年代,美国就报道了发酵剂在香肠制作中的应用,如今,发酵肉制品在欧美有着广泛的消费市场,且在肉类工业中占据着独特的地位[5-6]。乳酸菌是最早从发酵肉制品中分离出来的微生物,是传统腌腊肉制品中重要的优势菌群,与产品品质有着密切的关联[7-8],近几年,也有一些从腌腊肉制品中筛选肉用乳酸菌发酵剂菌株的相关报道[4,9]。研究发现,乳酸菌可降低产品pH值,赋予产品特殊的发酵风味,改善组织质构,促进色泽与风味的形成[10-11]。同时,某些乳酸菌能产细菌素,抑制腐败菌和致病菌生长繁殖[12-14];降低产品中某些特定生物胺含量[15-17];降低胆固醇,抗氧化作用[18]等。但并非所有乳酸菌都适合做发酵剂菌种,研究发现不同种及不同菌株乳酸菌之间的性能差异对产品品质具有很大影响[5,19-20],因此真正适用于我国传统腌腊肉制品的性状优良菌株的选育是采用人工发酵方法提升腌腊肉制品产品品质的重要前提。本研究从多种农家自制,具有良好风味的传统腌腊肉制品中分离、筛选优势乳酸菌,旨在筛选出性状优良的野生乳酸菌菌种,并将筛选出的乳酸菌接种到腊肠中,制作人工接种发酵腊肠制品,对整个发酵成熟过程的微生物特性进行分析,并进行感官评价,为优良发酵剂的研制及优质腌腊肉制品的生产提供参考。
1 材料与方法
1.1 材料与试剂
菌株分离材料:农家自制传统腌腊肉制品采集自广西、湖南和四川3 个省区共20 种样品,包括腊肉、腊肠、酸肉等腌腊肉制品。
腊肠加工用猪后腿肉、猪背脂 北京二商大红门肉类食品有限公司;辅料:食盐、白砂糖和香辛料 中国肉类食品综合研究中心香辛料部。
培养基:MRS培养基、结晶紫中性红胆盐琼脂(violet red bile agar,VRBA)、甘露醇氯化钠琼脂培养基(mannitol and sodium chloride agar medium,MSA)、营养肉汤(nutrient broth,NB)、MRS肉汤 北京陆桥技术有限责任公司。改良MRS培养基:MRS培养基中添加质量分数6%NaCl和150 mg/kg的亚硝酸钠。
细菌基因组DNA提取试剂盒、2×Taq PCR MasterMix 天根生化科技有限公司;DNA Marker、溶菌酶 宝生物工程(大连)有限公司;通用引物27F(5’-AGAGTTTGATCMTGGCTCAG-3’)和1492R(5’-TACGGyTACCTTGTTACGACTT-3’) 上海立菲生物技术有限公司(北京);pH值精密试纸(pH 5.4~7.0);葡萄糖、亚硝酸钠、NaCl、KCl均为国产分析纯。
1.2 仪器与设备
生物安全柜 新加坡Esco公司;PB-10型数显酸度计、BSA822-CW型电子天平 赛多利斯科学仪器有限公司;G154DWS高压灭菌锅 致微(厦门)仪器有限公司;SCIENTZ-11L型无菌均质器 宁波新芝生物科技股份有限公司;VITEK 2 Compact全自动微生物鉴定仪及配套CBC鉴定卡片 北京威泰科生物技术有限公司;Primo Star生物显微镜 德国Zeiss公司;T100 Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc™ XR+凝胶成像系统 美国Bio-Rad公司;WH82绞肉机 德国赛德曼机械制造公司;OSCAR 20真空灌肠机 德国海因里希弗雷机械制造有限公司;DZ-600/2S型真空包装机 山东小康机械有限公司;水分活度仪 瑞士Novasina公司。
1.3 方法
1.3.1 乳酸菌分离纯化
在无菌条件下,取各样品25 g,剪碎,放入无菌均质袋中,加入225 mL无菌生理盐水,放于无菌均质器中拍打均质后根据需要进行梯度稀释[21]。取1 mL样品稀释液于无菌平板中,倒入改良的MRS培养基,混匀,凝固后置于37 ℃培养48 h,根据菌落形态、大小、透明度等挑取单菌落并反复划线纯化直至获得单菌株,挑取平板单菌落接种于MRS肉汤中,37 ℃、200 r/min振荡培养24 h,将培养液滴加到pH 5.4~7.0精密试纸上,选取试纸颜色变黄(pH值小于5.4)对应菌株进行革兰氏染色观察菌体形态,并保藏菌株[22]。
1.3.2 乳酸菌的筛选
根据发酵剂乳酸菌筛选标准进行以下筛选实验[4,23-24]:产酸特性实验、发酵葡萄糖产气实验、产黏实验、产H2S实验、牛津杯法抑菌实验(金黄色葡萄球菌和大肠杆菌)。
1.3.3 乳酸菌的鉴定
1.3.3.1 生理生化鉴定
用无菌棉签蘸取平板上纯菌落,制备2.7~3.3麦氏单位浓度的菌悬液,用VITEK 2 Compact及其配套CBC鉴定卡进行鉴定。
1.3.3.2 16S rRNA分子生物学鉴定
采用细菌基因组提取试剂盒提取细菌基因组DNA,并用0.8%琼脂糖凝胶电泳检测DNA提取质量和片段大小。采用通用引物27F和1492R,以基因组DNA为模板扩增16S rRNA序列。PCR体系(50 μL):DNA模板2 μL、引物27F和1492R各1 μL、2×Taq PCR MasterMix 25 μL、重蒸水21 μL;PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,35 个循环,72 ℃延伸10 min。PCR产物经凝胶电泳分析后,送英潍捷基贸易有限公司(北京)测序,应用BLAST程序将测序结果在GenBank基因数据库中进行同源性比较以鉴定菌种归属。
1.3.4 生长曲线及产酸能力测定
[22]的方法测定生长曲线及产酸能力。
1.3.5 干粉发酵剂的制备及活性测定
将新鲜菌液(浓度108~109CFU/mL)按2%的接种量转接至MRS肉汤培养基中,37 ℃、200 r/min振荡培养18~24 h,5 000 r/min离心15 min,弃上清液,加无菌生理盐水洗涤一次,离心弃上清液,加入原液体培养基体积1/10的生理盐水将菌体悬浮,备用。冻干小瓶中加入1 mL菌体悬浮液和质量分数10%的脱脂乳4 mL,混合均匀后,经过真空冻干制得菌粉。采用梯度稀释平板法测定冻干粉活性。
1.3.6 添加发酵剂腊肠的制备
加工工艺:原料肉(剔除结缔组织等)→绞肉(瘦肉与脂肪均使用8 mm孔径孔板)→加调味料和发酵剂搅拌混合(添加量分别为102、104、106、108CFU/g肉)→胶原蛋白肠衣灌制→23 ℃、相对湿度80%条件下发酵24 h→15 ℃、相对湿度85%条件下风干成熟→成品
对照组为未添加发酵剂的自然成熟腊肠,其他所有配方和加工工艺与添加发酵剂腊肠相同。
1.3.7 感官分析
腊肠成品真空包装后于室温(25 ℃)贮藏1 周平衡水分,再进行感官分析。选择15 位专业人员组成感官评定小组,将2 组腊肠蒸煮20 min,切成1.0 mm左右的薄片,通过盲评计分,就腊肠色泽、气味、滋味、组织结构和整体接受度5 方面打分,每项总分10 分,样品评定之间用清水漱口[25],评分标准见表1。

表1 感官评价标准Table 1 Criteria for sensory evaluation of sausage
1.3.8 水分含量与水分活度的测定
水分含量测定参照GB/T 9695.15—2008《肉与肉制品水分含量测定》进行;水分活度采用水分活度仪,测定6组,取平均值。
1.3.9 盐分测定
参照GB/T 9695.8—2008《肉与肉制品 氯化物含量测定》进行。
1.3.10 pH值和菌相变化分析
分别于腊肠制作第0、1、4、7、12天(成品)时取样进行pH值和菌相变化分析。
取腊肠不同部位若干块混合,均质,用pH计测定其pH值,每种样品设6 次平行重复[26]。无菌条件下取腊肠不同部位样品25 g放于225 mL无菌生理盐水中,均质后梯度稀释,接种于相应的选择性培养基中进行乳酸菌、葡萄球菌和大肠杆菌平板计数,每个实验设3 个重复。培养基和培养条件如表2所示[27]。

表2 菌相分析的培养基和培养条件Table 2 Selective media and incubation conditions used for bacterial isolation from sausages
1.4 数据统计分析
Excel 2007统计分析数据,计算标准差并制图。感官评价结果采用SPSS 17.0显著性差异分析。
2 结果与分析
2.1 乳酸菌的分离纯化和筛选
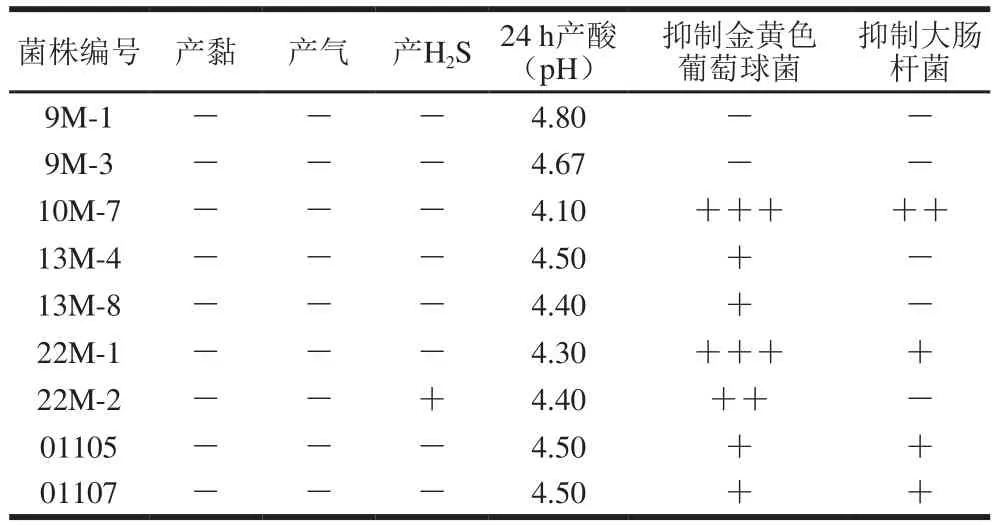
表3 9 个分离菌株的发酵特性Table 3 Fermentation characteristics of nine isolated strains
通过梯度稀释平板法和划线分离,从样品中分离出9 株耐受质量分数6% NaCl和150 mg/kg亚硝酸钠,且经24 h液体摇床培养pH值小于5.4的优势乳酸菌,其革兰氏染色均为阳性。菌株编号依次为9M-1、9M-3、10M-7、13M-4、13M-8、22M-1、22M-2、01105和01107。如表3所示,分离纯化得到的9株菌均不产黏,发酵葡萄糖不产气;产H2S实验中,只有22M-2菌株产H2S,因此22M-2菌株不适宜作为肉制品的发酵剂菌种。培养24 h的pH值由低到高依次为10M-7、22M-1、13M-8、22M-2、13M-4、01105、01107、9M-3、9M-1。这9 株乳酸菌对金黄色葡萄球菌和大肠杆菌抑制作用的强弱程度差别较大,其中菌株10M-7效果最好。
2.2 菌株10M-7的鉴定
2.2.1 形态学及生理生化鉴定
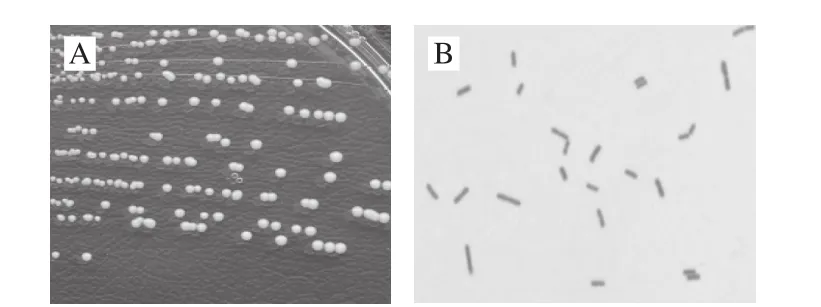
图1 10M-7的菌落形态(A)和革兰氏染色图(B)Fig. 1 Colony (A) and Gram-staining (B) of strain 10M-7
菌株10M-7来源于广西三江地区农家自制腊肉样品,观察图1发现,10M-7菌株在MRS培养基上生长良好,37 ℃培养24 h后形成直径约1 mm大小的圆形菌落,乳白色突起,表面湿润、有光泽,边缘整齐;革兰氏染色呈阳性,细胞杆状,单个、成对或链状排列,无芽孢,接触酶阴性,需进一步选取CBC鉴定卡进行生理生化鉴定。
经VITEK 2 Compact全自动微生物鉴定仪鉴定,10M-7株菌为植物乳杆菌(Lactobacillus plantarum),鉴定可信度达到95%,置信水平极好,该菌株的理化及酶学特性如表4所示。
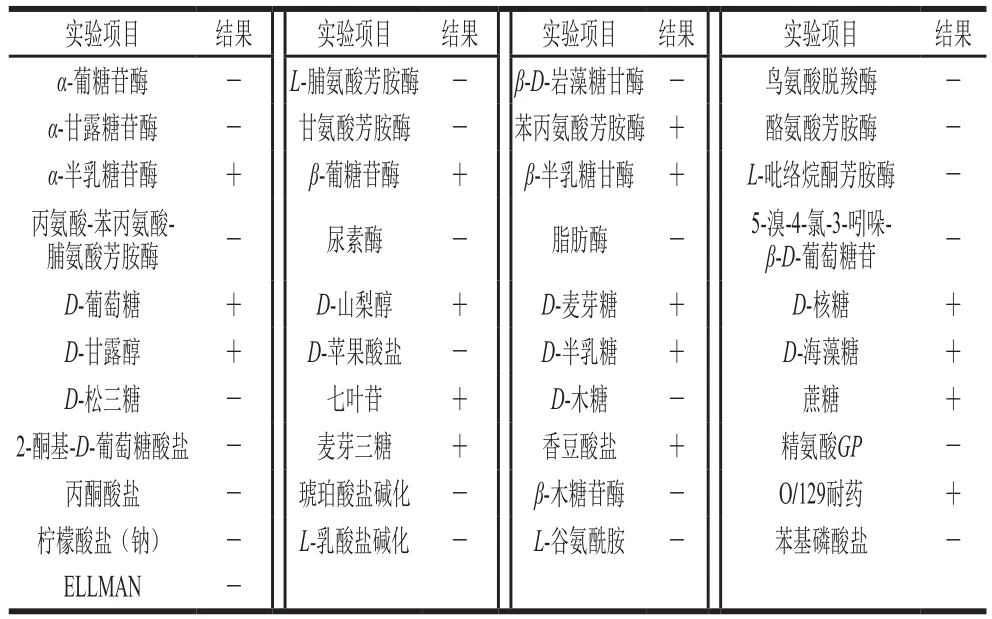
表4 菌株10M-7的生理生化鉴定结果Table 4 Identification of strain 10M-7 by CBC card
2.2.2 分子生物学鉴定
菌株10M-7的PCR产物凝胶电泳分析结果如图2,得到一条约1 500 bp的DNA片段,符合细菌16S rRNA序列长度,测序比对后发现,菌株10M-7的16S rRNA序列与GenBank中L. plantarum MH19登录号为FJ542291.1的序列同源性达到99%,因此,菌株10M-7的16S rRNA分子生物学鉴定结果为植物乳杆菌,这与生理生化鉴定结果一致。该菌株已于2015年9月8日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No. 11341。

图2 10M-7菌株16S rRNA基因PCR扩增结果Fig. 2 Agarose gel electrophoresis of PCR-amplified 16S rRNA gene of 10M-7
2.3 菌株的生长产酸特性

图3 菌株10M-7的生长曲线(A)和产酸能力(B)Fig. 3 Growth curve and acid-producing capacity of strain 10M-7
将菌株10M-7在MRS肉汤中培养,其生长曲线见图3A,0~2 h内为延滞期,时间较短;2~12 h内为对数生长期,此阶段OD600nm由0.153增加至1.924,活菌数由7.49(lg(CFU/mL))增加至9.17(lg(CFU/mL));12~30 h内是稳定期,之后为衰亡期。可见该菌株延滞期短,稳定期较长。产酸曲线见图3B,该菌株产酸能力较强,24 h内pH值由5.8下降至4.1,其中主要是对数生长期产酸较多。菌株生长快、pH值的迅速降低有利于在肉制品中的快速定殖、生长及产酸,从而抑制其他腐败微生物的生长,保证肉制品品质[28]。
2.4 乳酸菌10M-7制作人工发酵腊肠的应用效果
2.4.1 干粉发酵剂制备与活力测定
冷冻干燥法制得的干粉发酵剂为白色粉末,易溶于水,采用稀释平板法测得该发酵剂活力为4.75×1010CFU/g。根据原料肉质量,计算实验组中需添加的干粉发酵剂质量,使添加量依次为102、104、106、108CFU/g原料肉,未添加任何发酵剂的自然发酵腊肠为对照组。
2.4.2 感官分析
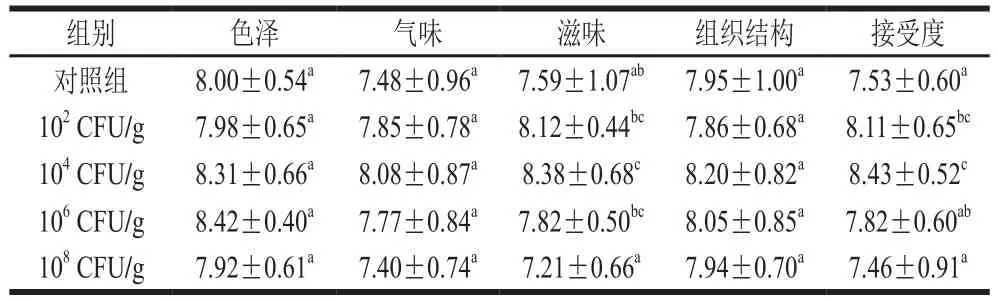
表5 感官评价结果Table 5 Results of sensory evaluation
如表5所示,发酵剂的添加对腊肠感官品质具有一定影响。对照组和添加发酵剂制作的人工发酵腊肠在色泽、气味和组织结构方面差异不显著,当乳酸菌添加量为104CFU/g时,产品滋味较好,不仅保持了传统腊肠特有的腊味,还具有发酵肉制品特有的香味,咸淡适中,酸味柔和,香味浓郁,整体评价得分最高。当添加量增加至106、108CFU/g时,滋味越来越酸,影响其整体接受度。因此,选择添加量为104CFU/g的发酵腊肠进行后续相关实验。
2.4.3 水分及盐含量变化
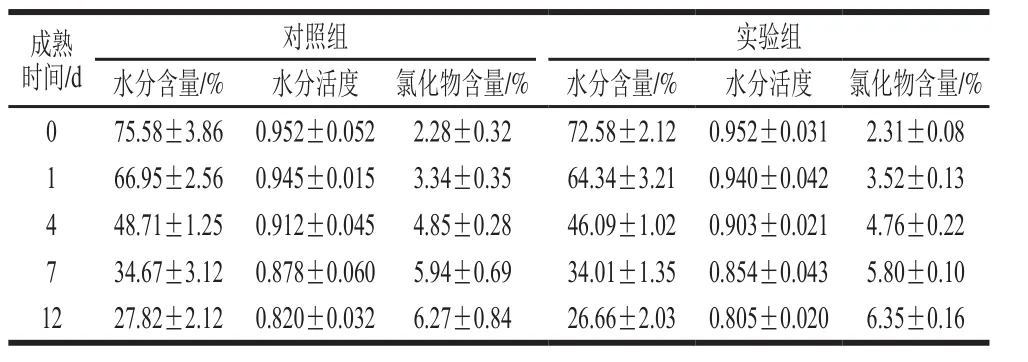
表6 腊肠制作过程中水分含量、水分活度和盐含量变化Table 6 Variations in water content, water activity and salt content during sausage production
如表6可知,随着腊肠发酵成熟过程的进行,水分含量和水分活度均呈持续下降的趋势,降低幅度差异不大,但添加发酵剂组腊肠的水分含量略低于对照组,水分活度下降更快。这可能与乳酸菌发酵产酸导致产品pH值下降有关,pH值的降低导致肌肉蛋白质保水能力减弱,风干速率加快[27]。随着水分的丧失,盐含量在成熟过程中逐渐增加,对照组和实验组差异不大,盐含量的提高有利于病原菌及腐败菌的抑制。
2.4.4 pH值变化
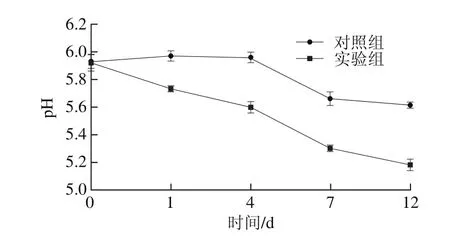
图4 腊肠制作过程中pH值变化Fig. 4 Changes in pH value during sausage production
由图4可知,对照组和添加发酵剂的实验组pH值均呈现下降趋势,但下降幅度不同。对照组腊肠的pH值在0~4 d略有上升,之后缓慢下降,这可能是因为自然发酵前期,乳酸菌生长缓慢,而此时内源蛋白酶降解肉蛋白产生非蛋白氮[29],后期乳酸菌繁殖产酸导致pH值降低。添加发酵剂的腊肠pH值在发酵成熟初期便迅速下降,0~7 d其pH值由5.92下降至5.30,这是由于人工添加发酵剂后,乳酸菌在初期便具有生长优势,经过短时间的适应后便大量繁殖产酸,后期7~12 d其pH值由5.30下降至5.18,降幅变缓,可能是因为随着风干成熟过程的进行,其水分活度降低,抑制了乳酸菌的繁殖。
2.4.5 菌相变化分析

图5 腊肠制作过程中菌相变化Fig. 5 Changes in bacterial populations during sausage production
图5为添加发酵剂腊肠与对照组腊肠在整个制作过程中乳酸菌、葡萄球菌和大肠杆菌的数量变化情况。乳酸菌在0~7 d增长速率较快,7~12 d变化较平稳,且添加发酵剂的实验组腊肠中乳酸菌在初期增加较快,其含量始终高于对照组。葡萄球菌和大肠杆菌的变化基本呈现先增加然后趋于稳定,后期略有下降的趋势。且发酵剂组中葡萄球菌和大肠杆菌的增长幅度和总量都低于对照组,这主要是由于添加发酵剂组腊肠中乳酸菌增殖速率快,很快成为优势菌种,竞争性抑制了其他微生物的生长,同时乳酸菌繁殖产生大量乳酸,产品pH值下降,也会抑制葡萄球菌和大肠杆菌的繁殖[30-31]。
3 结 论
从多种农家自制的传统腌腊肉制品中分离纯化出9 株耐受质量分数6% NaCl和150 mg/kg亚硝酸钠的优势乳酸菌,通过研究其生长产酸特性及抑菌特性等,从中筛选得到1 株性状优良的乳酸菌10M-7,通过形态学、生理生化和分子鉴定确定该菌株为植物乳杆菌(L. plantarum)。通过冷冻干燥制得该菌株的纯种发酵剂,并制作人工发酵腊肠,以未添加发酵剂的传统腊肠作为对照,实验发现,该发酵剂的添加能迅速降低产品发酵初期pH值,有效减少发酵成熟过程中大肠杆菌和葡萄球菌数量;水分含量、水分活度和盐含量与对照组相比无明显变化。感官评价显示,当添加量为104CFU/g原料肉时,腊肠成熟后,不仅保持了传统腊肠特有的风味,还具有发酵肉制品特有气味。产品色泽、风味、组织结构各方面的评分与对照相比均无显著性差异,且滋味方面,发酵剂组被描述为咸淡适中,酸味柔和,香味浓郁,较好地保持和改善了产品风味,整体感觉更好。
因此,实验中分离得到的植物乳杆菌适合作为传统腊肠的发酵剂菌株,提高了产品的食用安全性,很好地保持和改善了产品风味,为传统腊肠乃至传统腌腊肉制品发酵剂的研制提供了一定的实验基础。关于该菌株在其他传统腌腊肉制品中的应用及与其他菌种结合开发复配发酵剂还需进一步研究。
参考文献:
[1] 唐静, 张迎阳, 吴海舟, 等. 传统腌腊肉制品挥发性风味物质的研究进展[J]. 食品科学, 2014, 35(15): 283-288. DOI:10.7506/spkx1002-6630-201415057.
[2] WANG X H, REN H y, LIU D y, et al. Effects of inoculating Lactobacillus sakei starter cultures on the microbiological quality and nitrite depletion of Chinese fermented sausages[J]. Food Control, 2013, 32(2): 591-596. DOI:10.1016/j.foodcont.2013.01.050.
[3] 王虎虎, 刘登勇, 徐幸莲, 等. 我国传统腌腊肉制品产业现状及发展趋势[J]. 肉类研究, 2013, 27(9): 36-40.
[4] 帅瑾. 传统自然发酵四川香肠中乳酸菌的分离、鉴定及其应用[D].雅安: 四川农业大学, 2013: 2-12.
[5] AMMOR M S, MAyO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: an update[J]. Meat Science, 2007, 76(1): 138-146. DOI:10.1016/ j.meatsci.2006.10.022.
[6] 龙强, 聂乾忠, 刘成国. 发酵肉制品功能性发酵剂研究现状[J].食品科学, 2016, 37(17): 263-269. DOI:10.7506/spkx1002-6630-201617044.
[7] 陈韵, 胡萍, 湛剑龙, 等. 我国传统发酵肉制品中乳酸菌生物多样性的研究进展[J]. 食品科学, 2013, 34(13): 302-306. DOI:10.7506/ spkx1002-6630-201313064.
[8] LIU S N, HAN y, ZHOU Z J. Lactic acid bacteria in traditional fermented Chinese foods[J]. Food Research International, 2011, 44(3): 643-651. DOI:10.1016/j.foodres.2010.12.034.
[9] LANDETA G, CURIEL J A, CARRASCOSA A V, et al. Technological and safety properties of lactic acid bacteria isolated from Spanish drycured sausages[J]. Meat Science, 2013, 95(2): 272-280. DOI:10.1016/ j.meatsci.2013.05.019.
[10] LÓPEZ C, MEDINA L M, PRIEGO R, et al. Behaviour of the constitutive biota of two types of Spanish dry-sausages ripened in a pilot-scale chamber[J]. Meat Science, 2006, 73(1): 178-180. DOI:10.1016/j.meatsci.2005.10.014.
[11] COPPOLA R, GIAGNACOVO B, IORIZZO M, et al. Characterization of lactobacilli involved in the ripening of soppressata molisana, a typical southern Italy fermented sausage[J]. Food Microbiology, 1998, 15(3): 347-353. DOI:10.1006/fmic.1997.0179.
[12] GAO y R, LI D P, LIU X y. Bacteriocin-producing Lactobacillus sakei C2 as starter culture in fermented sausages[J]. Food Control, 2014, 35(1): 1-6. DOI:10.1016/j.foodcont.2013.06.055.
[13] 张小美, 楼秀玉, 顾青. 1 株产细菌素乳酸菌的鉴定和细菌素的分离纯化[J]. 中国食品学报, 2013, 13(12): 181-187. DOI:10.16429/j.1009-7848.2013.12.039.
[14] SWETWIWATHANA A, VISESSANGUAN W. Potential of bacteriocin-producing lactic acid bacteria for safety improvements of traditional Thai fermented meat and human health[J]. Meat Science, 2015, 109: 101-105. DOI:10.1016/j.meatsci.2015.05.030.
[15] 孙霞, 杨勇, 巩洋, 等. 发酵香肠中生物胺控制技术的研究进展[J]. 食品工业科技, 2015, 36(11): 373-388. DOI:10.13386/ j.issn1002-0306.2015.11.068.
[16] TOSUKHOWONG A, VISESSAGUAN W, PUMPUANG L, et al. Biogenic amine formation in Nham, a Thai fermented sausage, and the reduction by commercial starter culture, Lactobacillus plantarum BCC 9546[J]. Food Chemistry, 2011, 129: 846-853. DOI:10.1016/ j.foodchem.2011.05.033.
[17] ZHANG Q L, LIN S L, NIE X H. Reduction of biogenic amine accumulation in silver carp sausage by an amine-negative Lactobacillus plantarum[J]. Food Control, 2013, 32(2): 496-500. DOI:10.1016/j.foodcont.2013.01.029.
[18] 丁苗, 刘洋, 葛平珍, 等. 发酵酸肉中降胆固醇乳酸菌的筛选、鉴定及降胆固醇作用[J]. 食品科学, 2014, 35(19): 203-207. DOI:10.7506/ spkx1002-6630-201419041.
[19] LEE J y, KIM C J, KUNZ B. Identification of lactic acid bacteria isolated from kimchi, and studies on their suitability for application as starter culture in the production of fermented sausages[J]. Meat Science, 2006, 72(3): 437-445. DOI:10.1016/j.meatsci.2005.08.013.
[20] ADAB S E, ESSID I, HASSOUNA M. Microbiological, biochemical and textural characteristics of a Tunisian dry fermented poultry meat sausage inoculated with selected starter cultures[J]. Journal of Food Safety, 2014, 35(1):75-85. DOI:10.1111/jfs.12164.
[21] 国家质量监督检验检疫总局. 肉与肉制品 取样方法: GB/T 9695.19—2008[S]. 北京: 中国标准出版社, 2008.
[22] 潘晓倩, 赵燕, 张顺亮, 等. 中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J]. 食品科学, 2016, 37(7): 93-98. DOI:10.7506/ spkx1002-6630-201607018.
[23] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 117-124.
[24] RUBIO R, JOFRE A, MARTIN B, et al. Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter cultures for fermented sausages[J]. Food Microbiology, 2014, 38(4): 303-311. DOI:10.1016/j.fm.2013.07.015.
[25] 国家质量监督检验检疫总局. 中式香肠: GB/T23493—2009[S].北京: 中国标准出版社, 2009.
[26] 国家质量监督检验检疫总局. 肉与肉制品 pH测定: GB/T 9695.5—2008[S]. 北京: 中国标准出版社, 2008.
[27] 孔保华, 夏让, 夏秀芳, 等. 直投式发酵剂制备的哈尔滨风干肠在成熟过程中的理化及微生物特性变化[J]. 食品工业科技, 2012, 33(8): 168-175. DOI:10.13386/j.issn1002-0306.2012.08.063.
[28] BONOMO M G, RICCIARDI A, ZOTTA T, et al. Molecular and technological characterization of lactic acid bacteria from traditional fermented sausages of Basilicata region (Southern Italy)[J]. Meat Science, 2008, 80(4): 1238-1248. DOI:10.1016/j.meatsci.2008.05.032.
[29] CEBALLOS L S, MORALES E R, DE LA TORRE ADARVE A, et al. Composition of goat and cow milk produced under similar conditions and analyzed by identical methodology[J]. Journal of Food Composition & Analysis, 2009, 22(4): 322-329. DOI:10.1016/ j.jfca.2008.10.020.
[30] KOLOZyN-KRAJEWSKA D, DOLATOWSKI Z. Probiotic meat products and human nutrition[J]. Process Biochemistry, 2012, 47(12): 1761-1772. DOI:10. 1016/j.procbio.2012.09.017.
[31] SHAH N, JELEN P. Survival of lactic acid bacteria and their lactases under acidic conditions[J]. Journal of Food Science, 1990, 55(2): 506-509. DOI:10.1111/j.1365-2621.1990.tb06797.x.
Screening and Identification of Lactic Acid Bacteria from Cured Meat Product and Its Application in Sausage
PAN Xiaoqian, CHENG Xiaoyu, ZHANG Shunliang, ZHAO Bing, QIAO Xiaoling, CHEN Wenhua, LI Jiapeng, QU Chao, WANG Shouwei*
(China Meat Research Center, Beijing 100068, China)
In order to screen lactic acid bacterial strains (LAB) with good performance for the fermentation of traditional cured meat products, nine strains of LAB were isolated and purified from home-made cured meat products. Out of these nine isolates, strain 10M-7 was selected for its good fermentation properties and it was prepared into a starter culture by freezedrying method. Effects of the starter culture on sensory quality and microbial growth in fermented sausage were examined using naturally fermented sausage without any starter cultures as a control. The results showed that strain 10M-7 had good acid production performance and antibacterial properties, and it was identified as Lactobacillus plantarum according to its morphological, physiological and biochemical characteristics and 16S rRNA sequence alignment. The pH value of LAB-fermented sausage decreased apparently during the early fermentation period, which was always lower than that of the control. LAB in artificially fermented sausage grew rapidly and the numbers of Staphylococcus and Escherichia coli were significantly lower than those in the control group. Addition of the starter culture at 104CFU/g raw meat could retain and improve the flavor of sausages so that the group exhibited better overall sensory acceptance.
starter culture; traditional cured meat products; lactic acid bacteria; identification; application
10.7506/spkx1002-6630-201716009
TS251.1
A
1002-6630(2017)16-0057-07
潘晓倩, 成晓瑜, 张顺亮, 等. 腌腊肉制品中乳酸菌的筛选鉴定及其在腊肠中的应用[J]. 食品科学, 2017, 38(16): 57-63. DOI:10.7506/spkx1002-6630-201716009. http://www.spkx.net.cn
PAN Xiaoqian, CHENG Xiaoyu, ZHANG Shunliang, et al. Screening and identification of lactic acid bacteria from cured meat product and its application in sausage[J]. Food Science, 2017, 38(16): 57-63. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716009. http://www.spkx.net.cn
2016-11-03
公益性行业(农业)科研专项(201303082)
潘晓倩(1987—),女,工程师,硕士,研究方向为微生物与肉制品质量安全。E-mail:go_ahead123@163.com *通信作者:王守伟(1961—),男,教授级高级工程师,硕士,研究方向为肉品加工技术。E-mail:cmrcwsw@126.com

