小檗碱对代谢综合征肾损害CHOP mRNA、GRP78 mRNA和炎症因子的影响
陈小青 付婷婷 黄春来 张 勇 庄永泽 王丽萍
小檗碱对代谢综合征肾损害CHOP mRNA、GRP78 mRNA和炎症因子的影响
陈小青 付婷婷 黄春来 张 勇 庄永泽 王丽萍
目的:观察小檗碱对代谢综合征合并肾损害患者C/EBP同源蛋白(C/EBP homology protein,CHOP)mRNA、糖调节蛋白78(glucose-regulated protein 78,GRP78)mRNA表达和炎症因子的影响,探讨小檗碱对保护代谢综合征合并肾损害的分子生物学机制。 方法:收集2015年2月至2015年12月福州总医院肾内科临床诊断符合代谢综合征合并肾损害的患者20例,随机分为治疗组10例(给予盐酸小檗碱300 mg,3次/d);对照组10例(采用常规西药治疗)。疗程8周,观察两组治疗前、治疗4周、8周后尿微量白蛋白/肌酐比值(U-mAlb/C)、血清肌酐(SCr)及尿素氮(BUN)的变化。采用RT-PCR法检测尿液中CHOP mRNA、GRP78 mRNA的表达;采用ELISA法检测血清中白细胞介素8(IL-8)、肿瘤坏死因子α(TNF-α)的含量。 结果:治疗8周后,对照组和治疗组尿微量白蛋白/肌酐比值分别较治疗前下降(P<0.05)。与对照组比较,治疗组尿微量白蛋白/肌酐比值下降更明显(P<0.05)。两组治疗前后SCr及BUN水平无显著性差异。治疗8周后,治疗组尿液CHOP mRNA、GRP78 mRNA的表达及血清IL-8、TNF-α的含量均较治疗前显著降低(P<0.05),对照组治疗前后差异无统计学意义;与对照组比较,治疗组尿液CHOP mRNA、GRP78 mRNA的表达及血清IL-8、TNF-α的含量均下降更明显(P<0.05)。 结论:小檗碱可减少代谢综合征合并肾损害患者的白蛋白尿,降低肾脏组织过度激活的内质网应激反应,改善炎症状态。
代谢综合征 内质网应激 肾脏损害 小檗碱 炎症因子
代谢综合征作为现代社会的一个重大健康危机,胰岛素抵抗为其共同病理基础。目前内质网应激正成为代谢综合征和/(或)胰岛素抵抗分子机制中新的研究热点[1-3]。越来越多研究结果表明,代谢综合征能引起及加重肾脏损害[4-5],内质网应激反应是代谢综合征肾损害的重要发病机制之一[6]。我们前期的研究发现,以果糖喂养建立大鼠代谢综合征模型,电镜下可见肾小管上皮细胞肿胀,内质网减少甚至消失,支持内质网应激是引起代谢综合征肾脏损害的重要机制之一。故针对内质网应激的治疗可能是一个新的治疗方向。
近年来研究发现小檗碱对改善代谢综合征、糖尿病肾病有较好疗效[7-8]。我们前期基础研究通过果糖诱导刺激人肾小管上皮细胞凋亡,观察到小檗碱可下调糖调节蛋白78(GRP78)、C/EBP同源蛋白(CHOP)的表达,通过抑制过度激活的内质网应激反应,拮抗肾小管上皮细胞凋亡。因此,我们推测小檗碱对代谢综合征肾损害的保护作用可能是通过内质网应激途径实现的。故本文拟观察盐酸小檗碱对代谢综合征合并肾损害患者内质网应激相关因子GRP78 mRNA及CHOP mRNA表达及炎症因子的影响,从而探讨其保护肾损害的分子生物学机制,为小檗碱在临床的应用提供依据。
对象和方法
研究对象 收集2015年2月至2015年12月在福州总医院肾内科经临床诊断符合代谢综合征合并肾损害患者20例。
纳入标准 (1)符合代谢综合征诊断标准;(2)年龄18~60周岁;(3)尿微量白蛋白/肌酐范围在30~200 mg/mmol;(4)血清肌酐(SCr)≤176.8 μmol/L;(5)肾损害病史出现在代谢综合征之后;(6)愿意在我院接受治疗和接受随访并签署知情同意书。
排除标准 (1)对小檗碱过敏者;(2)在12个月内使用糖皮质激素的患者;在8周内开始使用肾素-血管紧张素系统(RAS)阻断剂者;(3)合并糖尿病急性并发症(急性感染、低血糖、酮症酸中毒、高渗性昏迷及乳酸性酸中毒);(4)1型糖尿病、妊娠糖尿病;(5)肾病综合征;(6)急性肾功能不全;(7)妊娠或哺乳期妇女;(8)合并严重感染、严重心、脑、肝和造血系统疾病及精神病患者。
诊断标准 代谢综合征的诊断:参照中华医学会糖尿病分会(CDS)2004年标准[9]。慢性肾脏病诊断标准:根据2002年美国肾脏病基金会的肾脏病预后质量倡议(Kidney Disease Outcomes Quality Initiative,K/DOQI)提出的慢性肾脏病的定义[10]。
退出标准 (1)治疗期间出现过敏或发生不良事件,持续超过7d,无法继续试验:ALT和AST>正常值上限的2倍;SCr>176.8 μmol/L;白细胞<3.0×109/L,或中性粒细胞<1.5×109/L;(2)研究者认为,严重违背方案(患者不能遵循研究流程及用药要求、用药依从性过低、擅自应用降低小檗碱疗效的含鞣质的中药);(3)患者连续7d由于各种原因(如感染等)未按方案服用小檗碱;(4)治疗过程中出现病情恶化,经判断须停止临床试验者;(5)患者在临床试验过程中出现证型改变,不适于继续使用小檗碱者;(6)患者在研究期间不愿继续进行临床试验。
治疗方法 对照组在接受健康教育,饮食控制基础上,给予氯沙坦钾片(杭州默沙东制药有限公司生产,国药准字H20000371) 100 mg/次,1次/d,治疗组在对照组治疗的基础上,加服盐酸小檗碱(山东仁和堂药业有限公司生产,国药准字H37022610)300 mg/次,3次/d,均签署知情同意书。两组均连续服药8周,在治疗前和治疗后4、8周分别观察疗效。
实验方法
标本的采集及处理 嘱患者访视前一天20:00后禁食禁水,访视当天留取清洁中段晨尿15 ml,然后低温离心后提取RNA。采集患者访视当天的空腹静脉血液标本5 ml,低速离心分离出患者的血清(常温,3 000 r/min,5 min),放入-80℃冰箱保存。
标本检测方法
尿液 CHOP mRNA、GRP78 mRNA测定 采用RT-PCR法进行操作:Trizol提取尿RNA,反转录酶逆转录RNA为cDNA,在PCR仪上进行扩增。GRP78引物序列为:上游5′-TTCTTCAATGGCAAGGAACC-3′下游5′-TGACACCTCCCACAGTTCA-3′,产物长度为634 bp,退火温度为58℃,经35个循环;CHOP引物序列为:上游5′-CATCACCACACCTGAAAGCA-3′ 下游5′-GGTACCCCCATTTTCATCTG-3′,产物长度620 bp,退火温度为58℃,35个循环;内参β-actin引物序列为:上游5′-GTCAGAAGGACTCCTACGTG -3′ 下游5′-TAGGAGCCAGGGCAGTAATC-3′,产物长度825 bp,退火温度为58℃,35个循环。PCR产物在1.0%琼脂糖上进行凝胶电泳。应用凝胶成像系统摄取所需各样品电泳图。通过Image J图像分析软件将各样品电泳图转换为灰度值。平均灰度值=目的基因吸光度值(A)/β-actin吸光度值。
血清IL-8、TNF-α的含量的测定 采用ELISA法进行操作,所有操作均按试剂盒内所附说明书进行。
观察指标 观察两组患者治疗前(T0)、治疗后4周(T1)、8周(T2)的尿微量白蛋白/肌酐比值、SCr及尿素氮(BUN)。收集两组患者治疗前、治疗后4周、8周晨尿,用逆转录-聚合酶链反应(reversetranscription-polymerase chain reaction,RT-PCR)法检测尿液中CHOP mRNA、GRP78 mRNA的表达;收集两组患者血清,采用酶联免疫(enzyme-linked immunosorbent assay,ELISA)法检测血清白细胞介素8(IL-8)、肿瘤坏死因子α(TNF-α)的含量。试验结束后,观察到两组均未出现明显血常规、肝功能、电解质、血糖、血脂及心电图异常。两组均无严重不良事件发生。
统计学方法 采用SPSS 18.0软件进行分析。符合正态分布的计量资料用均数±标准差表示,计数资料以例数和百分比表示,采用卡方检验。组间比较采用t检验或秩和检验,组内比较采用单因素方差分析及秩和检验,P<0.05为差异具有统计学意义。
结 果
一般资料 将20例患者按首次就诊顺序进行编号,随机抽取奇数编号中的10例为对照组,其余10例为治疗组。患者一般资料情况见表1,两组比较无统计学意义(P>0.05),具有可比性。

表1 两组一般资料情况
BMI:体质量指数;MS:代谢综合征
治疗前后尿微量白蛋白/肌酐比值及肾功能 治疗8周后,对照组和治疗组尿微量白蛋白/肌酐比值分别较治疗前下降(7.37±3.14) mg/mmol、(24.74±19.29) mg/mmol(P<0.05)。其下降幅度两组比较差异有显著性(P<0.05)(见图1)。两组治疗4周、8周间的差异无显著性(P>0.05)。与对照组比较,治疗组尿微量白蛋白/肌酐比值明显下降(P<0.05)。两组治疗前后SCr及BUN水平无显著性差异(表2)。
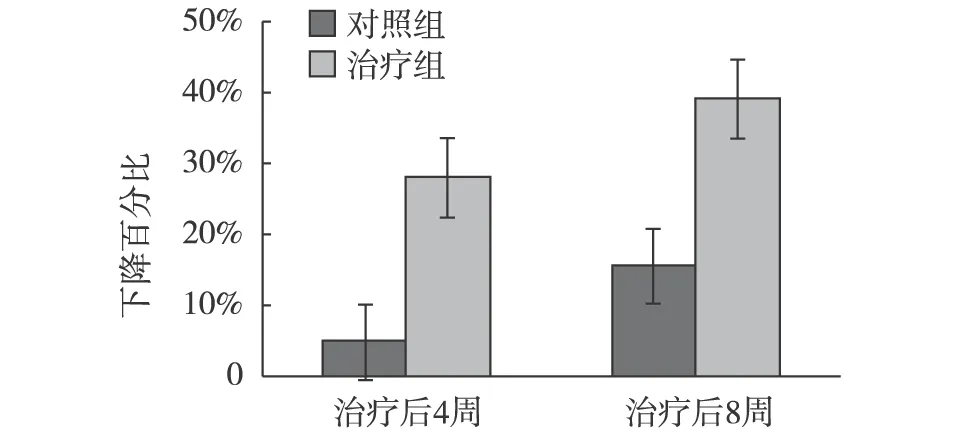
图1 两组治疗后尿微量白蛋白/肌酐比值下降百分比

表2 两组治疗前后尿微量白蛋白/肌酐比值及肾功能比较±s)
T0:治疗前;T1;治疗后4周;T2:治疗后8周;*:与治疗前比较,P<0.05,△:与对照组比较,P<0.05
治疗前后尿液GRP78 mRNA、CHOP mRNA的平均灰度值 治疗前后尿液中GRP78 mRNA、CHOP mRNA的电泳结果(图2),随着治疗时间的延长,治疗组尿液GRP78 mRNA、CHOP mRNA表达量均逐渐减少。

图2 两组尿液GRP78 mRNA、CHOP mRNA的表达T0:治疗前;T1;治疗后4周;T2:治疗后8周;GRP78:糖调节蛋白78;CHOP:C/EBP同源蛋白
治疗8周后,治疗组尿液GRP78 mRNA、CHOP mRNA较治疗前明显下降(P<0.05),对照组尿液GRP78 mRNA、CHOP mRNA治疗前后无统计学差别;治疗组中治疗8周尿液GRP78 mRNA、CHOP mRNA水平低于治疗4周(P<0.05),对照组中治疗4周、8周之间无统计学差异;与对照组比较,治疗组尿液中GRP78 mRNA、CHOP mRNA明显下降(P<0.05)(图3)。
治疗前后血清IL-8、TNF-α的含量比较 治疗8周后,治疗组血清IL-8、TNF-α较治疗前下降(P<0.05),对照组血清IL-8、TNF-α治疗前后无统计学差别;两组治疗4周、8周之间差异均不具有显著性。两组血清IL-8、TNF-α下降幅度差异有显著性(表3)。

图3 两组尿液GRP78 mRNA和CHOPmRNA灰度值变化T0:治疗前;T1;治疗后4周;T2:治疗后8周;*:与治疗前比较,P<0.05;△:与对照组比较,P<0.05;#:组内治疗8周与4周相比,P<0.05
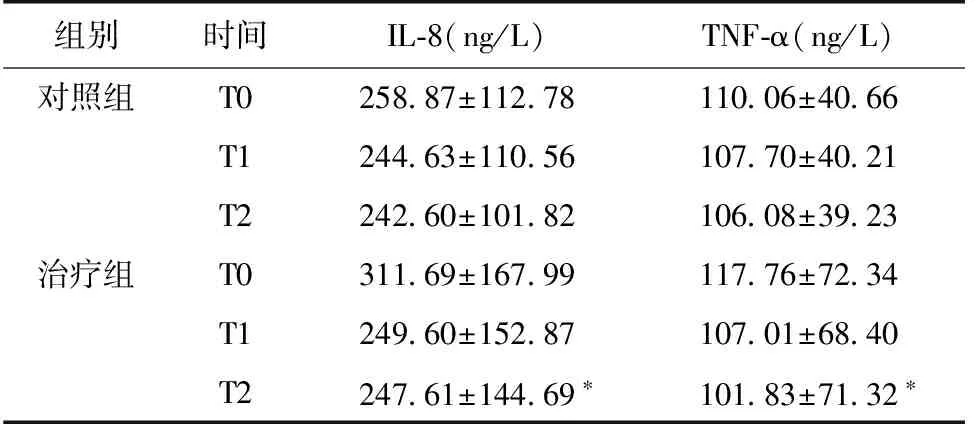
表3 两组治疗前后血清IL-8、TNF-α含量的变化
T0:治疗前;T1;治疗后4周;T2:治疗后8周;IL-8:白细胞介素8;TNF-α:肿瘤坏死因子α;*:与治疗前比较,P<0.05。该表比较采用秩和检验
讨 论
研究发现小檗碱不仅在治疗代谢综合征方面效果好,而且具有保护肾脏的作用[7]。小檗碱可通过激活Nrf2通路和抑制转化生长因子β/Smad/上皮细胞-间充质转化信号活动通路改善糖尿病肾病的肾小管间质纤维化[8]。本研究应用小檗碱治疗代谢综合征合并肾脏损害,发现其可明显减少此类患者临床尿白蛋白的排泄,进一步支持小檗碱在保护肾脏方面具有潜在作用。
越来越多研究表明,代谢综合征能引起及加重肾脏损害。关于代谢综合征引起肾损害的基础研究相对较少,发病机制尚不明确,可能涉及内质网应激、氧化应激、高胰岛素血症、RAS激活、肥胖、高血压、脂代谢紊乱、微炎症状态、凝血异常等因素[6,11-12]。其中,炎症反应的激活可能为其损伤机制之一。IL-8和TNF-α是在炎症反应中释放较早的两种内源性介质,在细胞分化和凋亡等过程中起着重要作用[13]。TNF-α可诱导IL-1、IL-6、白三烯等炎症介质的合成,促进免疫炎症反应进展,并能刺激系膜细胞的增殖,促进肾单位受损和肾小球硬化[14]。IL-8可使中性粒细胞趋化,加强炎症反应。炎症刺激肾小管上皮细胞分泌释放更多的免疫介质和细胞因子,使肾间质单核-巨噬细胞聚集,导致间质纤维化。本研究表明小檗碱可减少血清中TNF-α和IL-8含量,减轻炎症反应,因此推断小檗碱明显减少代谢综合征合并肾损害患者临床尿白蛋白的排泄可能部分通过促炎症和纤维变性反应达到保护肾脏的作用。
内质网应激作为近年的研究热点,其与炎症反应的关系也引起广泛关注。GRP78和CHOP都是内质网应激的重要标志性因子,GRP78是内质网应激的标志性蛋白[15],其表达可反映内质网的启动和稳态调节能力[16],CHOP通路是内质网应激介导细胞凋亡的通路之一[17],在内质网应激诱导细胞凋亡中发挥重要作用[18]。当发生内质网应激时,原来与GRP78结合处于失活状态的3个内质网应激跨膜蛋白均被激活,并启动一系列的炎症通路,参与炎症通路的基因表达,包括IL-8和TNF-α[19]。Wang等[20]通过体外实验发现,内质网应激的减弱及胰岛素传导信号的增强与小檗碱的作用有关。Wang等[21]通过体内外研究证实,小檗碱能下调GRP78、CHOP蛋白的表达,缓解内质网应激,起到保护足细胞的作用。本研究发现小檗碱可明显降低代谢综合征肾损害患者尿液中GRP78 mRNA、CHOP mRNA的表达,效果明显优于对照组且观察到随着用药时间的推移,GRP78 mRNA、CHOP mRNA的表达不断下降,对照组则无显著改变,表明小檗碱可降低肾组织过度激活的内质网应激状态。当机体内细胞发生内质网应激反应时,表达增多的GRP78可通过内质网跨膜蛋白IRE-l、PERK及ATF6这三条途径启动其下游的信号分子CHOP蛋白的表达,并使其不断地增加而介导细胞凋亡[22]。
本研究虽证实小檗碱可降低代谢综合征合并肾损害患者尿液GRP78 mRNA、CHOP mRNA的表达,但其作用机制具体是通过抑制已激活的某一条途径还是整体作用于三条途径而达到缓解机体内质网应激的作用,本研究尚无法确定。因此有待进一步研究选择各条途径内相关因子进行观察研究,以明确小檗碱降低过度激活的内质网应激状态的确切途径。另外,本研究未能同时检测GRP78、CHOP蛋白的表达情况,因此无法说明执行蛋白表达量与GRP78 mRNA、CHOP mRNA表达量是否成线性关系,有待进一步检验;本研究病例数较少,仍需大样本的研究数据支持。
综上所述,本研究应用小檗碱治疗代谢综合征合并肾损害,显示小檗碱明显减少患者临床尿白蛋白的排泄,其可能部分通过降低肾组织过度激活的内质网应激反应或改善炎症状态从而对代谢综合征合并肾损害达到保护作用。
1 Ozcan U,Cao Q,Yilmaz E,et al.Endoplasmic reticulum stress links obesity,insulin action,and type 2 diabetes.Science,2004,306(5695):457-461.
2 Ozcan U,Yilmaz E,Ozcan L,et al.Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes.Science,2006,313(5790):1137-1140.
3 Hirosumi J,Tuncman G,Chang L,et al.A central role for JNK in obesity and insulin resistance.Nature,2002,420(6913):333-336.
4 Chen J,Muntner P,Hamm LL,et al.The metabolic syndrome and chronic kidney disease in U.S.adults.Ann Intern Med,2004,140(3):l67-174.
5 Kurella M,Lo JC,Chertow GM.Metabolic syndrome and the risk for chronic kidney disease among nondiabetic adults.J Am Soc Nephro1,2005,16(7):2l34-2l40.
6 National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification and stratification.Am J Kidney Dis,2002,39(2 Suppl 1):Sl-266.
7 Zinszner H,Kuroda M,Wang X,et al.CHOP is implicated in programmed cell death in response to impaired function of the endoplasmic reticulum.Genes Dev,1998,12(7):982-995.
8 Zhang X,He H,Liang D,et al.Protective Effects of Berberine on Renal Injury in Streptozotocin (STZ)-Induced Diabetic Mice,2016,17(8):1327-1342.
9 Sharkey D,Fainberg HP,Wilson V,et al.Impact of early onset obesity and hypertension on the unfolded protein response in renal tissues of juvenile sheep.Hypertension,2009,53(6):925-931.
10 中华医学会糖尿病学分会代谢综合征研究协作组.中华医学会糖尿病学分会关于代谢综合征的建议.中华糖尿病杂志,2004,12(3):156-161.
11 Lastra G,Manrique C,McFarlane SI,et al.Cardiometabolic syndrome and chronic kidney disease.Curr Diab Rep,2006,6(3):207-212.
12 Li Z,Woollard JR,Wang S,et al.Increased glomerular filtration rate in early metabolic syndrome is associated with renal adiposity and microvascular proliferation.Am J Physiol Renal Physiol,2011,301(5):F1078-1087.
13 Navarro-González JF,Mora-Fernández C,Muros de Fuentes M,et al.Inflammatory molecul-es and pathways in the pathogenesis of diabetic nephropathy.Nat Rev Nephrol,2011,7(6):327-340.
14 Fernández-Real JM,Vendrell J,García I,et al.Structural damage in diabetic nephropathy is associated with TNF-α system activity.Acta Diabetol,2012,49(4):301-305.
15 Mu YP,Ogawa T,Kawada N.Reversibility of fibrosis,inflammation,and endoplasmic reticulum stress in the liver of rats fed a methionine-choline-deficient diet.Lab Invest,2010,90(2):245-256.
16 Li C,Harada A,Oh Y.IGFBP-3 sensitizes antiestrogen-resistant breast cancer cells through interaction with GRP78.Cancer Lett,2012,325(2):200-206.
17 Walter P,Ron D.The unfolded protein response:from stress pathway to homeostatic regulation.Science,2011,334(6509):1081-1086.
18 Dong B,Zhou H,Han C,et al.Ischemia/reperfusion-induced CHOP expression promotes apoptosis and impairs renal function recovery:the role of acidosis and GPR4.PLoS One,2014,9(10):e110944.
19 Hotamisligil GS.Endoplasmic reticulum stress and the inflammatory basis of metabolic disease.Cell,2010,140(6):900-917.
20 Wang ZS,Lu FE,Xu LJ,et al.Berberine reduces endoplasmic reticulum stress and improves insulin signal transduction in hep g2 cells.Acta Pharmacol Sin,2010,31(5):578-584.
21 Wang B,Xu X,He X,et al.Berberine Improved Aldo-Induced Podocyte Injury via Inhibiting Oxidative Stress and Endoplasmic Reticulum Stress Pathways both In Vivo and In Vitro.Cell Physiol Biochem,2016,39(1):217-228.
22 Gorbatyuk MS,Gorbatyuk OS.The molecular chaperone GRF78/BiP as a therapeutic target for neurodegenerative disorders:a mini review.J Genet Syndr Gene Ther,2013,4(2):128.
(本文编辑 逸 沐)
Effect of Berberine on expression of CHOP mRNA, GRP78mRNA and inflammatory cytokines in patients with metabolic syndrome and renal damage
CHENXiaoqing,FUTingting,HuangChunlai,ZHANGYong,ZHUANGYongze,WANGLiping
DepartmentofNephrologyofFuzhouGeneralHospital,Fuzhou350025,China
WANGLiping(E-mail:wanglp306@126.com)
Objective:To investigate the effects of berberine(BBR) on the expression of CHOP mRNA, GRP78 mRNA and inflammatory cytokines in patients with metabolic syndrome complicated with renal damage, and to explore the molecular mechanism of BBR in the metabolic syndrome with renal damage. Methodology:Twenty patients with metabolic syndrome complicated with renal damage were enrolled into this study. They were randomly divided into treatment group of 10 cases were given berberine 300 mg, 3 times/day, and other 10 cases in control group were treated by routine medicine. The therapeutic course for both groups was 8 weeks. The indexes of efficacy including microalbumin/creatinine ratio (U-mAlb/C), serum creatinine (SCr) and urea nitrogen (BUN) were observed. RT-PCR was used to detect the expression of CHOP mRNA and GRP78 mRNA in urine, and the content of interleukin (IL)-8 and tumor necrosis factor (TNF)-alpha in serum were detected by ELISA. Results:After treatment for 8 weeks, the U-mAlb/C in the control group and the treatment group was lower than that before treatment (P<0.05). Compared with the control group, the U-mAlb/C in the treatment group was decreased more significantly (P<0.05). There was no significant difference between the two groups before and after treatment of SCr and BUN (P>0.05). After 8 weeks of treatment, Urine CHOP mRNA, GRP78 mRNA expression and the contentof serum IL-8 and TNF-α in the treatment group were significantly lower than that before treatment, the difference was statistically significant (P<0.05), the control group before and after treatment there was no statistically significant difference (P>0.05). Compared with control group, urine CHOP mRNA, GRP78 mRNA expression and the content of serum IL-8 and TNF-α in treatment group was decreased obviously (P<0.05). Conclusion:Berberine can reduce albuminuria in patients with metabolic syndrome and renal damage, its molecular mechanism may be related to reduce the excessive activation of endoplasmic reticulum stress response and improve the state of inflammation.
Metabolic Syndrome Endoplasmic Reticulum Stress Renal Damage Berberine Inflammatory Cytokines
10.3969/j.issn.1006-298X.2017.04.007
国家自然基金面上项目(81373837);福建省自然科学基金(2014J01371)
福州总医院肾内科 福建医科大学福总临床医学院(福州,350025)
王丽萍(E-mail:wanglp306@126.com)
2016-12-13
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有

