吲哚菁绿荧光实时成像技术在机器人肝切除中的初步应用(附二例报告)
陈琳 罗鸿萍 朱鹏 李玕勋 陈伟勋 廖威 王宇蔚 张必翔 陈孝平
·论 著·(技术前沿)
吲哚菁绿荧光实时成像技术在机器人肝切除中的初步应用(附二例报告)
陈琳 罗鸿萍 朱鹏 李玕勋 陈伟勋 廖威 王宇蔚 张必翔 陈孝平
目的 探讨吲哚菁绿荧光实时成像技术在机器人辅助腹腔镜肝切除中应用的可行性。方法 回顾性分析华中科技大学同济医学院附属同济医院2017年8月使用吲哚菁绿荧光实时成像技术行机器人肝切除的2例病人的临床资料。病例1原发性肝癌拟行机器人辅助腹腔镜肝8段切除,术前超声引导下经皮肝穿刺肝8段门静脉分支,注射吲哚菁绿染色剂;术中利用PINPOINT荧光显象系统确定切除边界并引导离断肝实质。病例2肝右叶海绵状血管瘤,术中经门静脉注入吲哚菁绿染色剂,对血管瘤进行负染,确定血管瘤边界,引导离断肝脏实质。结果 病例1肝脏8段包膜及肝实质在PINPOINT系统中均呈现绿色荧光,与周围肝组织界限清晰,离断肝实质过程中可根据荧光指引肝切除平面,完整切除肝脏8段。病例2肝血管瘤无荧光染料滞留,与周围呈绿色荧光的肝组织界限清晰,在荧光指引下准确找到血管瘤包膜,并完整剜除。上述病人术中无大出血,术后恢复顺利,无并发症发生。结论 吲哚菁绿荧光实时成像系统应用于机器人辅助腹腔镜肝切除手术是安全有效的。
机器人肝切除; 荧光成像; 吲哚菁绿
肝切除是治疗各种肝脏良恶性肿瘤的首选方法[1]。确定准确的肝切除范围是成功实施肝切除手术的先决条件。恶性肿瘤通常采取基于肝段的解剖性肝切除,其关键在于确定切除肝段的范围[2];而良性肝肿瘤为尽量减少正常肝实质的损失,沿肿瘤边界局部切除即可,其关键在于肿瘤边界的准确定位。基于吲哚菁绿(indocyanine green, ICG)荧光实时成像系统可帮助外科医生通过肉眼判断肝段范围、肿瘤边界及隐匿的肿瘤病变,已广泛应用于开腹和腹腔镜肝切除手术。但在机器人辅助腹腔镜肝切除手术(robotic-assisted laparoscopic hepatectomy, RALH)未见报道,其原因是RALH仅在少数大型医疗中心开展[3-4],目前还没有专门针对机器人手术的荧光成像设备。同济医院肝脏外科中心在近期利用腹腔镜荧光成像系统PINPOINT,成功实施了两例RALH,现将初步结果报告如下。
病 例 资 料
例1(实时肝段区域染色):男,55岁,增强CT提示肝脏8段7.3 cm×5.3 cm肿瘤性病变,考虑原发性肝细胞癌(hepatocellular carcinoma,HCC)(图1A)。三维重建[5]可见肝脏位于肝中静脉及肝右静脉之间,紧邻8段肝蒂(图1B)。超声可见肝脏右叶一大小6.8 cm×6.4 cm低回声区,考虑肿瘤病变。甲胎蛋白(α-fetoprotein,AFP):2.87 μg/L,糖类抗原19-9(CA19-9):9.16 U/ml,乙肝表面抗原(+),HBV-DNA:2.05×102U/ml,肝功能Child-Pugh分级为A级,吲哚菁绿15 min(ICG15 min)清除率为2.37%。肺部CT、心肺功能无明显异常。初步诊断为原发性肝癌。既往有高血压病史10年,服用硝苯地平缓释片及阿司匹林,血压控制在正常范围,术前1周停用阿司匹林。
手术方法:病人全麻插管后,在超声引导下经皮穿刺肝脏8段门静脉分支,置入18 G穿刺针,缓慢注入5 ml吲哚菁绿溶液(0.4 mg/ml),注射全程在超声检测下进行,以防染料反流入其他肝段门静脉(图1C)。手术过程:①常规置入机器人器械(da Vinci Surgical System),辅助孔置入荧光成像系统(NOVADAQ PINPOINT)镜头;②关闭机器人自带冷光源,通过PINPOINT视野观察可见绿色荧光标记的肝脏8段范围(图1D),并使用超声刀予以标记;③在机器人视野下超声刀结合射频止血系统[6]沿标记线离断肝脏实质,间断使用PINPOINT系统确定切面准确位置(图1E)。
例2(肝海绵状血管瘤负染):女,53岁,右上腹持续胀痛1年余。本院CT及超声均提示肝右叶巨大海绵状血管瘤,胆囊多发结石(图2A)。三维重建提示肝脏8段巨大海绵状血管瘤(图2B):AFP、CEA、CA19-9均为阴性,乙肝表面抗原(+),肝功能Child-Pugh分级为A级,心肺功能无明显异常,无特殊既往史。初步诊断为肝脏巨大海绵状血管瘤,胆囊多发结石。决定行肝脏海绵状血管瘤切除+胆囊切除。手术方法:病人常规麻醉,消毒铺巾后置入机器人器械,切除胆囊,解剖第一肝门,显露门静脉,使用18 G穿刺针穿刺门静脉,缓慢注入5 ml吲哚菁绿溶液(0.4 mg/ml)。手术过程:①PINPOINT视野下,正常肝脏组织显示绿色荧光,血管瘤为负染,无荧光,与正常组织界限清晰,可轻易标记(图2C)。②机器人视野下沿预切除线离断肝脏实质,找到血管瘤包膜,超声刀结合射频止血系统沿包膜完整切除血管瘤(图2D)。
结 果
例1:注射吲哚菁绿染料后,在PINPOINT镜头下可见肝脏8段表面呈现明显的绿色荧光,沿荧光边界确定手术切面,离断肝实质后切除侧肝断面可见绿色荧光,保留侧肝脏断面无荧光。在荧光成像系统间断指引下,完整切除肝脏8段。手术时间4 h,术中阻断第一肝门2次,分别为15 min和10 min,术中出血300 ml。病人术后恢复顺利,术后3 d拔除腹腔引流管,5 d出院。病理诊断为中低分化肝细胞癌。
例2:由于肝海绵状血管瘤组织内无正常肝细胞组织,无吲哚菁绿染料滞留,在PINPOINT视野下无荧光。周围肝组织呈现明显的绿色荧光。二者之间有明显的分界线。在荧光成像系统指引下,完整切除肝脏血管瘤,手术时间3.5 h,术中阻断第一肝门一次,共20 min,术中出血250 ml。病人术后恢复顺利,术后2 d排气排便,3 d拔除引流管,5 d出院。病理诊断:肝海绵状血管瘤,胆囊结石,慢性胆囊炎。
讨 论
肝段间并没有明确的肉眼可见的解剖界限,因此明确肝段边界是实施解剖性肝切除的关键步骤。目前常用的方法主要是:①采用肝表面标记及术中超声确定重要血管走行,大致估计手术切除范围[7];>②阻断目标肝段的入肝血流,通过缺血线确定肝段范围;③穿刺目标肝段的门静脉,注入亚甲蓝染料,通过染色范围确定肝段界线[8-9]。但第一种方法确定的切除范围并不准确,后两种方法标记后在肝脏包膜表面分界比较明显,在肝脏实质内很难通过肉眼辨别颜色差异,因此一旦进入深部肝脏实质,难以界定准确的切除平面。吲哚菁绿是一种近红外荧光染料,可被波长750~810 nm的红外光激发,发射波长840 nm左右的近红外光,生物安全性好,可被肝细胞特异性摄取并通过胆汁排泄[10-12]。自Gotoh等[13]2009年首次报道将吲哚菁绿荧光成像技术应用与肝细胞癌切除术以来,已逐渐广泛应用于开腹和腹腔镜肝脏切除手术,吲哚菁绿荧光染色既可以外周静脉注射帮助确定肿瘤边缘,寻找隐匿病灶[9,14],也可通过门静脉属支注射正染或反染肝段指导解剖性肝切除[15]。机器人辅助腹腔镜肝切除刚刚兴起,荧光成像技术应用尚无相关报道。我们近期对荧光成像技术在机器人肝切除术中的应用进行了初步探索,体会如下:①对于解剖性肝段切除手术,荧光显象技术可以使标记肝段边界很好的可视化,突出的优点是离断深部肝实质时仍然可显示清晰荧光,并不受出血及组织焦痂的影响。可实时对手术切除平面进行修正。②由于其血供及组织学特性,吲哚菁绿难以滞留在海绵状血管瘤组织中。因此通过门静脉注入吲哚菁绿后,肝脏组织呈现绿色荧光而血管瘤无染色,达到了切除目标负染的效果,也可清晰引导术中寻找血管瘤包膜,避免切破引起大出血。③开腹手术时可行术中超声引导穿刺门静脉属支[15],但有时气腹状态下性超声穿刺肝段门静脉较为困难,可在气腹建立前经皮穿刺注射染料,更为便捷。
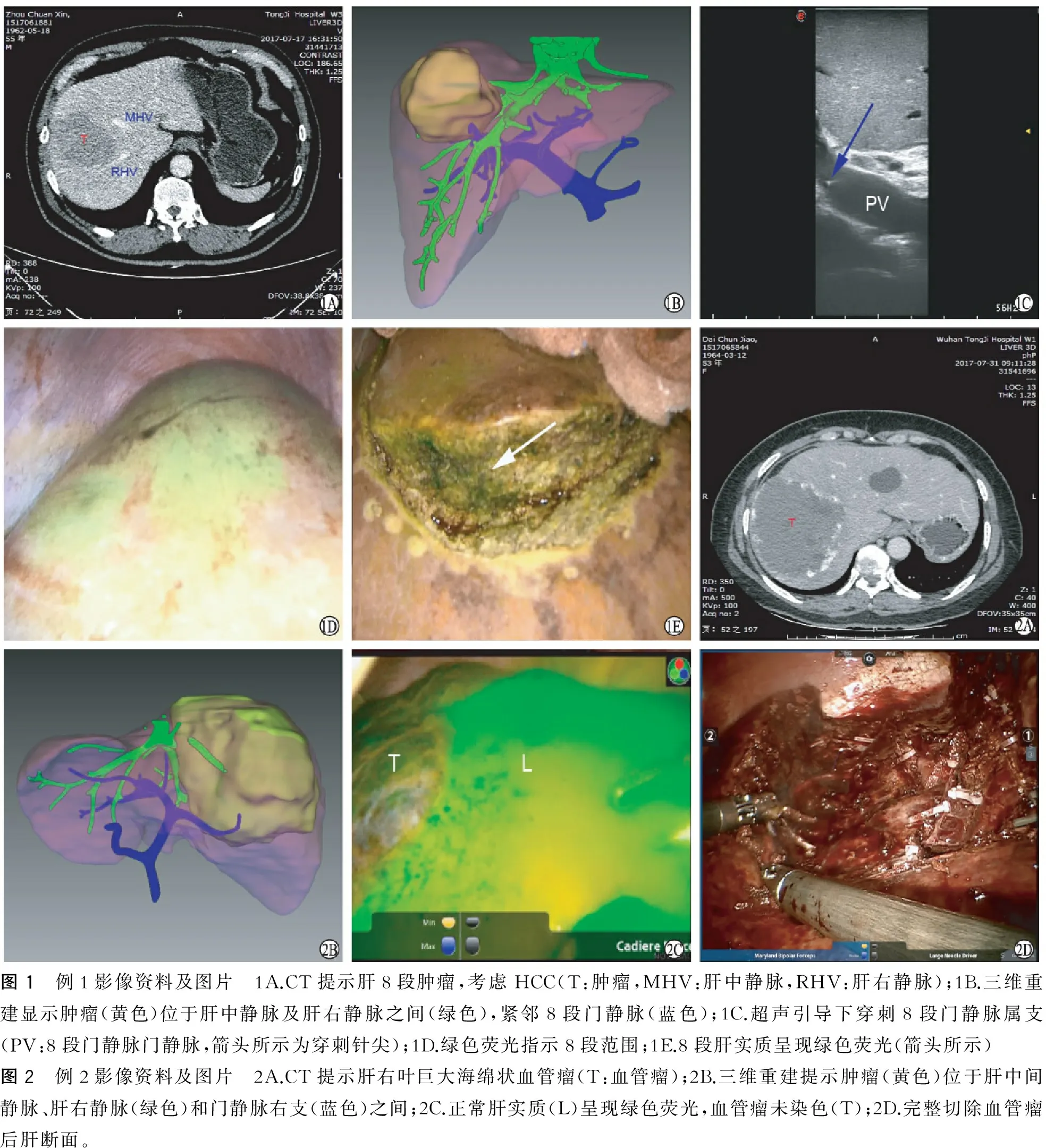
图1 例1影像资料及图片 1A.CT提示肝8段肿瘤,考虑HCC(T:肿瘤,MHV:肝中静脉,RHV:肝右静脉);1B.三维重建显示肿瘤(黄色)位于肝中静脉及肝右静脉之间(绿色),紧邻8段门静脉(蓝色);1C.超声引导下穿刺8段门静脉属支(PV:8段门静脉门静脉,箭头所示为穿刺针尖);1D.绿色荧光指示8段范围;1E.8段肝实质呈现绿色荧光(箭头所示)图2 例2影像资料及图片 2A.CT提示肝右叶巨大海绵状血管瘤(T:血管瘤);2B.三维重建提示肿瘤(黄色)位于肝中间静脉、肝右静脉(绿色)和门静脉右支(蓝色)之间;2C.正常肝实质(L)呈现绿色荧光,血管瘤未染色(T);2D.完整切除血管瘤后肝断面。
综上所述,吲哚菁绿荧光成像系统在机器人辅助肝切除术中可以帮助确定肝段边界,并可实时修正,达到真正的解剖性肝段切除。同时可以对海绵状血管瘤进行负染,对确定血管瘤边界有较大帮助。该技术的其他优势及局限性有待大样本病例的临床研究。
1 陈孝平,张志伟.《肝细胞癌外科治疗方法的选择专家共识》解读.中华外科杂志,2017,55:7-10.DOI:10.3760/cma.j.issn.0529-5815.2017.01.003.
2 蔡守旺,吕文平,杨世忠,等.持久亚甲蓝染色法在肝细胞癌合并胆管癌栓解剖性肝切除术中的应用.中华外科杂志,2012,50:502-504.DOI:10.3760/cma.j.issn.0529-5815.2012.06.008.
3 曹利,李建伟,陈健,等.机器人辅助腹腔镜肝切除35例分析.实用医院临床杂志 2015:19-22.DOI:10.3969/j.issn.1672-6170.2015.01.007.
4 周宁新,刘全达,陈军周,等.机器人肝切除术:附17例报告.外科理论与实践,2011,16:526-530.DOI:1007-9610(2011)06.0526.0.
5 陈琳,罗鸿萍,董水林,等.三维重建技术在评估大肝癌手术安全性中的作用.中华外科杂志, 2016,54:669-674.DOI:10.3760/cma.j.issn.0529-5815.2016.09.005.
6 陈琳,董水林,陈姚,等.射频止血系统在肝切除术中的应用(附65例报告).腹部外科, 2017,30:188-191.DOI:10.3969/j.issn.1003-5591.2017.03.011.
7 陈焕伟,廖珊,王峰杰,等.解剖性肝切除治疗肝细胞癌的长期结果和预后影响因素分析:附90例报告.中华肝胆外科杂志,2012,18:110-114.DOI:10.3969/cma.j.issn.1007-8118.2017.03.011.
8 Ahn KS,Kang KJ,Park TJ,et al.Benefit of systematic segmentectomy of the hepatocellular carcinoma:revisiting the dye injection method for various portal vein branches.Ann Surg,2013,258:1014-1021.DOI:10.1097/SLA.0b013e318281eda3.
9 刘兵,迟崇巍,袁静,等.吲哚菁绿近红外荧光显像技术在肝细胞癌肝切除术中的应用价值.中华消化外科杂志,2016,15:490-495.DOI:10.3760/cma.j.issn.1673-9752.2016.05.017.
10Alander JT,Kaartinen I,Laakso A,et al.A review of indocyanine green fluorescent imaging in surgery.Int J Biomed Imaging,2012,2012:940585.DOI:10.1155/2012/940585.
11Boni L,David G,Mangano A,et al.Clinical applications of indocyanine green (ICG) enhanced fluorescence in laparoscopic surgery.Surg Endosc,2015,29:2046-2055.DOI:10.1007/s00464-014-3895-x.
12Chi C,Du Y,Ye J,et al.Intraoperative imaging-guided cancer surgery:from current fluorescence molecular imaging methods to future multi-modality imaging technology.Theranostics,2014,4:1072-1084.DOI:10.7150/thno.9899.
13Gotoh K,Yamada T,Ishikawa O,et al.A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation.J Surg Oncol,2009,100:75-79.DOI:10.1002/jso.21272.
14Boogerd LS,Handgraaf HJ,Lam HD,et al.Laparoscopic detection and resection of occult liver tumors of multiple cancer types using real-time near-infrared fluorescence guidance.Surg Endosc,2017,31:952-961.DOI:10.1007/s00464-016-5007-6.
15Kobayashi Y,Kawaguchi Y,Kobayashi K,et al.Portal vein territory identification using indocyanine green fluorescence imaging:Technical details and short-term outcomes.J Surg Oncol,2017.DOI:10.1002/jso.24752.[Epub ahead of print]
The clinical application of indocyanine green flurescence imaging in the robotic-assisted laparoscopic hepatectomy--2 cases report
Chen Lin,Luo Hongping,Zhu Peng,Li Ganxun,Chen Weixun,Liao Wei,Wang Yuwei,Zhang Bixiang,Chen Xiaoping.
Hepatic Surgery Centre,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Zhang Bixiang,Email:bixiangzhang@163.com;Chen Xiaoping,Email:chenxp@medmail.com.cn
Objective To investigate the clinical application of indocyanine green (ICG) flurescence imaging in robotic-assisted laparoscopic hepatectomy (RALH).Methods The clinical data of 2 cases of RALH using ICG flurescence imaging were retrospectively analyzed.For case 1,a patient with HCC underwent RALH for the segment 8.ICG was injected into the portal vein branch of the segment 8 by ultrasound-guided percutaneous transhepatic portal vein puncture before surgery.The boundary of the segment 8 was determined by ICG fluorescence imaging system.Parenchymal transection was intermittently monitored by ICG fluorescence imaging system (PINPOINT).For case 2,a patients with hepatic cavernous hemangioma
limited liver resection.The ICG was injected into portal vein directly during surgery.The boundary of tumor was detected and the parenchyma was transected under PINPOINT guidance.Results In case 1,the surface and parenchyma of the segment 8 showed green fluorescence in PINPOINT system,and the boundary was very clear.Resection plane was guided by the fluorescence of parenchyma.The segment 8 was completely resected.In case 2,the normal liver tissue showed green fluorescence and the hepatic cavernous hemangioma did not,thus the boundary of hemangioma was defined and the tumor was totally removed.No intraoperative massive hemorrhage and postoperative complication occurred on those patients.Conclusions The application of ICG fluorescence real-time imaging system in RALH is safe and effective.
Robotic liver resection; Fluorescence imaging; Indocyanine green
“十二五”国家科技重大专项项目(2012ZX10002016-004);国家自然科学基金青年基金资助项目(81400653)
430030 武汉,华中科技大学同济医学院附属同济医院肝脏外科中心(陈琳、罗鸿萍为共同第一作者)
张必翔,Email:bixiangzhang@163.com;陈孝平,Email:chenxp@medmail.com.cn
R657.3
A
10.3969/j.issn.1003-5591.2017.04.005
2017-08-07)

