Fascin-1对恶性黑色素瘤细胞增殖和凋亡的影响及其作用机制
骆曼,李灵毅
(1 武汉市第一医院,武汉430014;2 华中科技大学同济医学院附属武汉中心医院)
Fascin-1对恶性黑色素瘤细胞增殖和凋亡的影响及其作用机制
骆曼1,李灵毅2
(1 武汉市第一医院,武汉430014;2 华中科技大学同济医学院附属武汉中心医院)
目的 探讨Fascin-1对恶性黑色素瘤细胞增殖和凋亡的影响及其作用机制。方法 体外培养人恶性黑色素瘤细胞A375和人皮肤成纤维细胞CCC-HSF-1。将A375细胞随机分为CON组和Fascin-1-shRNA组,分别按照10 MOI的感染复数加入CON和Fascin-1-shRNA病毒,培养48 h。采用qRT-PCR法及Western blotting法检测常规培养的CCC-HSF-1、A375细胞以及CON组、Fascin-1-shRNA组Fascin-1 mRNA和蛋白表达。分别采用Dye67染色法、Annexin V/PI染色法检测CON组、Fascin-1-shRNA组细胞增殖指数及凋亡率,采用Western blotting法检测Bcl-2、Bax、Bad蛋白表达。结果 常规培养的CCC-HSF-1、A375细胞中Fascin-1 mRNA相对表达量分别为0.21±0.015、1.00±0.01,Fascin-1蛋白相对表达量分别为0.12±0.04、0.75±0.11,二者比较P均<0.01。CON组、Fascin-1-shRNA组Fascin-1 mRNA相对表达量分别为1.00±0.01 、0.19±0.04,Fascin-1蛋白相对表达量分别为1.28±0.17、0.24±0.10,两组比较P均<0.01。Fascin-1-shRNA组培养3、4天时细胞增殖指数均低于CON组同期(P均<0.05)。Fascin-1-shRNA组细胞凋亡率高于CON组(P<0.01)。Fascin-1-shRNA组Bcl-2蛋白相对表达量低于CON组,Bax、Bad蛋白相对表达量高于CON组(P均<0.01)。结论 Fascin-1表达下调可抑制恶性黑色素瘤细胞增殖并诱导其凋亡,其机制可能与下调细胞中Bcl-2表达及上调Bax、Bad表达有关。
恶性黑色素瘤;Fascin-1;细胞增殖;细胞凋亡;Bcl-2家族
恶性黑色素瘤是一种由痣转变而来的皮肤恶性肿瘤[1],近年来其发病率不断上升[2,3]。恶性黑色素瘤患者预后主要取决于是否发生淋巴结转移[4]。研究证实,恶性黑色素瘤细胞分裂速度、瘤体厚度与肿瘤侵袭和转移密切相关[5,6]。Fascin-1蛋白是一种在肌动蛋白中具有捆绑作用的蛋白,通常在上皮细胞中低表达或不表达[7,8]。研究发现,Fascin-1可改变肺癌、结肠癌、胃癌等肿瘤细胞的增殖状态,并促进其迁移和侵袭[9~12]。但目前关于Fascin-1与恶性黑色素瘤发生、发展的关系鲜见报道。2015年1月~2016年1月,我们观察了Fascin-1对恶性黑色素瘤细胞增殖和凋亡的影响,现分析结果并探讨其作用机制。
1 材料与方法
1.1 材料 人皮肤成纤维细胞系CCC-HSF-1和人恶性黑色素瘤细胞系A375,购自北京协和医学院细胞库。Fascin-1-shRNA序列:5′-ACTATAACAAGGTGGCCAT-3′,非识别对照shRNA序列(CON序列):5′-GTTCTCCGAACGTGTCACGT-3′,由美国Sigma公司设计合成。Western blotting检测相关仪器,美国Bio-Rad公司;流式细胞仪、Dye670染料,美国BD公司;Annexin V/PI凋亡检测试剂盒,天津三箭生物技术股份有限公司;Fascin-1、Bcl-2、Bax、Bad一抗,美国Cell Signal Technology公司;辣根过氧化物酶偶联二抗,北京中杉金桥生物技术有限公司。慢病毒包装体系为Addgene第3代慢病毒包装系统,以空载质粒包装CON病毒,Fascin-1-shRNA包装Fascin-1-shRNA病毒,收集慢病毒包装48 h时病毒上清,PEG纯化,进行后续实验。
1.2 CCC-HSF-1、A375细胞Fascin-1表达检测 将CCC-HSF-1细胞、A375细胞接种于RPMI 1640培养基,置于37 ℃、5% CO2细胞培养箱培养48 h,收集两种细胞,分别检测其Fascin-1 mRNA和蛋白表达。①Fascin-1 mRNA表达:采用qRT-PCR法。按Qiagen RNeasy Mini Kit试剂盒说明提取细胞总RNA,按TaKaRa cDNA Synthesis Kit试剂盒说明将总RNA反转录为cDNA,然后进行PCR扩增。引物序列:Fascin-1上游引物:5′-AAGAAGAAGCAGATCTGGAC-3′,下游引物:5′-CACGATGAGGAAACGGCAGT-3′;GAPDH上游引物:5′-TATGCTCTCCTCATGCATTG-3′,下游引物:5′-GGGACGACCTTCGATCTACC-3′。所有操作严格按TaKaRa SYBR Premix Ex Taq试剂盒说明进行。以GAPDH为内参,2-ΔΔCt法计算Fascin-1 mRNA相对表达量。实验重复3次,取平均值。②Fascin-1蛋白表达:采用Western blotting法。取两种细胞,RIPA冰上裂解30 min,BCA法蛋白定量,取部分蛋白加入5×上样缓冲液,100 ℃水浴10 min,然后行SDS-PAGE,50 V恒压,待溴酚蓝跑至浓缩胶与分离胶分界处时,切换至120 V恒压;当溴酚蓝跑至胶板底部时,400 mA恒流将蛋白转印至PVDF膜上;分别加入Fascin-1(1∶200)与β-actin(1∶1 000)一抗,37 ℃孵育4 h;加入辣根过氧化物酶偶联二抗(1∶1 000)孵育过夜;ECL发光后显影。采用Quantity One 1-D软件分析各蛋白电泳条带灰度值。以β-actin为内参,目的蛋白电泳条带灰度值/β-actin蛋白电泳条带灰度值作为目的蛋白相对表达量。实验重复3次,取平均值。
1.3 转染Fascin-1-shRNA对A375细胞增殖和凋亡影响的观察
1.3.1 CON、Fascin-1-shRNA病毒转染 将A375细胞接种于RPMI 1640培养基,37 ℃、5% CO2细胞培养箱培养48 h。随机将细胞分为CON组、Fascin-1-shRNA组,按照10 MOI(病毒∶细胞=10∶1)的感染复数加入CON病毒和Fascin-1-shRNA病毒,继续培养48 h。收集两组细胞,分别采用qRT-PCR法、Western blotting法检测Fascin-1 mRNA和蛋白表达,方法同1.2。结果显示,CON组、Fascin-1-shRNA组Fascin-1 mRNA相对表达量分别为1.00±0.01、0.19±0.04,Fascin-1蛋白相对表达量分别为1.28±0.17、0.24±0.10,两组比较P均<0.01。证实Fascin-1-shRNA病毒能够抑制Fascin-1表达,可进行后续实验。
1.3.2 细胞增殖指数检测 采用Dye670染色法。取CON组、Fascin-1-shRNA组转染48 h细胞,制成单细胞悬液(细胞密度为1×107个/mL),然后加入适量Dye670染料,使其终浓度为10 μmol/L,37 ℃避光染色10 min,再加入5倍体积的完全培养基,冰上孵育5 min,完全培养基冲洗3次。将标记后的细胞接种于24孔板,每孔1×106个,37 ℃孵育,分别于培养0、1、2、3、4天时采用BD Calibur流式细胞仪检测细胞增殖指数。
1.3.3 细胞凋亡检测 采用Annexin V/PI染色法。取CON组、Fascin-1-shRNA组转染48 h细胞,制成单细胞悬液(细胞密度为1×107个/mL),PBS清洗2次,Binding Buffer重悬,加入相应比例(1∶1 000)的Annexin V抗体避光染色10 min,然后加入适量PBS溶液及PI染液混匀,流式细胞仪检测Annexin V阳性细胞比例,即为细胞凋亡率。
1.3.4 Bcl-2、Bax、Bad蛋白表达 采用Western blotting法。一抗分别为Bcl-2(1∶200)、Bax(1∶200)、Bad(1∶200)、β-actin(1∶200),二抗为辣根过氧化物酶偶联二抗(1∶1 000),具体操作步骤同1.2。
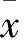
2 结果
2.1 CCC-HSF-1、A375细胞Fascin-1 mRNA和蛋白表达比较 CCC-HSF-1、A375细胞Fascin-1 mRNA相对表达量分别为0.21±0.02、1.00±0.01,Fascin-1蛋白相对表达量分别为0.12±0.04、0.75±0.11,二者比较P均<0.01。
2.2 转染Fascin-1-shRNA或CON对A375细胞增殖和凋亡影响的观察
2.2.1 两组转染不同时间细胞增殖指数和细胞凋亡率比较 见表1。

表1 两组转染不同时间细胞增殖指数和细胞凋亡率比较±s)
注:与CON组比较,*P<0.05,△P<0.01。
2.2.2 两组Bcl-2、Bax、Bad蛋白表达比较 见表2。
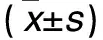
表2 两组Bcl-2、Bax、Bad蛋白相对表达量比较
注:与CON组比较,*P<0.01。
3 讨论
Fascin-1定位于染色体7p22,可与F-肌动蛋白结合,参与调节细胞运动等[13]。Fascin-1蛋白的第39位丝氨酸是蛋白激酶C的磷酸化位点,该位点磷酸化后可调节Fascin-1蛋白与F-肌动蛋白的结合活性,抑制Fascin-1肌钙蛋白的组装功能,并影响细胞膜表面伪足和微棘形成[14]。Fascin-1在非小细胞肺癌组织中高表达,参与调节细胞增殖与迁移,并与肿瘤临床分期、淋巴结转移相关[15]。在结肠癌组织中,Fascin-1通过caspase介导的失巢凋亡,发挥癌基因作用[16]。Fascin-1在胃癌组织中高表达,是影响胃癌患者预后的独立危险因子[17]。miR-429通过靶向下调FSCN1表达抑制胃癌细胞增殖、迁移和侵袭[18,19]。Fascin-1在卵巢癌组织中高表达,且随着TNM分期升高而表达增高,可能参与卵巢癌的恶性转化[20]。以上研究说明,Fascin-1可作为癌基因参与多种恶性肿瘤的发生、发展。
本研究以人恶性黑色素瘤细胞系A375为研究对象,以人皮肤成纤维细胞CCC-HSF-1为对照,结果显示,常规培养的A375细胞Fascin-1 mRNA和蛋白相对表达量均高于CCC-HSF-1细胞,提示Fascin-1高表达可能与人恶性黑色素瘤的发生有关。进一步将A375细胞给予空载质粒包装的CON病毒和Fascin-1-shRNA包装的Fascin-1-shRNA病毒转染发现,Fascin-1-shRNA组Fascin-1 mRNA和蛋白相对表达量均低于CON组,提示慢病毒处理可敲低A375细胞Fascin-1表达;Fascin-1敲低后,A375细胞的增殖受到抑制,其凋亡率显著高于CON组,提示Fascin-1低表达可诱导A375细胞凋亡。
Bcl-2家族是目前研究最广泛的凋亡调控基因之一,包括抑制凋亡基因与促进凋亡基因两大类,抑制凋亡基因主要有Bcl-2、Bcl-w等,促进凋亡基因主要有Bax、Bad、Bid等[21]。本研究结果显示,与CON组比较,Fascin-1-shRNA组Bcl-2表达下降,Bax、Bad表达增加,表明Fascin-1对A375细胞增殖和凋亡的影响与其调控Bcl-2家族相关基因的表达有关。
综上所述,Fascin-1表达下调可抑制恶性黑色素瘤细胞增殖并诱导其凋亡,其机制可能与下调Bcl-2表达及上调Bax、Bad表达有关。
[1] Naveh HP, Rao UN, Butterfield LH. Melanoma-associated leukoderma-immunology in black and white[J]. Pigment Cell Melanoma Res, 2013,26(6):796-804.
[2] Vecchiato A, Zonta E, Campana L, et al. Long-term survival of patients with invasive ultra-thin cutaneous melanoma: a single-center retrospective analysis[J]. Medicine, 2016,95(2):e2452.
[3] Kyrgidis A, Tzellos T, Mocellin S, et al. Sentinel lymph node biopsy followed by lymph node dissection for localised primary cutaneous melanoma[J]. Cochrane Database Syst Rev, 2015,16 (5):CD010307.
[4] Jaukovic L, Sijan G, Rajovic′ M, et al. Lymphoscintigraphy and sentinel lymph node biopsy, in cutaneous melanoma staging and treatment decisions[J]. Hell J Nucl Med, 2014,18(2):146-151.
[5] Speijers MJ, Bastiaannet E, Sloot S, et al. Tumor mitotic rate added to the equation: melanoma prognostic factors changed[J]. Ann Surg Oncol, 2015,22(9):2978-2987.
[6] Stanelle EJ, Busam KJ, Rich BS, et al. Early-stage non-Spitzoid cutaneous melanoma in patients younger than 22 years of age at diagnosis: long-term follow-up and survival analysis[J]. J Pediatr Surgery, 2015,50(6):1019-1023.
[7] Gungor-Ordueri NE, Celik-Ozenci C, Cheng CY. Fascin 1 is an actin filament-bundling protein that regulates ectoplasmic specialization dynamics in the rat testis[J]. Am J Physiol Endocrinol Metab, 2014,307(9):E738-E753.
[8] Ma Y, Reynolds LE, Li A, et al. Fascin 1 is dispensable for developmental and tumour angiogenesis[J]. Biology Open, 2013,2(11):1187-1191.
[9] Zhao W, Gao J, Wu J, et al. Expression of Fascin-1 on human lung cancer and paracarcinoma tissue and its relation to clinicopathological characteristics in patients with lung cancer[J]. OncoTargets Ther, 2015(8):2571-2576.
[10] Kanaan Z, Qadan M, Eichenberger MR, et al. The actin-cytoskeleton pathway and its potential role in inflammatory bowel disease-associated human colorectal cancer[J]. Genetic Test Mol Biomarkers, 2010,14(3):347-353.
[11] Tsai WC, Jin JS, Chang WK, et al. Association of cortactin and fascin-1 expression in gastric adenocarcinoma: correlation with clinicopathological parameters[J]. J Histochem Cytochem, 2007,55(9):955-962.
[12] Ma Y, Li A, Faller W J, et al. Fascin 1 is transiently expressed in mouse melanoblasts during development and promotes migration and proliferation[J]. Development, 2013,140(10):2203-2211.
[13] Adams JC. Fascin-1 protrusions in cell interactions[J]. Trends Cardiovasc Med, 2004,14(6):221-226.
[14] Larsson C. Protein kinase C and the regulation of the actin cytoskeleton[J]. Cell Signal, 2006,18(3): 276-84.
[15] Liang Z, Wang Y, Shen Z, et al. Fascin 1 promoted the growth and migration of non-small cell lung cancer cells by activating YAP/TEAD signaling[J]. Tumor Biol, 2016,37(8):10909-10915.
[16] Kanda Y, Kawaguchi T, Kuramitsu Y, et al. Fascin regulates chronic inflammation-related human colon carcinogenesis by inhibiting cell anoikis[J]. Proteomics, 2014,14(9):1031-1041.
[17] Tu L, Xu J, Wang M, et al. Correlations of fascin-1 and cadherin-17 protein expression with clinicopathologic features and prognosis of patients with gastric cancer[J]. Tumor Biol, 2016,37(7):8775-8782.
[18] Zhang M, Dong B, Lu M, et al. miR-429 functions as a tumor suppressor by targeting FSCN1 in gastric cancer cells[J]. OncoTargets Therapy, 2016(9):1123-1133.
[19] Xue M, Zhao L, Yang F, et al. MicroRNA145 inhibits the malignant phenotypes of gastric carcinoma cells via downregulation of fascin 1 expression[J]. Mol Me Rep, 2016,13(1):1033-1039.
[20] 王永来,郑玉霞,陈双,等.子宫内膜癌中人类Fascin1基因的表达及临床意义[J].山东医药,2007,47(27):52-54.
[21] Buranabunwong N, Ruangrungsi N, Chansriniyom C, et al. Ethyl acetate extract from Glycosmis parva leaf induces apoptosis and cell-cycle arrest by decreasing expression of COX-2 and altering BCL-2 family gene expression in human colorectal cancer HT-29 cells[J]. Pharmaceutical Biology, 2015,53(4):540-547.
李灵毅(E-mail: 1114395480@qq.com)
10.3969/j.issn.1002- 266X.2017.28.012
R739.5
A
1002- 266X(2017)28- 0043- 03
2016-10-29)

